方案详情
文
该方法能够可靠地检测红葡萄酒和白葡萄酒基质中的 八种真菌毒素,回收率和精密度皆满足要求。该方法具有高灵敏度,可在大大低于现行的关于葡萄酒、酿酒原材料或其它食品中的最高限量的水平下检测八种真菌毒素,因此有望应用于葡萄酒产品中真菌毒素的常规监测。
方案详情

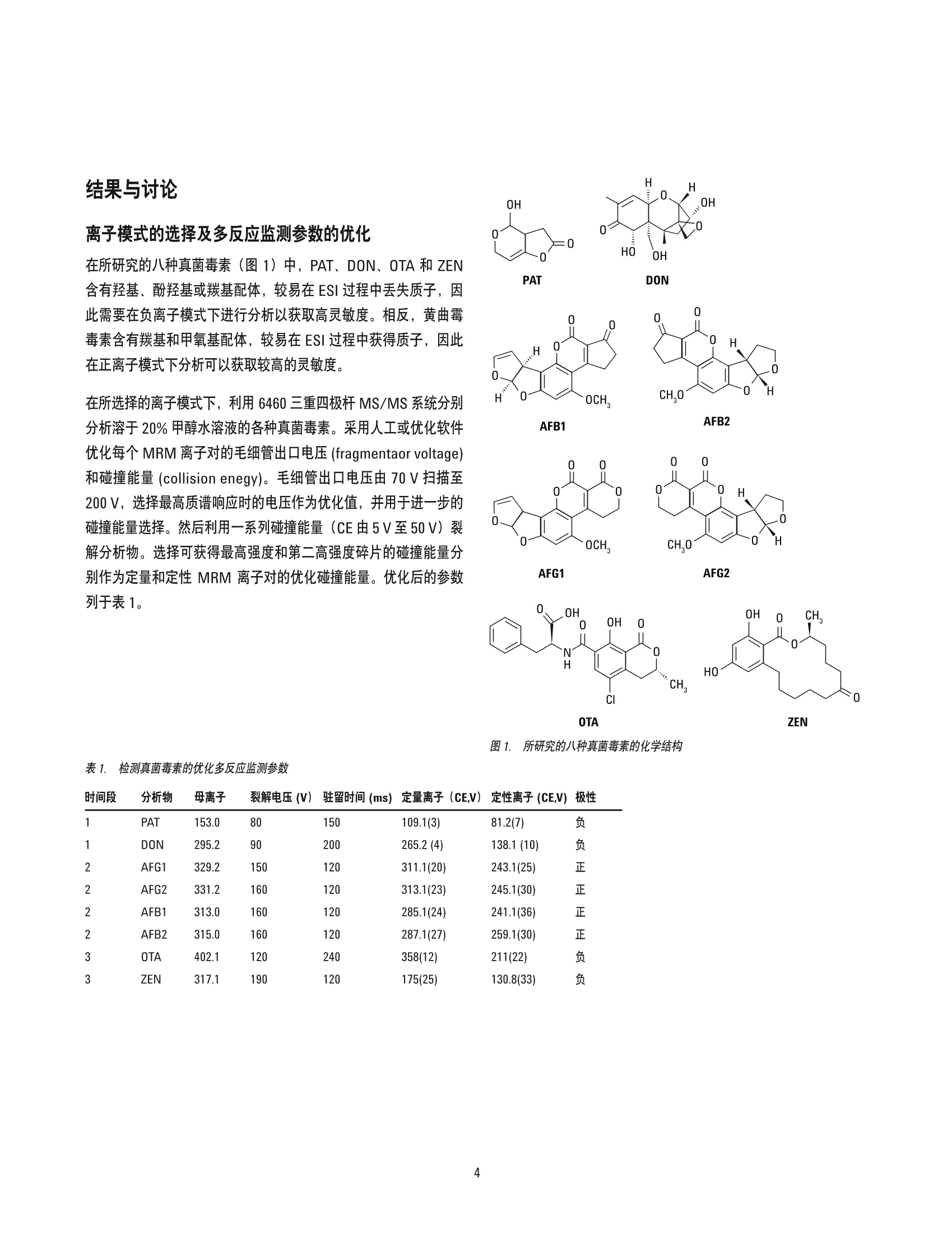
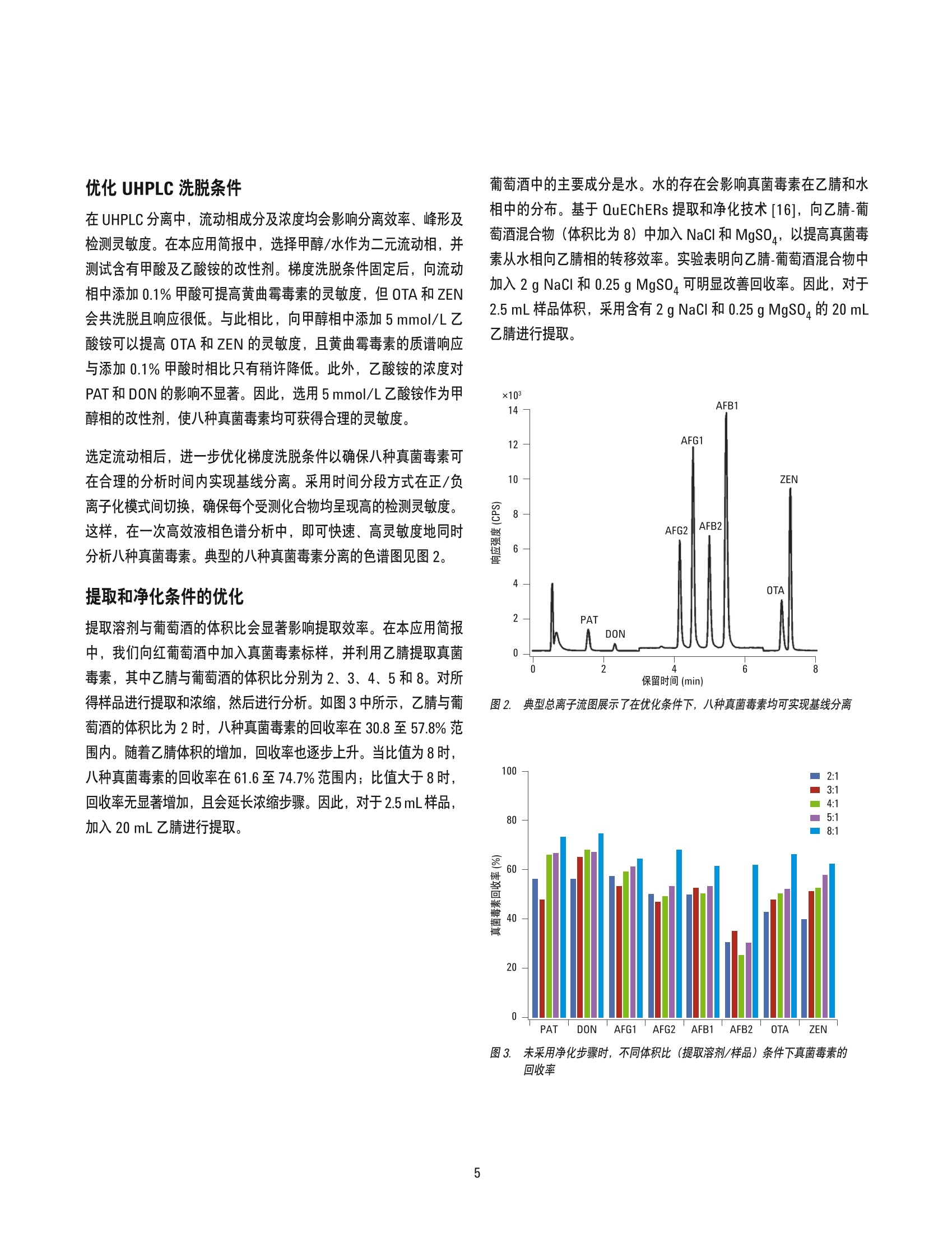
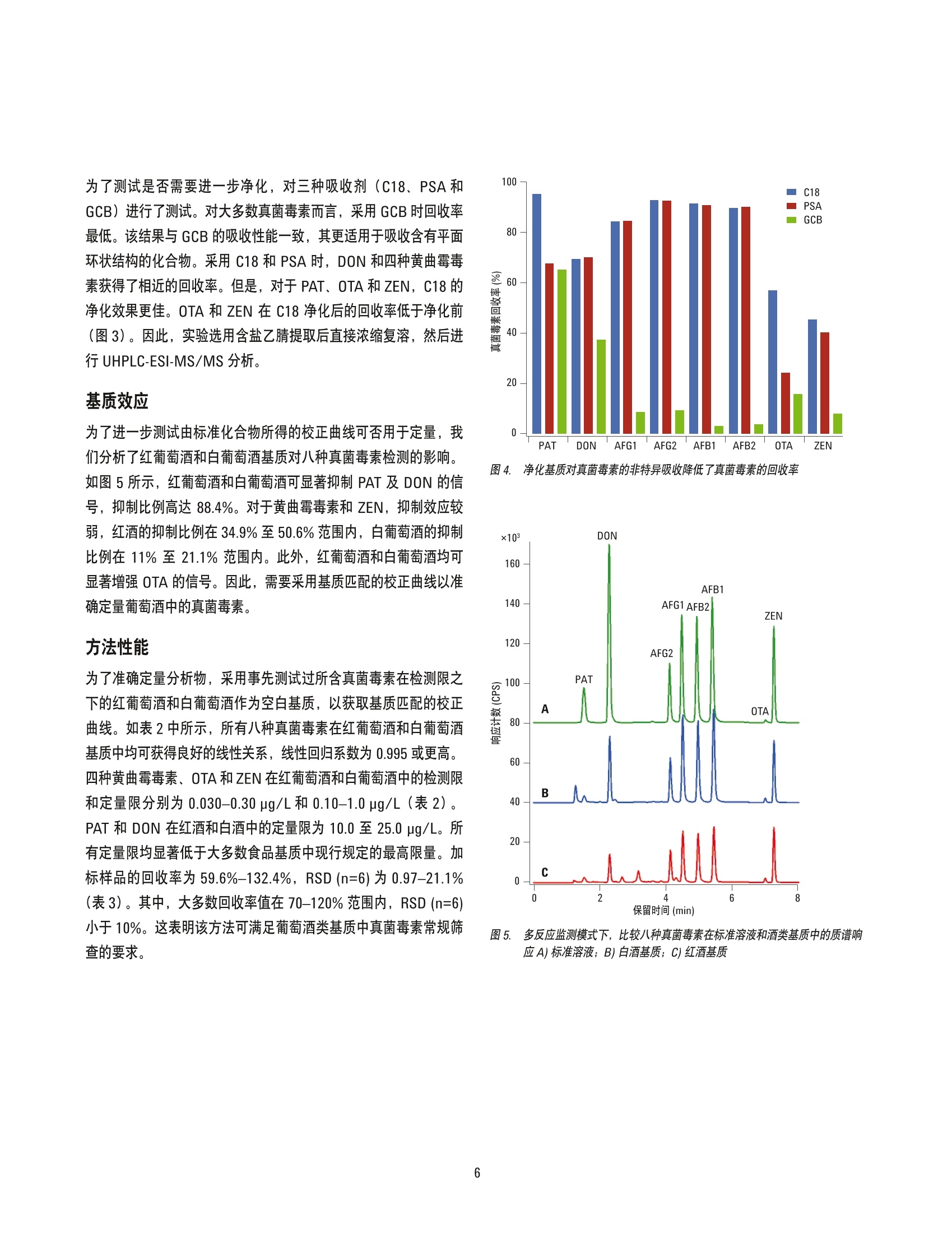
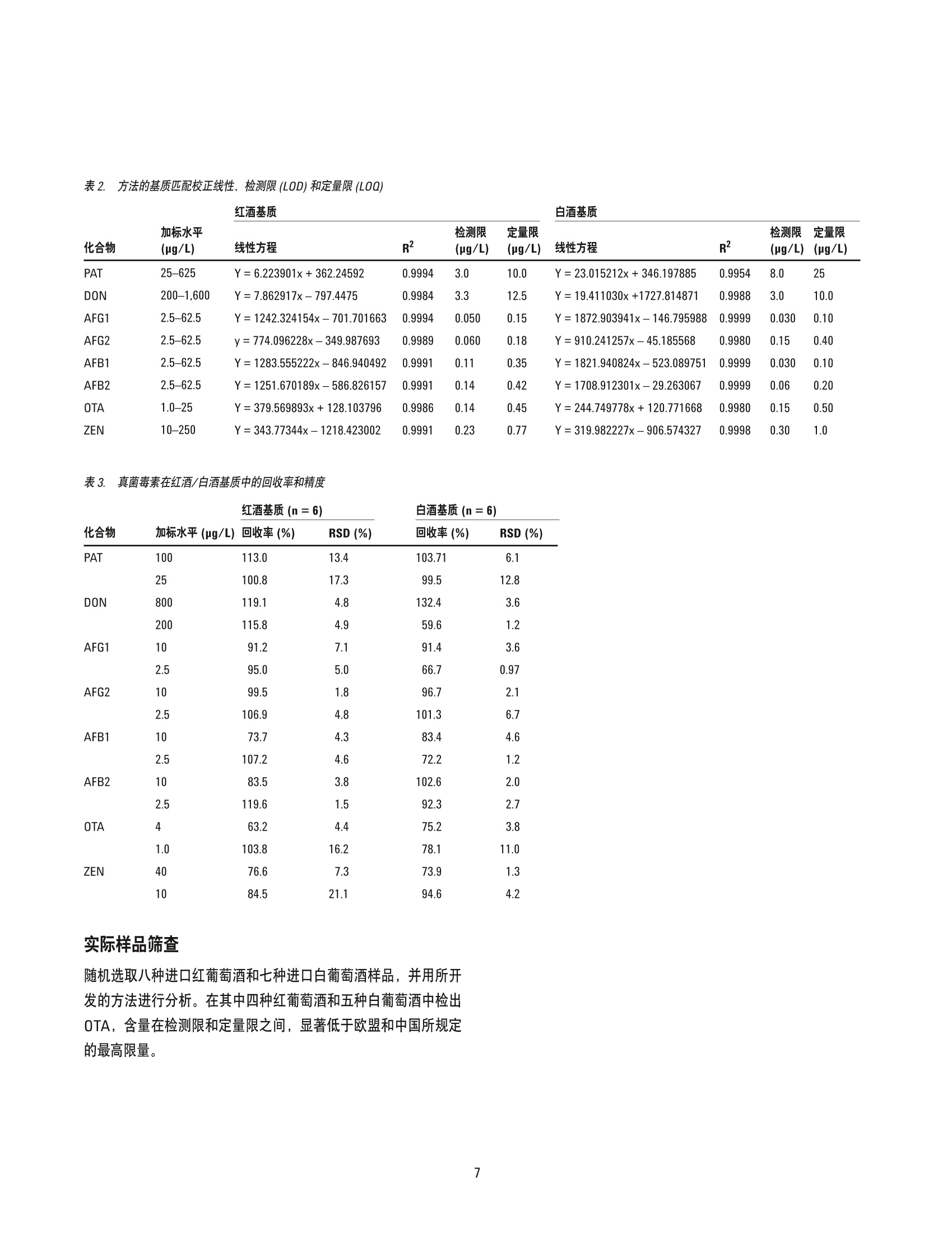
韩深、刘萤、王珮玥、王金花 北京出入境检验检疫局检验检疫技术中心中国北京 吕美玲和周珊 安捷伦科技(中国)有限公司 中国北京 摘要 本文开发了一种可同时时定葡萄酒中八种真菌毒素的方法,包括黄曲霉毒素 B1、B2、G1 和G2、展青霉素、呕吐毒素、赭曲霉毒素A以及玉米赤霉烯酮。在氯化钠和硫酸镁存在的条件下,采用乙腈对样品进行初步提取。采用旋转蒸发法对得到的提取物进行浓缩,然后进行复溶,再利用超高效液相色谱 (UHPLC)三重四极杆质谱多反应模式 (MRM)检测。结果表明在红葡萄酒和白葡萄酒中八种真菌毒素的检测限(LOD)分别在0.050至3.3 pg/L 和0.030至8.0pg/L范围内,定量限(LOQ)分别介于0.15至2.5 pg/L和0.10至25 pg/L范围内。对于全部八种真菌毒素,在选定的两个数量级的基质匹配校准范围内线性响应良好,线性回归系数为0.995或更高。对于所测定的两个加标水平,回收率介于 59.6-132.4%,精密度(RSD)介于 1.2-21.1%(n=6)。其中,大部分加标样品的回收率为 70%-120%, RSD 小于10%。本文开发的方法快速、准确、灵敏,可用于葡萄酒中多种真菌毒素的高通量常规筛查,并可能扩展到其它发酵酒类样品的应用中。 真菌毒素是由各种真菌在适宜的气候条件下自我复制而生成的一系列次级代谢产物。已见诸报道的真菌毒素有300余种。研究表明一些真菌毒素会导致多种不良健建效应,包括抑制免疫系统,诱发癌症及畸形,干扰生长发育,等等[1,2]。用于酿酒的农产品(例如葡萄)在生长、储存和加工过程中易感染真菌,进而受到真菌毒素的污染。 赭曲霉毒素A (OTA) 是葡萄酒中最常见的一种真菌毒素[3-5]。欧盟(EU) 规定酒中 OTA 的最高限量为 2 pg/L。 事实上许多其它的真菌毒素也可能存在于酿造完成的酒中,例如黄曲霉毒素(B1、B2、G1和G2),呕吐毒素 (DON)、玉米赤霉烯酮(ZEN)、展青霉素 (PAT)[6.7]。一些国家和国织组织已经规定了大多数原始农产品中这类真菌霉素的最高限量。但是,这些真菌毒素在酒中的限量至今并没有得到太大的关注。 不同于其它食物商品,酒是一种特殊的饮品,其主要成分为酒精。与真菌毒素自身对人体健康的影响相比,在饮酒的同时摄入真菌毒素可能会加重影响。一篇近期的报道指出,小鼠同时摄入黄曲霉毒素B1(一种致癌的真菌毒素)及乙醇表现出加合效应,会显著加重对其肝脏的氧化损伤[8]。与其它食品相比,人体对酒中某些真菌毒素的耐受性可能较低,因此,需要建立一种灵敏可靠的方法对酒中的潜在真菌毒素进行常规筛查,以确保消费者的安全。对酒中的潜在真菌毒素进行常规筛查以确保安全性。 高效液相色谱电喷雾串联质谱法 (HPLC-ESI-MS/MS), 结合多种预提取技术,已广泛应用于检测玉米、饲料、牛奶及草药等基质中的真菌毒素[9-14]。但是,极少有报道关注葡萄酒中的多种真菌毒素[15]。本应用简报基于 UHPLC-ESI-MS/MS技术,展示了一种用于快速有效检测葡萄酒中潜在八种真菌毒素的高通量检测方法。 实验部分 试剂、化学品和样品 八种真菌毒素包括展青毒素 (PAT)、呕吐毒素 (DON)、黄曲霉毒素G1 (AFG1)、黄曲霉毒素G2 (AFG2)、黄曲霉毒素 B1 (AFB1)、黄曲霉毒素B2(AFB2)、赭曲霉毒素(OTA) 以及玉米赤霉烯酮 (ZEN)(纯度大于等于99%)均购自 Romer实验室(澳地利)。甲酸和乙酸铵分别购自美国天地及赛默飞世尔科技公司。红葡萄酒和白葡萄酒均为进口葡萄酒,从当地进口商处随机选择。 真菌毒素化合物的标准溶液制备采用纯甲醇配制,储备溶液浓度为10 pg/mL, 于-18℃下储存。利用甲醇/水(20:80,体积比)将其稀释至适当浓度用于校正。 样品前处理 准确量取葡萄酒样品2.5mL 于离心管中,加入20mL纯乙腈(ACN)混合。然后向离心管中加入氯化钠(2g)及硫酸镁 (0.25g)。对所得混合物涡旋振荡 3 min 后, 在 8000 rpm 下离心 10 min。将占原始体积80%的上清液转移至干净的鸡心瓶中,40°℃下旋转蒸发至近干。残渣用2mL甲醇/水(20:80,体积比)复溶,并用0.22um 膜过滤后,进行UHPLC-ESI-MS/MS 分析。 为了检验是否需要进一步净化,这里分别尝试了 C18、PSA和石墨化炭黑 (GCB)对提取液进行净化。乙腈提取后所得的上清液均分为三等份加入离心管中,分别与 C18、PSA和 GCB 混合,持续振荡10min。将混合物在 8000 rpm 下离心 10 min,所得的上清液采用旋转蒸发进一步浓缩。所得所渣用2mL甲醇/水(20:80,体积比)复溶,并用0.22 um膜过滤后, 进行UHPLC-ESI-MS/MS分析。使用真菌毒素的回收率评估净化效率。 为了验证红葡萄酒或白葡萄酒基质是否会影响这些真菌毒素检测的准确度,根据样品前处理步骤向葡萄酒中加入一定量的真菌毒素。采用 UHPLC-ESI-MS/MS分析所得到的样品。比较每种分析物与相同水平标准溶液中真菌毒素的峰面积。与标准溶液相比,加标基质样品中峰面积比例的降低或增加分别代表基质抑制或增强的程度。 基质匹配的线性校正、检测限及定量限 为了评估线性及检测灵敏度,选用事先确定无检测目标分析物的空白基质。同样品一样,对空白基质进行提取和浓缩。所得残渣使用一系列溶于甲醇/水(20:80,体积比)的真菌毒素标准溶液进行复溶。基质匹配的标准溶液用 0.22um 膜过滤后, 进行UHPLC-ESI-MS/MS分析。对每种分析物的峰面积及其浓度进行相关分析以验证线性。利用基质匹配校准标样的最低浓度样品生成的S/N, 计算所开发方法的检出限(S/N=3)及定量限(S/N=10)。 准确度和精度 为了验证方法的准确度和精密度,向空白基质中加入两个水平的各种真菌毒素作为加标样品,重复分析六次。由于葡萄酒、葡萄或其它可参考农产品中每种真菌毒素所规定的限量水平相差很大,且每种真菌毒素的质谱灵敏度相差也很大,因此将中国法规中现行最高限量水平及其四分之一水平作为每个分析物的加标水平。加标样品前处理同样品前处理过程相同,并采用 UHPLC-ESI-MS/MS进行分析。使用六次重复测定的平均回收率和相对标准偏差评估方法的准确度和精密度。 UHPLC-MS/MS条件 整个研究过程中均采用 Agilent 1290 Infinity UHPLC 系统。其包括1290 Infinity 二元泵、自动进样器和柱温箱。采用 AgilentZORBAX Eclipse Plus C18 色谱柱 (100 mm×2.1 mm,1.8um)进行八种真菌毒素的分离。流动相是溶液A 和溶液 B 的在线混合物,其中A为纯水, B为含有5 mmol/L乙酸铵的甲醇。初始梯度为 10%B, 0-2.4 min 内线性增加至42%B, 然后在 2.4-6 min内持续增加至51%B。接着在 6.0-6.2 min 内,%B快速增加至90%, 保持 2 min 以确保所有分析物和干扰物质可从色谱柱中洗脱出来。流速为 0.4 mL/min, 进样量为5pL, 柱温为40℃。两次连续分析间的柱平衡时间设置为 1 min。 UHPLC 系统的洗脱液由射流电喷雾 (JetStream ESI) 离子源直接进入 Agilent 6460 三重四极杆 MS/MS系统, 并在多反应监测模式(MRM)下进行检测。正 (pos) 和负(neg)模式下的一般离子源参数如下:毛细管电压, 3500V(pos), 2000V(neg); 喷嘴电压,500V(pos), 1900V(neg);干燥气温度,325℃;干燥气流速,6 L/min; 雾化气压力, 45 psi;鞘气温度, 350℃; 鞘气流速,11 L/min。针对每种化合物优化毛细管出口电压和碰撞能量。 离子模式的选择及多反应监测参数的优化 在所研究的八种真菌毒素(图1)中, PAT、 DON、 OTA 和 ZEN含有羟基、酚羟基或羰基配体,较易在ESI过程中丢失质子,因此需要在负离子模式下进行分析以获取高灵敏度。相反,黄曲霉毒素含有羰基和甲氧基配体,较易在ESI过程中获得质子,因此在正离子模式下分析可以获取较高的灵敏度。 在所选择的离子模式下,利用6460三重四极杆 MS/MS系统分别分析溶于20%甲醇水溶液的各种真菌毒素。采用人工或优化软件优化每个 MRM离子对的毛细管出口电压 (fragmentaor voltage)和碰撞能量 (collision enegy)。毛细管出口电压由70V扫描至200V, 选择最高质谱响应时的电压作为优化值,并用于进一步的碰撞能量选择。然后利用一系列碰撞能量 (CE由5V至50V)裂解分析物。选择可获得最高强度和第二高强度碎片的碰撞能量分别作为定量和定性 MRM 离子对的优化碰撞能量。优化后的参数列于表1。 PAT DON 0 Q 0 0 H .0 0、 CH,0 H H 0 OCH. AFB2 AFB1 0 0 0 0 0 H 0 0 CH0 H OCH. AFG1 AFG2 时间段 分析物 母离子 裂解电压(V)驻留时间(ms) 定量离子(CE,V)定性离子(CE,V)极性 PAT 153.0 80 150 109.1(3) 81.2(7) 负 DON 295.2 90 200 265.2(4) 138.1(10) 负 AFG1 329.2 120 311.1(20) 243.1(25) 正 AFG2 331.2 120 313.1(23) 245.1(30) 正 AFB1 313.0 160 120 285.1(24) 241.1(36) 正 AFB2 315.0 120 287.1(27) 259.1(30) 正 OTA 402.1 240 358(12) 211(22) 负 ZEN 317.1 190 120 175(25) 130.8(33) 负 优化 UHPLC 洗脱条件 在UHPLC分离中,流动相成分及浓度均会影响分离效率、峰形及检测灵敏度。在本应用简报中,选择甲醇/水作为二元流动相,并测试含有甲酸及乙酸铵的改性剂。梯度洗脱条件固定后,向流动相中添加0.1%甲酸可提高黄曲霉毒素的灵敏度,度 OTA 禾ZEN会共洗脱且响应很低。与此相比,向甲醇相中添加5mmol/L乙酸铵可以提高 OTA 和 ZEN的灵敏度,且黄曲霉毒素的质谱响应与添加0.1%甲酸时相比只有稍许降低。此外,乙酸铵的浓度对PAT 和 DON的影响不显著。因此,选用5 mmol/L乙酸铵作为甲醇相的改性剂,使八种真菌毒素均可获得合理的灵敏度。 选定流动相后,进一步优化梯度洗脱条件以确保八种真菌毒素可在合理的分析时间内实现基线分离。采用时间分段方式在正/负离子化模式间切换,确保每个受测化合物均呈现高的检测灵敏度。这样,在一次高效液相色谱分析中,即可快速、高灵敏度地同时分析八种真菌毒素。典型的八种真菌毒素分离的色谱图见图2。 提取和净化条件的优化 提取溶剂与葡萄酒的体积比会显著影响提取效率。在本应用简报中,我们向红葡萄酒中加入真菌毒素标样,并利用乙腈提取真菌毒素,其中乙腈与葡萄酒的体积比分别为2、3、4、5和8。对所得样品进行提取和浓缩,然后进行分析。如图3中所示,乙腈与葡萄酒的体积比为2时,八种真菌毒素的回收率在30.8至57.8%范围内。随着乙腈体积的增加,回收率也逐步上升。当比值为8时,八种真菌毒素的回收率在61.6至74.7%范围内;比值大于8时,回收率无显著增加,且会延长浓缩步骤。因此,对于2.5mL样品,加入20mL乙腈进行提取。 葡萄酒中的主要成分是水。水的存在会影响真菌毒素在乙腈和水相中的分布。基于 QuEChERs 提取和净化技术[16],向乙腈-葡窑酒混合物(体积比为8)中加入 NaCl和 MgSO,以提高真菌毒素从水相向乙腈相的转移效率。实验表明向乙腈-葡萄酒混合物中加入 2 g NaCl 和 0.25 g MgSo 可明显改善回收率。因此,对于2.5mL样品体积,采用含有 2 g NaCl和0.25g MgSO 的 20mL乙腈进行提取。 图2. 典型总离子流图展示了在优化条件下,八种真菌毒素均可实现基线分离 图3. 未采用净化步骤时,不同体积比(提取溶剂/样品)条件下真菌毒素的回收率 为了测试是否需要进一步净化,对三种吸收剂 (C18、PSA和GCB) 进行了测试。对大多数真菌毒素而言,采用 GCB时回收率最低。该结果与 GCB 的吸收性能一致,其更适用于吸收含有平面环状结构的化合物。采用 C18 和PSA 时, DON 和四种黄曲霉毒素获得了相近的回收率。但是,对于 PAT、OTA 和 ZEN, C18的净化效果更佳。OTA 和ZEN 在 C18 净化后的回收率低于净化前(图3)。因此,实验选用含盐乙腈提取后直接浓缩复溶,然后进行UHPLC-ESI-MS/MS 分析。 基质效应 为了进一步测试由标准化合物所得的校正曲线可否用于定量,我们分析了红葡萄酒和白葡萄酒基质对八种真菌毒素检测的影响。如图5所示,红葡萄酒和白葡萄酒可显著抑制 PAT 及 DON 的信号,抑制比例高达 88.4%。对于黄曲霉毒素和 ZEN,抑制效应较弱,红酒的抑制比例在34.9%至50.6%范围内,白葡萄酒的抑制比例在11%至21.1%范围内。此外,红葡萄酒和白葡萄酒均可显著增强 OTA的信号。因此,需要采用基质匹配的校正曲线以准确定量葡萄酒中的真菌毒素。. 方法性能 为了准确定量分析物,采用事先测试过所含真菌毒素在检测限之下的红葡萄酒和白葡萄酒作为空白基质,以获取基质匹配的校正曲线。如表2中所示,所有八种真菌毒素在红葡萄酒和白葡萄酒基质中均可获得良好的线性关系,线性回归系数为0.995 或更高。四种黄曲霉毒素、OTA 和 ZEN在红葡萄酒和白葡萄酒中的检测限和定量限分别为 0.030-0.30 pg/L 和 0.10-1.0 pg/L (表2)。PAT 和 DON 在红酒和白酒中的定量限为10.0至25.0ug/L。所有定量限均显著低于大多数食品基质中现行规定的最高限量。加标样品的回收率为 59.6%-132.4%, RSD (n=6) 为 0.97-21.1%(表3)。其中,大多数回收率值在 70-120% 范围内, RSD (n=6)小于10%。这表明该方法可满足葡萄酒类基质中真菌毒素常规筛查的要求。 图4. 净化基质对真菌毒素的非特异吸收降低了真菌毒素的回收率 图5. 多反应监测模式下,比较八种真菌毒素在标准溶液和酒类基质中的质谱响应A)标准溶液; B)白酒基质; C)红酒基质 表2.方法的基质匹配校正线性、检测限(LOD)和定量限(LOQ) 加标水平 检测限 定量限 检测限 定量限 化合物 (pg/L) 线性方程 B2 (pg/L) (ug/L) 线性方程 R2 (ug/L) (ug/L) PAT 25-625 Y=6.223901x+362.24592 0.9994 3.0 10.0 Y=23.015212x+346.197885 0.9954 8.0 25 DON 200-1,600 Y=7.862917x-797.4475 0.9984 3.3 12.5 Y=19.411030x+1727.814871 0.9988 3.0 10.0 AFG1 2.5-62.5 Y=1242.324154x-701.701663 0.9994 0.050 0.15 Y=1872.903941x-146.795988 0.9999 0.030 0.10 AFG2 2.5-62.5 y=774.096228x-349.987693 0.9989 0.060 0.18 Y=910.241257x-45.185568 0.9980 0.15 0.40 AFB1 2.5-62.5 Y=1283.555222x-846.940492 0.9991 0.11 0.35 Y=1821.940824x-523.089751 0.9999 0.030 0.10 AFB2 2.5-62.5 Y=1251.670189x-586.826157 0.9991 0.14 0.42 Y=1708.912301x-29.263067 0.9999 0.06 0.20 OTA 1.0-25 Y=379.569893x+128.103796 0.9986 0.14 0.45 Y=244.749778x+120.771668 0.9980 0.15 0.50 ZEN 10-250 Y=343.77344x-1218.423002 0.9991 0.23 0.77 Y=319.982227x-906.574327 0.9998 0.30 1.0 表3. 真菌毒素在红酒/白酒基质中的回收率和精度 红酒基质(n=6) 白酒基质(n=6) 化合物 加标水平(pg/L) 回收率(%) RSD(%) 回收率(%) RSD (%) PAT 100 113.0 13.4 103.71 6.1 25 100.8 17.3 99.5 12.8 DON 800 119.1 4.8 132.4 3.6 200 115.8 4.9 59.6 1.2 AFG1 10 91.2 7.1 91.4 3.6 2.5 95.0 5.0 66.7 0.97 AFG2 10 99.5 1.8 96.7 2.1 2.5 106.9 4.8 101.3 6.7 AFB1 10 73.7 4.3 83.4 4.6 2.5 107.2 4.6 72.2 1.2 AFB2 10 83.5 3.8 102.6 2.0 2.5 119.6 1.5 92.3 2.7 OTA 4 63.2 4.4 75.2 3.8 1.0 103.8 16.2 78.1 11.0 ZEN 40 76.6 7.3 73.9 1.3 10 84.5 21.1 94.6 4.2 实际样品筛查 随机选取八种进口红葡萄酒和七种进口白葡萄酒样品,并用所开发的方法进行分析。在其中四种红葡萄酒和五种白葡萄酒中检出OTA, 含量在检测限和定量限之间,显著低于欧盟和中国所规定的最高限量。 结论 本应用简报开发了一种同时监测红葡萄酒和白葡萄酒基质中八种真菌毒素的高灵敏度方法。采用八倍样品体积的含盐乙腈对样品进行提取,在浓缩后采用多反应监测模式进行 UHPLC-ESI-MS/MS分析。通过免去净化步骤,并利用时间分段法在一次高效液相色谱分析中,于正、负离子模式下同时检测真菌毒素,显著改善了方法通量。该方法能够可靠地检测红葡萄酒和白葡萄酒基质中的八种真菌毒素,回收率和精密度皆满足要求。该方法具有高灵敏度,可在大大低于现行的关于葡萄酒、酿酒原材料或其它食品中的最高限量的水平下检测八种真菌毒素,因此有望应用于葡萄酒产品中真菌毒素的常规监测。 ( 参考文献 ) ( 1. H.S. Hussein and J.M. Brasel "Toxicity, metabolism, andimpact of mycotoxins on h umans and animals" To x icol. 2001,167: 1 01-134 ) 2. J.W. Bennett and M. Klich"Mycotoxins"Clin. Microbio.Rev. 2003,16:497516 ( 3. C. Brera, F. Debegnach, V.Minardi, et al."Ochratoxin Acontamination in I t alian wine samples and evaluation ofthe exposure i n the Italian population"J. Agric. Food Chem. 2008,56:10611 - 618 ) 4. H. Otteneder and P. Majerus "Occurrence of ochratoxinA (OTA) in wines: influence of the type of wine and itsgeographical origin" Food Add. Contamin.2000, 47:793-798 ( 5. A.M. Chiodini , P. Scherpenisse, and A . A. Bergwerff"Ochratoxin A contents in wine: comparison of organi- cally and conventionally produced products" J. Agric.Food Chem.2006, 54: 7399-7404 ) 6. A.E.L. Khoury, T. Rizk, R. Lterf, H. Azouri, M.L. Delia,A. Lebrihi “Fungal contamination and aflatoxin B1 andochratoxin A in Lebanese wine-grapes and musts" FoodChem. Toxicol.2008,46:2244-2250 7. C. Jiang, J. Shi, Q. Han, Y. Liu “Occurrence of toxin-pro-ducing fungi in intact and rotten table and wine grapesand related influencing factors" Food Control, 2013, 31:5-13 8. 1.A. Adedara, S.E. Owumi, A.0. Uwaifo, E.0. Farombi"Aflatoxin B1 and ethanol co-exposure induces hepaticoxidative damage in mice" Toxicol. Ind. Health, 2010, 26:717-724 9. S. Sforza, C. Dall’s Asta,and R. Marchelli “Recentadvances in mycotoxin determination in food and feed byhyphenated chromatographic techniques/mass spec-trometry" Mass Spectrom. Rev.2006, 25: 54-76 10.>X.M. Gong, Y.P. Ren, J. Dong, et. al."Determination of 18mycotoxin contaminants in peanuts and oils by gel per-meation chromatography and ultra performance liquidchromatography tandem mass spectrometry"Chin. J.Instrum. Anal.,2011, 30:6-12 11.S. Monbaliu, C. Van Poucke, C. Detavernier, et al.“Occurrence of mycotoxins in feed as analyzed by amulti-mycotoxin LC-MS/MS method"J. Agric. FoodChem.,2010,58:66-71 12.E. Varga, T. Glauner, R. Koppen, et al. "Stable isotopedilution assay for the accurate determination of myco-toxins in maize by UHPLC-MS/MS" Anal. Bioanal.Chem., 2012,402:2675-2686 13.B.F. Huang, Z. Han, Z.X. Cai, Y.J. Wu, Y.P. Ren"Simultaneous determination of aflatoxins B1, B2, G1,G2, M1 and M2 in peanuts and their derivative productsby ultra-high-performance liquid chromatography-tandemmass spectrometry" Anal. Chim. Acta 2010,662:62-68 14.S. Han, Y. Liu, M. Lu, J.Z. Li, J.H. Wang“UsingIAC/UHPLC-ESI/MS/MS to determine five types of afla-toxins in Chinese patent medicines and medicinal herbs"Chin. J. Chromatogr., 2011,29: 613-617 15.F. Al-Taher, K. Banaszewski, L. Jackson, J. Zweigenbaum,D. Ryu, and J. Cappozzo "Rapid method for the determi-nation of multiple mycotoxins in wines and beers by LC-MS/MS using a stable isotope dilution assay [J]"mrJ.Agri. Food Chem., 2013, 61:2378-84 16. F.J. Schenck and J.E. HobbsEvaluation of the QuickEasy, Cheap, Effective, Rugged, and Safe (QuEChERS)Approach to Pesticide Residue Analysis [J]"Bull. Environ. Contam. Toxicol. 2004,73:24-30 更多信息 这些数据代表典型结果。有关我们的产品和服务的详细信息,请访问我们的网站: www.agilent.com/chem/cn www.agilent.com/chem/cn 安捷伦对本资料可能存在的错误或由于提供、展示或使用本资料所造成的间接损失不承担任何责任。 本文中的信息、说明和技术指标如有变更,恕不另行通知。 @安捷伦科技(中国)有限公司,2013 2013年11月26日,中国印制 5991-3337CHCN Agilent Technologies 摘要 本文开发了一种可同时测定葡萄酒中八种真菌毒素的方法,包括黄曲霉毒素B1、B2、G1 和G2、展青霉素、呕吐毒素、赭曲霉毒素A 以及玉米赤霉烯酮。在氯化钠和硫酸镁存在的条件下,采用乙腈对样品进行初步提取。采用旋转蒸发法对得到的提取物进行浓缩,然后进行复溶,再利用超高效液相色谱(UHPLC) 三重四极杆质谱多反应模式(MRM)检测。结果表明在红葡萄酒和白葡萄酒中八种真菌毒素的检测限(LOD) 分别在0.050 至3.3 μg/L 和0.030 至8.0 μg/L 范围内,定量限(LOQ) 分别介于0.15 至2.5 μg/L 和0.10至25 μg/L 范围内。对于全部八种真菌毒素,在选定的两个数量级的基质匹配校准范围内线性响应良好,线性回归系数为0.995 或更高。对于所测定的两个加标水平,回收率介于59.6–132.4%,精密度(RSD) 介于1.2–21.1% (n = 6)。其中,大部分加标样品的回收率为70%–120%,RSD 小于10%。本文开发的方法快速、准确、灵敏,可用于葡萄酒中多种真菌毒素的高通量常规筛查,并可能扩展到其它发酵酒类样品的应用中。 前言 真菌毒素是由各种真菌在适宜的气候条件下自我复制而生成的一系列次级代谢产物。已见诸报道的真菌毒素有300 余种。研究表明一些真菌毒素会导致多种不良健康效应,包括抑制免疫系统,诱发癌症及畸形,干扰生长发育,等等[1,2]。用于酿酒的农产品(例如葡萄)在生长、储存和加工过程中易感染真菌,进而受到真菌毒素的污染。 赭曲霉毒素A (OTA) 是葡萄酒中最常见的一种真菌毒素[3-5]。欧盟(EU) 规定酒中OTA 的最高限量为2 μg/L。事实上许多其它的真菌毒素也可能存在于酿造完成的酒中,例如黄曲霉毒素(B1、B2、G1 和G2),呕吐毒素(DON)、玉米赤霉烯酮(ZEN)、展青霉素(PAT) [6,7]。一些国家和国际组织已经规定了大多数原始农产品中这类真菌霉素的最高限量。但是,这些真菌毒素在酒中的限量至今并没有得到太大的关注。 不同于其它食物商品,酒是一种特殊的饮品,其主要成分为酒精。与真菌毒素自身对人体健康的影响相比,在饮酒的同时摄入真菌毒素可能会加重影响。一篇近期的报道指出,小鼠同时摄入黄曲霉毒素B1(一种致癌的真菌毒素)及乙醇表现出加合效应,会显著加重对其肝脏的氧化损伤[8]。与其它食品相比,人体对酒中某些真菌毒素的耐受性可能较低,因此,需要建立一种灵敏可靠的方法对酒中的潜在真菌毒素进行常规筛查,以确保消费者的安全。对酒中的潜在真菌毒素进行常规筛查以确保安全性。高效液相色谱电喷雾串联质谱法(HPLC-ESI-MS/MS),结合多种预提取技术,已广泛应用于检测玉米、饲料、牛奶及草药等基质中的真菌毒素[9-14]。但是,极少有报道关注葡萄酒中的多种真菌毒素[15]。本应用简报基于UHPLC-ESI-MS/MS 技术,展示了一种用于快速有效检测葡萄酒中潜在八种真菌毒素的高通量检测方法。 结论 本应用简报开发了一种同时监测红葡萄酒和白葡萄酒基质中八种真菌毒素的高灵敏度方法。采用八倍样品体积的含盐乙腈对样品进行提取,在浓缩后采用多反应监测模式进行UHPLC-ESI-MS/MS分析。通过免去净化步骤,并利用时间分段法在一次高效液相色谱分析中,于正、负离子模式下同时检测真菌毒素,显著改善了方法通量。该方法能够可靠地检测红葡萄酒和白葡萄酒基质中的八种真菌毒素,回收率和精密度皆满足要求。该方法具有高灵敏度,可在大大低于现行的关于葡萄酒、酿酒原材料或其它食品中的最高限量的水平下检测八种真菌毒素,因此有望应用于葡萄酒产品中真菌毒素的常规监测。
确定






还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《葡萄酒中八种真菌毒素检测方案(液相色谱仪)》,该方案主要用于葡萄酒及果酒中真菌毒素检测,参考标准--,《葡萄酒中八种真菌毒素检测方案(液相色谱仪)》用到的仪器有安捷伦 1290 Infinity 二元液相色谱系统(1290 LC)
推荐专场
该厂商其他方案
更多
















