方案详情
文
使用 EMR-Lipid 可有效去除基质且不会造成分析物的 意外损失。出色的仪器洁净度可改善色谱性能并减少维护和故障排除,可同时节省时间与成本。该解决方案仅需极少专业技能与设备,可在食品实验室中实现轻松应用。虽然该应用仅对其中一类真菌毒素进行了重点研究,但 EMR-Lipid 的设计可用于多残留应用。因此,EMR-Lipid 不同于免疫亲和柱,可轻松应用于多类真菌毒素分析。
方案详情

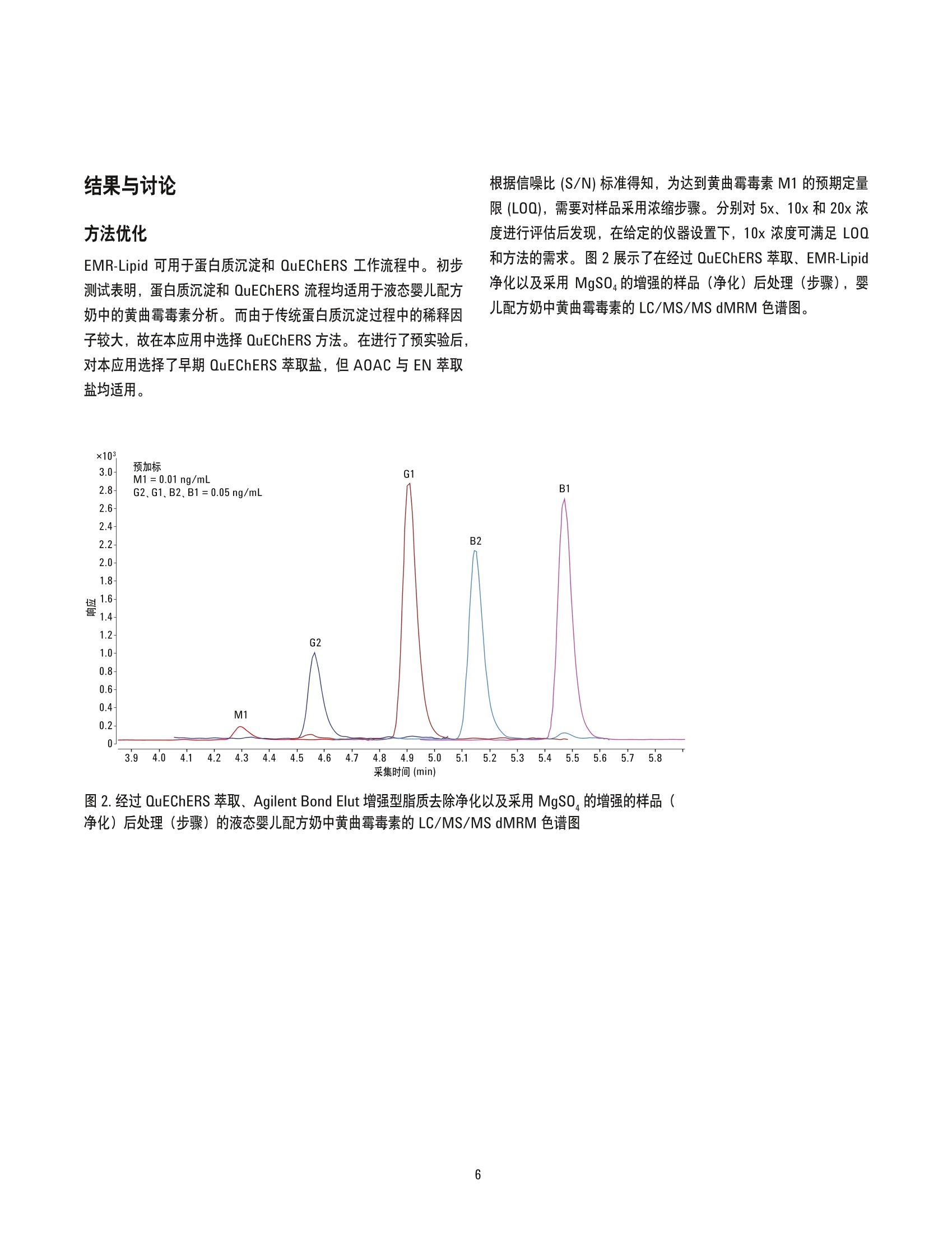
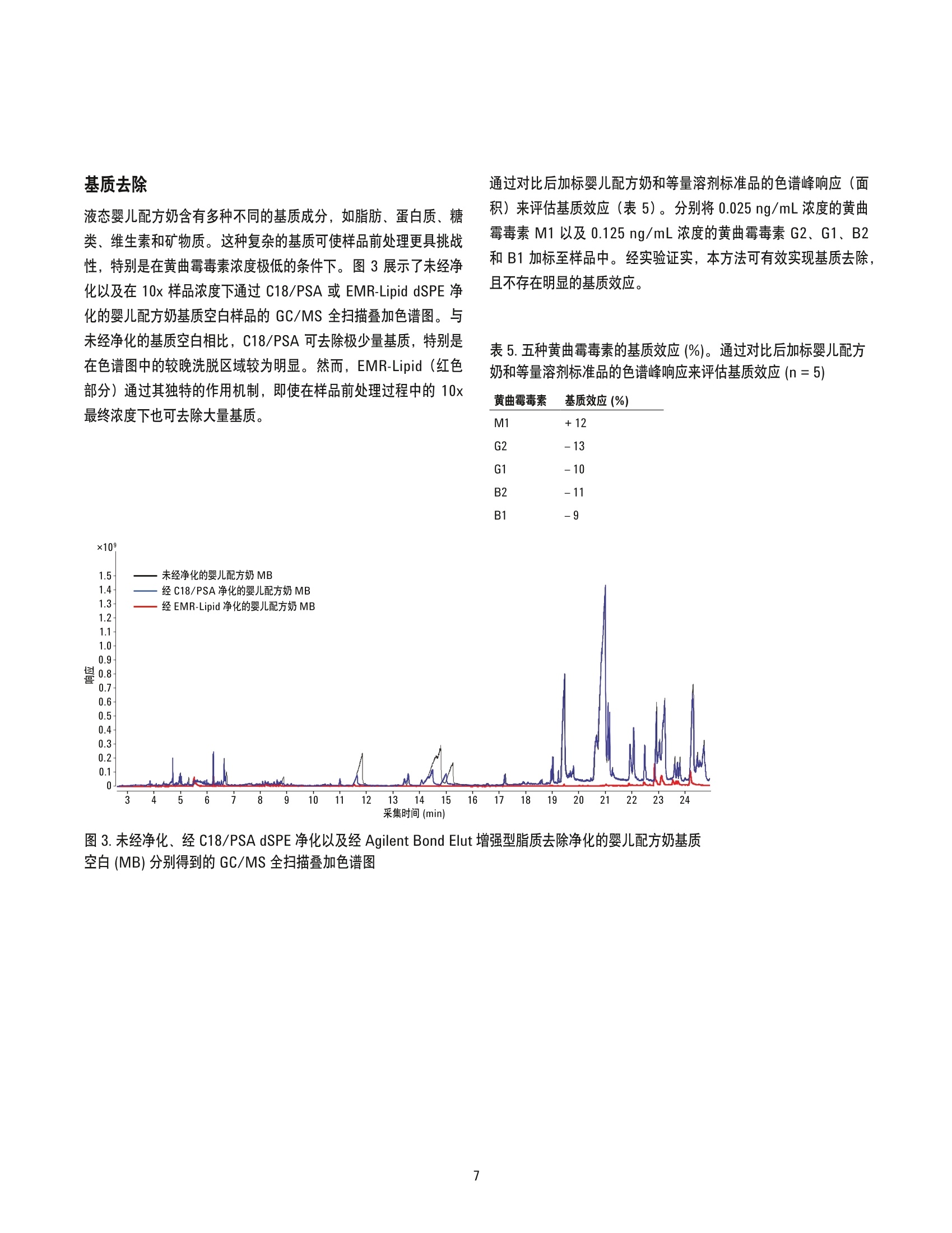
增强型脂质去除产品 EMR-Lipid 通过LC/MS/MS对婴儿配方奶进行黄曲霉毒素分析 应用简报食品检验 作者 摘要 Megan Juck 安捷伦科技有限公司 黄曲霉毒素 M1 是牛奶中最主要的一种黄曲霉毒素。欧盟委员会(EC) 规定欧洲婴儿配方奶中该物质的最大浓度为 0.025 ug/kg。在美国,食品和药品监督管理局(FDA)规定牛奶中黄曲霉毒素的干预浓度为 0.5 pg/kg。本应用简报介绍了采用 Agilent Bond Elut增强型脂质去除产品 EMR-Lipid 通过 LC/MS/MS 对婴儿配方奶中的黄曲霉毒素M1、G2、G1、B2和B1进行测定。本研究首先采用 QuEChERS 萃取,然后采用 EMR-Lipid 分散式固相萃取 (dSPE) 进行净化。该方法可使所有浓度的所有黄曲霉毒素实现出色的回收率(88%-113%)与精密度 (RSD=1.3%-13.6%)。由于充分的基质去除,其定量限(LOQ)要远远低于美国和欧洲的法规限值。这一简单而稳定的方法仅需极少设备和专业技术,因此可在食品实验室中实现轻松应用。 Agilent Technologies 真菌毒素是真菌的次生代谢产物,是全球食品和饲料供应中最常见的污染物之一。联合国粮食及农业组织(FAO) 估计世界上有多达25%的农产品受到了真菌毒素的污染。这种污染会造成灾难性的经济损失,对粮食产业而言更是如此[1]。黄曲霉毒素(表1)是由多种真菌(特别是黄曲霉和寄生曲霉)产生的一类真菌毒素[2]。黄曲霉毒素M1 是牛奶中最常见的真菌毒素,奶牛食用了受黄曲霉毒素 B1污染的饲料并对其进行代谢后即可产生黄曲霉毒素 M1 [3]。美国食品和药品监督管理局(FDA)以及欧盟委员会 (EC) 均已对多种食品中的黄曲霉毒素限值进行了规定[4.5]。表2总结了美国和欧洲的 FDA 和 EC 黄曲霉毒素限值。 黄曲霉毒素的法规限值极低,在婴儿食用的乳制品基质和配方奶中更是如此。为去除基质干扰以增强低浓度下的分析物信号,样品前处理必不可少。通常使用免疫亲和柱分析多种包括黄曲霉毒素在内的真菌毒素[6-9]。但这类色谱柱价格昂贵,并需要采用对食品实验室来说并不方便的独特的多种工作流程。快速、简便、经济、高效、耐用和安全的QuEChERS 方法针对样品采用简单的三步流程(萃取、净化和分析)。因此,该方法在谷物和乳制品中包括黄曲霉毒素在内的多种不同分析物和基质的前处理方面极具前景[3,10,11]。但通过 C18 或 PSA 进行的 QuEChERS 净化在分析肉类和牛奶等含有大量脂质的样品时有一定限制。这种限制来自于与目标分析物的非选择性相互作用以及几乎无法去除的主要脂类物质。所有残留的脂质均会聚集于分析流路中,从而导致维护次数增加、色谱图异常,并大大降低数据准确度和精密度。 Agilent Bond Elut 增强型脂去去除产品 EMR-Lipid 是一种新型吸附剂,该产品结合了独特的体积排阻和疏水相互作用,可选择性去除样品中的主要脂类,且不会保留不需要的其他分析物。这种吸附剂可用于通过 QuEChERS 进行的 dSPE 净化以及蛋白质沉淀工作流程,有有于实现简单高效的净化[12,13]。本研究对婴儿配方奶中的五种黄曲霉毒素进行了分析。婴儿配方奶富含脂质且有明确的黄曲霉毒素法规限值,因此选择它作为基质。在QuEChERS 萃取后进行EMR-Lipid dSPE 净化,并使用无水MgSO,进行增强的样品(净化)后处理(步骤),可获得出色的基质去除效果。本应用简报证实了 EMR-Lipid 在三种不同浓度的黄曲霉毒素分析中的有效性。 表1.五种黄曲霉毒素的化学和物理信息 黄曲霉毒素 分子式 结构 pKa logP M1 C7H120, 0 0 11.4 0.93 OH 0 H B1 CH20 1.58 0 H B2 C7H140 1.57 H. G1 CH20, H 1.37 H. G2 C7H1407 1.36 表 2. EC 与 FDA 规定的相关基质中的黄曲霉毒素限值 黄曲霉毒素 限值(pg/kg) 基质 监管机构 M1 0.025 婴儿配方奶 EC [5] 0.05 生牛奶 EC [5] 0.50 生牛奶 FDA [14] B1 0.10 婴儿食品 EC [5] 2-12* 普通食品 EC [5] B1+B2+G1+G2 4-15* 坚果、无花果、干果、谷类、玉米、调味料 EC [5] (总浓度) 20 普通食品 FDA [15]** 20-300 动物饲料 FDA[16]** *参见欧盟委员会法规第1881/2006号了解相关特定基质[5]。 **黄曲霉毒素 B1的归属必须通过化学衍生物的生成得到确证[15,16]。 实验部分 试剂与化学品 所有试剂均为 HPLC级或更高等级。乙腈(ACN)和甲醇购自Honeywell (Muskegon, MI, USA)。水的净化处理由 EMD MilliporeMilli-Q Integral 系统 (Darmstadt, Germany)完成。试剂级甲酸(FA,部件号 G2453-85060)来自安捷伦科技公司。欧州标准物质 ERM-BD283 (含低浓度黄曲霉毒素 M1 的全脂奶粉)购自LGC Standards (Teddington, Middlesex, UK)。黄曲霉毒素 M1(10 pg/mL, 溶于乙腈)、黄曲霉毒素混合物(B1、G1、B2、G2: 均为 20 ug/mL, 溶于乙腈)以及甲酸铵购自 Sigma-Aldrich公司 (St. Louis, MO, USA)。根据生厂商的建议,黄曲霉毒素标准储备溶液分别在2-8C(M1) 以及-20 ℃ (B1、B2、G1、G2混合物)下储存。液态即食婴儿配方奶购自当地杂货店。 设备 所用的仪器与材料: ·上Eppendorf 移液器和连续分液器 涡旋仪和多管涡旋仪 (VWR, Radnor, PA,USA) ( Geno/Grinder (SPEX, M etuchen, NJ, USA) ) ( Centra CL3R 离心机 (Thermo IEC,MA, USA) ) ( ·T T urbovap LV (Biotage, Charlotte, NC,USA) ) ( ·E Eppendorf 微量离心机(Brinkmann Inst r uments, Westbury, NY,USA) ) ( Agilent Bond Elut 早期 QuEChERS方法(无缓冲盐)萃取试 剂盒(10g样品),配有陶瓷均质子(部件号5982-5550CH) ) ( Agilent Bond Elut EMR-Lipid dSPE 增强型脂质去争净化管 (部件号5982-1010) ) ( ● A g ilent Bond Elut EMR-Li p id Polish MgSO 反萃管(部件号 5982-0102) ) 仪器 采用 Agilent 1290 Infinity LC 进行分析, 其中包括: · Agilent 1290 Infinity 二元泵 (G4220A) 配备Agilent 1290 FC/ALS 温控装置 (G1330B) 的 Agilent1290 Infinity 高性能自动进样器 (G4226A) · Agilent 1290 Infinity 柱温箱(G1316C) 该液相色谱系统联用配备安捷伦喷射流电喷雾离子化技术的Agilent 6460A 三重四极杆 LC/MS/MS 系统。采用 AgilentMassHunter 工作站软件进行所有的数据采集和分析。 样品前处理 取液态婴儿配方奶(10mL) 加入 50 mL 离心管中,并添加适量标准品作为质量控制(QC)样品。加入两粒陶瓷均质子及 10 mL乙腈,然后将样品涡旋混合2分钟。在样品中加入早期(非缓冲盐,10g样品)QuEChERS 萃取盐包。在机械振荡器中将样品混合2分钟, 然后在5000 rpm 下离心5分钟。在 EMR-Lipid dSPE增强型脂质去除净化管中加入 5mL水,然后加入5 mL样品粗提物。立即对样品进行涡旋混合,然后用多管涡旋仪继续涡旋混合60秒。将样品在 5000 rpm 下离心5分钟,然后将其倒入另一个空的15 mL离心管中。将 Polish 除脂萃取盐包中的无水硫酸镁(MgSO4) 加入萃取液中。立即将样品涡旋混合60秒以分散其中的盐,然后以5000 rpm 离心3分钟。将上清液移至含有1.5gMgSO (来自新的 Polish 除萃萃取盐包) 的 15 mL 离心管中。立即对样品进行涡旋混合,然后再次涡旋混合60 秒。以 5000 rpm离心3分钟后,将最终样品(1mL)转移至一个16×100 mm 的玻璃试管中,并在50°℃下用氮气吹干。吹干前需要向空白基质中加入校准标样。用100pL含有0.1%甲酸/乙腈(80/20)的水对样品进行复溶,并涡旋混合至少2分钟。然后对样品进行超声处理与离心(如需要)。将最终样品转移至带内衬管的样品瓶中进行 LC/MS/MS分析。图1展示了整个样品前处理过程。 仪器条件 HPLC 色谱: Agilent Poroshell 120 SB-C18 2.1×100 mm, 2.7 pm (部件号685775-902) 保护沐: Agilent Poroshell 120 SB-C18 UHPLC 保护柱, 2.1 mm×5mm, 2.7 pm (部件号821725-912) 流动相: A)含有0.1%甲酸的5mM甲酸铵水溶液 B)含有0.1%甲酸的5mM甲酸铵的 50/50乙腈/ 甲醇溶液 流速: 0.3 mL/min 柱温: 40°℃ 自动进林器温度: 4°C 进样量: 5pL 注射针清洗: 1:1:1:1乙腈:甲醇:异丙醇:水,含0.2%甲酸 梯度: 时间 (min) 0 7 7.25 95 停止时间: 11 min 后运行时间: 2 min MS 电喷雾电离(ESI), 正离子模式 气体温度: 325°C 载气流速: 10L/min 雾化器压力: 50 psi 鞘气温度: 350°C 鞘气流速: 11 L/min 毛细管电压: 4000V Delta EMV (+): 300 V 时间段: 编号 时间 (min) 分流阀0 至废液2 2 至质谱 图1.通过 Agilent Bond Elut 增强型脂质去除净化及采用 MgSO的增强的样品(净化)后处理(步骤)对液态婴儿配方奶中黄曲霉毒素的样品前处理方案 表3.目标分析物的 LC/MS/MS dMRM 参数和保留时间 子离子 RT 母离子 碎裂电压 定量离子 定性离子 分析物 (min) (m/z) (V) (m/z) (m/z) 黄曲霉毒素 M1 4.28 329.1 143 273.1 21 229 黄曲霉毒素 G2 4.55 331.1 164 313.1 25 245 33 黄曲霉毒素 G1 4.88 329.07 149 243.1 25 115.1 80 黄曲霉毒素 B2 5.13 315.09 174 287.1 25 259.1 29 黄曲霉毒素B1 5.44 313.07 169 241 41 128 80 校准标样和质量控制 将储备液用乙腈稀释制得黄曲霉毒素工作溶液,浓度分别为2 ug/mL (黄曲霉毒素M1) 和10pg/mL (黄曲霉毒素 G2、G1、B2和B1)。为满足不同的法规限值要求,黄曲霉毒素 M1 的浓度比其他黄曲霉毒素的浓度低5倍。通过对工作溶液进行适当稀释而制得 100x 最终浓度的校准品和 QC标准品。表4列出了婴儿配方奶中校准品和QC 样品的最终浓度。将工作溶液、所有校准品及所有 QC标准品均置于棕色瓶于2-8℃下储存。在萃取前,向基质空白婴儿配方奶中加入 100 pL 的相应 QC 标准品。而对于基质匹配校准标样,在吹干前向 990 uL的基质空白乙腈萃取液中加入10pL适当校准标样。 表4.婴儿配方奶中的预加标 QC和后加标校准样品的最终浓度 标准品* (ng/mL) (ng/mL) 校准品1 0.01 0.05 校准品2 0.02 0.10 校准品3 0.10 0.50 校准品4 0.50 2.50 校准品5 1.00 5.00 校准品6 2.50 12.5 低 QC 0.025 0.125 中Qc 0.25 1.25 高 Qc 2.00 10.0 *通过加标制得 100x最终浓度的标准品。 根据信噪比 (S/N)标准得知,为达到黄曲霉毒素M1的预期定量限(LOQ),需要对样品采用浓缩步骤。分别对 5x、 10x和 20x浓度进行评估后发现,在给定的仪器设置下, 10x 浓度可满足 LOQ和方法的需求。图2展示了在经过 QuEChERS 萃取、EMR-Lipid净化以及采用MgSO,的增强的样品(净化)后处理(步骤),婴儿配方奶中黄曲霉毒素的 LC/MS/MS dMRM 色谱图。 图 2.经过 QuEChERS 萃取、Agilent Bond Elut 增强型脂质去除净化以及采用 MgSO 的增强的样品(净化)后处理(步骤)的液态婴儿配方奶中黄曲霉毒素的 LC/MS/MS dMRM 色谱图 基质去除 液态婴儿配方奶含有多种不同的基质成分,如脂肪、蛋白质、糖类、维生素和矿物质。这种复杂的基质可使样品前处理更具挑战性,特别是在黄曲霉毒素浓度极低的条件下。图3展示了未经净化以及在 10x样品浓度下通过 C18/PSA 或 EMR-Lipid dSPE 净化的婴儿配方奶基质空白样品的 GC/MS 全扫描叠加色谱图。与未经净化的基基空白相比, C18/PSA 可去除极少量基质,特别是在色谱图中的较晚洗脱区域较为明显。然而, EMR-Lipid(红色部分)通过其独特的作用机制,即使在样品前处理过程中的10x最终浓度下也可去除大量基质。 通过对比后加标婴儿配方奶和等量溶剂标准品的色谱峰响应(面积)来评估基质效应(表5)。分别将 0.025 ng/mL 浓度的黄曲霉毒素M1以及0.125 ng/mL 浓度的黄曲霉毒素 G2、G1、B2和B1加标至样品中。经实验证实,本方法可有效实现基质去除,且不存在明显的基质效应。 表5.五种黄曲霉毒素的基质效应(%)。通过对比后加标婴儿配方奶和等量溶剂标准品的色谱峰响应来评估基质效应(n=5) 黄曲霉毒素 基质效应(%) M1 +12G2 -13G1 -10B2 -11 图3.未经净化、经 C18/PSA dSPE 净化以及及 Agilent Bond Elut 增强型脂质去除净化的婴儿配方奶基质空白(MB)分别得到的 GC/MS 全扫描叠加色谱图 线性和 LOQ 婴儿配方奶中的黄曲霉毒素M1 以及黄曲霉毒素 G2、G1、B2和B1的线性范围分别为 0.01-2.50 ng/mL 和 0.05-12.5 ng/mL。表6展示了本研究中每种黄曲霉毒素的线性范围、以R²值表示的回归/权重以及 LOQ。根据方法性能通过实验得出 LOQ。黄曲霉毒素 M1的 LOQ可低至美国干预浓度与欧洲最大浓度以下。 表6.每种黄曲霉毒素的校准详情(回归拟合、权重、R²值、线性范围及 LOQ) 线性范围 LOQ 黄曲霉毒素 权重 R2 (ng/mL) (ng/mL) M1 线性拟合, 1/x² 0.9931 0.01-2.50 0.01 G2 线性拟合,1/x 0.9990 0.05-12.5 0.05 G1 线性拟合,1/x 0.9994 0.05-12.5 0.05 B2 线性拟合, 1/x 0.9986 0.05-12.5 0.05 B1 线性拟合,1/x 0.9987 0.05-12.5 0.05 回收率与重现性 本研究评估了该方法的回收率与重现性。通过对空白液态婴儿配方奶加标0.025、0.25和 2.00 ng/mL 浓度的黄曲霉毒素 M1 来制备QC标准品(n=6)。此外,还分别在0.125、1.25和10.0 ng/mL的浓度下制备了黄曲霉毒素 G2、G1、B1和 B2 的 QC标准品。然后采用本应用简报之前详述的流程对样品进行萃取。按前述方法制备一系列校准品,并在整个运行过程对其进样(总数为6)以检查仪器响应是否有显著变化,结果表明其中无变化。通过在基质匹配校准曲线中对比预加标 QC 样品的响应而计算出它们的回收率。图4和5列出了回收率和相对标准偏差 (RSD) 数据。全部五种黄曲霉毒素在全部三个 QC 浓度下的平均回收率约为101%, 平均 RSD <5.0%。 图4. 采用 Agilent Bond Elut 增强型脂质去除净化得到的液态婴儿配方奶中五种黄曲霉毒素的回收率(%)。(n=6) 图5.采用 Agilent Bond Elut 增强型脂质去除净化得到的液态婴儿配方奶中五种黄曲霉毒素的 RSD (%)。 (n=6) 已选样品 无法购买到含有黄曲霉毒素的已选婴儿配方奶参比标样。因此,采用欧洲标准物质 (ERM)-BD283(含有低浓度黄曲霉毒素M1的全脂奶粉)进一步评估本应用简报中详述的方法。该标准品的报道标准值为0.111 +0.018 pg/kg [17]。根据 ERM 认证报告中详述的生产商建议对该全脂奶粉标准品进行复溶。简言之,在10g全脂奶粉中加入 100 mL水,即采用十倍稀释。因此,复溶奶的浓度应为报道浓度的十分之一,即0.0093-0.0129 ng/mL。然后采用之前详述的相同流程对该复溶样品进行萃取。在一批样品中对已选样品(n = 1) 进行分析,这些样品中包括一组完整的校准品以及三个不同浓度的 QC (n=3)。此外由于已选样品的预计含量与方法的 LOQ (黄曲霉毒素 M1 为0.01 ng/mL)十分接近,因此额外增加了一个浓度为 0.01 ng/mL 的 LOQ QC (n=3)。表7列出了此次运行得到的结果。ERM-BD283的定量分析结果为0.0101 ng/mL, 处于标准物质的预期浓度范围内。这一结果证明了该方法在分析固态(通过加水)和液态婴儿配方奶样品中的灵活性和通用性。 表 7.已选样品(n=1)和QC样品(n=3)中黄曲霉毒素 M1 的分析结果 预期浓度 计算浓度 样品 (ng/mL) (ng/mL) 准确度 RSD 低 QC 0.025 0.0219 88 1.9 中QC 0.25 0.2378 95 1.1 高QC 2.00 2.0285 101 0.6 LOQ QC 0.01 0.0107 107 4.7 ERM-BD283 0.0111 0.0101 91 无 结论 本文开发了一个简单高效的婴儿配方奶中黄曲霉毒素的 LC/MS/MS分析方法。通过 QuEChERS 流程、Agilent Bond Elut EMR-LipiddSPE 净以以及采用 MgSO,的增强的样品(净化)后处理(步骤)对样品进行萃取。该方法在较宽的线性范围内实现了高回收率(平均101%)和高精密度(平均 RSD<5.0%)。经过浓缩步骤后 LOO可降至法规限值以下,且不存在不必要的基质效应。 该方法证明使用 EMR-Lipid 可有效去除基质且不会造成分析物的意外损失。出色的仪器洁净度可改善色谱性能并减少维护和故障排除,可同时节省时间与成本。该解决方案仅需极少专业技能与设备,可在食品实验室中实现轻松应用。虽然该应用仅对其中一类真菌毒素进行了重点研究,但 EMR-Lipid 的设计可用于多残留应用。因此, EMR-Lipid 不同于免疫亲和柱,可轻松应用于多类真菌毒素分析。下一步工作将继续研究 EMR-Lipid 净化在其他复杂的高脂肪含量样品中的应用。 ( 参考文献 ) ( 1. J ard, G .; Liboz, T.; Mathieu, F .; Guyonvarc'h ; Lebrihi, A.Review of mycotoxin reduction i n food and feed: from prevention in the field to d etoxification by adsorption or transformation. Food Additives and Contaminants: Part A. 2011,28(11), 1590-1609 ) ( 2. W ang, H. ; Zhou, X. J.; Liu, Y. Q.; Yang, H. M.; Guo, Q. L.Determination of aflatoxin M1 in milk by triple quadrupole liquid chromatography-tandem m ass spectrometry. Food Additives and Contaminants: Part A. 2010,27(9), 1261-1265 ) 3. SSartori, A. V.; Swensson de Mattos,J.; Paulino de Moraes,M. H., Wanderley de Nobrega, A. Determination ofAflatoxins M1,M2, B1, B2, G1, and G2 and Ochratoxin A inUHT and Powdered Milk by Modified QuEChERS Methodand Ultra-High-Performance Liquid ChromatographyTandem Mass Spectrometry. Food Analytical Methods2015,8(9),2321-2330 4. Anon. Guidance for Industry: Action Levels for Poisonousor Deleterious Substances in Human Food and AnimalFeed; http://www.fda.gov/Food/GuidanceRegulation/GuidanceDocumentsRegulatoryInformation/ChemicalContaminantsMetalsNaturalToxinsPesticides/ucm077969.htm#afla. Accessed on 7 0ctober 2015 ( 5. Anon. C ommission R e gulation (EC) N o 1881/2006 of19 December 2006 setting maximum levels for certaincontaminants in foodstuffs; http://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX:02006R1881-20140701Accessed on 11 F eburary 2016 ) ( 6. Meucci, V.; Razzuoli, E .; Soldani, G.; Massart, F. Mycotoxindetection in infant formula milks in Italy. F ood Additives & Contaminants: Part A. 2 0 10, 27(1), 64-71 ) ( 7. D D ragacci, S.; Grosso, F ; Gilbert, J. Immunoaffinity ColumnCleanup with Liquid Chromatography f o r Determinationof Aflatoxin M~1 in Liquid Milk: Collaborative Study. J. of AOAC International 2001, 84(2), 437-443 ) ( 8. Iha, M. H.; Barbosa, C. B.;Okada,I . A. ; Trucksess, M. W. Occurrence of aflatoxin M1 in dairy products in B r azil. Food Contro/ 2011,22,1971-1974 ) ( 9. S S hundo, L.; Sabino, M. Aflatoxin M1 in milk by immunoaffinity column cleanup with TLC/HPLC determination. Brazilian Journal of Microbiology. 2006,37,164-167 ) ( 10. Bursic. V . P . ; Vukovic, G. Lj. ; Ja j ic, I. M . ; La z ic, S. D.; Cara, M. H.; C olovic, R. R. ; Vukmirovic, D. M. Analysis of Aflatoxins B1 and G 1 in M aize by QuEChERS. Jour. Na t . Sci, Matica Srpska N ovi Sad 2013, 124, 5 1-57 ) ( 11. Filigenzi, M. S.; Ehrke, N . ; Aston, L. S.; Poppenga, R. H .Evaluation of a rapid screening method for chemical contaminants of c oncern in four food-related matrices using QuEChERS extraction, UHPLC and hi g h resolutionmass spectrometry. Food Additives & Contaminants:Part A. 2011, 28 (10) , 1324-1339 ) 12. Zhao, L.; Lucas, D. 使用 Agilent Bond Elut 增强型脂质去除产品 EMR-Lipid 对牛油果中的农药多留留进行LC/MS/MS 分析;应用简报,安捷伦科技有限公司,出版号5991-6098CHCN, 2015 查找当地的安捷伦客户中心: www.agilent.com/chem/contactus-cn 免费专线: 800-820-3278,400-820-3278(手机用户) 联系我们: LSCA-China_800@agilent.com 在线询价:www.agilent.com/chem/erfq-cn ( 13.Zhao, L.; Lucas, D. 采用 LC/MS/MS进行牛肝中的 兽药多残留分析,应用简报,安捷伦科技有限公司, 出版号5991-6096CHCN, 2015 ) 14.Anon. CPG Sec. 527.400 Whole Milk, Lowfat Milk,Skim Milk -Aflatoxin M1; http://www.fda.gov/ICECI/ComplianceManuals/CompliancePolicyGuidanceManual/ucm074482.htm Accessed on 7 October 2015 15. Anon. CPG Sec. 555.400 Foods-Adulterationwith Aflatoxin; http://www.fda.gov/ICECI/ComplianceManuals/CompliancePolicyGuidanceManual/ucm074555.htm Accessed on 7 0ctober 2015 16. Anon. CPG Sec. 683.100 Action Levels for Aflatoxinsin Animal Feeds. http://www.fda.gov/ICECI/ComplianceManuals/CompliancePolicyGuidanceManual/ucm074703.htm Accessed on 7 0ctober 2015 17.Josephs, R.D.; Koeber, R.;Bernreuther, A.; Schimmel,H.; Ulberth, F.; EUR Report 21202 EN -DG JointResearch Centre, Institute for Reference Materials andMeasurements, 2005.https://ec.europa.eu/jrc/sites/default/files/rm/ERM-BD284_report.pdf 更多信息 这些数据仅代表典型的结果。有关我们的产品与服务的详细信息,请访问我们的网站 www.agilent.com。 www.agilent.com 仅限研究使用。不可用于诊断目的。 本文中的信息、说明和指标如有变更,恕不另行通知。 C安捷伦科技(中国)有限公司,2016 2016年3月31日, 中国出版 5991-6818CHCN 摘要 黄曲霉毒素 M1 是牛奶中最主要的一种黄曲霉毒素。欧盟委员会 (EC) 规定欧洲婴儿配方奶中该物质的最大浓度为 0.025 μg/kg。在美国,食品和药品监督管理局 (FDA) 规定牛奶中黄曲霉毒素的干预浓度为 0.5 μg/kg。本应用简报介绍了采用 Agilent Bond Elut增强型脂质去除产品 EMR-Lipid 通过 LC/MS/MS 对婴儿配方奶中的黄曲霉毒素 M1、G2、G1、B2 和 B1 进行测定。本研究首先采用 QuEChERS 萃取,然后采用 EMR-Lipid 分散式固相萃取 (dSPE) 进行净化。该方法可使所有浓度的所有黄曲霉毒素实现出色的回收率 (88%-113%) 与精密度 (RSD = 1.3%-13.6%)。由于充分的基质去除,其定量限 (LOQ)要远远低于美国和欧洲的法规限值。这一简单而稳定的方法仅需极少设备和专业技术,因此可在食品实验室中实现轻松应用。 前言 真菌毒素是真菌的次生代谢产物,是全球食品和饲料供应中最常见的污染物之一。联合国粮食及农业组织 (FAO) 估计世界上有多达 25% 的农产品受到了真菌毒素的污染。这种污染会造成灾难性的经济损失,对粮食产业而言更是如此 [1]。黄曲霉毒素(表 1)是由多种真菌(特别是黄曲霉和寄生曲霉)产生的一类真菌毒素 [2]。黄曲霉毒素 M1 是牛奶中最常见的真菌毒素,奶牛食用了受黄曲霉毒素 B1 污染的饲料并对其进行代谢后即可产生黄曲霉毒素 M1 [3]。美国食品和药品监督管理局 (FDA) 以及欧盟委员会 (EC) 均已对多种食品中的黄曲霉毒素限值进行了规定 [4,5]。表 2 总结了美国和欧洲的 FDA 和 EC 黄曲霉毒素限值。 黄曲霉毒素的法规限值极低,在婴儿食用的乳制品基质和配方奶中更是如此。为去除基质干扰以增强低浓度下的分析物信号,样品前处理必不可少。通常使用免疫亲和柱分析多种包括黄曲霉毒素在内的真菌毒素 [6-9]。但这类色谱柱价格昂贵,并需要采用对食品实验室来说并不方便的独特的多种工作流程。快速、简便、经济、高效、耐用和安全的 QuEChERS 方法针对样品采用简单的三步流程(萃取、净化和分析)。因此,该方法在谷物和乳制品中包括黄曲霉毒素在内的多种不同分析物和基质的前处理方面极具前景 [3,10,11]。但通过 C18 或 PSA 进行的 QuEChERS 净化在分析肉类和牛奶等含有大量脂质的样品时有一定限制。这种限制来自于与目标分析物的非选择性相互作用以及几乎无法去除的主要脂类物质。所有残留的脂质均会聚集于分析流路中,从而导致维护次数增加、色谱图异常,并大大降低数据准确度和精密度。 结论 本文开发了一个简单高效的婴儿配方奶中黄曲霉毒素的 LC/MS/MS分析方法。通过 QuEChERS 流程、Agilent Bond Elut EMR-LipiddSPE 净化以及采用 MgSO4 的增强的样品(净化)后处理(步骤)对样品进行萃取。该方法在较宽的线性范围内实现了高回收率(平均 101%)和高精密度(平均 RSD < 5.0%)。经过浓缩步骤后 LOQ 可降至法规限值以下,且不存在不必要的基质效应。 该方法证明使用 EMR-Lipid 可有效去除基质且不会造成分析物的意外损失。出色的仪器洁净度可改善色谱性能并减少维护和故障排除,可同时节省时间与成本。该解决方案仅需极少专业技能与设备,可在食品实验室中实现轻松应用。虽然该应用仅对其中一类真菌毒素进行了重点研究,但 EMR-Lipid 的设计可用于多残留应用。因此,EMR-Lipid 不同于免疫亲和柱,可轻松应用于多类真菌毒素分析。下一步工作将继续研究 EMR-Lipid 净化在其他复杂的高脂肪含量样品中的应用。
确定








还剩8页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《婴儿配方奶中黄曲霉毒素检测方案(液相色谱仪)》,该方案主要用于婴幼儿配方乳粉中真菌毒素检测,参考标准--,《婴儿配方奶中黄曲霉毒素检测方案(液相色谱仪)》用到的仪器有安捷伦 1290 Infinity 二元液相色谱系统(1290 LC)
推荐专场
该厂商其他方案
更多
















