方案详情
文
在进样之前用水稀释,可以使样品适合于 LC/MS/MS 分析并能保持早洗脱分析物的峰形良好。Agilent 1290 Infinity 液相色谱和Agilent 6490 三重四极杆液质联用系统灵敏度较高,使用直接稀释的样品仍可满足检测限的要求,与常用的干燥与复溶方法相比,这一工作流程能够节省大量时间和精力,并可防止可能发生的偏差和分析物损失。
方案详情

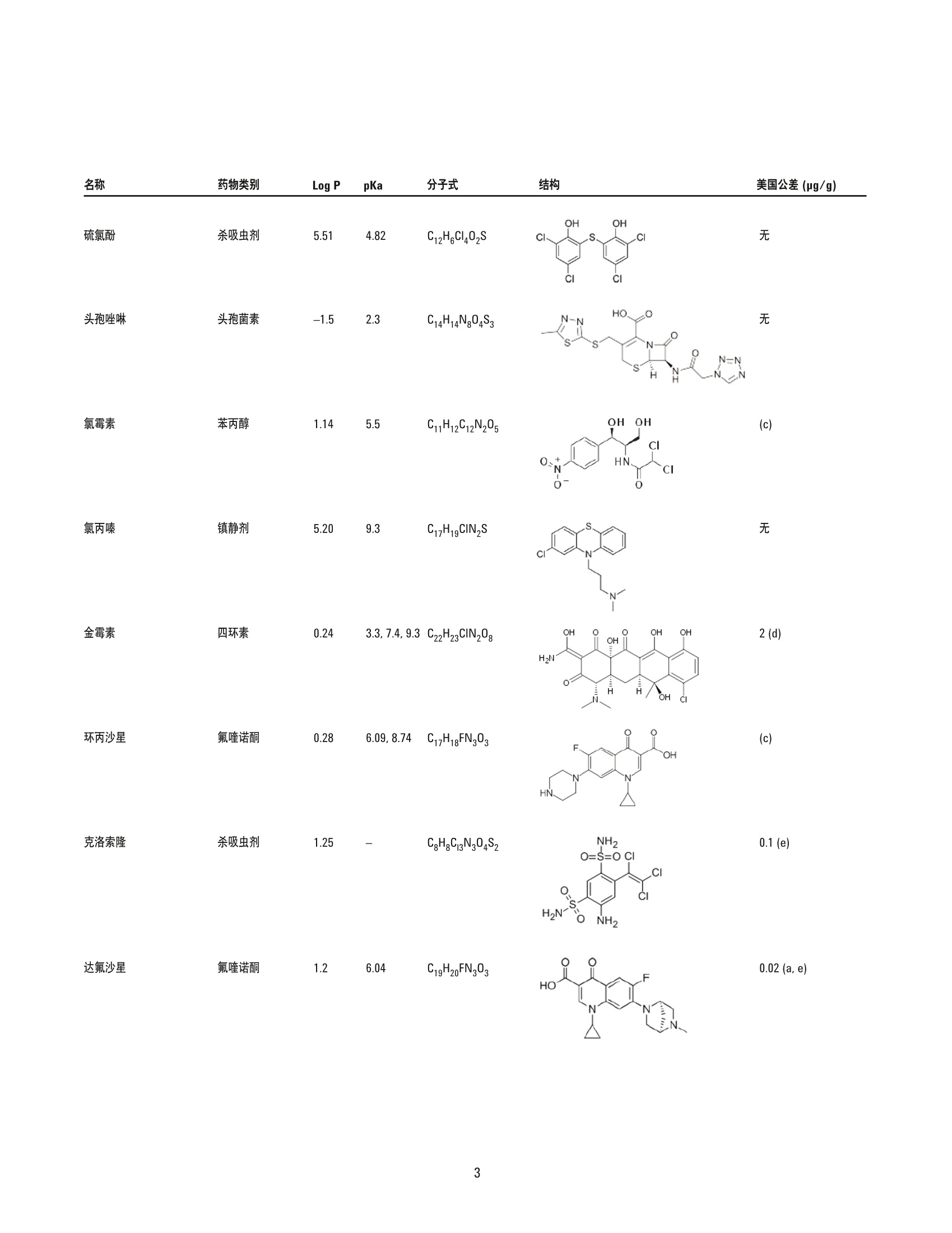
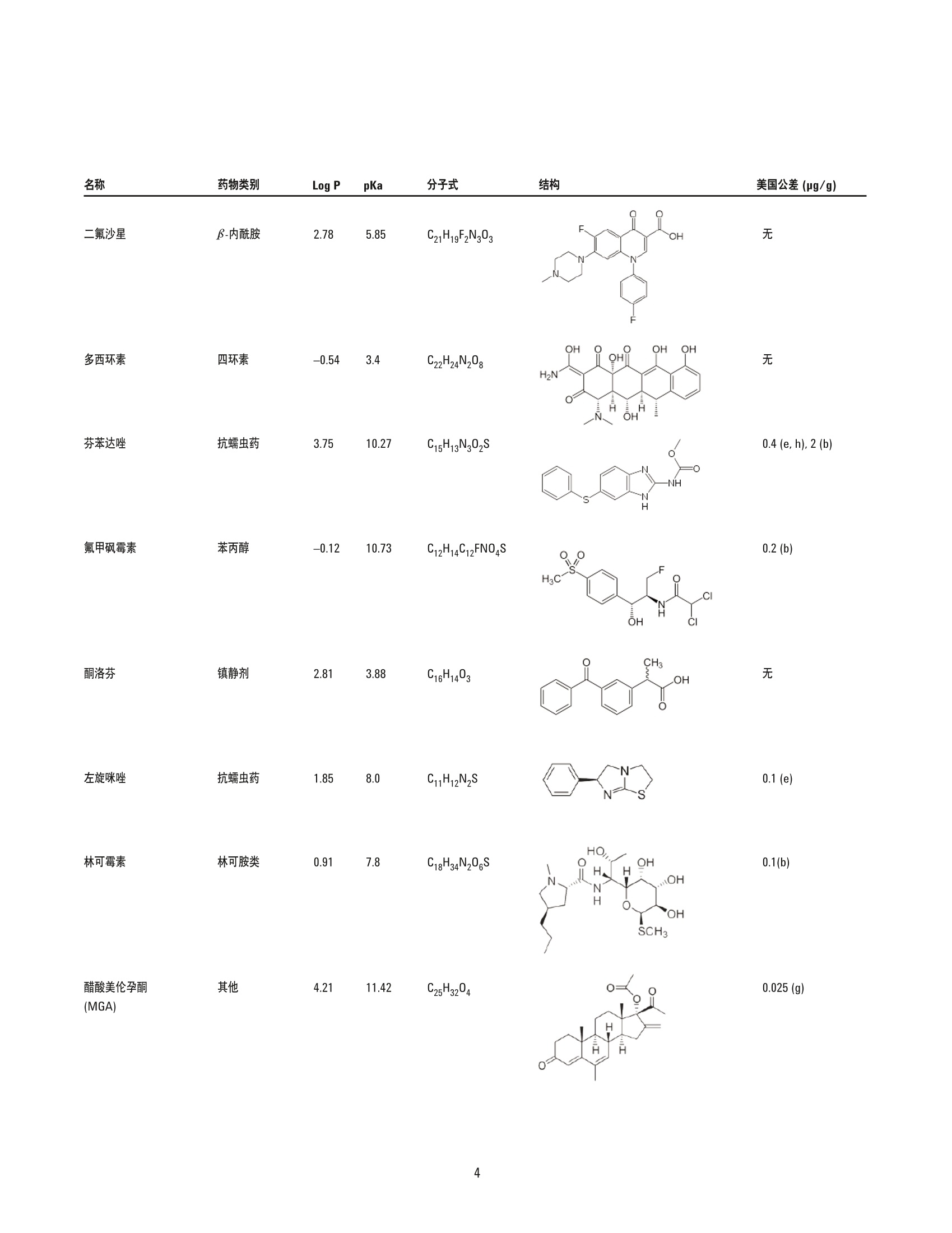
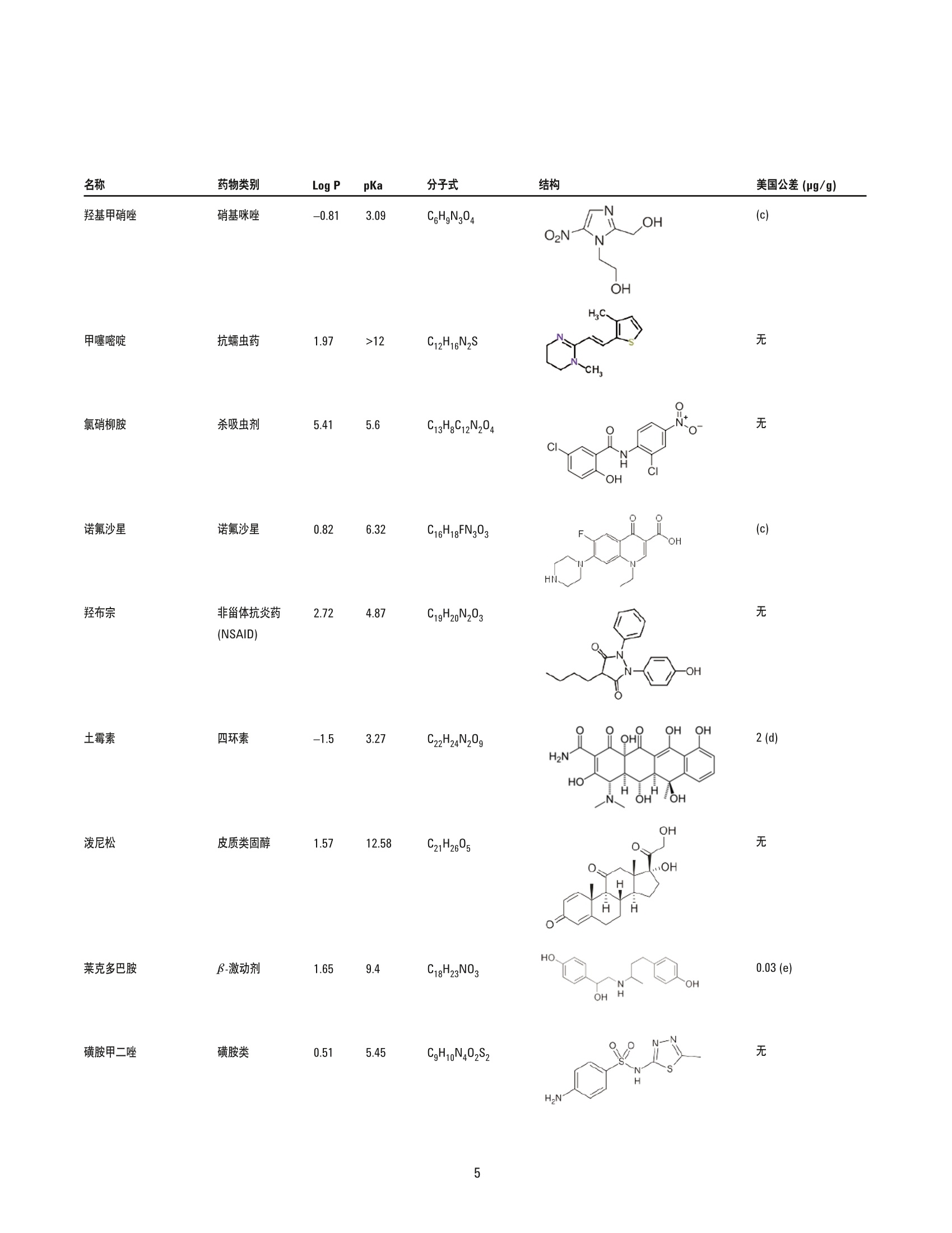
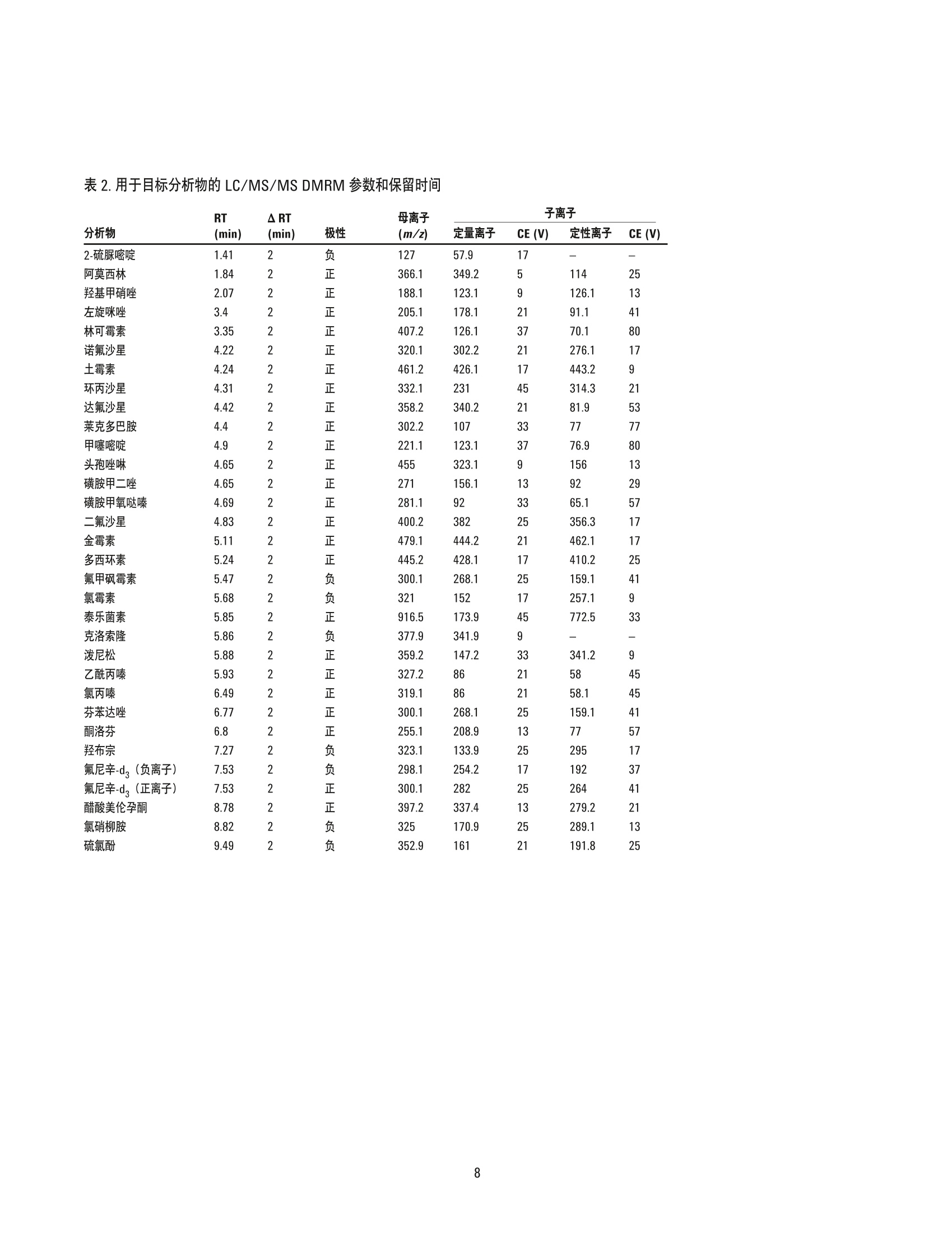
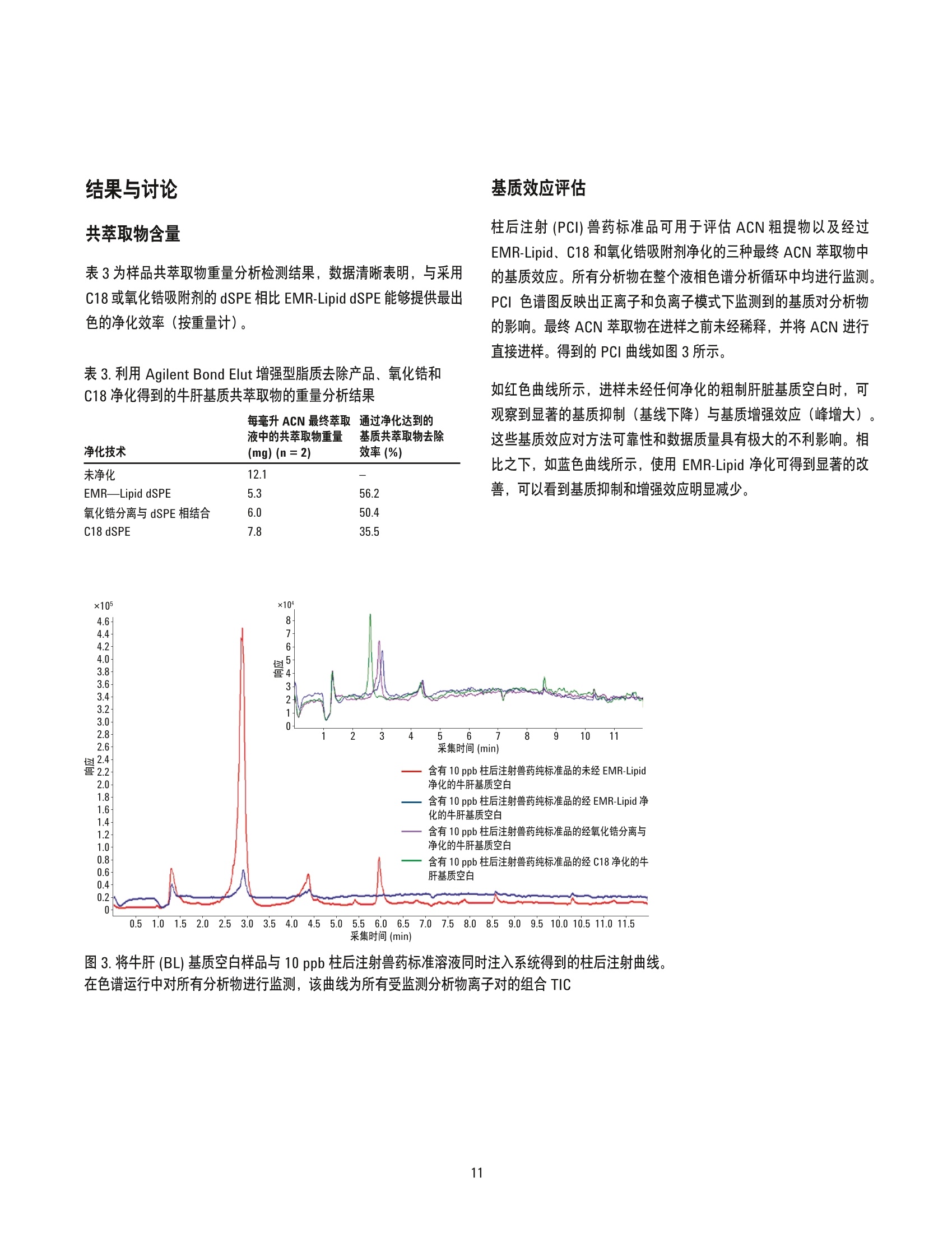
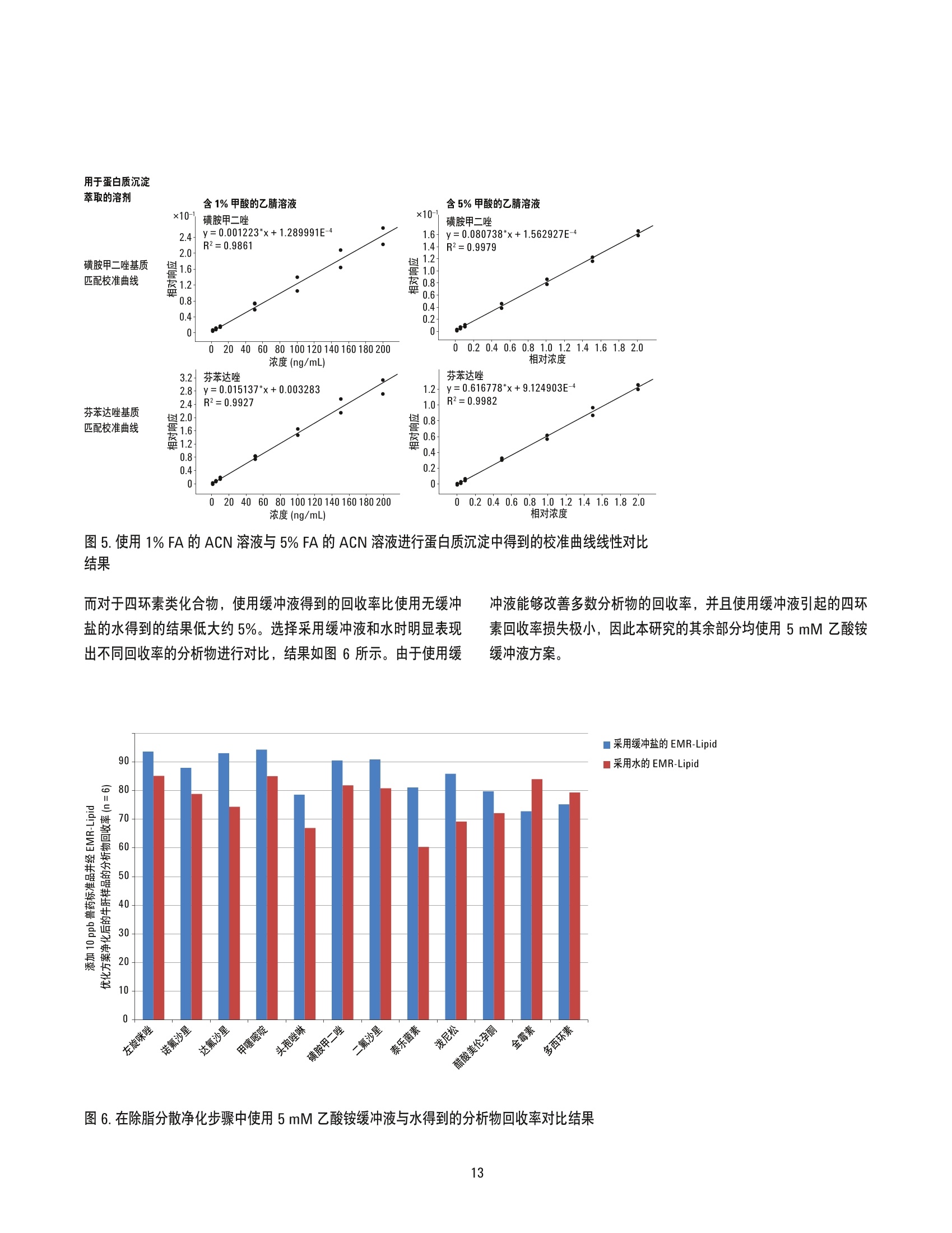
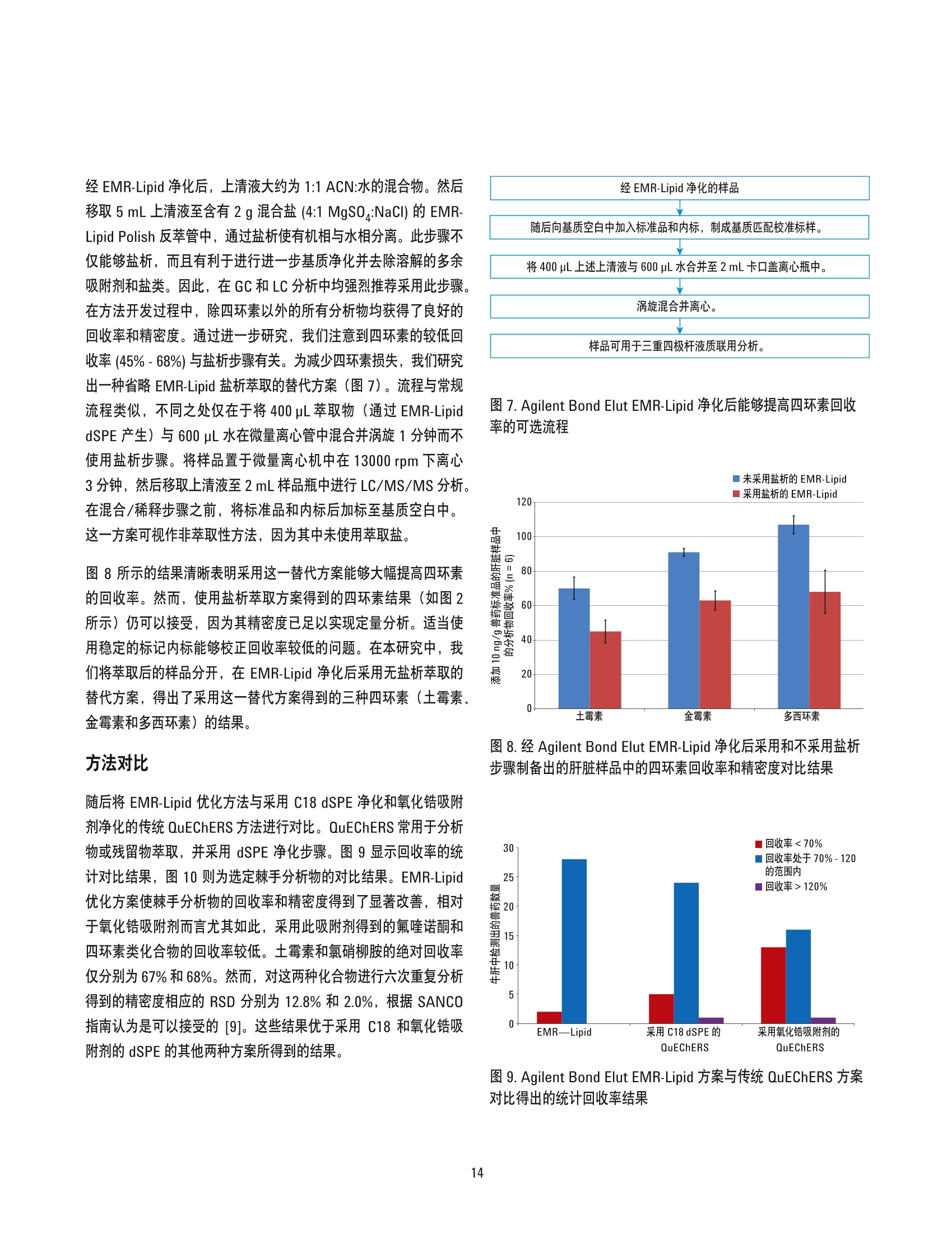
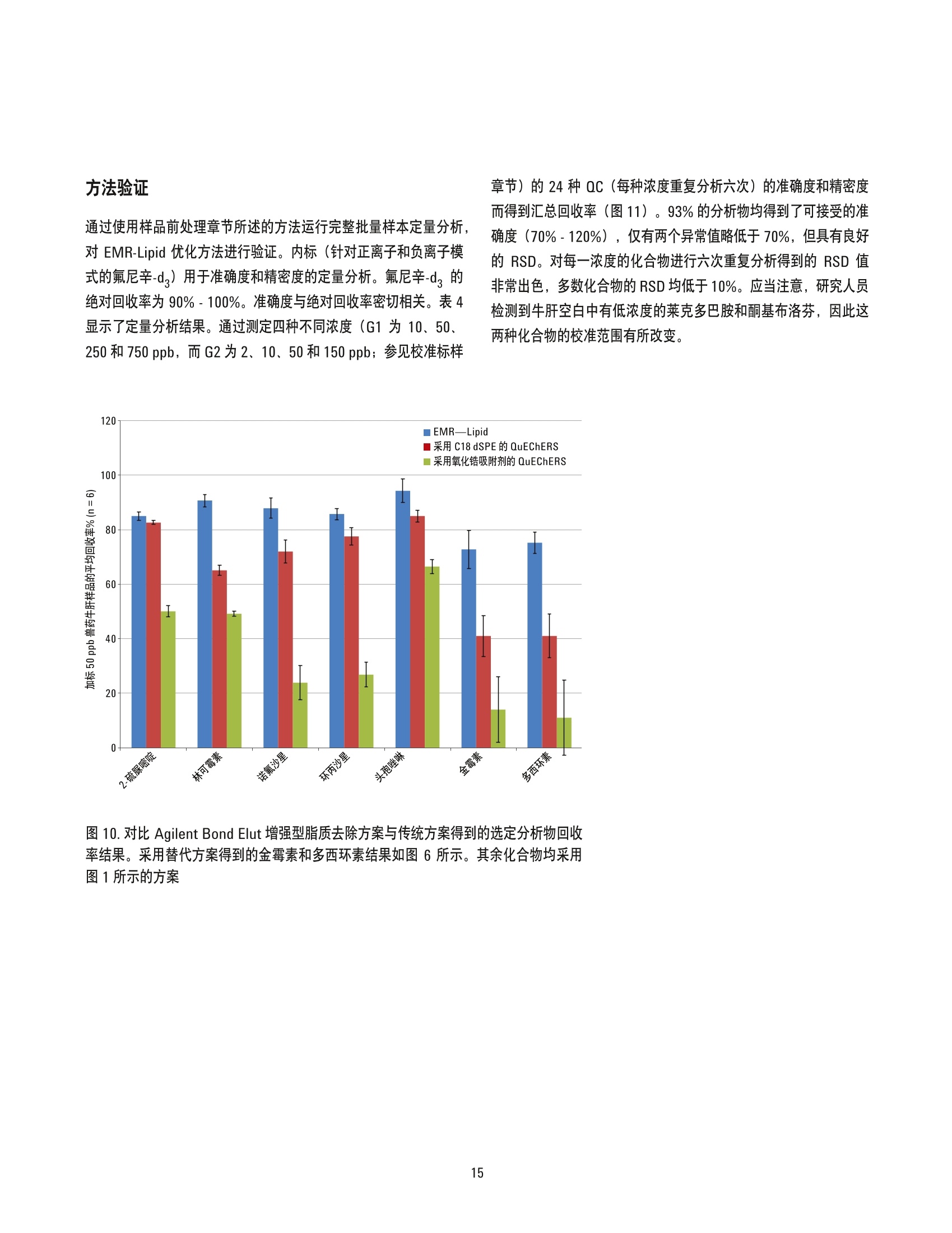
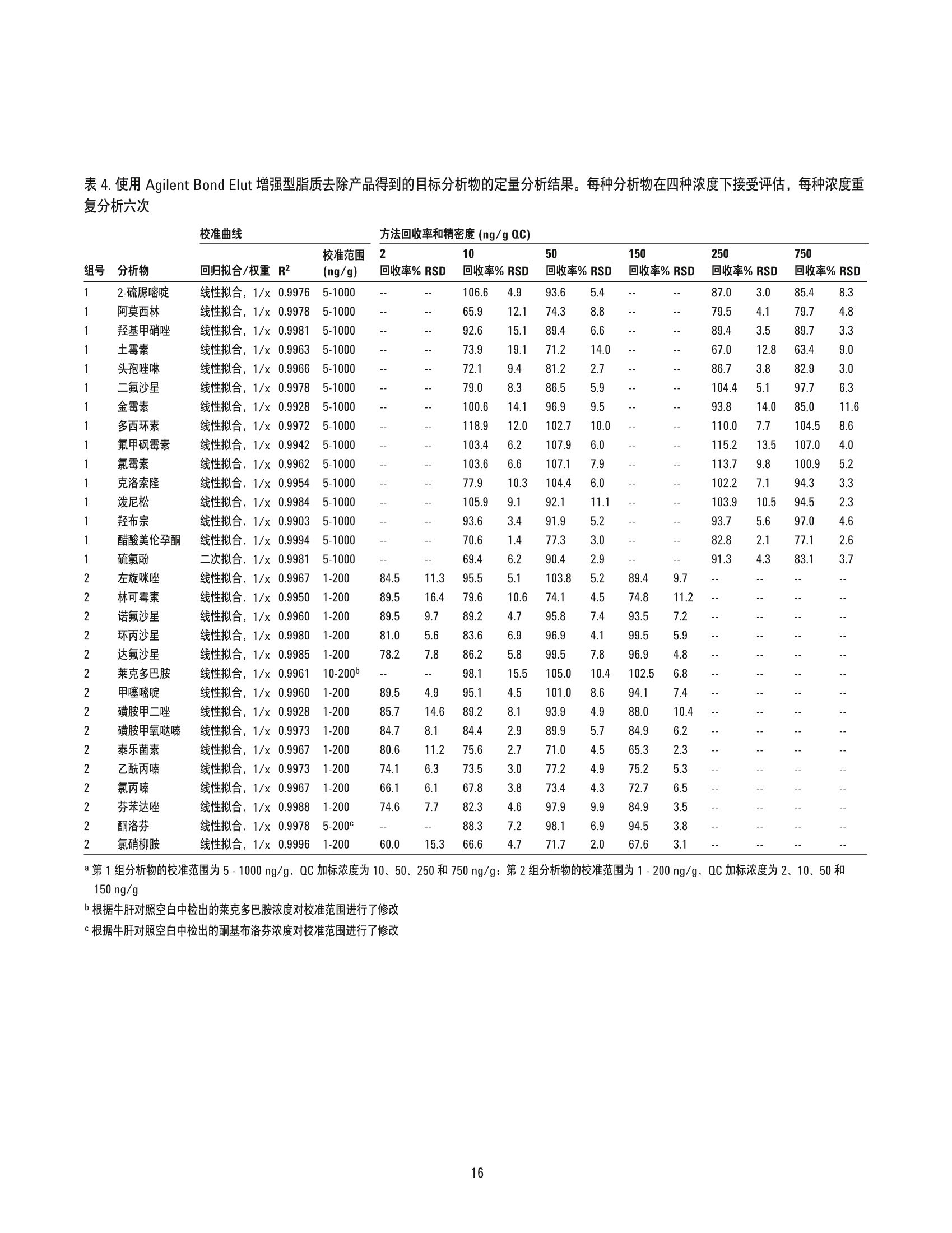
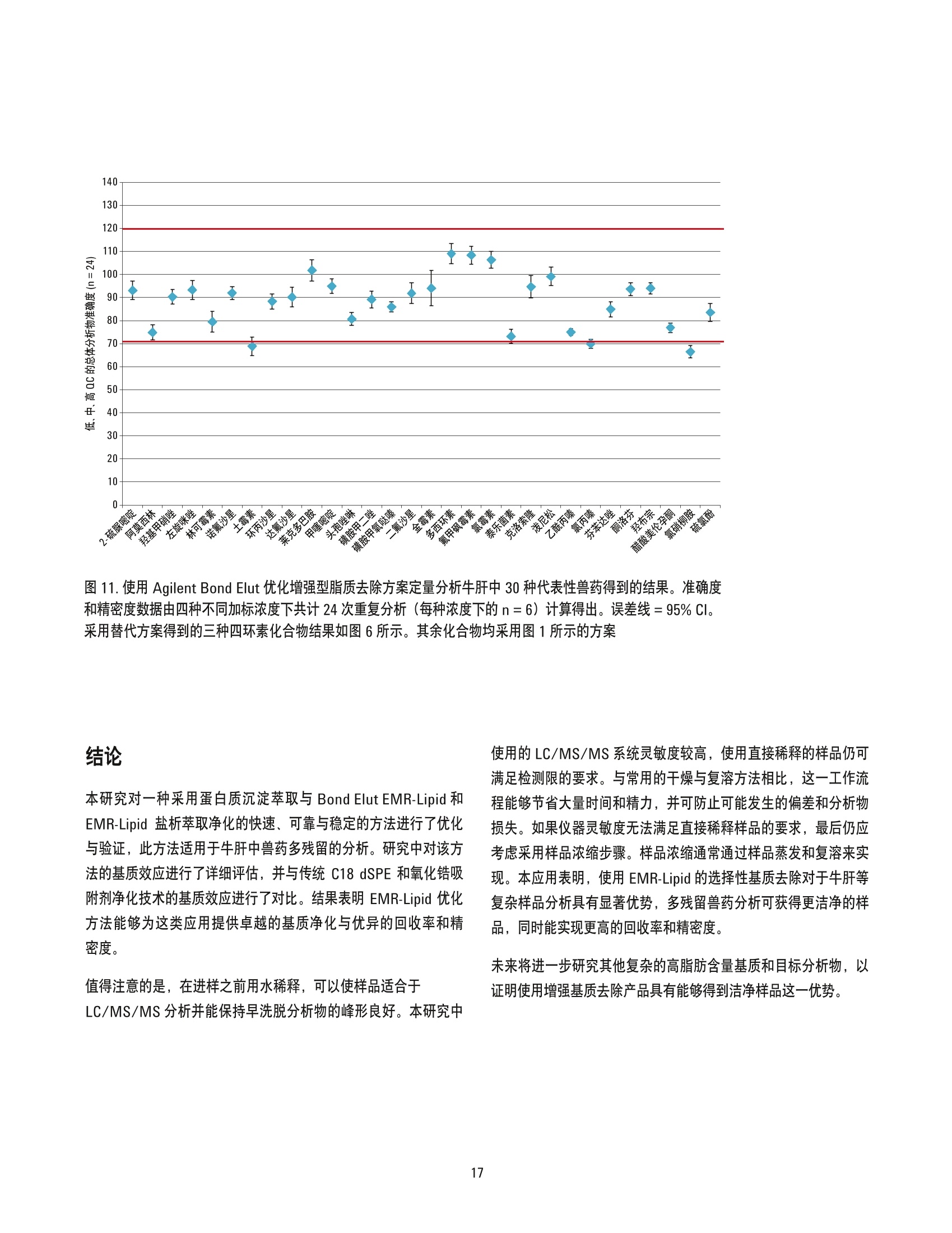
美国公差(pg/g) 作者 Limian Zhao 和 Derick Lucas 安捷伦科技有限公司 牛肝中兽药多残留的LC/MS/MS分析 Agilent Bond Elut QuEChERSEMR-Lipid增强型脂质去除产品 应用简报 食品检测与农业 摘要 Agilent Bond Elut QuEChERS 增强型脂质去除产品 (Agilent Bond Elut QuEChERSEMR-Lipid) 是新一代样品前处理产品,适用于便捷的分散固相萃取 (dSPE)。这种材料对于共萃取基质具有较高选择性,尤其适用于脂肪样品(脂肪含量>5%),而不会对分析物回收率产生不利影响。本研究介绍应用这款新型产品对牛肝中的30种代表性兽药进行的分析。分析流程包括利用酸化乙腈实现快速高效的蛋白质沉淀萃取,然后使用EMR-Lipid 增强型脂质去除净化管和 EMR-Lipid Polish 反萃管进行进一步净化。研究中通过共萃取物重量与柱后注射实验来测定由 EMR-Lipid 方案去除的基质量。与其他基质净化产品相比, EMR-Lipid 增强型脂质去除净化管能够提供更有效的基质去除和更出色的分析物回收率。EMR-Lipid 优化方法能够为各种浓度下的全部30种兽药提供卓越的洁净度以及优异的准确度和精密度,实现快速、稳定而有效的高脂肪含量样品分析。 兽药广泛用于食品生产行业的动物中,以预防动物疾病或作为生长促进剂。这些药物将在动物组织中发生富集,使用不当更是会导致药物残留在食用组织中不断积累,对人类健康构成威胁。随着人们对食品安全的日益关注,几乎每个国家都出台了限制食品动物产品中所使用药物的法规[1-4]。 肌肉、肝脏和鸡蛋等动物源食品通常具有复杂的化学成分,因此,采用包括常规萃取和高效净化的高效样品前处理方法至关重要。已有的样品前处理方法包括传统的溶剂萃取、固相萃取 (SPE)或多项技术的组合。这些方法通常费力费时,仅适用于有限的化合物类别,并且需要额外进行方法开发。 多类别、多残留方法在监管性监测项目中越来越受青睐,因为它们可以扩大分析范围并提高实验室效率。过去几年来接受监测的兽药数量越来越多,如今已报道了100多种兽药[5-8]。样品前处理通常包括采用乙乙:水混合物进行萃取,然后利用C18和/或其他净化技术进行净化。C18等吸附剂去除共萃脂质的能力有限,可能在稀释或复溶过程中产生沉淀。沉淀生成后需要在 LC/MS/MS 进样之前对样品进行过滤,这可能造成分析物损失。可以在分散固相萃取 (dSPE) 过程中加入己烷来去除共萃取液中的脂质,但这种方法费时费力且无选择性,并且会去除疏水性分析物。与 C18相比,使用氧化锆吸附剂进行净化能够改善基质净化效果, 但也会导致更多的分析物损失,对于氟喹诺酮、四环素和大环内酯等含羧酸和羟基的化合物而言尤其如此[7,8]。 Agilent Bond Elut QuEChERS EMR-Lipid 增强型脂质去除产品是一种新型吸附剂材料,能够选择性去除样品中的主要脂类而不会使分析物损失。去除复杂基质中的脂质干扰物对于 QuEChERS 和蛋白质沉淀等技术而言尤其重要。由于这些简单的样品前处理方法无法充分去除脂质,因此脂质共萃取物将与目标分析物一起保留到最终样品萃取物中。这会导致色谱峰异常、数据精密度和准确度下降以及维护问题增加。在本研究中,我们考察了一种用于分析牛肝中30种棘手的代表性兽药的新型样品前处理方法,该方法采用简单的蛋白质沉淀萃取后用 EMR-Lipid 进行净化。所选的兽药代表了17种不同的类别,包括亲水性、疏水性、酸性、中性和碱性药物。表1显示这些兽药的化学和法规信息。 表1.兽药的化学与物理性质 美国公差(pg/g) 名称 药物类别 Log P pKa 分子式 结构 美国公差(pg/g) 2-硫脲嘧啶 硫氧嘧啶类 -0.28 7.75 C4H4N20S 无 NH S 乙酰丙嗪 镇静剂 3.49 9.3 C19H22N2OS 无 阿莫西林 B-内酰胺 0.86 2.4 C16H19N30gS HO~ NH 0.01 名称 药物类别 Log P pKa 分子式 结构 硫氯酚 杀吸虫剂 5.51 4.82 C12H6C1402S OH OH C 无 CI CI 头孢唑啉 头孢菌素 -1.5 2.3 C14H14N804S3 HO.N 无 C S N-N H 氯霉素 苯丙醇 1.14 5.5 CH12C12N205 OH OH CI HN. CI (c) O 氯丙嗪 镇静剂 5.20 9.3 C17H1gCIN,S 无 CI 金霉素 四环素 0.24 3.3,7.4,9.3 C22H23CIN20: OH H OH OH 2(d) HN O 环丙沙星 氟喹诺酮 0.28 6.09,8.74 C17H18FN303 OH (c) HN 克洛索隆 杀吸虫剂 1.25 C8H8C13N304S2 NH2 O=S=O CI .CI 0.1 (e) H,2N NH2 达氟沙星 氟喹诺酮 1.2 6.04 CgH20FN303 HO 0.02(a, e) 名称 药物类别 Log P pKa 分子式 结构 美国公差 (pg/g) 二氟沙星 B-内酰胺 2.78 5.85 C21H19F2N303 OH 无 F 多西环素 四环素 -0.54 3.4 OH OH OH C22H24N20: H2N' C HoH C15H13N302S =(:O 无 芬苯达唑 抗蠕虫药 3.75 10.27 0.4 (e,h), 2 (b) -NH H 氟甲砜霉素 苯丙醇 -0.12 10.73 C12H14C12FNOS O // 0.2 (b) H( .CI OH CI 酮洛芬 镇静剂 2.81 3.88 C16H1403 CH3 .OH 无 左旋咪唑 抗蠕虫药 1.85 8.0 CH2N,S N 0.1 (e) N `S 林可霉素 林可胺类 0.91 7.8 C18H34N206S H1C0, OH 0.1(b) OH OH SCH3 醋酸美伦孕酮 (MGA) 其他 4.21 11.42 C25H3204 0.025(g) H 0 名称 药物类别 Log P pKa 分子式 结构 羟基甲硝唑 硝基咪唑 -0.81 3.09 CHgN304 02N OH (C) OH H 甲噻嘧啶 抗蠕虫药 1.97 >12 C12H16N2S 无 ~CH, 氯硝柳胺 杀吸虫剂 5.41 5.6 C13H8C12N204 CI 无 H CI 'OH 诺氟沙星 诺氟沙星 0.82 6.32 C1618FN303 OH (c) HN 羟布宗 非甾体抗炎药 (NSAID) 2.72 4.87 C19H20N203 无 C -OH 土霉素 四环素 -1.5 3.27 C22H24N20g H2N HO OH OH 2(d) Hon 泼尼松 皮质类固醇 1.57 12.58 C21H2605 OH C ..OH H 无 0 OH 莱克多巴胺 B-激动剂 1.65 9.4 C18H23N03 HO 0.03 (e) OH 磺胺甲二唑 磺胺类 0.51 5.45 CgH10N402S2 无 H HN 无 a牛肝中的公差(土拉霉素已规定了标记物物留) b猪肌肉中的公差 实验部分 所有试剂和溶剂均为 HPLC或分析纯纯。乙腈(ACN)购自Honeywell (美国密歇根州马斯基根)。二甲基亚砜(DMSO)、兽药标准品和内标购自西格玛奥德里奇公司(美国密苏里州圣路易斯)。试剂级甲酸(FA)购自安捷伦公司(部件号 G2453-86060)。乙酸铵 (NH 0Ac)购自 Fisher Chemicals (美国新泽西州费尔劳恩)。 溶液与标准品 将5mL甲酸加入 95 mL ACN 中新鲜制得甲酸 (5%) ACN 溶液。将19.27 g NH 0Ac 溶解于 250 mL Milli-Q 水中制得乙酸铵储备液(1M)。该溶液保存于4℃。将5mL1M乙酸铵储备液加入1LMilli-Q水中,制得5mM乙酸铵水溶液。 标准品和内标 (IS)储备液采用 DMSO进行配制,除达氟沙星与环丙沙星的 DMSO储备液浓度分别为1.0 mg/mL 和 0.25 mg/mL外,其他储备液浓度均为 2.0 mg/mL。阿莫西林和头孢唑啉储备 液采用水进行配制,浓度为2.0 mg/mL。除阿莫西林和头孢唑啉储备液用塑料瓶配制以外,其他所有储备液均在棕色玻璃瓶中进行配制。所有储备液均保存于-20°C下。根据仪器响应不同,将30种化合物分为两组 G1 和 G2。在1/1的ACN/水中配制得到25/5pg/mL的混合(G1/G2)标准工作溶液。氟尼辛-d,内标工作溶液 (25 ug/mL) 也采用 1/1的 ACN/水进行配制。 设备 样品前处理所用的设备和材料包括: ( Geno/Grind e r (SPEX, 美国新泽西州墨图根) ) ( Centra CL3R 离心机 (Thermo IEC, 美国马萨诸塞州) ) ( Eppendorf微型离心机(Brinkmann Instrument s ,美国纽 约州韦斯特伯里) ) 涡旋仪和多管涡旋仪(VWR, 美国宾夕法尼亚州拉德诺) 瓶口分液器 (VWR,美国新泽西州南普兰菲尔德) ( Eppendorf 移液管和重复用吸管 ) Agilent Bond Elut EMR-Lipid 增强型脂质去除净化管鞘气流量:12 L/min(部件号5982-1010)毛细管电压:3000 ViFunnel 参数正离子负离子Agilent Bond Elut EMR-Lipid Polish反萃管高压RF90V90V(部件号5982-0101)低压RF70V60V 仪器 实验采用 Agilent 1290 Infinity LC 进行分析,其中包括: Agilent 1290 Infinity 四元泵 (G4204A) 配备 Agilent 1290 Infinity 自动进样器温控器 (G1330B) 的Agilent 1290 Infinity 高性能自动进样器 (G4226A),以及Agilent 1290 Infinity 柱温箱 (G1316C) 该UHPLC系统联用配备安捷伦喷射流电喷雾离子源并采用 iFunnel技术的 Agilent 6490三重四极杆液质联用系统。采用 AgilentMassHunter 工作站软件进行数据采集和分析。 仪器条件 高效液相色谱条件 色谱柱: Agilent Poroshell 120 EC-C18 柱, 2.1 ×150 mm, 2.7 pm (部件号693775-902), Agilent Poroshell 120 EC-C18 UHPLC 保护柱, 2.1×5 mm, 2.7 pm (部件号821725-911) 流动相: A)0.1%甲酸的水溶液 B) 0.1%甲酸的乙腈溶液 流速: :0.3 mL/min 柱温: 40°C 自动进样器温度: 4°C 进样量: 3pL注射针清洗: 1:1:1:1ACN:MeOH:IPA:H,0, 含 0.2% FA梯度: 时间(min)%B0 10 停止时间: 12 min 后运行时间: 3 min 质谱条件 正/负离子模式 载气温度: 120°C 载气流速:14L/min 雾化器压力: 40 psi 鞘气温度: 400°C 分析物对应的 MS DMRM 条件如表2所示,图1为典型色谱图。 样品前处理 最终样品前处理流程按照以下步骤进行优化。 1. 称取2g(±0.1g)均质牛肝于 50 mL 离心管中 2. 加入 10mL酸化乙腈(含有5%甲酸) 3. 使用机械振荡器混合2 min 4. 在 5000 rpm 下离心 5 min 5. 将5mL乙酸铵缓冲液(5mM) 加入15 mL EMR-LipiddSPE 管中 6. 移取5mL 上清液至EMR-Lipid 管中 7. 立即涡旋混合使样品分散,随后在多位涡旋台上额外涡旋60s 8. 在 5000 rpm 下离心3 min 9. 移取5 mL上清液至含有2g盐(1:4NaCl:MgS0 )的 15mLEMR-Lipid Polish反萃管中,并漩涡混合1 min 10. 在5000 rpm下离心3 min 11.将200pL上层 ACN 相与 800pL水合并到 2mL样品瓶中并涡旋混合 表2.用于目标分析物的 LC/MS/MS DMRM 参数和保留时间 子离子 图1.加入50 ng/g兽药标准品后依次经蛋白质沉淀萃取以及 Agilent Bond ElutEMR-Lipid 净化得到的牛肝样品的典型 LC/MS/MS 色谱图 (DMRM) 样品可直接进行LC/MS/MS分析。完整的样品前处理流程呈图2所示。 图2.使用 Agilent Bond Elut EMR-Lipid 进行牛肝中兽药分析时的样品前处理流程 校准标样和质控样品 在步骤1之后将相应混合标准工作溶液加入到适量样本中,即得预加标QC样品,用于进行6次重复测定。对于 G1分析物而言,QC样品的浓度相当于浓度为10、50、250和750 ng/g的牛肝样品。而对于 G2分析物而言, QC样品相当于浓度为2、10、50和150 ng/g 的牛肝样品。除基质空白外的所有样品均加入内标溶液,浓度相当于含200 ng/g氟尼辛-d,的肝脏样品。 基质匹配校准标样由标准品和内标工作溶液制得。步骤8后基质空白样品中添加标样和内标,得浓度相当于 5、25、50、250、750和1000ng/g的肝脏样品 (G1), 或1、5、10、50、150和200 ng/g的肝脏样品(G2),内标浓度为 200 ng/g。 共萃取物含量测定 通过重量分析法[7]测定采用C18、氧化锆吸附剂和EMR-Lipid三种不同净化技术得到的共萃取物含量。样品前处理步骤如下所述。 1. 将玻璃管在110℃下加热约1h以除去水分 2. 将试管冷却至室温 3. 对试管称重 4. 准确移取1 mL 原始空白基萃萃取液(未净化)以及经各方法净化后的空白基质,各重复两次 5. 将所有样品置于 CentriVap 中并在50℃下烘干1h或使其充分干燥 6. 将试管在110℃下加热约1h以除去水分 7. 将试管冷却至室温 8. 再次对试管称重 步骤8和步骤3之间的重量差即为样品共萃取物的含量。净化前后基质共萃取物的平均重量差即为净化去除的共萃取物量。 基质效应评估 研究中采用柱后注射实验对色谱基质效应进行评估。基质空白样品进样后,以 60 pL/min 的速率将 10 ppb 纯标准品药药溶液同时柱后注射系统,并对整个液相色谱分析时间中的所有化合物的检测信号进行监测。 此外,实验还将后加标肝脏萃取物与等量纯溶液的分析物响应(峰面积)进行了对比。将标准溶液后加标至肝脏空白基质萃取液中,即制得了后加标肝脏萃取物。响应差异(峰面积)与基质效应直接相关。 方法优化、验证与对比 方法优化和评估;针对蛋白质沉淀采用5% FA的ACN溶液夜1%FA 的 ACN 溶液, 针对 EMR-Lipid 净化采用乙酸铵缓冲液与水,以及在 EMR-Lipid净化后采用或不采用萃取盐。并根据分析物回收率、精密度及其他定量参数对结果进行评估。然后通过包含所有 QC样品的重复校准曲线标准品运行完整批量样本定量,对最终优化后的方法进行验证。 回收率实验数据通过对比肝脏样品进行50 ng/g 预加标和后加标的差异来获取。随后采用可接受的净化方案对萃取物进行处理。对于包含蛋白质沉淀的 EMR-Lipid方案,应采用如图2所述的净化流程。而对于 QuEChERS,则按照如下步骤使用C18 或氧化锆吸附剂 dSPE 净化。 1. 称取2g肝脏于50mL试管中 ( 2. 加入8 mL磷酸盐缓冲液 (pH7.0)和10mL酸化 ACN (5%FA) ) 3. 将样品涡旋混合30s 4. 加入 EN盐进行分配/萃取,并在机械振荡器中剧烈振摇 5. 在 5000 rpm 下离心 5 min ACN 肝脏粗提物按照如下步骤进行进一步净化。 1. 将1 mL ACN 肝脏粗提物加入含有25mg C18 和150mgMgSO 勺2mL样品瓶(部件号5982-4921),或加入含有100 mg 氧化锆吸附剂的2mL样品瓶中 2. 盖紧瓶盖并涡旋 1 min 3. 在13000 rpm 下离心3 min(微型离心机) 4. 移取 200pL上清液至另一盛有800 pL 水的样品瓶中 5. 涡旋混合并用0.45 pm 再生纤维素滤膜进行过滤 随后样品可直接进行 LC/MS/MS 分析。将分析物预加标和后加标样品的峰面积相比即可计算出回收率。 结果与讨论共萃取物含量 表3为样品共萃取物重量分析检测结果,数据清晰表明,与采用C18或氧化锆吸附剂的 dSPE 相比 EMR-Lipid dSPE能够提供最出色的净化效率(按重量计)。 表3.利用 Agilent Bond Elut 增强型脂质去除产品、氧化锆和C18净化得到的牛肝基质共萃取物的重量分析结果 净化技术 (mg)(n=2) 效率(%) 未净化 12.1 EMR-Lipid dSPE 56.2 氧化锆分离与 dSPE 相结合 50.4 C18 dSPE 35.5 柱后注射 (PCI)兽药标准品可用于评估ACN 粗提物以及经过EMR-Lipid、C18和氧化锆吸附剂净化的三种最终 ACN 萃取物中的基质效应。所有分析物在整个液相色谱分析循环中均进行监测。PCI色谱图反映出正离子和负离子模式下监测到的基质对分析物的影响。最终 ACN 萃取物在进样之前未经稀释,并将 ACN 进行直接进样。得到的 PCI曲线如图3所示。 如红色曲线所示,进样未经任何净化的粗制肝脏基质空白时,可观察到显著的基质抑制(基线下降)与基质增强效应(峰增大)。这些基质效应对方法可靠性和数据质量具有极大的不利影响。相比之下,如蓝色曲线所示,使用 EMR-Lipid净化可得到显著的改善,可以看到基质抑制和增强效应明显减少。 图3.将牛肝(BL)基质空白样品与 10 ppb 柱后注射兽药标准溶液同时注入系统得到的柱后注射曲线。 在色谱运行中对所有分析物进行监测,该曲线为所有受监测分析物离子对的组合 TIC 图3中的色谱图插图为采用不同净化技术的基质空白样品进样得到的PCI 曲线。 EMR-Lipid(蓝色)与氧化锆吸附剂(紫色)所得到的曲线相似。C18净化(绿色)曲线同样与另外两种技术的曲线相似,但存在更多基质增强和抑制区域。这一对比结果与共萃取物重量分析评估结果相一致,其中 EMR-Lipid 净化的净化效率略高于氧化锆吸附剂,而这两种净化技术的效率均高于 C18。 后加标基质样品与纯标准品之间的分析物响应对比也可用于评估基质效应。对于多数分析物而言,分析物响应不存在显著差异。然而,对于疏水性更强的后洗脱化合物而言,通过C18 和氧化锆吸附剂净化的样品将会表现出更多离子抑制。由于多数脂质干扰物保留较强洗脱较晚,因此疏水性分析物基质离子抑制效应的下降证明 EMR-Lipid 相比于 dSPE C18 和氧化锆吸附剂能够有效去除共萃取脂质。图 4 显示 EMR-Lipid 净化降低基质离子抑制效应的两个示例。 方法优化 实验中还对蛋白质沉淀步骤中所用的溶剂进行了研究。已知在样品:有机溶剂之比为1:3-1:5时,乙腈能够使蛋白质有效形成沉淀,此外酸化乙腈更有利于蛋白质形成沉淀。牛肝是一种复杂的基质,去除蛋白质不仅对于基质去除至关重要,对于实现有效的 EMR-Lipid 净化更是不可或缺。在本研究中,考察了1%和5%FA的ACN 溶液的蛋白质沉淀效果,之后依次采用 EMR-Lipid净化并通过LC/MS/MS 进行分析。使用5% FA 的 ACN 溶液能够获得更出色的精密度,如校准曲线所示(图5)。此外对分析物回收率进行对比后发现, 5% FA 的 ACN 溶液同样实现了更出色的精密度。 加入额外的水或缓冲液以活化 EMR-Lipid 材料十分关键。这有助于改善该材料与样品基质(尤其是脂质)之间的相互作用,从而高效去除基质。实验中还对 EMR-Lipid 净化过程中使用乙酸铵缓冲液(5mM) 的影响进行了研究,将结果与使用水得到的结果进行了对比。通常情况下,使用乙酸铵缓冲液能够将许多分析物(除四环素以外)的回收率提高5%-10%。 图4.疏水性分析物的基质离子抑制效应对比。基质效应 (ME) 由后加标肝脏萃取物与相应纯标准品的峰面积之比计算得出 图 5.使用1% FA 的ACN 溶液与5% FA的 ACN 溶液进行蛋白质沉淀中得到的校准曲线线性对比结果 而对于四环素类化合物,使用缓冲液得到的回收率比使用无缓冲盐的水得到的结果低大约5%。选择采用缓冲液和水时明显表现出不同回收率的分析物进行对比,结果如图6所示。由于使用缓 冲液能够改善多数分析物的回收率,并且使用缓冲液引起的四环素回收率损失极小,因此本研究的其余部分均使用5mM乙酸铵缓冲液方案。 ■采用缓冲盐的 EMR-Lipid ■采用水的 EMR-Lipid 图6.在除脂分散净化步骤中使用5mM乙酸铵缓冲液与水得到的分析物回收率对比结果 经 EMR-Lipid 净化后,上清液大约为 1:1 ACN:水的混合物。然后移多5mL上清液至含有2g混合盐 (4:1 MgSO :NaCI)的 EMR-Lipid Polish 反萃管中,通过盐析使有机相与水相分离。此步骤不仅能够盐析,而且有利于进行进一步基质净化并去除溶解的多余吸附剂和盐类。因此,在 GC 和LC分析中均强烈推荐采用此步骤。在方法开发过程中,除四环素以外的所有分析物均获得了良好的回收率和精密度。通过进一步研究,我们注意到四环素的较低回收率(45%-68%)与盐析步骤有关。为减少四环素损失,我们研究出一种省略 EMR-Lipid 盐析萃取的替代方案(图7)。流程与常规流程类似,不同之处仅在于将400pL萃取物 (通过 EMR-LipiddSPE 产生)与 600 uL 水在微量离心管中混合并涡旋1分钟而不使用盐析步骤。将样品置于微量离心机中在13000 rpm 下离心3分钟,然后移取上清液至2mL样品瓶中进行LC/MS/MS分析。在混合/稀释步骤之前,将标准品和内标后加标至基基质白中。这一方案可视作非萃取性方法,因为其中未使用萃取盐。 图8所示的结果清晰表明采用这一替代方案能够大幅提高四环素的回收率。然而,使用盐析萃取方案得到的四环素结果(如图2所示)仍可以接受,因为其精密度已足以实现定量分析。适当使用稳定的标记内标能够校正回收率较低的问题。在本研究中,我们将萃取后的样品分开, 在 EMR-Lipid 净化后采用无盐析萃取的替代方案,得出了采用这一替代方案得到的三种四环素(土霉素、金霉素和多西环素)的结果。 方法对比 随后将 EMR-Lipid 优化方法与采用 C18 dSPE 净化和氧化锆吸附剂净化的传统QuEChERS 方法进行对比。QuEChERS常用于分析物或残留物萃取, 并采用 dSPE 净化步骤。图9显示回收率的统计对比结果,图10则为选定棘手分析物的对比结果。EMR-Lipid优化方案使棘手分析物的回收率和精密度得到了显著改善,相对于氧化锆吸附剂而言尤其如此,采用此吸附剂得到的氟喹诺酮和四环素类化合物的回收率较低。土霉素和氯硝柳胺的绝对回收率仅分别为67%和68%。然而, 对这两种化合物进行六次重复分析得到的精密度相应的 RSD 分别为 12.8%和2.0%, 根据 SANCO指南认为是可以接受的[9]。这些结果优于采用 C18 和氧化锆吸附剂的 dSPE 的其他两种方案所得到的结果。 经 EMR-Lipid 净化的样品 样品可用于三重四极杆液质联用分析。 随后向基质空白中加入标准品和内标,制成基质匹配校准标样。 将400pL上述上清液与 600uL水合并至2mL卡口盖离心瓶中。 图 7. Agilent Bond Elut EMR-Lipid 净化后能够提高四环素回收率的可选流程 图8.经 Agilent Bond Elut EMR-Lipid 净化后采用和不采用盐析步骤制备出的肝脏样品中的四环素回收率和精密度对比结果 图9. Agilent Bond Elut EMR-Lipid 方案与传统 QuEChERS 方案对比得出的统计回收率结果 方法验证 通过使用样品前处理章节所述的方法运行完整批量样本定量分析,对 EMR-Lipid 优化方法进行验证。内标(针对正离子和负离子模式的氟尼辛-d,)用于准确度和精密度的定量分析。氟尼辛-d,的绝对回收率为 90%-100%。准确度与绝对回收率密切相关。表4显示了定量分分结果。通过测定四种不同浓度 (G1 为10、50、250和750 ppb, 而 G2为2、10、50和150ppb;参见校准标样 章节)的24种 QC(每种浓度重复分析六次)的准确度和精密度而得到汇总回收率(图11)。93%的分析物均得到了可接受的准确度(70%-120%),仅有两个异常值略低于70%,但具有良好的 RSD。对每一浓度的化合物进行六次重复分析得到的 RSD 值非常出色,多数化合物的RSD均低于10%。应当注意,研究人员检测到牛肝空白中有低浓度的莱克多巴胺和酮基布洛芬,因此这两种化合物的校准范围有所改变。 图10.对比 Agilent Bond Elut 增强型脂质去除方案与传统方案得到的选定分析物回收率结果。采用替代方案得到的金霉素和多西环素结果如图6所示。其余化合物均采用 图1所示的方案 表 4. 使用 Agilent Bond Elut 增强型脂质去除产品得到的目标分析物的定量分析结果。每种分析物在四种浓度下接受评估,每种浓度重复分析六次 校准曲线 方法回收率和精密度(ng/g QC) 组号 校准范围 2 150 250 750 分析物 回归拟合/权重 R2 (ng/g) 回收率% RSD 回收率% RSD 回收率% RSD 回收率% RSD 回收率% RSD 回收率% RSD 2-硫脲嘧啶 线性拟合, 1/x 0.9976 5-1000 -- 106.6 4.9 93.6 5.4 -- -- 87.0 3.0 85.4 8.3 阿莫西林 线性拟合, 1/x 0.9978 5-1000 -- -- 65.9 12.1 74.3 8.8 -- 79.5 4.1 79.7 4.8 羟基甲硝唑 线性拟合, 1/x 0.9981 5-1000 -- 92.6 15.1 89.4 6.6 -- -- 89.4 3.5 89.7 3.3 土霉素 线性拟合, 1/x 0.9963 5-1000 -- -- 73.9 19.1 71.2 14.0 -- -- 67.0 12.8 63.4 9.0 头孢唑啉 线性拟合, 1/x 0.9966 5-1000 -- 72.1 9.4 81.2 2.7 -- -- 86.7 3.8 82.9 3.0 二氟沙星 线性拟合,1/x 0.9978 5-1000 -- 79.0 8.3 86.5 5.9 -- 104.4 5.1 97.7 6.3 金霉素 线性拟合, 1/x 0.9928 5-1000 -- --- 100.6 14.1 96.9 9.5 -- 93.8 14.0 85.0 11.6 多西环素 线性拟合, 1/x 0.9972 5-1000 -- -- 118.9 12.0 102.7 10.0 -- 110.0 7.7 104.5 8.6 氟甲砜霉素 线性拟合, 1/x 0.9942 5-1000 -- -- 103.4 6.2 107.9 6.0 -- 115.2 13.5 107.0 4.0 氯霉素 线性拟合, 1/x 0.9962 5-1000 -- 103.6 6.6 107.1 7.9 113.7 9.8 100.9 5.2 克洛索隆 线性拟合,1/x 0.9954 5-1000 -- -- 77.9 10.3 104.4 6.0 102.2 7.1 94.3 3.3 泼尼松 线性拟合,1/x 0.9984 5-1000 =- -- 105.9 9.1 92.1 11.1 -- -- 103.9 10.5 94.5 2.3 羟布宗 线性拟合, 1/x0.9903 5-1000 -- -- 93.6 3.4 91.9 5.2 -- -- 93.7 5.6 97.0 4.6 醋酸美伦孕酮 线性拟合, 1/x 0.9994 5-1000 -- 70.6 1.4 77.3 3.0 82.8 2.1 77.1 2.6 硫氯酚 二次拟合, 1/x0.9981 5-1000 -- -- 69.4 6.2 90.4 2.9 91.3 4.3 83.1 3.7 2 左旋咪唑 线性拟合, 1/x 0.9967 1-200 84.5 11.3 95.5 5.1 103.8 5.2 89.4 9.7 -- 2 林可霉素 线性拟合, 1/x0.9950 1-200 89.5 16.4 79.6 10.6 74.1 4.5 74.8 11.2 -- -- -- -- 2 诺氟沙星 线性拟合, 1/x0.9960 1-200 89.5 9.7 a第1组分析物的校准范围为5-1000 ng/g, QC 加标浓度为 10、50、250和750ng/g;第2组分析物的校准范围为1-200 ng/g, QC 加标浓度为2、10、50和150 ng/g b根据牛肝对照空白中检出的莱克多巴胺浓度对校准范围进行了修改 ·根据牛肝对照空白中检出的酮基布洛芬浓度对校准范围进行了修改 本研究对一种采用蛋采质沉淀萃取与 Bond Elut EMR-Lipid 和EMR-Lipid 盐析萃取净化的快速、可靠与稳定的方法进行了优化与验证,此方法适用于牛肝中兽药多残留的分析。研究中对该方法的基质效应进行了详细评估,并与传统 C18 dSPE 和氧化锆吸附剂净化技术的基质效应进行了对比。结果表明 EMR-Lipid 优化方法能够为这类应用提供卓越的基质净化与优异的回收率和精密度。值得注意的是,在进样之前用水稀释,可以使样品适合于LC/MS/MS分析并能保持早洗脱分析物的峰形良好。本研究中 使用的LC/MS/MS系统灵敏度较高,使用直接稀释的样品仍可满足检测限的要求。与常用的干燥与复溶方法相比,这一工作流程能够节省大量时间和精力,并可防止可能发生的偏差和分析物损失。如果仪器灵敏度无法满足直接稀释样品的要求,最后仍应考虑采用样品浓缩步骤。样品浓缩通常通过样品蒸发和复溶来实现。本应用表明,使用 EMR-Lipid 的选择性基质去除对于牛肝等复杂样品分析具有显著优势,多残留兽药分析可获得更洁净的样品,同时能实现更高的回收率和精密度。未来将进一步研究其他复杂的高脂肪含量基质和目标分析物,以证明使用增强基质去除产品具有能够得到洁净样品这一优势。 ( 参考文献 ) ( 1. A non. A Description of the U.S. Food Safety System,March 2 0 00; U . S. Food a n d Drug Administration, U.SDepartment of Agriculture, W ashington DC. www.fsis.usda.gov/oa/codex/system.htm ) 2. ( Anon. European Commission, C o mmission De c ision of 12 August 2002 implementing Co u ncil Di r ective96/23/EC concerning the performance of analyticalmethods an d the interpretation of r esults; Off. J. Eur. Comm.2002,L122,8 ) ( 3. Anon. A dministrative Maximum Residue Limits (AMRLs) and Maximum Residue Limits (MRLs) set by Canada, May 2012; Health Canada, Ottawa. www.hc-sc.gc.ca/dhp-mps/alt _ formats/pdf/vet/mrl- Imr_versus_new-nouveau-eng.pdf ) 查找当地的安捷伦客户中心: 4. Ellis, R. L. Food Addit. Contam. A 2008,25,1432-1438. www.agilent.com/chem/contactus-cn ( 5. Fagerquist, C. K. ; Lightfield, A. R. ; Lehotay, S. J. Anal. Chem.2005,5, 1 473-1482 ) 免费专线: ( 6. Mastovska, K.; Lightfield, A. R. J. C hromatogr. A 2008, 1202,118-123 ) 800-820-3278,400-820-3278(手机用户) 7. Geis-Asteggiante, L.; Lehotay, S. J.; Lightfield, A. R.;Dulko, T.; Ng, C.; Bluhm, L. J. Chromatogr.A 2012, 1258,43-54 联系我们: LSCA-China_800@agilent.com 8. Schneider, M. J.; Lehotay, S. J.; Lightfield, A. R.Anal. Bioanal. Chem. 2015,407,4423 在线询价:www.agilent.com/chem/erfq-cn 9. Anon. Guidance Document on Analytical Quality Contro/and Validation Procedures for Pesticide ResiduesAnalysis in Food and Feed,SANCO/12571/2013,19November 2013; European Commission, Health and. Consumer Protection Directorate-General, Brussels,Belgium www.agilent.com 安捷伦对本资料可能存在的错误或由于提供、展示或使用本资料所造成的间接损失不承担任何责任。 更多信息 本文中的信息、说明和技术指标如有变更,恕不另行通知。 ◎安捷伦科技(中国)有限公司,2015 这些数据代表典型结果。有关我们的产品与服务的详细信息,请访问我们的网站 www.agilent.com。 ( 2015年7月30日,中国出版 ) 5991-6096CHCN Agilent Technologies 摘要 Agilent Bond Elut QuEChERS 增强型脂质去除产品(Agilent Bond Elut QuEChERSEMR-Lipid) 是新一代样品前处理产品,适用于便捷的分散固相萃取(dSPE)。这种材料对于共萃取基质具有较高选择性,尤其适用于脂肪样品(脂肪含量> 5%),而不会对分析物回收率产生利影响。本研究介绍应用这款新型产品对牛肝中的30 种代表性兽药进行的分析。分析流程包括利用酸化乙腈实现快速高效的蛋白质沉淀萃取,然后使用EMR-Lipid 增强型脂质去除净化管和EMR-Lipid Polish 反萃管进行进一步净化。研究中通过共萃取物重量与柱后注射实验来测定由EMR-Lipid 方案去除的基质量。与其他基质净化产品相比,EMR-Lipid 增强型脂质去除净化管能够提供更有效的基质去除和更出色的分析物回收率。EMR-Lipid 优化方法能够为各种浓度下的全部30 种兽药提供卓越的洁净度以及优异的准确度和精密度,实现快速、稳定而有效的高脂肪含量样品分析。 前言 兽药广泛用于食品生产行业的动物中,以预防动物疾病或作为生长促进剂。这些药物将在动物组织中发生富集,使用不当更是会导致药物残留在食用组织中不断积累,对人类健康构成威胁。随着人们对食品安全的日益关注,几乎每个国家都出台了限制食品动物产品中所使用药物的法规[1-4]。 肌肉、肝脏和鸡蛋等动物源食品通常具有复杂的化学成分,因此,采用包括常规萃取和高效净化的高效样品前处理方法至关重要。已有的样品前处理方法包括传统的溶剂萃取、固相萃取(SPE) 或多项技术的组合。这些方法通常费力费时,仅适用于有限的化合物类别,并且需要额外进行方法开发。 多类别、多残留方法在监管性监测项目中越来越受青睐,因为它们可以扩大分析范围并提高实验室效率。过去几年来接受监测的兽药数量越来越多,如今已报道了100 多种兽药[5-8]。样品前处理通常包括采用乙腈:水混合物进行萃取,然后利用C18 和/或其他净化技术进行净化。C18 等吸附剂去除共萃脂质的能力有限,可能在稀释或复溶过程中产生沉淀。沉淀生成后需要在LC/MS/MS进样之前对样品进行过滤,这可能造成分析物损失。可以在分散固相萃取(dSPE) 过程中加入己烷来去除共萃取液中的脂质,但这种方法费时费力且无选择性,并且会去除疏水性分析物。与C18相比,使用氧化锆吸附剂进行净化能够改善基质净化效果,但也会导致更多的分析物损失,对于氟喹诺酮、四环素和大环内酯等含羧酸和羟基的化合物而言尤其如此[7,8]。 Agilent Bond Elut QuEChERS EMR-Lipid 增强型脂质去除产品是一种新型吸附剂材料,能够选择性去除样品中的主要脂类而不会使分析物损失。去除复杂基质中的脂质干扰物对于QuEChERS 和蛋白质沉淀等技术而言尤其重要。由于这些简单的样品前处理方法无法充分去除脂质,因此脂质共萃取物将与目标分析物一起保留到最终样品萃取物中。这会导致色谱峰异常、数据精密度和准确度下降以及维护问题增加。在本研究中,我们考察了一种用于分析牛肝中30 种棘手的代表性兽药的新型样品前处理方法,该方法采用简单的蛋白质沉淀萃取后用EMR-Lipid 进行净化。所选的兽药代表了17 种不同的类别,包括亲水性、疏水性、酸性、中性和碱性药物。表1 显示这些兽药的化学和法规信息。 结论 本研究对一种采用蛋白质沉淀萃取与Bond Elut EMR-Lipid 和EMR-Lipid 盐析萃取净化的快速、可靠与稳定的方法进行了优化与验证,此方法适用于牛肝中兽药多残留的分析。研究中对该方法的基质效应进行了详细评估,并与传统C18 dSPE 和氧化锆吸附剂净化技术的基质效应进行了对比。结果表明EMR-Lipid 优化方法能够为这类应用提供卓越的基质净化与优异的回收率和精密度。 值得注意的是,在进样之前用水稀释,可以使样品适合于LC/MS/MS 分析并能保持早洗脱分析物的峰形良好。本研究中使用的LC/MS/MS 系统灵敏度较高,使用直接稀释的样品仍可满足检测限的要求。与常用的干燥与复溶方法相比,这一工作流程能够节省大量时间和精力,并可防止可能发生的偏差和分析物损失。如果仪器灵敏度无法满足直接稀释样品的要求,最后仍应考虑采用样品浓缩步骤。样品浓缩通常通过样品蒸发和复溶来实现。本应用表明,使用EMR-Lipid 的选择性基质去除对于牛肝等复杂样品分析具有显著优势,多残留兽药分析可获得更洁净的样品,同时能实现更高的回收率和精密度。 未来将进一步研究其他复杂的高脂肪含量基质和目标分析物,以证明使用增强基质去除产品具有能够得到洁净样品这一优势。
确定








还剩16页未读,是否继续阅读?
安捷伦科技(中国)有限公司为您提供《牛肝样品中兽药检测方案(液相色谱仪)》,该方案主要用于畜禽肉及副产品中兽药残留检测,参考标准--,《牛肝样品中兽药检测方案(液相色谱仪)》用到的仪器有安捷伦 1290 Infinity 二元液相色谱系统(1290 LC)、Agilent 6495B 三重四极杆液质联用系统
推荐专场
相关方案
更多
该厂商其他方案
更多

















