方案详情
文
本实验采用低场核磁共振技术对绿豆浸泡过程进行研究,利用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定
样品的自旋 - 自旋弛豫时间(T2)[5]。将绿豆置于永磁场中
心位置的射频线圈的中心进行 CPMG 脉冲序列实验。
CPMG 序列采用的参数:采样点数 TD = 120130,谱宽
SW = 100kHz,回波个数 EchoCount = 6000,重复扫
描次数 NS = 4,采样重复时间 TR = 1500ms,回波时间
TE = 100 μs。利用T2_FitFrm 软件调用CPMG 序列拟合T2。
方案详情

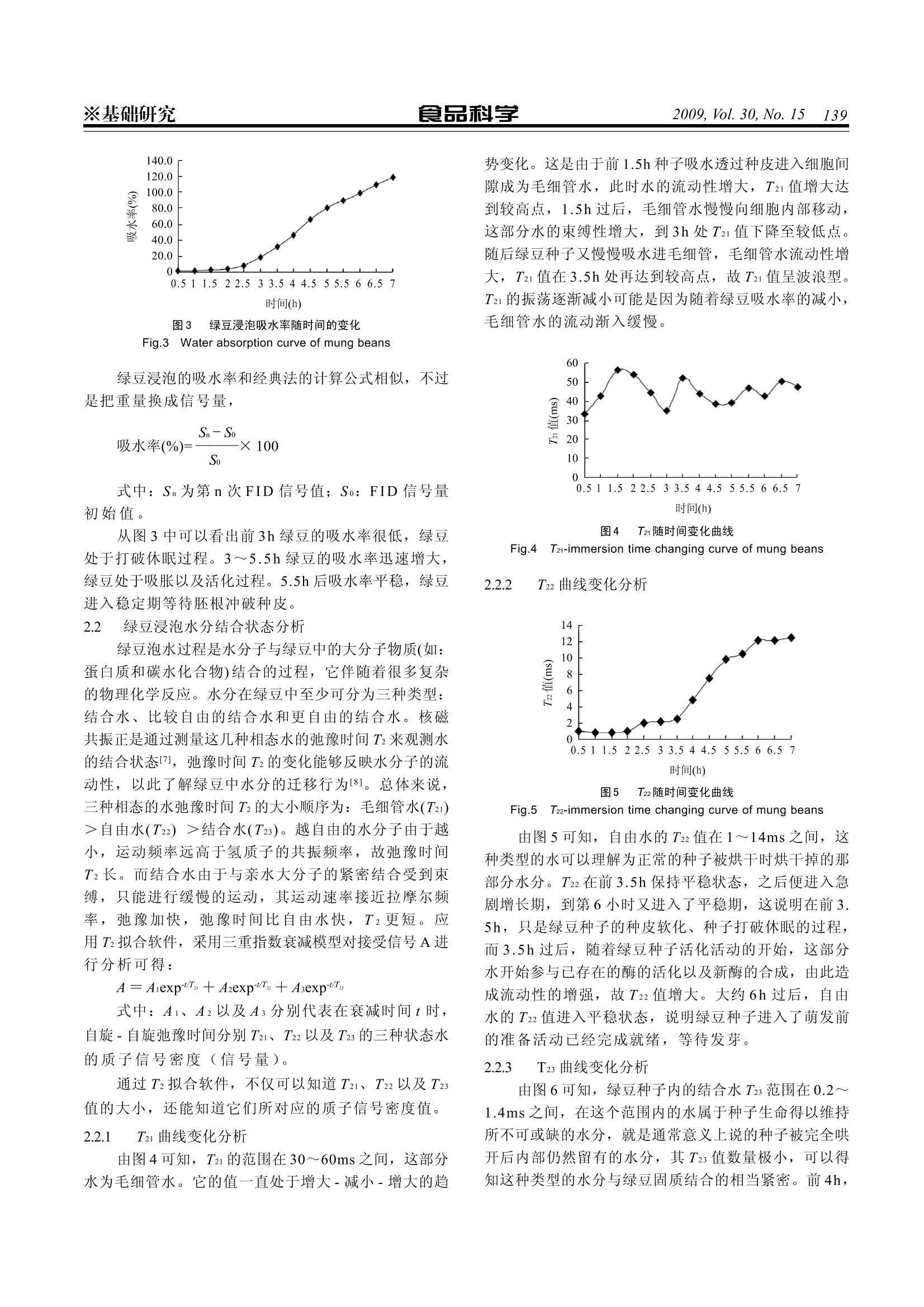
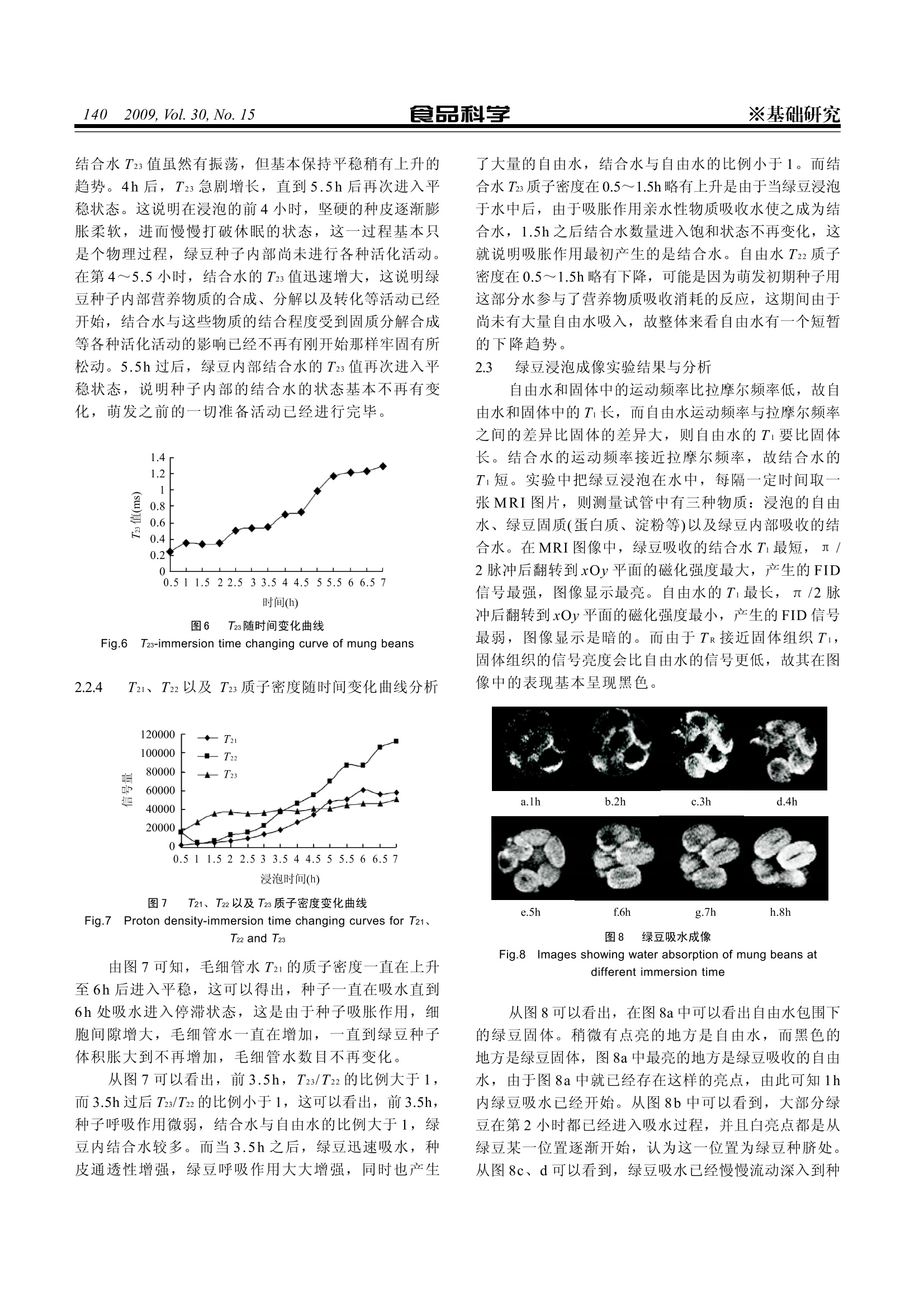
食品科学※基础研究2009, Vol. 30, No. 15 1137 应用低场核磁共振研究绿豆浸泡过程 李然1,李振川2*,陈珊珊12,俞捷l,汪红志1.2,张学龙! (1.上海理工大学医疗器械与食品学院,上海 200093;2.纽迈-上海医疗器械高等专科联合分析测试中心, 上海 200093) 摘 要:本实验采用低场核磁共振技术对绿豆浸泡过程进行研究,目的是从一种新的角度来解释绿豆种子内部吸水的动态过程,通过把绿豆浸泡入水中,每隔0.5h分别测量其量冲 FID信号、弛豫时间T2, 每隔1h进行核磁共振成像。实验结果表明:绿豆吸水率在浸泡3h后进入迅速增长,至5.5h后吸水率变化缓慢;绿豆吸入水分可分为三种状态水:毛细管水T21、自由水T22以及结合水T23;毛细管水T21随时间变化为波浪型,自由水T22以及结合水T23变化基本致,为稳定-上升-稳定;二;自由水作为溶剂在绿豆吸水过程中参与各种生化反应,故自由水的质子密度(信号量)上升量最大。从核磁共振图像中可以看到水是从种脐处慢慢进入绿豆内。低场核磁共振技术同样可应用于其他种子浸泡过程分析。 关键词: FID信号;T2弛豫时间;水分结合状态;质子密度;Ti加权成像 Study of Water Absorption of Mung Beans Based on Low-field Nuclear Magnetic Resonance Technology LI Ran, LI Zhen-chuan2*, CHEN Shan-shan12, YU Jie, WANG Hong-zhil2, ZHANG Xue-long' (1. School of Medical Instrument and Food Engineering, Shanghai Science and Technology University, Shanghai 200093, China;2. Shanghai Niumag Corporation-Shanghai Medical Instrumentation College United Analyzing and Testing Center, Shanghai 200093.China) Abstract: Low field (0.01 to 0.5 Tesla) nuclear magnetic resonance (NMR) instrument has spread out its applications in manyfields such as food manufacture, petroleum industry,agriculture, matireal research and so on because of its low cost and easymaintenance. For the purpose of explaining the dynamic water absorbing process of mung beans from a new point of view, low-field NMR technology was adopted in this study. Mung beans were immersed in watre and taken out every 0.5 hfor the testingof FID signal and T2 relaxation time and every 1 h for the NMR imaging. The water absorption of mung beans has a quick riseafter 3 hours and enters into a stable period after 5.5 hours. There are three states of water in the mung beans including capillarywater T2i, free water T22 and bound water T23. Capillary water T2 exhibited a wave-like movements change and free water T2and bound water T23 had a similar change: stable-rising-stable.Free water as a good solvent participates in different types ofbiochemical reaction and therefore the increase of proton density value (signal value) of free water was the biggest. The NRMimages showed that the watrer absorbing of mung bean was started hilum. Our study results prove that low-field NMR technologyalso can be applied in the studies of seed immersion of other grains. Key words: FID signal; T2 relaxation; Combination State of Water; Proton Density; T Weighted Imaging 中图分类号:TS201.2 文献标识码: A 文章编号:1002-6630(2009)15-0137-05 核磁共振(nuclear magnetic resonance, NMR)是处于静磁场中的原子核在另一交变磁场作用下发生的物理现象。作为-门新兴的分析检测手段,核磁共振技术以其快速、高效、无创性等诸多优点在医学、化学、生物学等领域扮演着极为重要的角色,尤其是在医学方面,核磁共振成像的迅速发展是有目共睹的。而近年来,核磁共振技术也被逐渐更广泛的应用于其他的领域,例如食品工业。NMR技术在食品工业中的应用主 要是通过测量T1、T2值研究食品的水分、油脂等成分的性质以及动态变化过程。 绿豆属于豆科植物,是除了谷类作物之外最重要的农作物之一,它含蛋白质26%左右,脂肪0.7%左右,碳水化合物54%左右,纤维素及矿物质8%左右。绿豆由于其营养丰富,深得民众喜爱。绿豆结构致密、坚硬,浸泡是豆类加工中最常用的预工序之一[]。浸泡一方面可以软化绿豆籽粒,使其便于加工处理;另一方 ( 收稿日期:20 0 9-06-20 ) ( 作者简介:李 然 (1986一),女 , 硕士研究生,研究方向为低场核磁共振测试分析。E-mail: 521liran@163.com ) ( *通讯作者:李 振 川(1986一),男,本 科 ,研究方向为低场核磁共振测试分析方法。E-mail: chuan481@yahoo.cn ) 面可以减少植酸、胃胀气因子(棉子糖、水苏糖等)、蛋白酶抑制剂等抗营养成分在绿豆中的含量。对于绿豆浸水的研究有很多报道,但都是用经典方法来进行研究的,本实验主要应用低场核磁共振及其成像技术,从一个新的角度来研究绿豆浸泡过程,通过NMR 方法计算出绿豆的吸水率,通过测量浸泡不同时间的绿豆T2值,分析绿豆中水分的结合状态,并利用核磁共振成像技术(MRI)观测水分在绿豆中流动的动态过程。 材料与方法 1.1 材料、试剂与仪器 丝宝宝牌绿豆 超市中购买; 0.5T PQ001核磁共振分析仪、Tz_Fit软件 上海纽迈科技有限公司。 1.2 方法 1.2.1 绿豆吸水率测量方法 绿豆浸泡吸水率的测定有很多经典方法,例如称重法I2]。但是该方法却忽略了绿豆中可溶溶质会在浸泡过程中渗出的现象。电子天平尽管精度已经很高,但是以克为单位也只能精确到小数点后两位,对于数目较少的绿豆吸水率测量存在误差。而用 NMR 方法观测吸水速率主要是对水质子的信号进行测量,这会避免以上两种原因造成的误差。 图1 固液两相FID曲线 Fig.1Solid-Liquid two-phase FID signal curve 图1是90°脉冲后一个固液两相体系的 FID(free in-duction decay) 曲线。在90°脉冲后, 70 us 的瞬间,大部分固相的质子已经完全衰减。70us后是水的慢速衰减。因此70us 处的信号强度(电压值)正比于液相水质子的浓度,将70us处的信号值记为S。 将5颗绿豆种子在常温下浸泡于水中,每隔30min拿出测量FID信号,记录每个 FID 信号70us处的信号值描绘出一条曲线。 1.2.2 绿豆浸泡水分结合状态分析方法 当高能态的核与低能态的核相互接近时[4],如果它们的进动频率相同,两杉便可以交换能量,高能态核将能量传递给低能态的核,使后者越向高能态,而自身则跃迁低能态。这一过程成为自旋-自旋弛豫。磁化 强度矢量M 在90°RF脉冲作用下,倒向xy平面,并在xy 平面散开,撤除RF照射后,其宏观磁矩水平分量减小63%时所需的时间叫做横向弛豫时间T2。 利用CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品的自旋-自旋弛豫时间(T2)B]。将绿豆置于永磁场中心位置的射频线圈的中心进行CPMG 脉冲序列实验。CPMG序列采用的参数:采样点数TD =120130,谱宽SW=100kHz, 回波个数 EchoCount=6000, 重复扫描次数NS=4,采样重复时间 TR=1500ms, 回波时间Te=100us。 利用T FitFrm 软件调用 CPMG序列列合Tz。 1.2.3 绿豆浸泡成像方法 将水连同绿豆一起放入样品试管中,将其置入射频线圈中进行测量,每30min 采一张图片当样品进行完CPMG序列实验后,进行SE 成像序列实验I6]。SE 序列如图2是在n/2激励脉冲之间施加n重聚焦脉冲组成的, SE序列的信号强度在组织一定的情况下,改变序列参数 TR 和Te就可改变质子密度、Ti及Tz对图像的影响程度或者加权权重。本研究通过使用短 TR 和短 TE 来获得Ti加权成像实验,实验参数设置为:重复时间TR=1000ms、回波时间 Te=14ms、矩阵192×128、层厚10mm、视野FOVx =FOVy=32mm、扫描次数NS=3、图像大小256×256。图像最终均以标准BMP 的格式保存。 图2 SE序列图 Fig.2 SE serial 2 结果与分析 2.1 绿豆吸水率测量实验结果与分析 种子萌发的吸水过程分为三个阶段:开始是种子内的胶体物质所引起的急剧吸水过程,为吸胀吸水的物理过程,与种子代谢作用无关;随后是吸水的停亭期,这时种子内代谢活动增强;;当胚根突破种皮,胚体迅速增大时又再次急剧吸水,此时为渗透吸水的生理过程。 表 信号值记录 Table 1 Signal value record 时间(h)0 0.5 1 1.522.5 3 3.5444.5 5 5.5 6 6.5 7 信号量525529535540 545570 625690770875948997 1043 11011150 图3 绿豆浸泡吸水率随时间的变化 Fig.3 Water absorption curve of mung beans 绿豆浸泡的吸水率和经典法的计算公式相似,不过是把重量换成信号量, 式中:Sn为第n次FID 信号值; So: FID 信号量初始值。 从图3中可以看出前3h绿豆的吸水率很低,绿豆处于打破休眠过程。3~5.5h绿豆的吸水率迅速增大,绿豆处于吸胀以及活化过程。5.5h后吸水率平稳,绿豆进入稳定期等待胚根冲破种皮。 2.2 绿豆浸泡水分结合状态分析 绿豆泡水过程是水分子与绿豆中的大分子物质(如:蛋白质和碳水化合物)结合的过程,它伴随着很多复杂的物理化学反应。水分在绿豆中至少可分为三种类型:结合水、比较自由的结合水和更自由的结合水。核磁共振正是通过测量这几种相态水的弛豫时间T2来观测水的结合状态,弛豫时间Tz的变化能够反映水分子的流动性,以此了解绿豆中水分的迁移行为[8]。总体来说,三种相态的水弛豫时间T2的大小顺序为:毛细管水(T21)>自由水(T22)>结合水(T23)。越自由的水分子由于越小,运动频率远高于氢质子的共振频率,故弛豫时间T2长。而结合水由于与亲水大分子的紧密结合受到束缚,只能进行缓慢的运动,其运动速率接近拉摩尔频率,弛豫加快,弛豫时间比自由水快,T2更短。应用T2拟合软件,采用三重指数衰减模型对接受信号A进行分析可得: 式中:A1、A2以及A分别代表在衰减时间t时,自旋-自旋弛豫时间分别T21、T22以及T23的三种状态水的质子信号密度(信号量)。 通过T2拟合软件,不仅可以知道T21、T22以及T23值的大小,还能知道它们所对应的质子信号密度值。 2.2.1 Tz曲线变化分析 由图4可知, T2的范围在30~60ms之间,这部分水为毛细管水。它的值一直处于增大-减小-增大的趋 势变化。这是由于前1.5h 种子吸水透过种皮进入细胞间隙成为毛细管水,此时水的流动性增大,T21值增大达到较高点,11.5h过后,毛细管水慢慢向细胞内部移动,这部分水的束缚性增大,到3h处T21值下降至较低点。随后绿豆种子又慢慢吸水进毛细管,毛细管水流动性增大,T21值在3.5h处再达到较高点,故T21值呈波浪型。T21的振荡逐渐减小可能是因为随着绿豆吸水率的减小,毛细管水的流动渐入缓慢。 图4 T21随时间变化曲线 Fig.4 T21-immersion time changing curve of mung beans 2.2.2 T22曲线变化分析 图5 T22随时间变化曲线 Fig.5 T22-immersion time changing curve of mung beans 由图5可知,自由水的T22值在1~14ms之间,这种类型的水可以理解为正常的种子被烘干时烘干掉的那部分水分。T22在前3.5h保持平稳状态,之后便进入急剧增长期,到第6小时又进入了平稳期,这说明在前3.5h,只是绿豆种子的种皮软化、种子打破休眠的过程,而3.5h过后,随着绿豆种子活化活动的开始,这部分水开始参与已存在的酶的活化以及新酶的合成,由此造成流动性的增强,故T22值增大。大约6h过后,自由水的T22值进入平稳状态,说明绿豆种子进入了萌发前的准备活动已经完成就绪,等待发芽。 2.2.3 T23曲线变化分析 由图6可知,绿豆种子内的结合结T23范围在0.2~1.4ms之间,在这个范围内的水属于种子生命得以维持所不可或缺的水分,就是通常意义上说的种子被完全哄开后内部仍然留有的水分,其T23值数量极小,可以得知这种类型的水分与绿豆固质结合的相当紧密。前4h, 结合水T23值虽然有振荡,但基本保持平稳稍有上升的趋势。4h后,T23急剧增长,直到5.5h后再次进入平稳状态。这说明在浸泡的前4小时,坚硬的种皮逐渐膨胀柔软,进而慢慢打破休眠的状态,这一过程基本只是个物理过程,绿豆种子内部尚未进行各种活化活动。在第4~5.5小时,结合水的T23值迅速增大,这说明绿豆种子内部营养物质的合成、分解以及转化等活动已经开始,结合水与这些物质的结合程度受到固质分解合成等各种活化活动的影响已经不再有刚开始那样牢固有所松动。5.5h过后,绿豆内部结合水的T23值再次进入平稳状态,说明种子内部的结合水的状态基本不再有变化,萌发之前的一切准备活动已经进行完毕。 图6 T23随时间变化曲线 Fig.6 T23-immersion time changing curve of mung beans 2.2.4 T21、T22以及 T23质度密度随时间变化曲线分析 图7 T21、T22以及T23质子密度变化曲线 Fig.7Proton density-immersion time changing curves for T21、T22 and T23 由图7可知,毛细管水T21的质子密度一直在上升至6h后进入平稳,这可以得出,种子一直在吸水直到6h处吸水进入停滞状态,这是由于种子吸胀作用,细胞间隙增大,毛细管水一直在增加,一直到绿豆种子体积胀大到不再增加,毛细管水数目不再变化。 从图7可以看出,前3.5h, T23/T22的比例大于1,而3.5h过后T23/T22的比例小于1,这可以看出,前3.5h,种子呼吸作用微弱,结合水与自由水的比例大于1,绿豆内结合水较多。而当3.5h之后,绿豆迅速吸水,种皮通透性增强,绿豆呼吸作用大大增强,同时也产生 了大量的自由水,结合水与自由水的比例小于1。而结合水T23质子密度在0.5~1.5h略有上升是由于当绿豆浸泡于水中后,由于吸胀作用亲水性物质吸收水使之成为结合水,, 1.5h之后结合水数量进入饱和状态不再变化,这就说明吸胀作用最初产生的是结合水。自由水T22质子密度在0.5~1.5h略有下降,可能是因为萌发初期种子用这部分水参与了营养物质吸收消耗的反应,这期间由于尚未有大量自由水吸入,故整体来看自由水有一个短暂的下降趋势。 2.3 绿豆浸泡成像实验结果与分析 自由水和固体中的运动频率比拉摩尔频率低,故自由水和固体中的Ti长,而自由水运动频率与拉摩尔频率之间的差异比固体的差异大,则自由水的Ti要比固体长。结合水的运动频率接近拉摩尔频率,故结合水的Ti短。实验中把绿豆浸泡在水中,每隔一定时间取一张MRI图片,则测量试管中有三种物质:浸泡的自由水、绿豆固质(蛋白质、淀粉等)以及绿豆内部吸收的结合水。在 MRI图像中,绿豆吸收的结合水Ti 最短,J/2脉冲后翻转到xOy平面的磁化强度最大,产生的FID信号最强,图像显示最亮。自由水的Ti最长,元/2脉冲后翻转到xOy 平面的磁化强度最小,产生的FID信号最弱,图像显示是暗的。而由于 TR 接近固体组织Ti,固体组织的信号亮度会比自由水的信号更低,故其在图像中的表现基本呈现黑色。 图8 绿豆吸水成像 Fig.8Images showing water absorption of mung beans atdifferent immersion time 从图8可以看出,在图8a中可以看出自由水包围下的绿豆固体。稍微有点亮的地方是自由水,而黑色的地方是绿豆固体,图8a中最亮的地方是绿豆吸收的自由水,由于图8a中就已经存在这样的亮点,由此可知1h内绿豆吸水已经开始。从图8b中可以看到,大部分绿豆在第2小时都已经进入吸水过程,并且白亮点都是从绿豆某一位置逐渐开始,认为这一位置为绿豆种脐处。从图8c、d可以看到,绿豆吸水已经慢慢流动深入到种 子内部,至图8e,绿豆已经吸水进入膨胀。从图8f可以明显看到绿豆种子已经胀大,视野内绿豆数目的减少时也是因为绿豆在试管内膨胀造成移位。在图8g、h中可以看到显示白亮色种子内部的一条黑色线,认为这是两片子叶中间的缝隙,这个缝隙在种子还没有胀大的时候并不明显。 3 结 论 运用低场核磁共振能够很好的了解绿豆吸水这一动态过程,绿豆的吸水率可以间接从测量 FID 信号获得,通过测量弛豫时间T2及其幅值,可以掌握水分在绿豆中的结合状态,运用核磁共振成像可以快速无损观测到绿豆内部吸水状况:绿豆先吸水打破休眠期,而后进入活化期,这个期间各种生化活动都在进行中,最后种子吸水进入平稳期,等待之后胚芽冲破种皮的过程。运用核磁共振对绿豆吸水过程的探索同理也可应用于其他 ( 种子吸水过程的研究。 ) ( 参考文献: ) ( [1] 李积华,黄茂芳,钟业.绿豆浸 泡 过程研究[J],食品科技,2008,33 (11):161 - 164. ) ( [2] ABUGHANNAM N, MCKENNA B. Hydration kinetics of red kidney beans[]. J ournal of Food Science, 1997, 62(3):520-523. ) ( [3] R UBEL G, Simultaneous determination of oil and water contents in different oilseeds by pulsed n uclear magnetic resonance[J]. Journal of the American Oil Chemists'Society, 1994, 71(10):1057-1062. ) ( [4] 赵喜平.核磁共振成像系统的原理及其应用[M].北京:科学出版社, 2000:676-680. ) ( [5] 熊国欣,李立本.核磁共振成像原理[M].北京:科学出版社,2007: 1 1 1 -118. ) ( [6] 王 娜,陈卫江,林向阳.核磁共振及成像技术中的基本序列在食品中的应用[] . 农产品加工, 2006(6):11-14. ) ( [7] 范明辉,范崇东,王淼.利用脉冲NMR研究食品体系中的水分性质 [J] . 食品与 机 械,2004,20(2):45-48. ) ( [8] LIN X Y,ROGER R, CHEN P. NMR state diagram concept of food products[J].食品科学,2004,25(10):91-94. )
确定



还剩3页未读,是否继续阅读?
苏州纽迈分析仪器股份有限公司为您提供《绿豆中浸泡水分结合状态检测方案(核磁共振)》,该方案主要用于豆制品中理化分析检测,参考标准--,《绿豆中浸泡水分结合状态检测方案(核磁共振)》用到的仪器有纽迈分析低场核磁共振成像分析仪-食品农业领域NMI20-015V-I
推荐专场
相关方案
更多
该厂商其他方案
更多
















