方案详情
文
采用循环伏安法对酵母核糖核酸与中性红的相互作用进行了研究。NR在玻碳电极上有一对氧化还原峰, 加入yRNA后, 氧化还原峰电流降低, 但没有新的氧化还原峰出现, 表明NR与yRNA发生了较强的相互作用, 紫外光谱进一步证实该作用方式为静电作用。求得NR与yRNA的结合比为1 ∶2, 建立了一种间接检测酵母核糖核酸的电化学方法, 检测范围为510 ×10 - 3 ~0125 g/L, 检出限达110 ×10 - 5 g/L。
方案详情

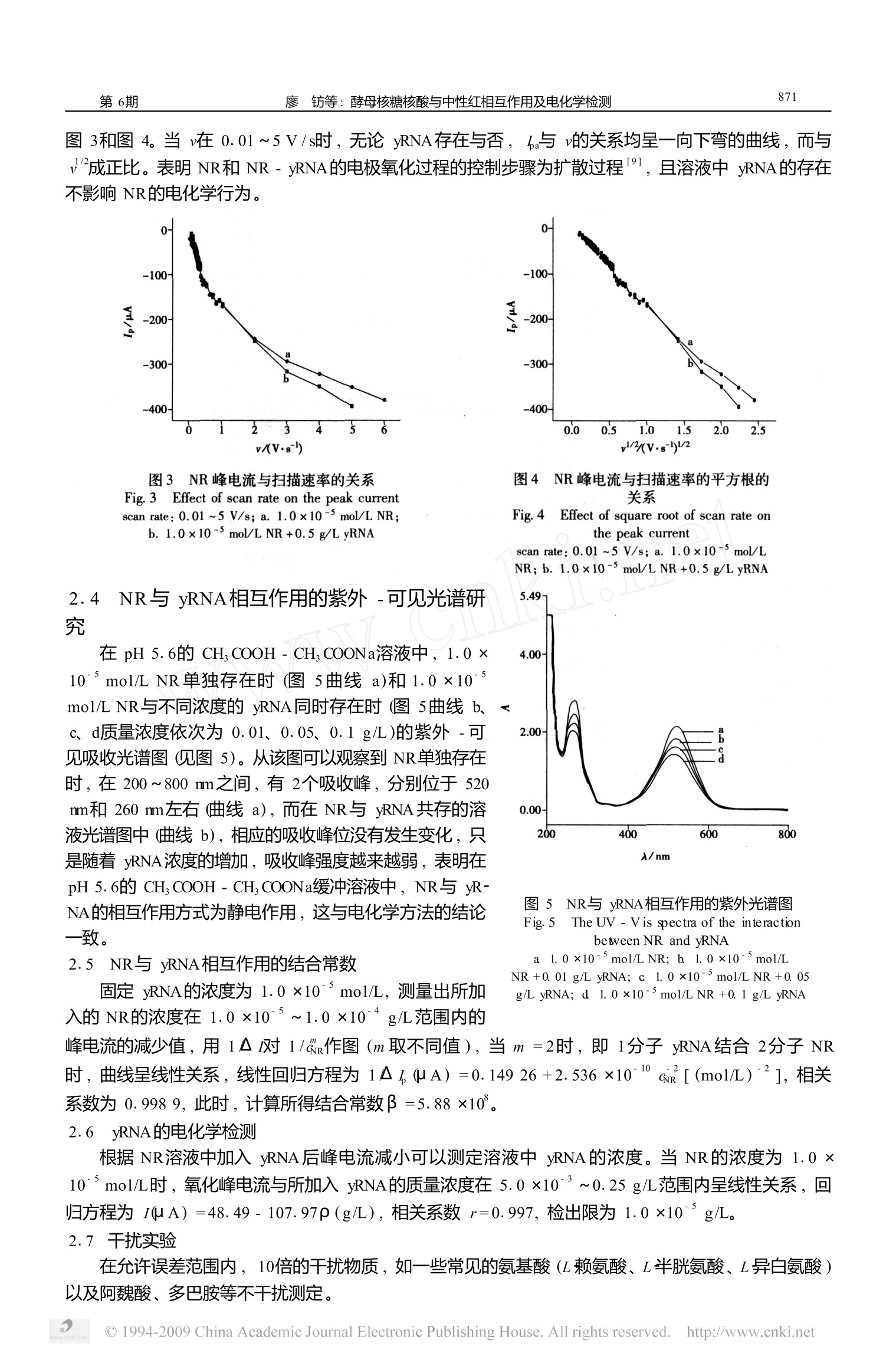
分析测试学报FENXICESHIXUEBAO (Joumal of Instrumental Analysis)Vol. 26 No.6869~872第26卷第6期2007年11月 870分析测试学报第26卷 酵母核糖核酸与中性红相互作用及电化学检测 廖 ,艾 珍,朱清涛,何晓英,蔡铎昌 (西华师范大学 化学化工学院,四J 南充 637002) 摘 要:采用循环伏安法对酵母核糖核酸与中性红的相互作用进行了研究。NR在玻碳电极上有一对氧化还原峰,加入 yRNA后,氧化还原峰电流降低,但没有新的氧化还原峰出现,表明NR与 yRNA发生了较强的相互作用,紫外光谱进一步证实该作用方式为静电作用。求得 NR与yRNA的结合比为1 :2,建立了一种间接检测酵母核糖核酸的电化学方法,检测范围为5.0×103~0.25 g/L,检出限达1.0×10g/L. 关键词:中性红;酵母核糖核酸;循环伏安法;电化学检测 中图分类号:0657.1;Q522 文献标识码:A 文章编号:1004-4957(2007)06-0869-04 Electrochem ical Study on the Interaction between Neutral Red and yRNA LAO Fang, A I Zhen, ZHU Qing-tao, HE Xiao-ying, CA IDuo-chang (Institute of Chem ical Engineering, China WestNomalUniversity, Nanchong637002, China) Abstract The interaction beween neutral red and yeast RNA was studied by cyclic voltammetryThere was a reduction peak and an anodic peak on the glass cabon electrode After addition yRNA,currents both reduction and anodic peaks decreased dramatically, whereas no new peaks occurred1Theresult indicated that the interaction ofNR and yRNA was electrostatic action in the CH, COOH-CH, COONa buffer solution ofpH 5.6. The UV - visual ab soip tion spectrum also confimed the interac-tion Composition in the complex was detem ined to be n(NR):n(yRNA)=1:2. An indirect elec-tranalyticalmethod for detem ining yRNA was also developed The detemm ining range was from 5.0×10’ g/L to 0.25 g/L and the detection lm it was 1.0 x10’ g/L. Keywords:::neutral red; yRNA; cyclic voltammetry; electroanalytical chem istry 核糖核酸(RNA)是所有生物的基本遗传物质,RNA与靶向小分子的相互作用是核酸研究的重要课题之一,从生物学和临床科学的角度来说研究小分子与 RNA的相互作用,对于认识小分子的生物活性以及药物作用机理有重要意义11-8。到目前为止,文献报道的核酸的主要测定方法有:荧光法、共振辐射法、拉曼光谱法及表面活性剂法等。近几年来,已有利用某些染料如乙基紫、红菁染料等作为标记物测定核酸的报道。本文建立了一种间接检测酵母核糖核酸(yRNA)的电化学方法。 中性红 (neutral red, 简称 NR)是一种常见的生物染料和光谱探针。从中性红的分子结构(见图可以看出,它具有易接受质子的N原子。本文采用电化学方法对 NR与yRNA的相互作用进行了研究,得到 yRNA与 NR相互作用为静电作用,且借助紫外光谱从分子水平上加以证实,并建立了一种间接检测酵母核糖核酸的电化学方法。 1) 实验部分 图1 NR的分子结构式 Fig.1 The structure ofNR 1.1 仪器与试剂 LK98BⅡ微机电化学分析系统(天津市兰力科化学电子高科技有限公司)。UV2550紫外-可见分光光度计(日本岛津)。三电极系统:玻碳电极为工作电极,饱和甘汞电极(SCE)为参比电极(以下报道的电位皆相对于此电极),铂片为对电极。 酵母核糖核酸(中国科学院生物化学研究所),中性红(分析纯),其他试剂均为分析纯。实验用水为二次蒸馏水。 ( 收稿日期:2006-10-19;修回日期:2006-12-02 ) ( 基金项目:四川省教育厅重点研究课题资助项目(2004A106);西华师范大学校级重点资助项目(2006A009) ) ( 作者简介:廖 纺(1974-) , 女,湖南兰 山 人,副教授, Te l : 0817-231 4 720, E-mail: liaozh a ng2003@163. com ) 1.2 实验方法 玻碳电极(直径为4mm)首先用0.05 umAlO;粉光粉抛光成镜面,然后分别在体积分数为50%的HNO溶液、1 :1 NaOH溶液和丙酮超声清洗 1min, 最后用二次蒸馏水冲洗即可。 溶液都用二次蒸馏水配制。配制1.0×10mol/L的 NR溶液及不同浓度的 yRNA溶液, pH5.6的CH, COOH- CH COONa缓冲溶液。 取一定体积 pH 5.6的 CH,COOH - CH,COONa缓冲溶液通氮除氧10min,电势扫描区间-1.0~0.0V,用循环伏安法活化电极,然后于一定体积的中性红标准溶液中,在一定电势扫描速率下记录-1.0~0.0V的循环伏安曲线。 紫外吸收的波长范围为200~800nm,分辨率为2mm,所有的实验均在(25±1)℃下进行。 1.3 实际样品测定 称取啤酒干酵母粉10 g,加入少许 0.04 mol/L的 NaOH溶液使之成为糊状,在乳钵中研磨均匀(待颜色由黄色变成白色时为止)。将研细的酵母粉转移至100 mL烧杯中,并且向烧杯中加入 0.04 mol/L的NaOH溶液至70mL。在沸水浴上加热30min后,冷却。1500 r/m in离心 30 min, 取上清液。然后向上清液中缓缓倾入酸性乙醇溶液(pH2.5左右),在加缓冲液的过程中注意经常搅拌,直至不再产生沉淀为止。待 RNA沉淀完全后,1500 r/min离心6min, 弃去清液。将得到的沉淀溶于缓冲液中,用电化学方法进行扫描,在0.68V和1.00V处可明显看到两个氧化峰,为酵母 RNA中的鸟嘌呤和腺嘌呤的特有峰。 2 结果与讨论 2.1 NR的电化学研究 图2a为在 pH 5.6的 CH, COOH - CH, COONa缓冲溶液中,且扫描速率为50mV/s时,1.0×10mol/L NR在玻碳电极上的循环伏安曲线,在曲线上可观察到1对氧化还原峰,其氧化峰和还原峰峰电位分别为-0.455V和-0.515V,峰电位差为60mV,氧化和和还原峰峰电流基本相等,因此, NR在此电位范围内发生准可逆的电化学反应,氧化还原式电位V=-485mV。这对氧化原峰归结于NR的第1对1电子的氧化还原反应o 试验了 pH值在2.0~7.0范围内,在玻碳电极上NR氧化峰峰电位与 pH值的关系。当pH值从2.0逐渐增加到7.0的过程中,氧化峰电位随 pH值的增加以68mV/pH的速率向负方向移动,其线性方程为: Vpa=-0.020 2- 图 2 NR与 yRNA相互作用的循环伏安图 Fig. 2 Cyclic voltammogram ofNR in CH,OOH-CH,COONa buffersolution(pH 5.6) a1.0 ×10-5mol/LNR; b 1.0 ×10-5 mol/L NR +0. 5 g/L yRNA 0.0682pH, 相关系数为-0.9912。表明质子参加了 NR的氧化过程,且参加反应的质子数与电子数相等110] 当NR的浓度在1.0×106~1.0x10mol/L之间时与峰电流呈线性关系,峰电流【(A)与质量浓度p(g/L)遵循如下关系: I=-0.8848-5.304×10 0,相关系数为0.999 4。 2.2 NR与 yRNA相互作用的电化学研究 采用循环伏安法对NR与 yRNA相互作用进行研究。图2曲线b为1.0 ×10mol/LNR+0.5g/L的 yRNA在 pH 5.6的 CH, COOH - CH,COONa缓冲液中的循环伏安曲线。在图中可观察到1对氧化还原峰,其峰电位分别为-0.452Ⅴ和-0.518V,峰电位差为66mV,氧化还原式电位V=-485 mV。比较曲线a和b,当往溶液中加入 yRNA时,氧化还原峰电流降低,但没有新的氧化还原峰出现,表明NR与yRNA相互作用时形成非电活性化合物,该化合物不能在电极表面发生氧化反应,或者说 NR与yRNA分子发生了较强的相互作用,该作用方式为静电作用。 2.3 扫描速率对 NR与 yRNA相互作用的电化学行为的影响 NR和NR- yRNA在玻碳电极上的循环伏安实验表明峰电流(Ⅰ)与扫描速率(v)有关。实验结果见 图3和图4。当v在0.01~5V/s时,无论 yRNA存在与否,Ia与v的关系均呈一向下弯的曲线,而与v成正比。表明NR和 NR-yRNA的电极氧化过程的控制步骤为扩散过程,且溶液中 yRNA的存在不影响 NR的电化学行为。 图3 NR峰电流与扫描速率的关系 Fig.3 Effect of scan rate on the peak currentscan rate: 0.01~5 V/s; a. 1.0×10-5 mol/LNR; b. 1.0×10-5 mol/L NR +0.5 g/L yRNA 2.4 NR与yRNA相互作用的紫外-可见光谱研究 在 pH5.6的 CH, COOH - CH, COONa溶液中,1.0×10mol/L NR单独存在时(图5曲线a)和1.0×10°mol/L NR与不同浓度的 yRNA同时存在时(图5曲线b、c、d质量浓度依次为0.01、0.05、0.1g/L)的紫外-可见吸收光谱图(见图5)。从该图可以观察到 NR单独存在时,在200~800mm之间,有2个吸收峰,分别位于520nm和260mm左右(曲线a),而在NR与yRNA共存的溶液光谱图中(曲线b),相应的吸收峰位没有发生变化,只是随着 yRNA浓度的增加,吸收峰强度越来越弱,表明在pH 5.6的 CH, COOH-CH,COONa缓冲溶液中,NR与yR-NA的相互作用方式为静电作用,这与电化学方法的结论一致。 2.5 NR与yRNA相互作用的结合常数 固定yRNA的浓度为1.0 ×10mol/L,测量出所加入的NR的浓度在1.0×10~1.0×10g/L范围内的 图4 NR峰电流与扫描速率的平方根的 关系 Fig. 4 Effect of square root of scan rate onthe peak current scan rate:0.01 ~5 V/s; a. 1.0×10-5mol/LNR; b. 1.0×10-5 mol/L NR +0.5 g/L yRNA 图5 NR与yRNA相互作用的紫外光谱图 Fig.5 The UV -Vis spectra of the interactionbeween NR and yRNA a1.0×10mol/L NR; b 1.0 ×10-mol/LNR +0. 01 g/L yRNA; c 1.0 ×10-mol/L NR+0.05g/L yRNA; dd1.0 ×10-5mol/L NR +0.1 g/L yRNA 峰电流的减少值,用1/I对1/Gp作图(m取不同值),当m=2时,即1分子 yRNA结合2分子NR时,曲线呈线性关系,线性回归方程为 1/AL("A)=0.149 26+2.536 ×10 6g [(mol/L)],相关系数为0.9989,此时,计算所得结合常数β=5.88 ×10° 2.6 yRNA的电化学检测 根据NR溶液中加入 yRNA后峰电流减小可以测定溶液中 yRNA的浓度。当NR的浓度为1.0×10~mol/L时,氧化峰电流与所加入 yRNA的质量浓度在 5.0×10~0.25 g/L范围内呈线性关系,回归方程为I(uA) =48.49-107.97p(g/L),相关系数 r=0.997, 检出限为1.0×10g/L. 2.7 干扰实验 在允许误差范围内,10倍的干扰物质,如一些常见的氨基酸(L赖氨酸、L半胱氨酸、L异白氨酸)以及阿魏酸、多巴胺等不干扰测定。 2.8样品的测定 按“1.3"方法,在选定的最佳条件下,取样品溶液10mL,采用标准加入法对实物中酵母核糖核酸进行了测定,结果见表1。回收率在 96%~109%之间。 表1样品分析结果(n=3) Table 1 Analytical results of samples(n=3) RNA original Added Found Recovery p/(10-4g.L) p/(10-4g·L-) pp/(10-4g.L-) R/% 3.0 1.0.2.0.3.0 4.0.5.2.6.3 96.108.109 ( 参考文献: ) ( T11 TJAHJONO D H, AK U TSU T, Y O SHDKAN, et al Cat i onic pophyrins bearing diazolium rings: synthesis and their in-teraction wit h calf thymus DNA[J] . B iochm etB iophys Acta, 1999, 1472:333-335 . ) ( 121 UNO T , HAMASAKIK, TAN IG A WA M, et al B inding of meso-tetrak is (N methylpyridinium) poiphyri n to doubl e heli-cal RNA and DNA -RNA h y brids[J]. . I norg Chem, 1997 , 36 : 1676 - 679. ) ( [3] MONNOTM, MAUF F RETO, SMONV, e t al DN A -d r ug r e cognition a nd effect s on topoisom e rase Ⅱ - med i a t e d cytotox-icity[J] . J Biol Chem , 1991,33 : 1 820-1 8 23. ) ( T4T KNEZM, SUMSER M, BITTNER AM, etalElectrochem ical modification of individual nano-objects[J]. J oumalofE-lectroanalytical Chem istr y , 2002, 522 : 70-7 4 . ) ( 5 BECKER H C, N OR D EN B. DNA bi n ding mode and seque n ce s pecificity of piperazinylcarbonyloxye thyl deriv a tives of an-thracene and pyrene[J]. J Am Che m Soc , 1999,121 : 11947-1 1 950. ) ( [6] MUKUNDANN E, P E THO G, D XON D W, et al I nteractions of an e lectron-rich t etracationic t entacle pomphyrin with calf thymus DNA[J]. I n org Chem, 1 994, 33: 4676-4679. ) ( [7] 艾珍,廖,朱林,等.酵母核糖核酸在碳纳米管修饰电极上的电化学行为及其分析测定[J].分析测试学报, 2005,24(5): 5 6-58. ) ( T8T 迟燕华,庄稼,董发勤,等.酵母核糖核酸的 UV-Vis光谱探针反应的机理研究[J].分析测试学报,2002,21 (1): 1 5-18. ) ( [9] LAV RON E J . Gen e ral exp r ession of the li n ear potential s w eep v o ltammogram in t he case of diffusionless electrochemicalsystem s[J ] . J Electroanal Chem , 1979 , 101 :1 9-28. ) ( 10] BARD A J, FAULKNERLR. E lectrochem icalmethods fandamental and application [M1. New York: John W iley & Sons, 1980 : 521-522 ) (上接第868页) 图3大米空白(A)总离子流色谱图及大米基质中 0.025mg/kg添加水平(B)的二苯醚化合物标准溶液总离子流色谱图 Fig.3 TIC chrmatograms ofrice blank solution (A) and rice sp iked with 0. 025 mg/kg diphenylether standard solutions(B) 1. cinmethylin(环庚草醚);2. fluordifen(氟咯草酮);3. oxyfluorfen(乙氧氟草醚);4. nitrofen(除草醚);5.aclonifen(苯草醚);6. chlomethoxyfen(甲氧除草醚); 7. bifenox(甲羧除草醚);8. lactofen(乳氟禾草灵);9. fluonoglycofen-ethyl(乙羧氟草醚) ( 参考文献: ) ( 1 赵贵民,贾凤聪.环庚草醚气相色谱分析方法[J].农药,2001,40(5): 20-21. ) [2] W IEDMANN JL. Revised confimatory piocedure for the detem ination of cobraMand metabolite residues in soybean seed[S1. EPA method BR-24107. ( 31 王逸虹,侯定远.除草醚的气相色谱测定[J].环境检测,1995, 5: 32-33. ) ( [4] 渠锋,莫汉宏,安凤春.反相高效液相色谱法检测水、土壤中的除草醚[J].农业环境保护,1999, 9, 1 1 8 8(2):79- ) 80 ( J5 王墙,龚龚生,连伟祥.乙羧氟草醚原药的高效液相色谱分析[J].农药,2002,41( 6 ):23-24. ) ( [61 LAGANA A, FAGO G, FA SCANIL, et al De t emm i nation of diphenyl-ether herbicides and metabolites in n atural watersusing high-perfomance liquid chromatography with diode array tandem mass spectrometric detection[J]. Anal Chim A cta,2000,414(1): 7 9-9 4 . ) O China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
确定



还剩2页未读,是否继续阅读?
天津市兰力科化学电子高技术有限公司为您提供《酵母核糖核酸与中性红中相互作用及电化学检测检测方案(电化学工作站)》,该方案主要用于其他中相互作用及电化学检测检测,参考标准--,《酵母核糖核酸与中性红中相互作用及电化学检测检测方案(电化学工作站)》用到的仪器有天津兰力科电化学工作站LK98BII
推荐专场
相关方案
更多
该厂商其他方案
更多
















