在这篇工作中,我们采用内标掺入 SILAC 的定量方法对大鼠胰岛进行了蛋白质组以及磷酸化蛋白质组的定量研究。通过对 SILAC 培养基的成分比例调整,我们优化了 INS-1E 细胞的标记方法。胰岛内包含多种细胞类型,如α细胞,β细胞,δ细胞等,我们发现采用 INS-1E 细胞系(一种β细胞系)已经可以较好的覆盖胰岛的全蛋白质组和磷酸化蛋白质组。若关心胰岛中的α细胞的话,则可以标记α细胞系来作为内标掺入胰岛。此外,我们还可以采用多种细胞系作为内标,这种称为“Super SILAC”的方法来完成对复杂组织蛋白质的全覆盖。
在磷酸化蛋白质组学流程中,我们采用了自制的基于StageTip 的TiO2萃取小柱来灵活的实现小量样品的磷酸化肽段富集。样品量始终是磷酸化以及其他一些翻译后修饰研究绕不过去的话题,一般来说只有增加样品量,并采取适当的预分级手段才能更深度的去覆盖这些翻译后修饰蛋白质组。ThermoFisher 也提供了商业化的 IMAC 试剂盒(Cat # 88300),鉴于 IMAC 和 TiO2 对磷酸化肽段富集有着较好的互补性,这两者联用会对磷酸化蛋白质组的深度覆盖达到更好的效果。
方案详情

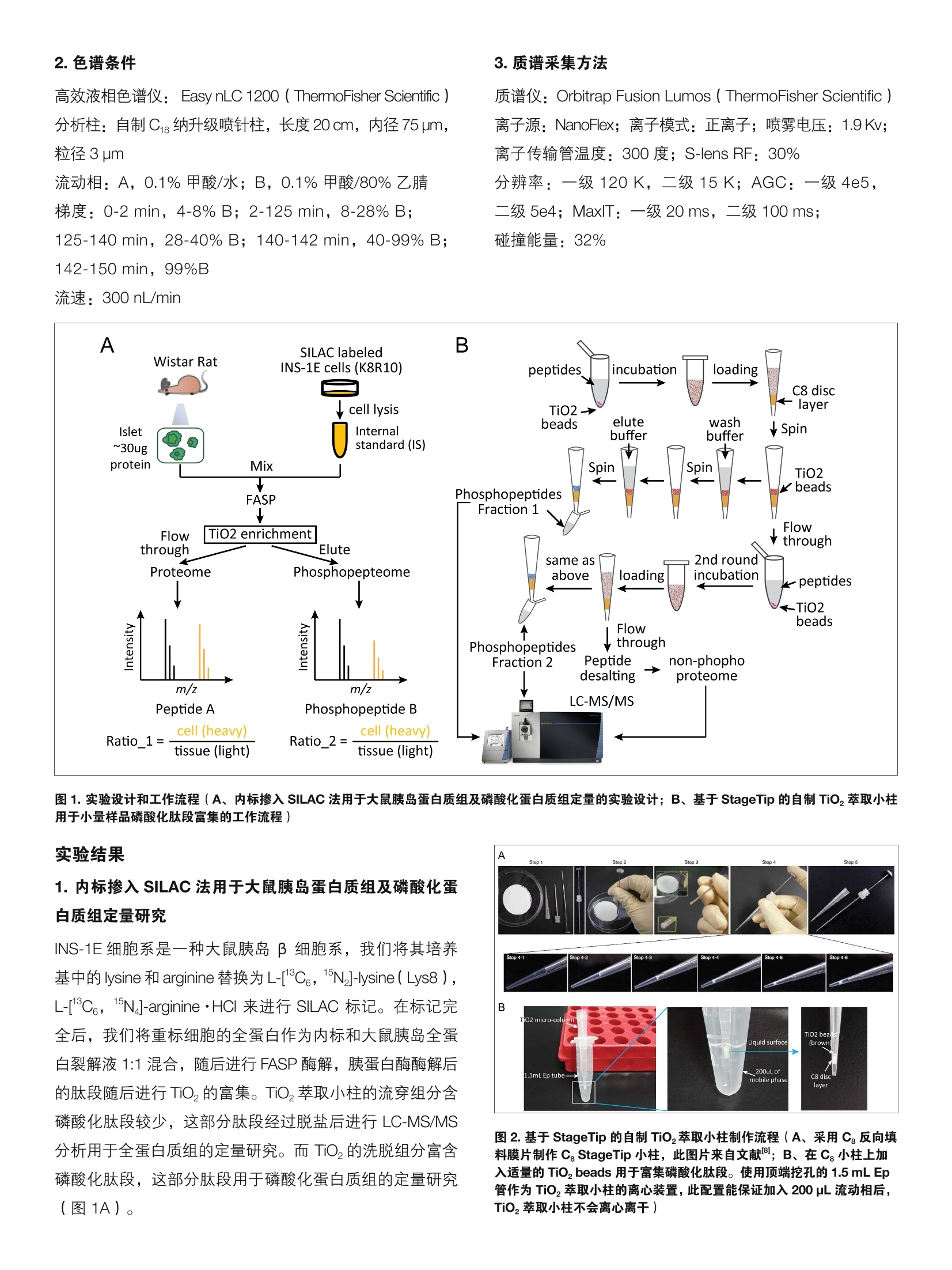
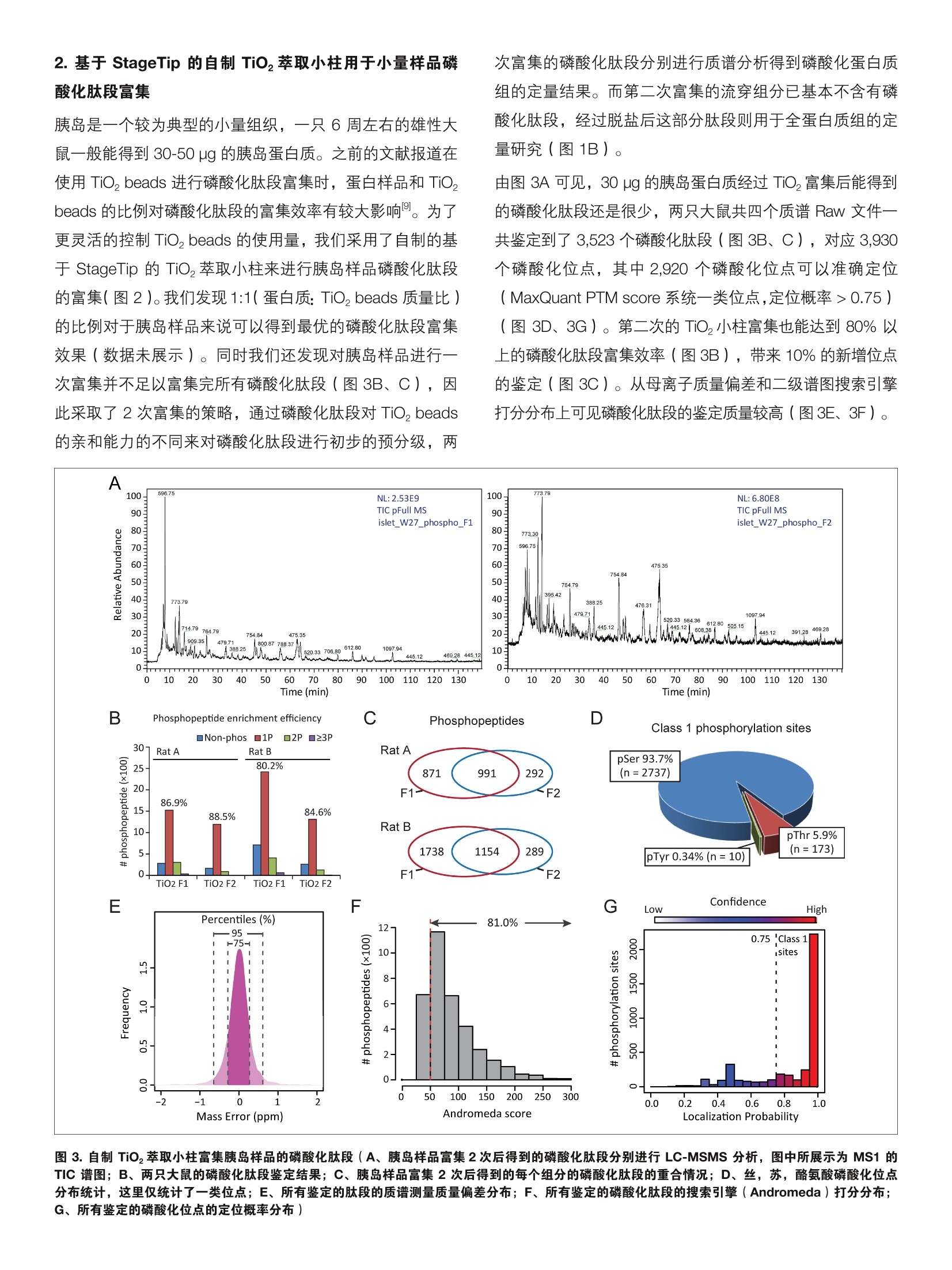
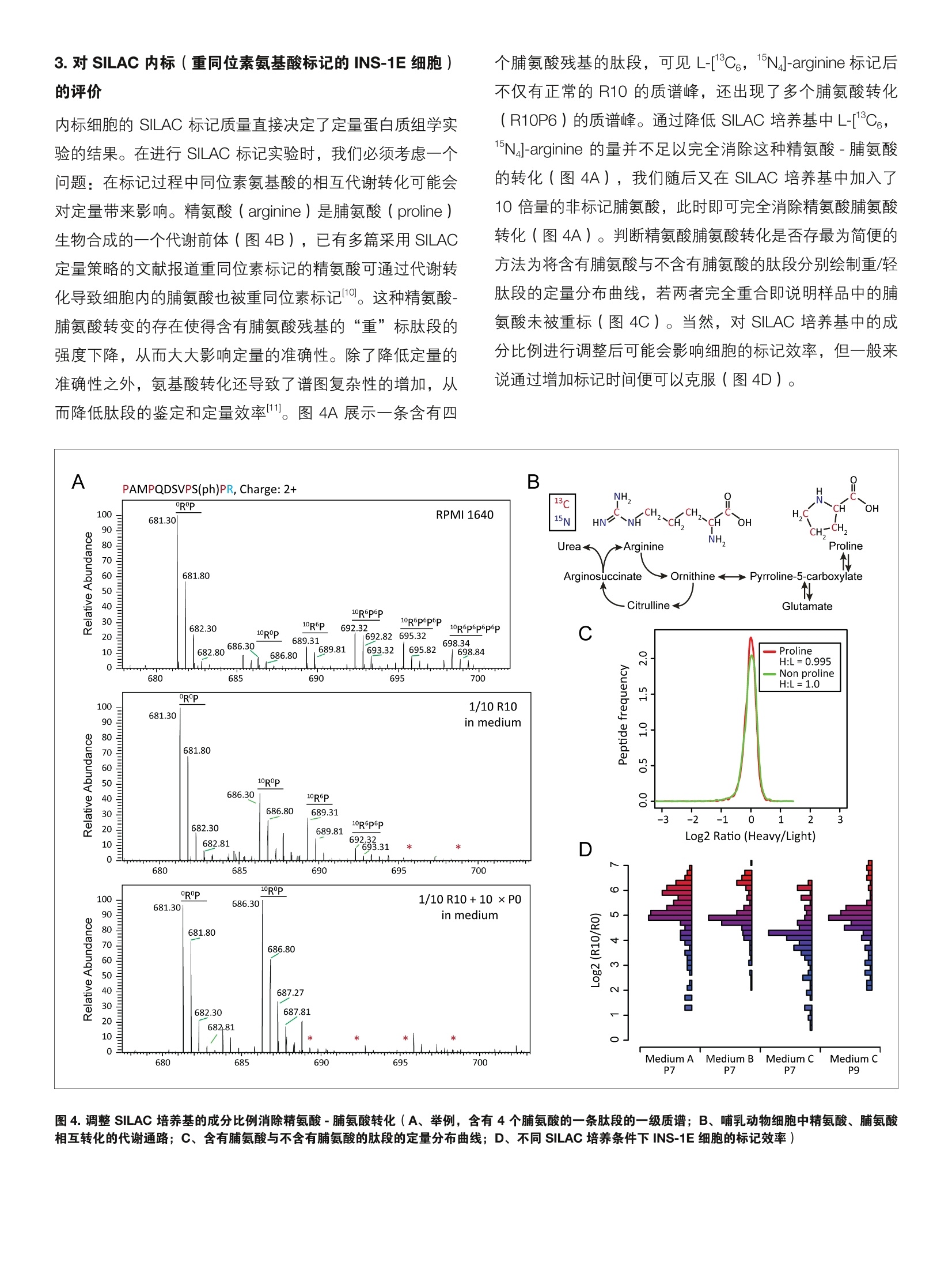
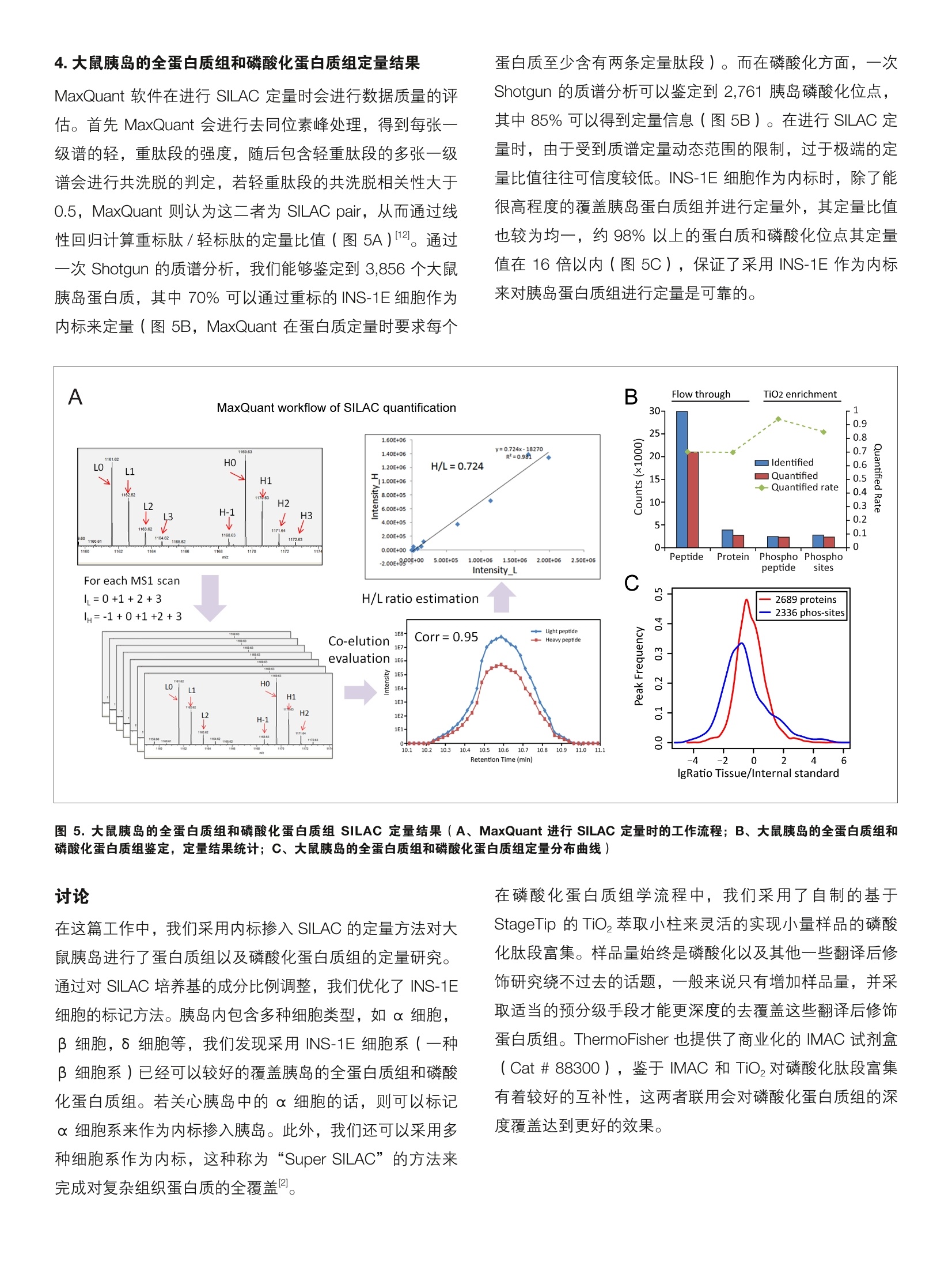
thermoscientific 内标掺入 SILAC 法用于小量组织的蛋白质组及磷酸化蛋白质组定量 唐家澍赛默飞世尔科技(中国)有限公司 关键词: spike-in SILAC, 小量组织,定量蛋白质组,磷酸化蛋白质组,胰岛 前言 非靶向蛋白质组学中有多种定量方法用于研究蛋白质表达以及翻译后修饰的调控,总体来说分为三类:非标记定量(label free),体内代谢标记和体外化学标记。稳定同位素氨基酸培养掺入标记(Stable Isotope Labeling byAmino acid in Cell culture, SILAC) 是使用最为广泛的一种体内代谢标记方法,除了能都实现对细胞系样品实的定量研究外, SILAC 方法还可以用于组织样品的定量蛋白质组学研究。通过使用合适的 SILAC 标记的细胞系样品作为内标,我们可以对组织样本的全蛋白质组2,乃至翻译后修饰3进行系统的定量研究。 磷酸化信号级联是生物体信号传导的关键分子机制,因此磷酸化蛋白质组学的研究一直是生物学研究的热点之一。磷酸化修饰在体内的丰度很低,因此需要对磷酸化肽段进行富集才能够通过质谱分析得到较好的鉴定结果。 实验方法 1.样品处理 磷酸化肽段的富集方法主要包括固定化金属亲和色谱( Immobilized Metal Affinity Chromatography, IMAC),二氧化钛(Titanium dioxide, Tio,)以及基于抗体的富集方法。受到蛋白质起始量的限制,在小量组织中进行磷酸化蛋白质组学的分析难度较大。在这篇工作中,我们采用适合小量组织的磷酸化蛋白质组学工作流程,结合内标掺入 SILAC 量定量方法对大鼠胰岛进行了蛋白质组以及磷酸化蛋白质组的定量研究。 INS-1E细胞采用 SILAC 培养基培养,其中掺入L-[13C,15N]-lysine(Lys8), L-[1C,;,15N]-arginine·HCI (Arg10)和普通脯氨酸(L-proline)。胰岛分离自6周雄性 Wistar大鼠,具体步骤参考文献。实验设计和工作流程见图1。 2.色谱条件 高效液相色谱仪:: EEasy nLC 1200 (ThermoFisher Scientific)分析柱:自制Cg纳升级喷针柱,长度20cm, 内径75 um,粒径3pm 流动相: A,0.1%甲酸/水;B,0.1%甲酸/80%乙腈梯度:0-2 min, 4-8% B; 2-125 min, 8-28% B;125-140 min, 28-40% B;; 140-142 min, 40-99% B;142-150 min, 99%B 3.质谱采集方法 质谱仪: Orbitrap Fusion Lumos ( ThermoFisher Scientific)离子源: NanoFlex;离子模式:正离子;喷雾电压:1.9Kv;离子传输管温度:300度; S-lens RF: 30%分辨率: 一级120K,二级15K; AGC:: -一级 4e5,二级5e4; MaxIT:一级20ms,二级100 ms;碰撞能量:32% 图1.实验设计和工作流程(A、内标掺入 SILAC 法用于大鼠胰岛蛋白质组及磷酸化蛋白质组定量的实验设计; B、基于 StageTip 的自制 TiO,萃取小柱用于小量样品磷酸化肽段富集的工作流程) 实验结果 1.内标掺入 SILAC 法用于大鼠胰岛蛋白质组及磷酸化蛋白质组定量研究 INS-1E 细胞系是一种大鼠胰岛β细胞系,我们将其培养基中的 lysine 和 arginine 替换为L-[C6,1N]-lysine(Lys8),L-13C,1N]-arginine·HCI 来进行 SILAC 标记。在标记完全后,我们将重标细胞的全蛋白作为内标和大鼠胰岛全蛋白裂解液1:1混合,随后进行FASP 酶解,胰蛋白酶酶解后的肽段随后进行 TiO,的富集。TiO,萃取小柱的流穿组分含磷酸化肽段较少,这部分肽段经过脱盐后进行 LC-MS/MS分析用于全蛋白质组的定量研究。而 TiO,的先脱组分富含磷酸化肽段,这部分肽段用于磷酸化蛋白质组的定量研究(图1A)。 图2.基于 StageTip 的自制 TiO,萃取小柱制作流程(A、采用Cg反向填料膜片制作 Cg StageTip 小柱,此图片来自文献;B、在Cg小柱上加入适量的 TiO,beads 用于富集磷酸化肽段。使用顶端挖孔的1.5mL Ep管作为 TiO,萃取小柱的离心装置,此配置能保证加入200 pL流动相后,Tio,萃取小柱不会离心离干) 2. 基于 StageTip 的自制 TiO,萃取小柱用于小量样品磷酸化肽段富集 胰岛是一个较为典型的小量组织,一只6周左右的雄性大鼠一般能得到 30-50 pg 的胰岛蛋白质。之前的文献报道在使用 TiO,beads 进行磷酸化肽段富集时,蛋白样品和 TiO,beads 的比例对磷酸化肽段的富集效率有较大影响。为了更灵活的控制 TiO, beads 的使用量,我们采用了自制的基于 StageTip 的 TiO,萃取小柱来进行胰岛样品磷酸化肽段的富集(图2)。我们发现1:1( 蛋白质: TiO, beads 质量比)的比例对于胰岛样品来说可以得到最优的磷酸化肽段富集效果(数据未展示)。同时我们还发现对胰岛样品进行一次富集并不足以富集完所有磷酸化肽段(图3B、C),因此采取了2次富集的策略,通过磷酸化肽段对 TiO, beads的亲和能力的不同来对磷酸化肽段进行初步的预分级,两 次富集的磷酸化肽段分别进行质谱分析得到磷酸化蛋白质组的定量结果。而第二次富集的流穿组分已基本不含有磷酸化肽段,经过脱盐后这部分肽段则用于全蛋白质组的定量研究(图1B)。 由图3A可见,30 pg的胰岛蛋白质经过 TiO,富集后能得到的磷酸化肽段还是很少,两只大鼠共四个质谱 Raw 文件一共鉴定到了3,523个磷酸化肽段(图3B、C),对应 3,930个磷酸化位点,其中2,920个磷酸化位点可以准确定位(MaxQuant PTM score 系统一类位点,定位概率>0.75)(图3D、3G)。第二次的 TiO,小柱富集也能达到80%以上的磷酸化肽段富集效率(图3B),带来10%的新增位点的鉴定(图3C)。从母离子质量偏差和二级谱图搜索引擎打分分布上可见磷酸化肽段的鉴定质量较高(图3E、3F)。 B Phosphopeptide enrichment efficiency C Phosphopeptides D 图 3.自制 TiO,萃取小集富集胰岛样品的磷酸化肽段(A、胰岛样品富集2次后得到的磷酸化肽段分别进行LC-MSMS 分析,图中所展示为MS1 的TIC 谱图; B、两只大鼠的磷酸化肽段鉴定结果;C、胰岛样品富集2次后得到的每个组分的磷酸化肽段的重合情况;D、丝,苏,酪氨酸磷酸化位点分布统计,这里仅统计了一类位点;E、所有鉴定的肽段的质谱测量质量偏差量布;F、所有鉴定的磷酸化肽段的搜索引擎(Andromeda)打分分布;G、所有鉴定的磷酸化位点的定位概率分布) 3. 对 SILAC 内标(重同位素氨基酸标记的 INS-1E 细胞)的评价 内标细胞的 SILAC 标记质量直接决定了定量蛋白质组学实验的结果。在进行 SILAC 标记实验时,我们必须考虑一个问题:在标记过程中同位素氨基酸的相互代谢转化可能会对定量带来影响。精氨酸 ( arginine ) 是脯氨酸 ( proline )生物合成的一个代谢前体(图4B),已有多篇采用 SILAC定量策略的文献报道重同位素标记的精氨酸可通过代谢转化导致细胞内的脯氨酸也被重同位素素记1。这种精氨酸-脯氨酸转变的存在使得含有脯氨酸残基的“重”标肽段的强度下降,从而大大影响定量的准确性。除了降低定量的准确性之外,氨基酸转化还导致了谱图复杂性的增加,从而降低肽段的鉴定和定量效率。图4A展示一条含有四 个脯氨酸残基的肽段,可见L-c,1N]-arginine 标记后不仅有正常的R10的质谱峰,还出现了多个脯氨酸转化(R10P6)的质谱峰。通过降低 SILAC 培养基中L-13C,15N]-arginine 的量并不足以完全消除这种精氨酸-脯氨酸的转化(图4A),我们随后又在 SILAC 培养基中加入了10倍量的非标记脯氨酸,此时即可完全消除精氨酸脯氨酸转化(图4A)。判断精氨酸脯氨酸转化是否存最为简便的方法为将含有脯氨酸与不含有脯氨酸的肽段分别绘制重/轻肽段的定量分布曲线,若两者完全重合即说明样品中的脯氨酸未被重标(图4C)。当然,对 SILAC 培养基中的成分比例进行调整后可能会影响细胞的标记效率,但一般来说通过增加标记时间便可以克服(图4D) 4.大鼠胰岛的全蛋白质组和磷酸化蛋白质组定量结果 MaxQuant 软件在行行 SILAC 定量时会进行数据质量的评估。首先 MaxQuant 会进行去同位素峰处理,得到每张一级谱的轻,重肽段的强度,随后包含轻重肽段的多张一级谱会进行共洗脱的判定,若轻重肽段的共洗脱相关性大于0.5, MaxQuant 则认为这二者为 SILAC pair, 从而通过线性回归计算重标肽/轻标肽的定量比值(图5A)12。通过一次 Shotgun 的质谱分析,我们能够鉴定到 3,856个大鼠胰岛蛋白质,其中70%可以通过重标的 INS-1E细胞作为内标来定量(图5B, MaxQuant 在蛋白质定量时要求每个 蛋白质至少含有两条定量肽段)。而在磷酸化方面,,一次Shotgun 的质谱分析可以鉴定到2,761胰岛磷酸化位点,其中85%可以得到定量信息(图5B)。在进行 SILAC 定量时,由于受到质谱定量动态范围的限制,过于极端的定量比值往往可信度较低。INS-1E细胞作为内标时,除了能很高程度的覆盖胰岛蛋白质组并进行定量外,其定量比值也较为均一,约98%以上的蛋白质和磷酸化位点其定量值在16倍以内(图5C),保证了采用 INS-1E 作为内标来对胰岛蛋白质组进行定量是可靠的。 讨论 在这篇工作中,我们采用内标掺入 SILAC 的定量方法对大鼠胰岛进行了蛋白质组以及磷酸化蛋白质组的定量研究。通过对 SILAC培养基的成分比例调整,我们优化了 INS-1E细胞的标记方法。胰岛内包含多种细胞类型,如α细胞,β细胞,8细胞等,我们发现采用 INS-1E细胞系(一种β细胞系)已经可以较好的覆盖胰岛的全蛋白质组和磷酸化蛋白质组。若关心胰岛中的α细胞的话,则可以标记α细胞系来作为内标掺入胰岛。此外,我们还可以采用多种细胞系作为内标,这种称为“Super SILAC”的方法来完成对复杂组织蛋白质的全覆盖2。 在磷酸化蛋白质组学流程中,我们采用了自制的基于StageTip 的 TiO,萃取小柱来灵活的实现小量样品的磷酸化肽段富集。样品量始终是磷酸化以及其他一些翻译后修饰研究绕不过去的话题,-一般来说只有增加样品量,并采取适当的预分级手段才能更深度的去覆盖这些翻译后修饰蛋白质组。ThermoFisher也提供了商业化的 IMAC 试剂盒(Cat#88300), 鉴于 IMAC 和 TiO,对磷酸化肽段富集有着较好的互补性,这两者联用会对磷酸化蛋白质组的深度覆盖达到更好的效果。 ( 2. Mann, M., F unctional and quantitative proteomics usingSILAC. Nat Rev Mol Cell Biol, 2006.7(12): p.952-8. ) ( 2. Geiger, T ., et al. , Super-SILAC mix f o r quantitativeproteomics of human tumor tissue. Nat M ethods,2010.7(5): p.383-5. ) ( 3. Monetti, M., et al. , Large-scale phosphositequantification in tissues by a spike-in SILAC m ethod.Nat Methods, 2011.8(8):p.655-8. ) ( 4. Posewitz, M.C. a nd P . Tempst, I m mobilized gallium(III)affinity chromatography of phosphopeptides. AnalChem,1999.71 ( 14): p. 2883-92. ) ( 5. Larsen, M .R., et al., H ighly s elective enrichment ofphosphorylated peptides from peptide mixtures using titanium dioxide microcolumns. Mol C e ll Proteomics, 2005.4(7): p . 873-86. ) ( 6. Carretero, J., et al . , Integrat i ve genomic an d proteomicanalyses identify targets for L kb1-deficient metastaticlung tumors.Cancer Cell, 2010. 1 7(6): p.547-59. ) ( 7. Lacy, P.E. and M. Kostianovsky, Method for the iso l ationof intact islets o f Langerhans from t h e r a t p a ncreas.Diabetes, 1 967. 16(1): p . 35-9. ) Orbitrap 组 赛默飞小分子质学俱乐部 谱应用技术群 赛默飞世尔科技(中国)有限公司 www.thermofisher.com 8. Rappsilber, J., M. Mann, and Y. Ishihama, Protocol formicro-purification, enrichment, pre-fractionation andstorage of peptides for proteomics using StageTips.Nat Protoc, 2007.2(8): p. 1896-906. 9. Li, Q.R., et al., Effect of peptide-to-TiO,beads ratio onphosphopeptide enrichment selectivity. J ProteomeRes,2009.8(11):p. 5375-81. 10. Ong, S.E., I. Kratchmarova, and M. Mann, Propertiesof 13C-substituted arginine in stable isotope labelingby amino acids in cell culture (SILAC). J ProteomeRes, 2003.2(2): p. 173-81. 11. Blagoev, B. and M. Mann, Quantitative proteomics tostudy mitogen-activated protein kinases. Methods,2006.40(3): p.243-50. ( 12. Cox, J. and M. Mann, MaxQuant enables high peptideidentification rates, individualized p.p.b.-range massaccuracies a nd proteome-wide protein quantification.Nat Biotechnol, 2008.26(12):p. 1 367-72. ) S CIENTIFIC 支持手机用户)
确定


还剩4页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《大鼠胰岛中小量组织的蛋白质组,磷酸化蛋白质组检测方案(液相色谱仪)》,该方案主要用于其他中小量组织的蛋白质组,磷酸化蛋白质组检测,参考标准--,《大鼠胰岛中小量组织的蛋白质组,磷酸化蛋白质组检测方案(液相色谱仪)》用到的仪器有赛默飞EASY-nLC 1200纳升级UHPLC
推荐专场
相关方案
更多
该厂商其他方案
更多
















