
方案详情
文
综上, 本文报道的食品和饮料中多种维生素的反相高效液相色谱同时测定方法, 实现了一次处理、同时分析12 种不同性质维生素的目的, 具有一定的实际应用价值。
方案详情

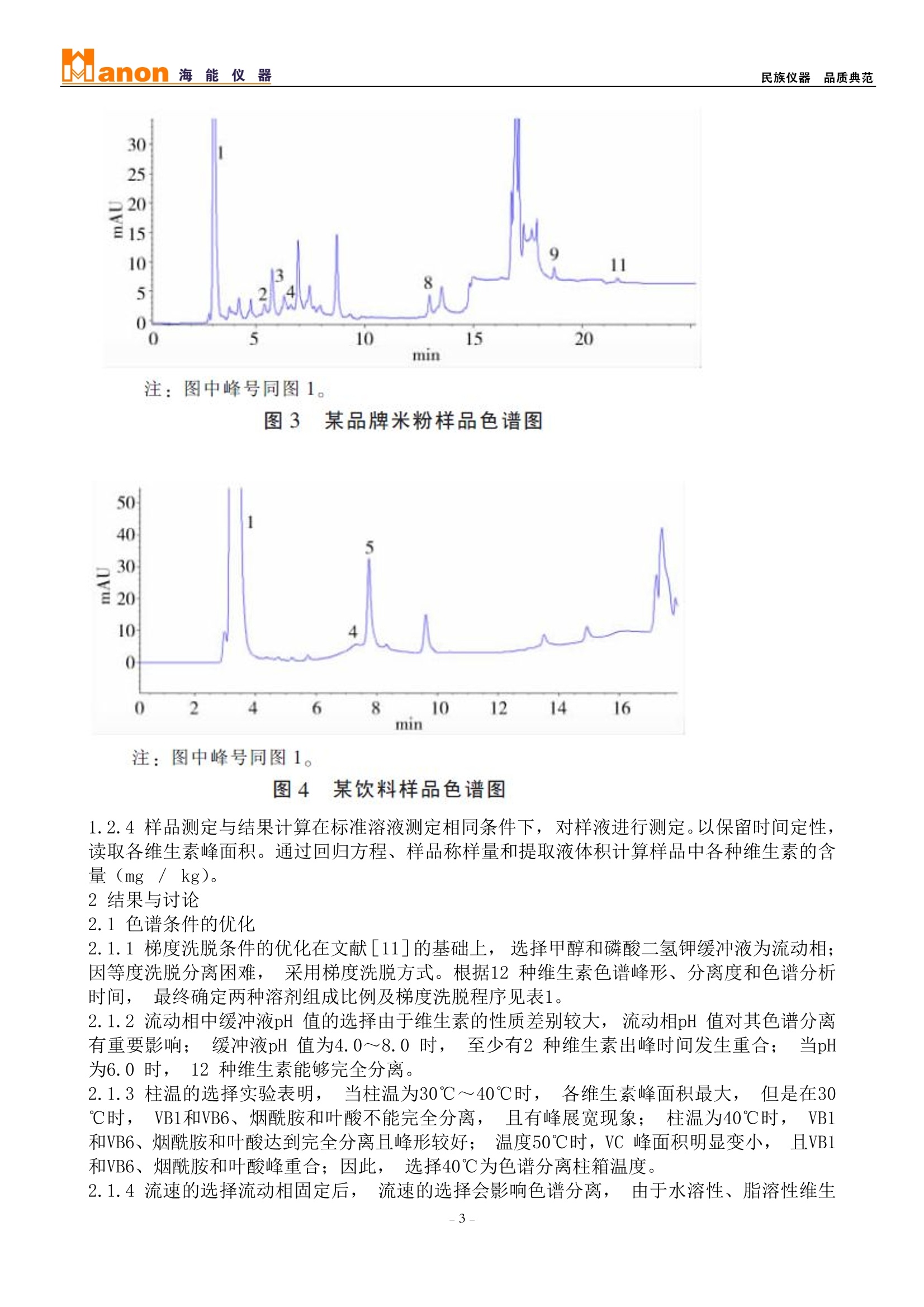
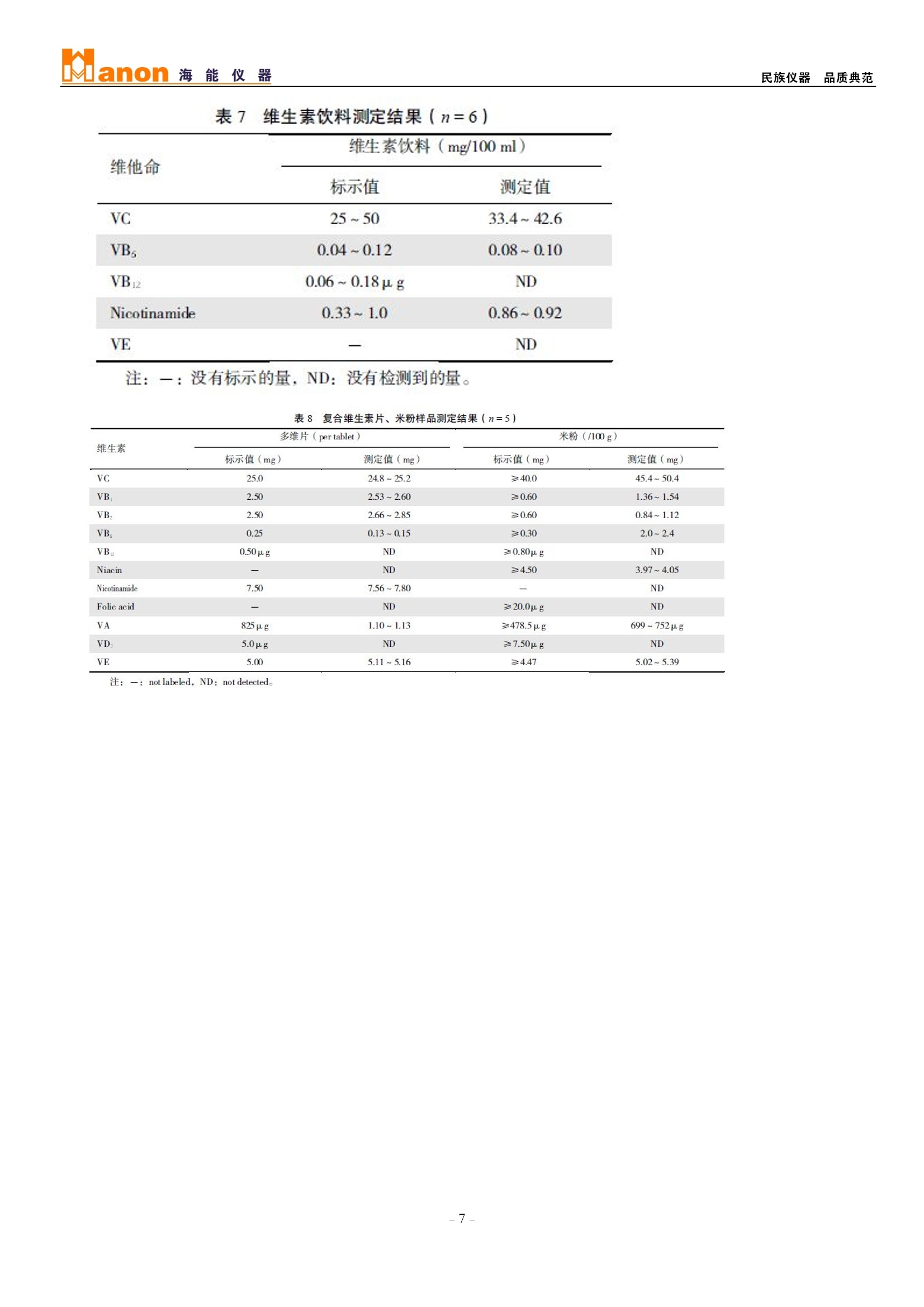
Manon海能仪 器民族仪器品质典范 食品、多维片和饮料中12种维生素的高效液相色谱法同时测定 维生素是一类性质各异的低分子量天然有机化合物,具有不同的生理功能、分子结构和理化性质,在生物体的生命活动中具有十分重要的作用,与人体的生长发育和健康密切相关;维生素的种类很多,按其溶解性可分为水溶性维生素和脂溶性维生素。目前维生素的测定方法主要有紫外光度法[1]、荧光光度法[2]、气相色谱法[3]、高效液相色谱法(HPLC)[4~7]和高效毛细管电泳法[8,9]等。HPLC 不仅操作简便,重现性好,而且其温和的操作条件对于稳定性差的维生素也可得到准确的定量结果;但在多数多用HPLC法对维生素进行测定的文献中只是对其中一类维生素中的几种进行测定,对水溶性、脂溶性维生素进行同时测定的文献报道极少。本研究建立了反相高效液相色谱法同时测定了8种水溶性维生素和4种脂溶性维生素的方法,并应用于实际样品中测定,取得了较为满意的结果。 1材料与方法 1.1主要仪器与试剂 海能LC7000高效液相色谱仪;色谱谱(C18,5um, 4.6×250mm);。甲醇(色谱纯)、 盐酸(优级纯)、乙醇(分析纯)、无水乙醚(分析纯)、氢氧化钾(分析纯)、磷酸二氢钾(分 析纯),其他试剂除指明外均为分析纯。维生素标准品: VC、VB1、VB2、VB6、VB12、烟酸、叶酸、VD3、VE标准品;烟酰胺标准品;VK1标准品所;VA(视黄醇) 标准品。维生素标准储备液:分别称取维生素A、D3、E、K1的标准贮备液(1mg/ ml, 乙醇配制),-18℃避光保存; VB1、VB2、VB6、VB12、烟酸、烟酰胺标准贮备液(1mg / ml, 0.01 mol/ LHCl配制);叶酸标准贮备液(1mg / ml, 200 p15mol/LKOH溶解后,再用0.01mol / L HCl定容); VC 临用新配 (1mg / ml, 0.01 mol / L HCl配制); 储备液均储于-18℃冰箱中。临用新配维生素标准应用液。 实验用水为Millipore 超纯水(18.2MQ·cm)。脂溶性维生素A和E 应用液浓度在测定前标定[10]。 本实验中的多维片、强化米粉、玉米粉和饮料样品均购自超市。 1.2实验方法 1.2.1色谱条件流动相:A:(0.05 mol/LKH2P04溶液(pH 6.0);;B: 甲醇;色谱线性梯度洗脱程序;柱温::40℃。见表1。 表11线性梯度洗脱程序(×10) 时间(min) A(%) B(%) 流速(ml/min) 0.00 97.0 3.0 1.10 13.00 40.0 60.0 1.10 13.01 0.0 100.0 1.10 18.00 0.0 100.0 1.10 18.01 0.0 100.0 1.50 26.00 0.0 100.0 1.50 1.2.2标准 曲线的绘制 根据不同样 品中维生素 的含量范 围,用标准 储备液配制 不同浓度的 混合标准 液,在高效液相色谱仪基线达平直后,进行测定并绘制标准曲线; 维生素混合标准色谱图见图1。 注: 1. 维生素C (VC,/9 3.0 min): 2. 烟;酸(Niacin,,5.3 min): 3.维生素B1 (VB1, 6.3 min): 4. :维生素B6 (VB6, 6.7 min): 5. :烟酰胺 (Nicotinamide, 7.4 min): 6.叶酸 (Folic acid, 7.8min); 7 维生素B12(VB12, 11.0 min); 8.维生素B2 (VB2,12.9 min); 9..:维生素A (VA,, 18.7 min); 10.维生素D3(VD3, 21.1 min): 11.维生素E(VE, 21.7min): 12.维生素K1 (VK1, 24.9 min). 图112种维生素混合标准样品色谱图 1.2.3样品处理复合维生素片剂、米粉准确称取0.2g碾磨混匀的样品于15ml离心管内,加入10 ml 0.01 mol / L HCl, 超声提取15 min 后12000 r / min 离心5 min,取上清液作为待测液A; 再准确称取样品(碾磨均匀的复合维生素片0.7g或米粉4g)于250ml三角瓶中,加入20 ml 乙醇,,i超声提取15min,加入50%的KOH溶液(复合维生素片剂5 ml;米粉10ml),90℃皂化30 min, 皂化液用100ml 乙醚萃取并于40℃水浴旋蒸至干,, 5ml乙醇定容,此为待测则B;将同种样品的A液与B液以体积比9:1混合作为测试液,201ul进样分析;样品色谱图见图2、3。 饮料取一定量经0.45um 滤膜过滤后, :20u1进样分析。样品色谱图见图4。 图2 某多维片样品色谱图 注:图中峰号同图1。 图3 某品牌米粉样品色谱图 注:图中峰号同图1。 图4 某饮料样品色谱图 1.2.4样品测定与结果计算在标准溶液测定相同条件下,对样液进行测定。以保留时间定性,读取各维生素峰面积。通过回归方程、样品称样量和提取液体积计算样品中各种维生素的含量(mg / kg)。 2结果与讨论 2.1色谱条件的优化 2.1.1梯度洗脱条件的优化在文献[11]的基础上,选择甲醇和磷酸二氢钾缓冲液为流动相;因等度洗脱分离困难, 采用梯度洗脱方式。根据12种维生素色谱峰形、分离度和色谱分析时间,最终确定两种溶剂组成比例及梯度洗脱程序见表1。 2.1.2流动相中缓冲液pH 值的选择由于维生素的性质差别较大,流动相pH 值对其色谱分离有重要影响; 缓冲液pH 值为4.0~8.0时, 至少有2种维生素出峰时间发生重合; 当pH为6.0时,12种维生素能够完全分离。 2.1.3柱温的选择实验表明, 当柱温为30℃~40℃时, 各维生素峰面积最大, 但是在30℃时,VB1和VB6、烟酰胺和叶酸不能完全分离,且有峰展宽现象; 柱温为40℃时, VB1和VB6、烟酰胺和叶酸达到完全分离且峰形较好; 温度50℃时, VC峰面积明显变小,,且VB1和VB6、烟酰胺和叶酸峰重合;因此, 选择40℃为色谱分离柱箱温度。 2.1.4流速的选择流动相固定后,流速的选择会影响色谱分离, 由于水溶性、脂溶性维生 素性质不同, 因此在分析过程中选择了不同的流速见表1。 2.1.5检测波长的选择8种水溶性维生素的最大吸收波长相近(见表2), 由于VB1与VB6、烟酸与叶酸的峰分离时间间隔较短,难以完成波长切换,,为确保方法灵敏度,将VB1、VB6、烟酰胺、叶酸的检测波长都设为266 nm; 其余均为其最大吸收波长。检测波长切换程序见表 3. 表2 12种维生素的最大吸收波长(nm) 维生素 最大吸收浓度 维生素 最大吸收浓度 VC 266 VB: 360 Niacin 266 VB: 266 VB 266 VA 325 VB. 291 VD. 265 Nicotinamide 266 VE 295 Folic acid 278 VK 254 表3检测波长切换程序 时间(min ) 检测波长(nm) 0.00 266 10.00 360 12.00 266 18.00 325 20.00 265 21.50 295 23.00 254 2.2测定液中乙醇含量对测定的影响 在维生素混合标准液中,', 乙醇含量对VA峰面积有增大作用, 其余11种维生素峰面积不受其影响。但当乙醇含量超过 10%时,,烟酸峰形开始分叉,随着乙醇比例的提高, VB1、VB6的峰形和分离度也受到影响;进样量太大,烟酸、VB1、VB6、烟酰胺和叶酸的峰形都也有变差的趋势。故在测定液中需固定乙醇含量在一定的范围。 2.3方法性能评价 2.3.1线性范围和检出限在优化的色谱条件下,本法的线性回归方程、最低检出限、保留时间和峰面积的相对标准差见表4。 表44方法的回归方程、线性范围、检出限和重现性(n=5) 维生素 线性范围(pg) 回归方程 7 检出限(pg/ml) 相对标准偏差(%) 相对标准偏差(%) VC 0~5.0 y=4.432x-27.53 0.999 0.073 0.82 4.20 VB 0~1.0 y=1.470x-3.764 0.999 0.094 0.76 2.32 VB: 0~1.0 v=4.015x+28.74 0.998 0.087 1.12 3.14 VB. 0~1.0 y=0.734x-2.163 0.999 0.170 1.33 3.29 VB: 0~1.0 v=1.016x-0.096 0.999 0.116 1.24 2.55 Niacin 0~0.5 v=1.417x-3.469 0.999 0.134 1.62 3.46 Nicotin-a mide 0~1.0 v=1.344x-0.669 0.999 0.076 1.78 2.13 Folic acid 0~1.0 y=2.435x-0.957 0.999 0.086 1.76 4.38 VA 0~2.0 y=2.397x-2.910 0.999 0.093 0.82 3.02 VD:1 0~0.4 y=1.13x-1.812 0.999 0.134 0.91 2.44 VE 0~1.0 v=0.145x+0.433 0.999 0.193 1.26 3.95 VK 0~1.0 y=0.938x+1.108 0.999 0.162 1.48 3.21 注:“保留时间的 RSD;‘峰面积的RSD。 2.3.2精密度本法峰面积的日间精密度范围为1.35%~4.11%。样品测定精密度测定RSD 范围为0.92%~4.80%。 2.3.3准确度由表5、6可见, 本法在多维片、米粉和饮料样品中各维生素的加标回收率范围是75.5%~129%。 2.4方法应用 应用本法测定了复合维生素片、米粉、饮料、玉米粉中水溶性和脂溶性维生素含量, 结果见表7、8。 综上,本文报道的食品和饮料中多种维生素的反相高效液相色谱同时测定方法, 实现了一次处理、同时分析12种不同性质维生素的目的,9具有一定的实际应用价值。 表5 多维片与米粉样品中维生素的回收率(n=3,x10=) 注: ND: not detected, -: not tested。 表6饮料中维生素的加标加收率实验(n=3,×10²) 维生素饮料(/20p.l) 维他命 本底值 加入量 测定值维他命 维生素饮料(/20p1) 本底值 加入量 测定值 回收率 (pg) (pg) (pg) 回收率 (pg) (pg) (pg) VC 236.8 113.2 352.1 102 VB ND 1.670 1.940 116 216.4 437.7 92.8 3.360 3.340 99.4 324.6 576.5 105 5.040 5.040 100 VB ND 0.940 0.990 105 Niacin ND 1.600 1.890 118 1.880 1.830 97.3 3.210 3.350 104 2.820 2.720 96.5 4.810 4.940 103 VB: ND 0.930 0.900 96.8 Nicotinamide 3.210 0.510 3.750 106 1.850 1.590 86.0 1.020 3.980 75.5 2.780 2.150 77.3 1.530 4.480 83.0 VB。 1.130 1.390 2.640 108 Folie acid ND 0.540 0.500 92.6 2.780 3.810 96.4 1.080 1.070 99.1 4.180 5.280 99.3 1.620 1.540 95.1 注: ND: not detected; 一: not tested。 表7 维生素饮料测定结果(n=6) 维他命 维生生饮料(mg/100 ml) 标示值 测定值 VC 25~50 33.4~ 42.6 VB, 0.04~0.12 0.08~0.10 VB2 0.06~0.18pg ND Nicotinamide 0.33~1.0 0.86~0.92 VE 一 ND 注:一:没有标示的量, ND:没有检测到的量。 表8复合维生素片、米粉样品测测结果(n=5) 维生素 多维片(per tablet) 米粉(/100g) 标示值(mg) 测定值(mg) 标示值(mg) 测定值(mg) VC 25.0 24.8~25.2 ≥40.0 45.4~50.4 VB 2.50 2.53~2.60 ≥0.60 1.36~1.54 VB. 2.50 2.66~2.85 ≥0.60 0.84~1.12 VB. 0.25 0.13~0.15 ≥0.30 2.0~2.4 VB过 0.50pg ND ≥0.80p.g ND Niacin 一 ND ≥4.50 3.97~4.05 Nicotinamide 7.50 7.56~7.80 二 ND Folic acid ND ≥20.0pg ND VA 825pg 1.10~1.13 ≥478.5pg 699~752pg VD: 5.0pg ND ≥7.50pg ND VE 5.00 5.11~5.16 ≥4.47 5.02~5.39 注: 一: not labeled, ND: not detected。 --
确定





还剩5页未读,是否继续阅读?
海能未来技术集团股份有限公司为您提供《饮料中多种维生素检测方案 》,该方案主要用于果蔬汁类及其饮料中营养成分检测,参考标准--,《饮料中多种维生素检测方案 》用到的仪器有
相关方案
更多
该厂商其他方案
更多








