
方案详情
文
在使用高效液相色谱(HPLC)进行分析时,溶剂的质量和纯度非常重要,因为溶剂要全程使用。对化合物的检测、定 性和定量分析很大程度上依赖于检出限,检出限可以在基线分析的同时获得。本文主要考察超纯水作为一种试剂对实验的 影响。我们出示了各种不同质量的水对分析的影响方式。在产生超纯水的整个复合纯化过程中,我们对有机污染物进行了 监测。这个超纯水纯化链的构造使得输出的超纯水无有机污染物(这些有机污染物会干扰反相色谱的灵敏性)。在进行痕 量有机物分析时,小心维持水纯化系统的稳定也是非常关键的。
方案详情

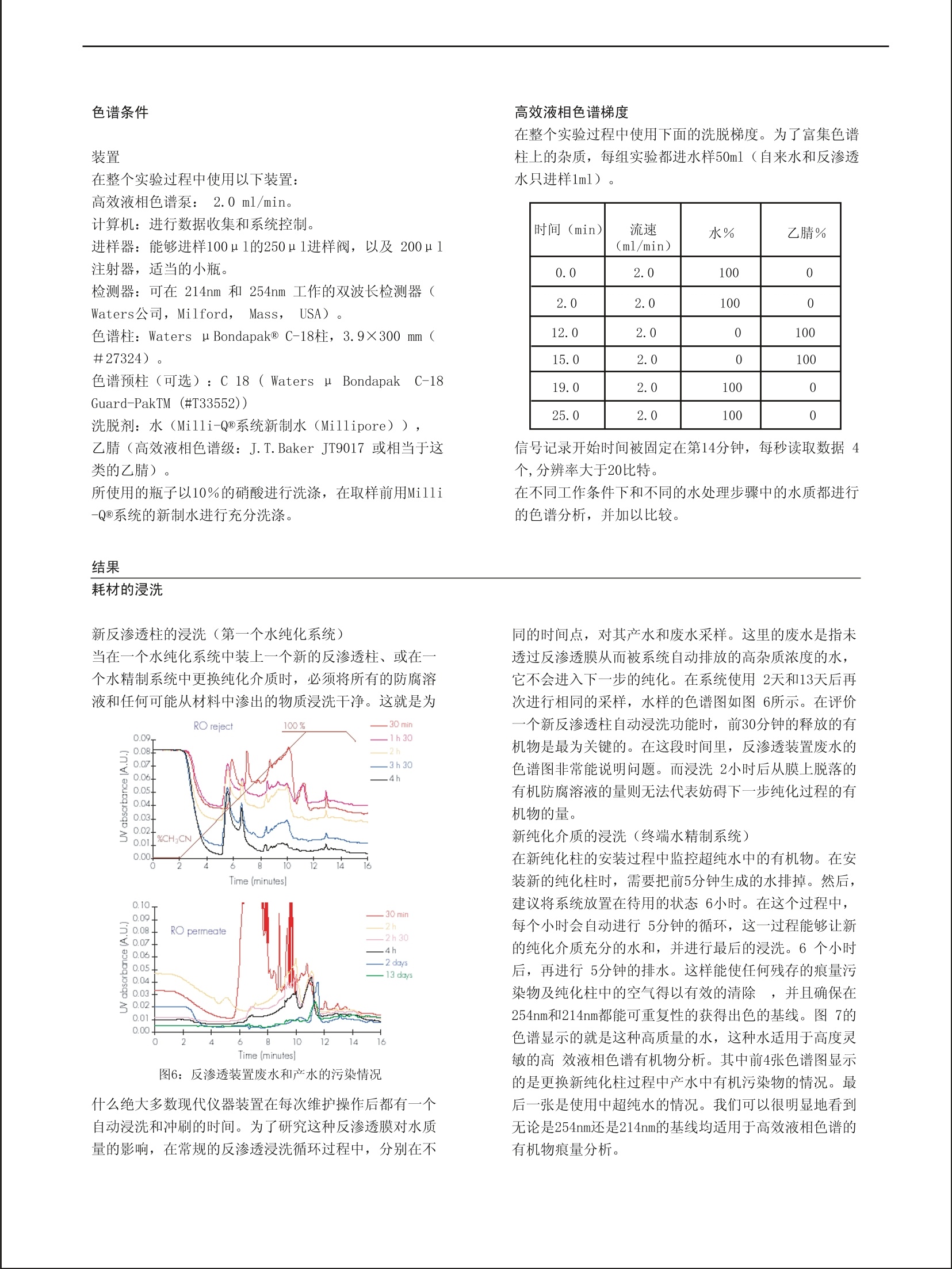
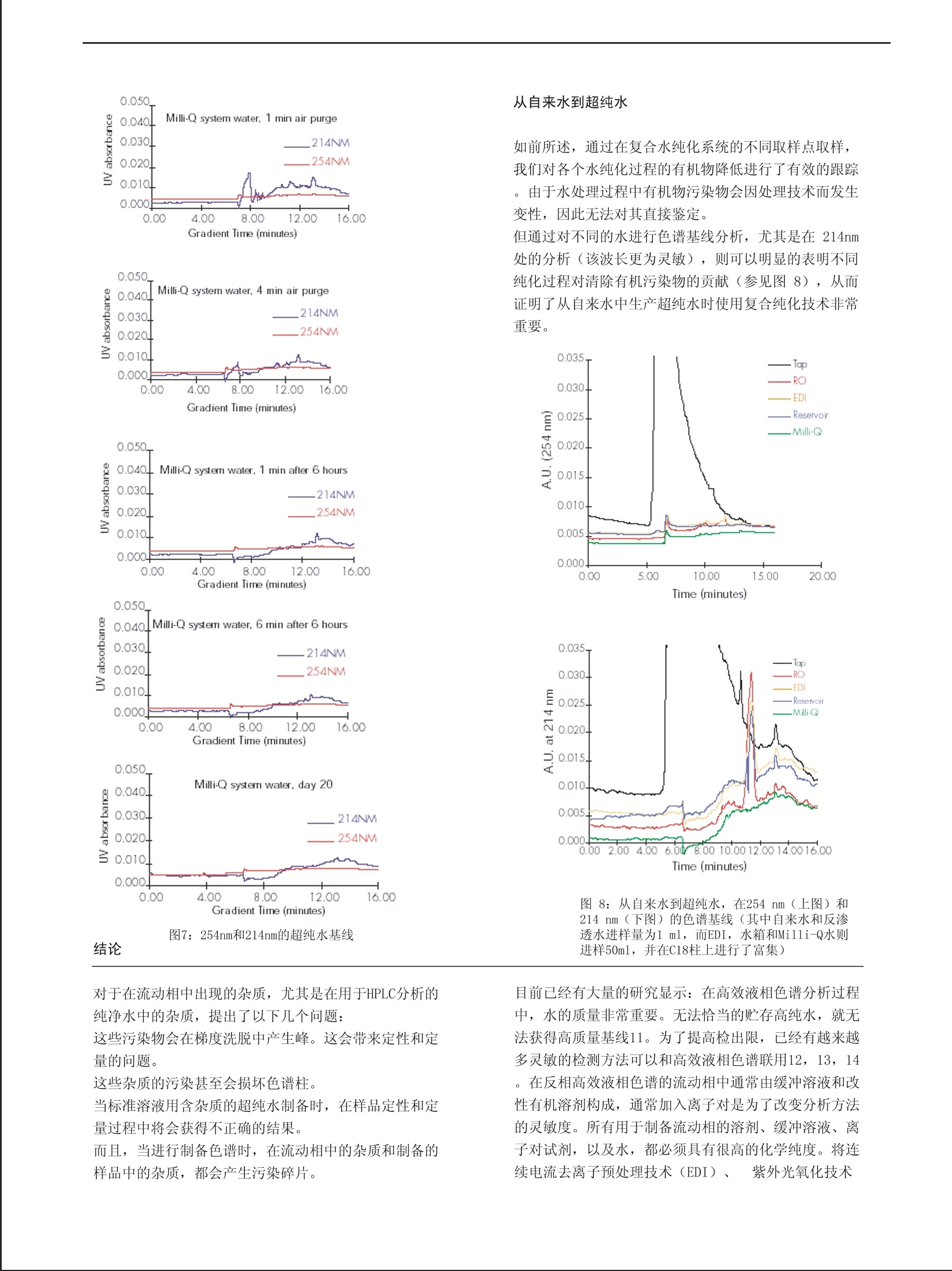
RD005 从自来水到超纯水:有机污染物的跟踪 Daniel Darbouret (1), Thomas Stone (2),姜勇(译)(3) (1) Research & Development, Laboratory Water Division, Millipore S.A., St Quentin en Yvelines, France. (2) Central Research & Development, Analytical Lab, Millipore Corp, USA. (3)密理博中国有限公司北京代表处 关键词:超纯水,有机污染物,反相色谱,紫外检测,基线 摘要: 在使用高效液相色谱(HPLC) 进行分析时,溶剂的质量和纯度非常重要,因为溶剂要全程使用。对化合物的检测、定性和定量分析很大程度上依赖于检出限,检出限可以在基线分析的同时获得。本文主要考察超纯水作为一种试剂对实验的影响。我们出示了各种不同质量的水对分析的影响方式。在产生超纯水的整个复合纯化过程中,我们对有机污染物进行了监测。这个超纯水纯化链的构造使得输出的超纯水无有机污染物(这些有机污染物会干扰反相色谱的灵敏性)。在进行痕量有机物分析时,小心维持水纯化系统的稳定也是非常关键的。 前言 高效液相色谱分析的质量很大程度上依赖于所使用的检测系统及所使用的溶剂的质量1。从物理信号的检测,到光发射/吸收信号的检测,再到电信号的检测,其检测方法各不相同。每种技术都对流动相有特殊要求,而且尤其关键的是:所用超纯水的质量将会影响检出限2。反相模式和紫外检测结合使用是液相色谱最常用的分离方法之一3,4,5。各种有机溶剂,如甲醇、乙腈、四氢呋喃,和水通常被用作流动相。因为流动相条件的变化能改变色谱柱的吸附特点,因此,流动相的优化对于获得有效的色谱分离非常重要6。绝大多数有机分子在其色谱的紫外检测区有吸收值。目前市场上有很多高效液相色谱级溶剂供应。它们是专门为使用紫外检测器的高效液相色谱准备的,它们能有效的降低背景。在波长大于240 nm的区域,溶剂的干扰没有波长在190~230 nm之间的干扰严重,在190~230 nm之间,微小的杂 前期的研究:传统的高效液相色谱 当获得的基基比较差时(尤其是在214 nm处,这个波长是绝大多数有机污染物的吸收波长),纯化水的质量通常遭到置疑。 为了验证这一点,我们先保持梯度洗脱起始条件(100%水)4分钟,在无测试样品的条件下用20分钟线性改变流动相至组成终点(100%乙腈)。另一组的过程基本相同,只是初始条件(100%水) 质也将会产生吸收。 当进行梯度洗脱时,流动相从100%水到100%有机溶剂,这时水中的杂质将会导致色谱图前段出现大量额外的吸收峰。后半段(流动相中有机溶剂的比例会逐渐提高)会出现相似的峰,这主要是由于有机溶剂的纯度受到水中杂质削弱所致。 为了获得能够在流动相中使用的低有机物污染的超纯水,我们使用复合纯化技术,以自来水为原料生产超纯水。在这个研究中,在每个水纯化步骤中都进行有机污染物的跟踪。 同时,给出确保高质量超纯水水质稳定的技术建议,包括更换耗材的注意事项。 对超纯水水质进行跟踪的参数使用最广泛的就是电阻率,但这个值无法反应有机污染物。在明显存在有机污染物时,电阻率读数依然还是18.2MQ.cm7。 图1:在214nm处获得的空白分析谱 要保持36分钟,而不是4分钟。后者杂质峰明显变大,所以可以肯定这些杂质来自水而非乙腈 (图1)。一旦待样品的峰和这些杂质峰重叠,定量分析就会产生误搓,即便不重叠,这些杂质峰也容易和未知产物峰搞混。 下面对不同类型纯化水进行了色谱分析。 Flgure 2: Poor baseline profiles af 214 and 254 nm. 图2:在214 nm 和 254 nm 处获得的很差的基线谱 首先是对50ml非超纯水的实验用水进行的梯度分析。先将水样用C18柱富集,然后后度洗脱至100%乙腈,调整检测波长,用双波长紫外检测器收集信号。如图2所示,这种水显然不能用于高效液相色谱分析,不论是等度洗脱还是梯度洗脱。图中大多数峰都是水中杂质峰只有最后两个峰是乙腈峰。 图3:三蒸水 图4:反渗透水 然后是对50ml三蒸水进行的梯度分析。先将水样用C18柱富集,然后梯度洗脱至100%乙腈,,调整检测波长,用双波长紫外检测器收集信号。这种水显然也不能用于高效液相色谱分析。如图3所示,前面的峰都是水中杂质峰,最后两个峰是乙腈峰。 图4显示的是对50 ml反渗透水进行的梯度分析。也是先用 C1柱富集,然后梯度洗脱至100%乙腈,调整检测波长,用双波长紫外检测器收集信号。这种水显然也不能用于高效液相色谱分析,不论是等度洗脱还是梯度洗脱。图中前面峰都是水中杂质峰,最后两个峰来自是乙腈。不仅如此,这种类型的纯化水残留背景非常高。 要想将自来水纯化成适合有机色谱分析的超纯水,将各种纯化技术整合链接势在必行。而为了确认这种纯化方法去除有机杂质的有效性,我们对各个主要纯化步骤输出的水都进行了有机物研究。 图5:被研究的水纯化系统 如上所述,要得到超纯水,复合纯化技术是必需的。在水纯化系统的各个位置对各种类型有机物进行跟踪的方法最早在1987年出现8。而复合技术则曾应用于去离子水生产过程中对污染情况的监控9。这里定性研究所用到的装置由两个新型水纯化系统构成。第一个是由反渗透装置和连续电流去离子 装置(EDI)组成的复合系统。它由自来水供水,产生的纯水储存在一个60升的水箱中。这种水箱是专门为优化高纯水的存储而设计的10。第二个则是活性炭吸附装置、离子交换树脂和紫外光处理装置组成的复合系统。该系统由第一个系统的产水供水。多个取样口保证水纯化过程全程都能取水(参见图5的箭头) 装置 在整个实验过程中使用以下装置: 计算机:进行数据收集和系统控制。 进样器:能够进样100u1的250u1进样阀,以及200ul注射器,适当的小瓶。 检测器:可在214nm 和 254nm工作的双波长检测器(Waters公司, Milford, Mass,. LUSA)。 色谱柱: Waters uBondapak@C-18柱,3.9×300rmm(#27324)。 色谱预柱(可选): C 18 ( Waters uBondapakC-18Guard-PakTM (#T33552)) 洗脱剂:水(Milli-Q@系统新制水 (Millipore)),乙腈(高效液相色谱级: J.T.Baker JT9017 或相当于这类的乙腈)。 所使用的瓶子以10%的硝酸进行洗涤,在取样前用Milli-Q@系统的新制水进行充分洗涤。 结果 耗材的浸洗 新反渗透柱的浸洗(第一个水纯化系统) 当在一个水纯化系统中装上一个新的反渗透柱、或在一个水精制系统中更换纯化介质时,必须将所有的防腐溶液和任何可能从材料中渗出的物质浸洗干净。这就是为 图6:反渗透装置废水和产水的污染情况 什么绝大多数现代仪器装置在每次维护操作后都有一个自动浸洗和冲刷的时间。为了研究这种反渗透膜对水质量的影响,在常规的反渗透浸洗循环过程中,分别在不 高效液相色谱梯度 在整个实验过程中使用下面的洗脱梯度。为了富集色谱柱上的杂质,每组实验都进水样50ml(自来水和反渗透水只进样1ml)。 时间(min) 流速(ml/min) 水% 乙腈% 0.0 2.0 100 0 2.0 2.0 100 0 12.0 2.0 0 100 15.0 2.0 0 100 19.0 2.0 100 0 25.0 2.0 100 0 信号记录开始时间被固定在第14分钟,每秒读取数据4个,分辨率大于20比特。在不同工作条件下和不同的水处理步骤中的水质都进行的色谱分析,并加以比较。 同的时间点,对其产水和废水采样。这里的废水是指未透过反渗透膜从而被系统自动排放的高杂质浓度的水,它不会进入下一步的纯化。在系统使用2天和13天后再次进行相同的采样,水样的色谱图如图6所示。在评价一个新反渗透柱自动浸洗功能时,前30分钟的释放的有机物是最为关键的。在这段时间里,反渗透装置废水的色谱图非常能说明问题。而浸洗2小时后从膜上脱落的有机防腐溶液的量则无法代表妨碍下一步纯化过程的有机物的量。 新纯化介质的浸洗(终端水精制系统) 在新纯化柱的安装过程中监控超纯水中的有机物。在安装新的纯化柱时,需要把前5分钟生成的水排掉。然后,建议将系统放置在待用的状态6小时。在这个过程中,每个小时会自动进行5分钟的循环,这一过程能够让新的纯化介质充分的水和,并进行最后的浸洗。6个小时后,再进行5分钟的排水。这样能使任何残存的痕量污染物及纯化柱中的空气得以有效的清除,并且确保在254nm和214nm都能可重复性的获得出色的基线。图7的色谱显示的就是这种高质量的水,这种水适用于高度灵敏的高效液相色谱有机物分析。其中前4张色谱图显示的是更换新纯化柱过程中产水中有机污染物的情况。最后一张是使用中超纯水的情况。我们可以很明显地看到无论是254nm还是214nm的基线均适用于高效液相色谱的有机物痕量分析。 16.C0 图7: 254nm和214nm的超纯水基线 结论 对于在流动相中出现的杂质,尤其是在用于HPLC分析的纯净水中的杂质,提出了以下几个问题: 这些污染物会在梯度洗脱中产生峰。这会带来定性和定量的问题。 这些杂质的污染甚至会损坏色谱柱。 当标准溶液用含杂质的超纯水制备时,在样品定性和定量过程中将会获得不正确的结果。 而且,当进行制备色谱时,在流动相中的杂质和制备的样品中的杂质,都会产生污染碎片。 如前所述,通过在复合水纯化系统的不同取样点取样,我们对各个水纯化过程的有机物降低进行了有效的跟踪。由于水处理过程中有机物污染物会因处理技术而发生变性,因此无法对其直接鉴定。但通过对不同的水进行色谱基线分析,尤其是在 214nm处的分析(该波长更为灵敏),则可以明显的表明不同纯化过程对清除有机污染物的贡献(参见图8),从而证明了从自来水中生产超纯水时使用复合纯化技术非常 重要。 图8:从自来水到超纯水,在254nm(上图)和214 nm(下图)的色谱基线(其中自来水和反渗透水进样量为1 ml,而EDI,水箱和Milli-Q水则进样50ml,并在C18柱上进行了富集) 目前已经有大量的研究显示:在高效液相色谱分析过程中,水的质量非常重要。无法恰当的贮存高纯水,就无法获得高质量基线11。为了提高检出限,已经有越来越多灵敏的检测方法可以和高效液相色谱联用12,13,14。在反相高效液相色谱的流动相中通常由缓冲溶液和改性有机溶剂构成,通常加入离子对是为了改变分析方法的灵敏度。所有用于制备流动相的溶剂、缓冲溶液、离子对试剂,以及水,都必须具有很高的化学纯度。将连续电流去离子预处理技术(EDI)、 紫外光氧化技术 (UV)和高质量的纯化介质等水纯化技术结合起来,同时保证易于维护的自动清洗和冲刷的能力,这样的超纯水生产系统输出的超纯水能适用于高灵敏的有机物分析 。另外,给超纯水系统配备在线 TOC(总的有机炭)检测器,将是在使用超纯水时对水中有机污染物进行监控的最好方法。 ( 参考文献 ) ( 1. Verity, I. ; “Solvent Pur i ty and th e Individual Re q uirements of Di f ferent HP L C Detectors”LC-GC I NT., Volume 8, Number 11, 652- 6 55, 1995 ) ( 2. Miyabe, K. ; Takeushi , S. ; “ Effect of fAcetonitrile / Water Mobile Phase Composition on Adsorption Characteristics o f R eversed P hase Liquid Chromatography” An a lytical Chemistry, Vol u me 69, 2567-2574, 1997 ) ( 3. Tanaka, M.; Yamazaki, H . ;“ Direct DDetermination of Pantoprazole E nantiomers in Human Serum byReversed-Phase High-Performance Liquid C hromatography U s ing a Cellulose-Based Chiral Stationary Phase and Column Switching System as a Sample Cleanup Procedure” A nalytical Chemistry, Volume 6 9 , N u mber 9 , l513-1516,1996 ) ( 4. Kuangjing Shao, L.; Locke, D. C . ;“Determinati o n of Paclitaxel a nd R elated T axanes in Bulk Drug and In jectable Dosage Forms by Reversed Phase Liquid Chromatography”A n alytical C h emistry, V o lume 6 9 , N u mber11, 2 008-2016 , 1997 ) ( 5. Corran , P .H.; “ Re v ersed ph a se chromatography of protei n s ”i n H P LC of Macromolecules. A p ractical approach. ( ed. Oliver, R .W.A.) I RL Press, O xford, 1 2 0-1 5 6, 1989 ) ( 6. McCown, S .M.; Southern, D .; Morrison, B.E. ; “ Solvent pr o perties and the i r eff e cts on gradient elut i onhighper f ormance l iquid c h romatography. I IIExpe r imental findings for w ater a nd a cetonitrile”Journalof Chromatography , 352 , 49 3 -509 , 1986 ) 7. Darbouret, D.; Ishii, N.; Kanazawa, M.; Kano, I. ;“Impact of feed water quality on the production ofultrapure water “ The R&D Notebook, Millipore RD004 (2000) 8. Denoncourt, J.P.; Egozy, Y. ; “Trace-level Analysis of High Purity Water Part III: High1PerformanceLiquid Chromatography” Ultrapure Water January/February 1987 9. Anantharaman, V.; Parekh, B. ; Hegde, R.; “Detection and Characterization of Organics in SemiconductorDI Water Processes” Ultrapure Water 11(3), 30-36, 1994 10.Darbouret, D. ;Kano, I.; Youf, E. ; Stewart, B. ;“Optimizing Storage of purified water for LaboratoryApplications” The R&D Notebook, Millipore RD001, 1998 11. GGabler, R. ; Hegde, R.; Hughes, D. ;“LDegradation of High Purity Water on Storage”Journal of liquidChromatography, 6 (13),2565-2570 12. Achilli , G.; Cellerino, G.P.; Melzi d’Eril, G.;“ Simultaneous d etermination of27 phenolsand herbicides in water by high-performance liquid chromatography with multielectrode electrochemicaldetection” Journal of Chromatography A, 697, 357-362,1995 13. Coquart, V.; Hennion, M.C.;“Determination of Chlorotriazines in Aqueous Environmental Samples at theng/1 Level Using Preconcentration with a Cation Exchanger andOn-Line High-Performance LiquidChromatography”Journal of Chromatography, 585, 67-73, 1991 14. Somsen, G.W. ; Hooyschuur, E.W.J.; Gooije r, C. ; Brinkman, U.A. Th.; Velthorst, N. H.; Visser, T.;“Coupling of Reversed Phase Liquid Column Chromatography and Fourrier Transform Infrared SpectrometryUsing Postcolumn On-Line Extraction and Solvent Elimination ”Analytical Chemistry, 68 (5),746-752,1996 15. Clark, K. ; Retzik, M.; Darbouret, D..““ Measuring TOC to maintain high-purity water”Ultrapure Water14(2), pp 21-24, (1997) ( 地址:北京建国门北大街8号密理博中国有限公司北京代表处 姜勇 邮编:100005 电话:010-65181058-634 传真:010-85191255 )
确定



还剩3页未读,是否继续阅读?
彤迪科学仪器(上海)有限公司为您提供《自来水中有机污染物检测方案 》,该方案主要用于环境水(除海水)中有机污染物检测,参考标准--,《自来水中有机污染物检测方案 》用到的仪器有
相关方案
更多








