蜂蜜柚子茶是从韩国传入的养生饮品,是以新鲜的柚子为原料,加入蜂蜜,经过恒温窖藏发酵工艺精
制而成.这种独特的发酵工艺,保留了新鲜柚子原有的营养,同时去除了柚子的苦涩味.蜂蜜的加入,进一步改善了柚子茶的风味,并增加了人体所需的微量元素.柚子中含有蛋白质、糖类、挥发油、类胰岛素、柚皮甙、橙皮甙、Vc、黄酮类物质、多种微量元素等活性成分.
目前,关于蜂蜜中糖类的研究比较多,而对柚子中糖类的研究较少,用离子色谱法测定蜂蜜柚子茶中糖类的研究更是未见报道.蜂蜜柚子茶中的可溶性糖是评价其质量优劣的一个标准,故分析蜂蜜柚子茶中的可溶性糖具有实际意义.糖类的分析方法有高效液相色谱法、分光光度法、气相色谱法、高效毛细管电泳法、离子色谱法等.高效阴离子交换色谱-脉冲安培检测(HPAEC-PAD)法分析糖类,不需要对样品进行衍生处理,操作简单,且所用流动相一般为稀的NaOH 或NaAc溶液,对环境污染小.本文采用超声波辅助提取蜂蜜柚子茶中的可溶性糖,以NaOH 溶液为淋洗液,研究了HPAEC-PAD检测蜂蜜柚子茶中的可溶性糖的方法.该方法具有前处理简单、分离效果好、操作简便等优点,结果令人满意.
方案详情

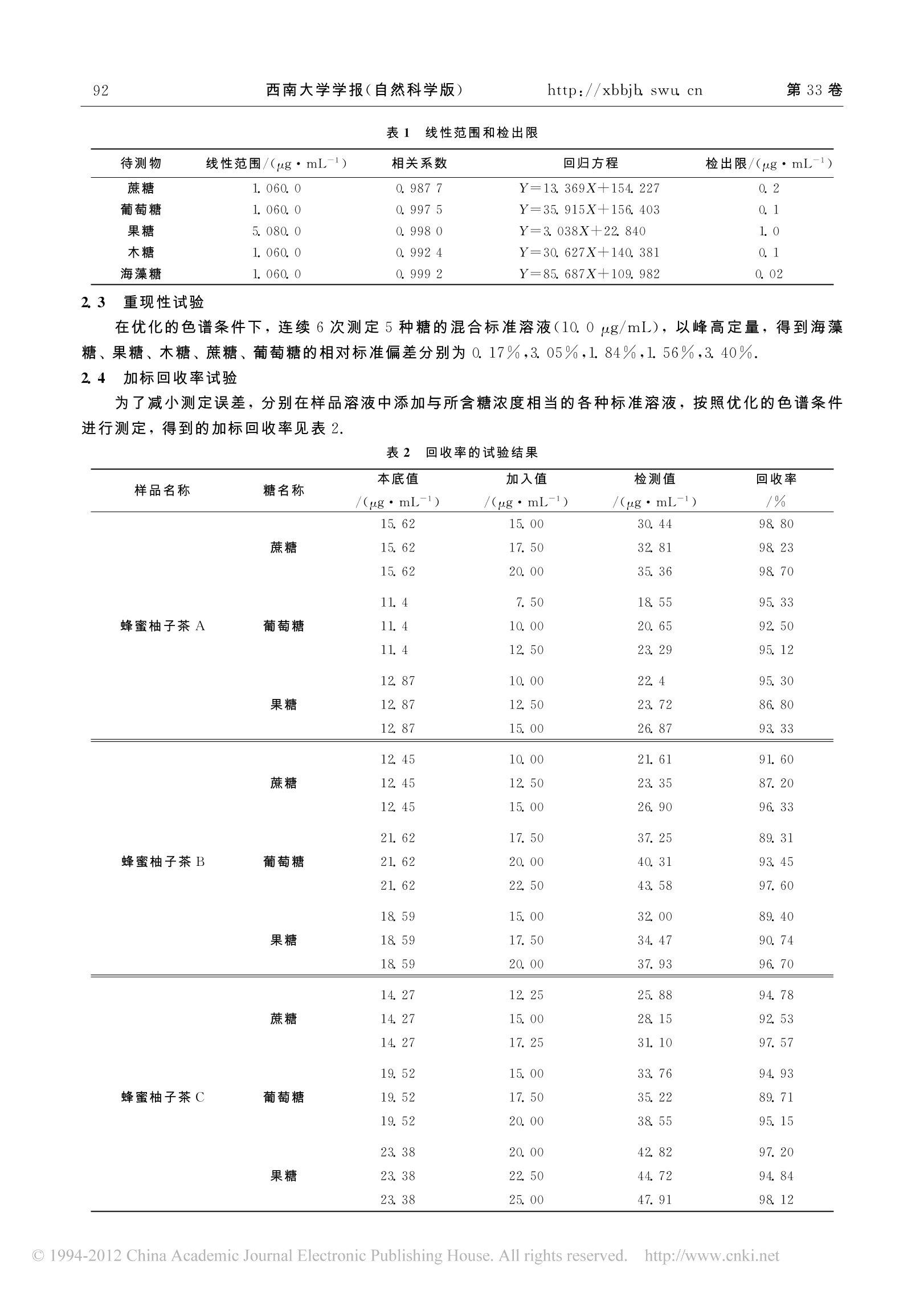
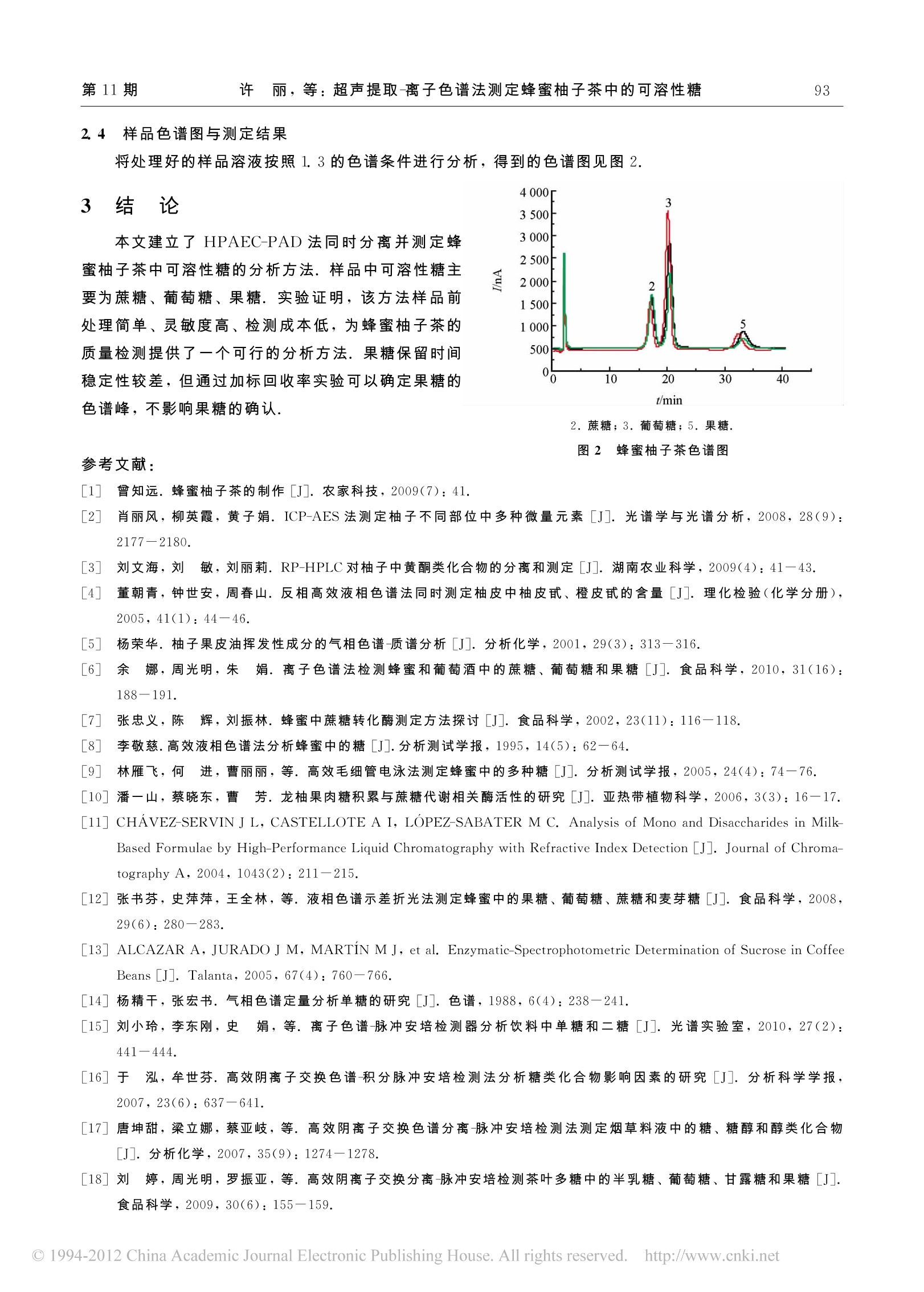
2011年11月Nov. 2011西南大学学报(自然科学版)Journal of Southwest University (Natural Science Edition)第33卷第11期Vol 33 No. 11 第11期许 丽,等:超声提取-离子色谱法测定蜂蜜柚子茶中的可溶性糖91 文章编号:1673-9868(2011)011-0090-05 超声提取一离子色谱法测定蜂蜜柚子茶中的可溶性糖唐 许 丽, 周光明, 余 娜, 张丽贤 发光与实时分析教育部重点实验室,重庆400715;西南大学化学化工学院,重庆400715 摘要:建立超声提取-高效阴离子交换-脉冲安培检测(HPAE-PAD)同时分离并测定蜂蜜柚子茶中可溶性糖的分析方法.采用METROSEP CARB 1(150 mm×4.0mm)分离柱,对分离条件进行了优化,确定淋洗液为5.0 mmol/L的 NaOH溶液,流速为1.0 mL/min.蔗糖、葡萄糖、果糖的检出限分别为0.2,0.1,1. 0 pg/mL.混合标准溶液连续6次进样,峰高相对标准偏差为1.56%3.40%,回收率为86.80%98.80%.该方法样品前处理简单,灵敏度高,为蜂蜜柚子茶的质量检测提供了一个简单有效的方法. 关 键 词:蜂蜜柚子茶;可溶性糖;离子色谱;脉冲安培检测 中图分类号:0657.7+5 文献标志码:A 蜂蜜柚子茶是从韩国传入的养生饮品,是以新鲜的柚子为原料,加入蜂蜜,经过恒温窖藏发酵工艺精制而成1.这种独特的发酵工艺,保留了新鲜柚子原有的营养,同时去除了柚子的苦涩味.蜂蜜的加入,进一步改善了柚子茶的风味,并增加了人体所需的微量元素.柚子中含有蛋白质、糖类、挥发油、类胰岛素、柚皮甙、橙皮甙、Vc、黄酮类物质、多种微量元素等活性成分2-5J. 目前,关于蜂蜜中糖类的研究L6-9]比较多,而对柚子中糖类的研究较少[10],用离子色谱法测定蜂蜜柚子茶中糖类的研究更是未见报道.蜂蜜柚子茶中的可溶性糖是评价其质量优劣的一个标准,故分析蜂蜜柚子茶中的可溶性糖具有实际意义.糖类的分析方法有高效液相色谱法11-12]、、分光光度法13]、气相色谱法14、高效毛细管电泳法[9、离子色谱法[15-19]等.高效阴离子交换色谱-脉冲安培检测(HPAEC-PAD)法分析糖类16J,不需要对样品进行衍生处理,操作简单,且所用流动相一般为稀的 NaOH 或 NaAc 溶液,对环境污染小.本文采用超声波辅助提取蜂蜜柚子茶中的可溶性糖,以NaOH 溶液为淋洗液,研究了HPAEC-PAD检测蜂蜜柚子茶中的可溶性糖的方法.该方法具有前处理简单、分离效果好、操作简便等优点,结果令人满意. 实验部分 1.1 仪器和试剂 仪器:861 Advanced Compact IC(瑞士万通公司), 817 Bioscan 脉冲安培检测器, METROSEP CARB1(150 mm×4.0 mm)分离柱,Metrohm IC-Net 2.3色谱工作站,隔膜真空泵(天津市腾达过滤器件厂), ( ① 收稿日期:2011-01-12 ) ( 基金项目:发 光 与实时分析重庆市重点实验室(西南大学)资助项目(CSTC2006CA8006);重庆市自然科学基金资助项目(CSTC2007BB5370);科技部重大专项资助项目(2008ZX07315). ) ( 作者简介:许 丽(1985-),女,四川资阳人,硕士研究生,主要从事离子色谱的研究. ) ( 通信作者:周光明,教授. ) 0.45 pm微孔滤膜,超声波清洗器(上海必能信超声波有限公司),电子分析天平(梅特勒 -托利多仪器上海有限公司). 试剂:D-果糖、D-木糖、D-海藻糖(生化试剂)(成都市科龙化工试剂厂),蔗糖、葡萄糖(分析纯)(成都市科龙化工试剂厂), NaOH(分析纯)(重庆川东化工集团有限公司),3种蜂蜜柚子茶(购于超市),超纯水(电阻率为18.2M2). 1.2 标准溶液和样品溶液的配制 1.2.1 标准溶液的配制 精密称取海藻糖、蔗糖、果糖、葡萄糖、木糖各0.100 0g, 分别用超纯水溶解并定容至100 mL,配成质量浓度为1000 ug/mL 的标准储备液. 1.2.2 样品溶液的配制 分别称取几种品牌的蜂蜜柚子茶各2.0g,加入30 mL超纯水,超声提取40 min, 不时搅拌,使可溶性糖充分浸出,离心、过滤,定容至50mL.精确移取1.0mL样品溶液于100 mL容量瓶中,用超纯水定容、摇匀,分别用0.45 um 微孔滤膜过滤待测. 1.3 色谱条件 色谱柱: METROSEP CARB1(150 mm×40mm)分离柱;淋洗液:5 mmol/L NaOH;流速:1.0 mL/min;柱温:32℃;进样量:20pL.在优化的色谱条件下测定5种糖的混合标准溶液(10.0pg/mL),以峰高定量,测定结果见图1. 2 结果与讨论 2.1 淋洗液浓度及流速的选择 高效阴离子交换色谱-脉冲安培检测法测定糖类时,常采用NaOH 溶液作淋洗液.淋洗液浓度对各种糖的出峰时间及分离度、灵敏度有很大的影响.本实验分别采用3.0,5.0,8.0,10.0 mmol/L 的 NaOH 溶液为淋洗液,当浓度大于5.0 mmol/L时,葡萄糖与蔗糖的峰部分重叠;当NaOH浓度为5.0 mmol/L时,5种单糖的分离效果很好,且保留时间适中;当浓度小于5.0mmol/L时,保留时间过长.因此,选用5.0 mmol/L 的 NaOH 溶液为淋洗液. 调节流速分别为0.5,0.7,0.9,1. 0,1.2 mL/min, 当流速降低时,保留时间明显延长,但对糖的分离程度影响很小.因此,为了提高实验效率,选用1.0mL/min 的流速. 2.2 方法的线性范围与检出限 用移液管分别移取蔗糖、葡萄糖、海藻糖、木海标准储备液0.1,0.5,1.0,2.0,4.0,6.0 mL 于不同的100mL容量瓶中,移取果糖标准储备液0.5,1. 0,2 0,4. 0,6.0,80 mL于不同的100 mL容量瓶中,分别用超纯水定容至刻度.得到蔗糖、葡萄糖、海藻糖、木糖的质量浓度为1.0,5.0,10.0,20.0,40.0,60.0 pg/mL 和果糖的质量浓度为5.0,10.0,20.0,40.0,60.0,80.0 ug/mL的标准溶液.分别移取10mL海藻糖、果糖、木糖、蔗糖、葡萄糖标准储备液于 100 mL容量瓶中,用超纯水定容至刻度,得到质量浓度为 10.0 ug/mL的5种糖的混合标准溶液. 在确定的色谱条件下,对不同质量浓度梯度的糖进行线性关系和检出限的测定.以糖的色谱峰高(Y)对其质量浓度(X, ug/mL)进行线性回归,得到线性回归方程,进一步稀释低浓度的标准溶液,确定其检出限.测定结果见表1. 表1 线性范围和检出限 待测物 线性范围/(ug·mL-) 相关系数 回归方程 检出限/(ugmL-) 蔗糖 1.060.0 0.9877 Y=13.369X+154. 227 0.2 葡萄糖 1.060.0 0.9975 Y=35.915X+156.403 0.1 果糖 5.080.0 0.9980 Y=3.038X+22.840 1.0 木糖 1.060.0 0.9924 Y=30.627X+140.381 0.1 海藻糖 1.060.0 0.9992 Y=85.687X+109.982 0.02 2.3 重现性试验 在优化的色谱条件下,连续6次测定5种糖的混合标准溶液(10.0 ug/mL),以峰高定量,得到海藻糖、果糖、木糖、蔗糖、葡萄糖的相对标准偏差分别为0.17%,3.05%,1.84%,1.56%,3.40%. 2.4 加标回收率试验 为了减小测定误差,分别在样品溶液中添加与所含糖浓度相当的各种标准溶液,按照优化的色谱条件进行测定,得到的加标回收率见表2. 表2 回收率的试验结果 样品名称 糖名称 本底值 加入值 检测值 回收率 /(ug·mL-I) /(ug·mL-) /(ug·mL-) /% 蔗糖 15.62 15.00 30.44 98.80 15.62 17.50 32.81 98.23 15.62 20.00 35.36 98.70 蜂蜜柚子茶A 葡萄糖 11.4 7.50 18.55 95.33 11.4 10.00 20.65 92.50 11.4 12.50 23.29 95.12 果糖 12.87 10.00 22.4 95.30 12.87 12.50 23.72 86.80 12.87 15.00 26.87 93.33 蔗糖 12.45 10.00 21.61 91.60 12.45 12.50 23.35 87.20 12.45 15.00 26.90 96.33 蜂蜜柚子茶B 葡萄糖 21.62 17.50 37.25 89.31 21.62 20.00 40.31 93.45 21.62 22.50 43.58 97.60 果糖 18.59 15.00 32. 00 89.40 18.59 17.50 34.47 90.74 18.59 20.00 37.93 96.70 蔗糖 14.27 12.25 25.88 94.78 14.27 15.00 28.15 92.53 蜂蜜柚子茶C 14.27 17.25 31.10 97.57 19.52 15.00 33.76 94.93 葡萄糖 19.52 17.50 35.22 89.71 19.52 20.00 38.55 95.15 果糖 23.38 20.00 42.82 97.20 23.38 22.50 44.72 94.84 23.38 25.00 47.91 98.12 2.4 样品色谱图与测定结果 将处理好的样品溶液按照1.3的色谱条件进行分析,得到的色谱图见图2. 3 结 论 本文建立了 HPAEC-PAD 法同时分离并测定蜂蜜柚子茶中可溶性糖的分析方法.样品中可溶性糖主要为蔗糖、葡萄糖、果糖.实验证明,该方法样品前处理简单、灵敏度高、检测成本低,为蜂蜜柚子茶的质量检测提供了一个可行的分析方法.果糖保留时间稳定性较差,但通过加标回收率实验可以确定果糖的色谱峰,不影响果糖的确认. 2.蔗糖;3.葡萄糖;5.果糖. 图2 蜂蜜柚子茶色谱图 ( 参考文献: ) ( 曾知远.蜂蜜柚子茶的制作 [J] . 农家科技,2009(7):41. ) ( 肖丽风,柳英霞,黄子娟. I C P-AES 法测定柚子不同部位中多种微量元素 [J].光谱学与光谱分析,2008,28(9): 2177 7一 2180. ) 阁刘文海,刘 敏,刘丽莉. RP-HPLC对柚子中黄酮类化合物的分离和测定 [J].湖南农业科学,2009(4):41-43.四 ( 董朝青,钟世安,周春山.反相高效液相色谱法同时测定柚皮中柚皮甙、橙皮甙的含量 [J] . 理化检验(化学分册), 2005,41(1):44 一4 6. ) ( 杨荣华.柚子果皮油皮发性成分的气相色谱-质谱分析[J].分析 化 学,2001,29(3):313-316. ) ( 余 娜,周光明,朱 娟.离子色谱法检测蜂蜜和葡萄酒中的蔗糖、葡萄糖和果糖 [J].食品科 学 ,2010,31(16): 188一191. ) ( 张忠义,陈 辉, 刘 振林.蜂 蜜 中蔗糖转化酶测定方法探讨 [J].食品 科 学,2002,23(11):116一11 8 . ) ( 李敬慈.高效液相色谱法分析蜂蜜中的糖[J].分析测试学报,1995,14(5):62一6 4 . ) ( 89 林雁飞,何 进,曹丽丽,等.高 效 毛细管电泳法测定蜂蜜中的多种糖 [J].分析测试学报,2005,24(4):74一76.[10] 潘 一山,蔡晓东,曹 芳.龙柚果肉糖积累与蔗糖代谢相关酶活性的研究 [J].亚热带植物科学,2006,3(3):16 17. ) ( [11] CHAVEZ-SERVIN J L , CASTELLOTE A I, LOPEZ-SABATER M C. Analy s is of Mono and Disaccharides in Milk-Based F ormulae b y H i gh-Pe r formance Liq u id Chr o matography with R efractive Index Detec t ion [J]. J o u r n a l of Ch r om a - tography A, 2004 , 1043(2):21 1-2 15. ) ( [1 2 ]张书芬,史萍萍,王全林,等.液相色谱示差折光法测定蜂蜜中的果糖、葡萄糖、蔗糖和麦芽糖 [J].食品科学,2008, 29(6):280 283. ) ( [ 1 3] A LCAZAR A, JU R ADOJM, MAR T IN MJ, et al. Enzym a ti c -Spectrophotometric Determination of Sucrose in Coffee Beans [ J] . Talanta, 200 5 ,67( 4 ):760- 7 66. ) ( [14]杨精干,张宏书.气 相 色谱定量分析单糖的研究 [J].色谱, 1 988,6(4):238一241. ) ( [15]刘小玲,李东刚,史 娟,等.离子色谱-脉冲安培检测器分析饮料中单糖和二糖唐[J ] . 光谱实验室,2010,27(2): 44111一4444. ) ( [16 ] 于 泓,牟世芬.高效阴离子交换色谱-积分脉冲安培检测法分析糖类化合物影响因素的研究[J].分析科学学报, 2007,23(6):637 -6 41. ) ( [17]唐坤甜,梁立娜,蔡亚岐,等.高效阴离子交换色谱分离-脉冲安培检测法测定烟草料液中的糖、糖醇和醇类化合物 [J].分析化学,2007,35(9):1274-1278. ) ( [18 ] 刘 婷,周光明,罗振亚,等.高效阴离子交换分离-脉冲安培检测茶叶多糖中的半乳糖、葡萄糖、甘露糖和果糖 [J]. 食品科学,2009,30(6):1 5 5-159. ) [19] TOMMASO RI, ANGELOTTI C M, BIANCO G. Determination of Mono and Disaccharides in Milk and Milk Productsby High-Performance Anion-Exchange Chromatography with Pulsed Amperometric Detection [J]. Analytica ChimicaActa, 2003,485(1):43-49. Determination of Soluble Sugars in Honey Pomelo Teaby Anion Chromatography with Ultrasonic Extraction XU Li, ZHOU Guang-ming, YU Na, ZHANG Li-xian Key Laboratory on Luminescence and Real-Time Analysis (Southwest University), Ministry of Education;School of Chemistry and Chemical Engineering, Southwest University, Chongqing 400715, China Abstract: A method for the determination of soluble sugars in honey pomelo tea by high performance anionexchange chromatography with ultrasonic extraction and pulsed amperometric detection (HPAE-PAD) isdescribed in this paper. The separation conditions were investigated on METROSEP CARB1 (150 mmX4. 0 mm) column. The optimal separations were achieved with 5. 0 mmol/L NaOH as the eluent at a rateof 1.0 mL/min. The detection limits of sucrose, glucose and fructose were 0. 2 pg/mL, 0.1 ug/mL and1. 0 ug/mL, respectively. The RSDs (relative standard deviation) of peak height for six consecutive deter-minations varied from 1. 56% to 3. 40%, with a recovery of 86. 80%-98.80%. The above method provedto be simple and highly sensitive for sample pretreatment and is, therefore, recommended for quality in-spection of honey pomelo tea. Key words: honey pomelo tea; soluble sugar; anion exchange chromatography; pulsed amperometric de-tection ( 责任编辑 潘春燕 ) ◎China Academic Journal Electronic Publishing House. All rights reserved. http://www.cnki.net
确定



还剩3页未读,是否继续阅读?
瑞士万通中国有限公司为您提供《蜂蜜柚子茶中可溶性糖检测方案 》,该方案主要用于茶饮料中营养成分检测,参考标准--,《蜂蜜柚子茶中可溶性糖检测方案 》用到的仪器有瑞士万通Metrohm 燃烧炉-离子色谱联用系统、瑞士万通930系列智能集成型离子色谱系统、瑞士万通940 系列谱峰思维TM离子色谱系统
推荐专场
相关方案
更多
该厂商其他方案
更多