“ 河北农业大学食品科技学院”选取四川、 陕西、 山东、 山西、 河北和云南六个产地的香椿为原料, 测定主要活性成分黄酮、 多酚和皂苷的含量, 并对香椿的气味进行感官评价分析。
方案详情

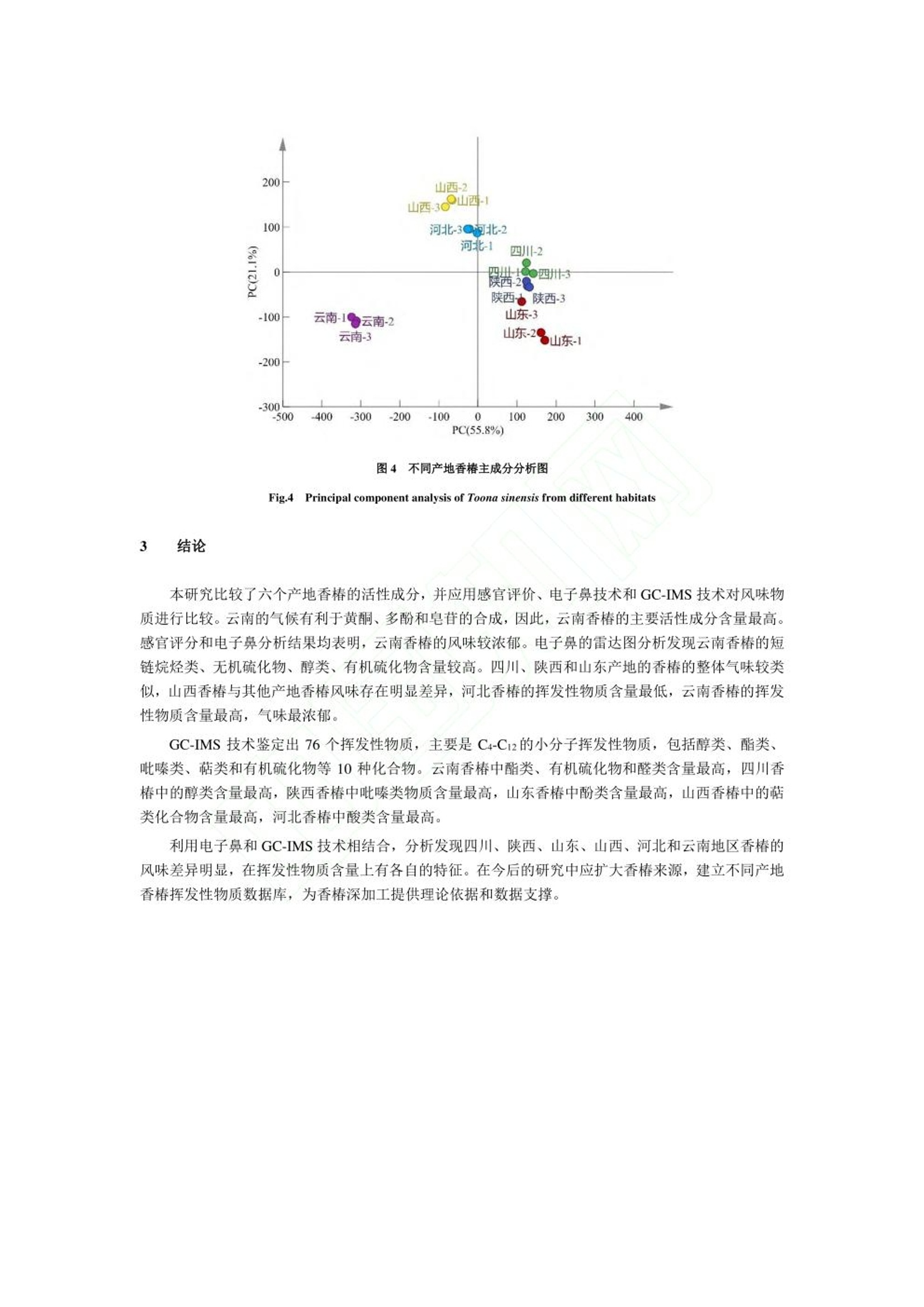
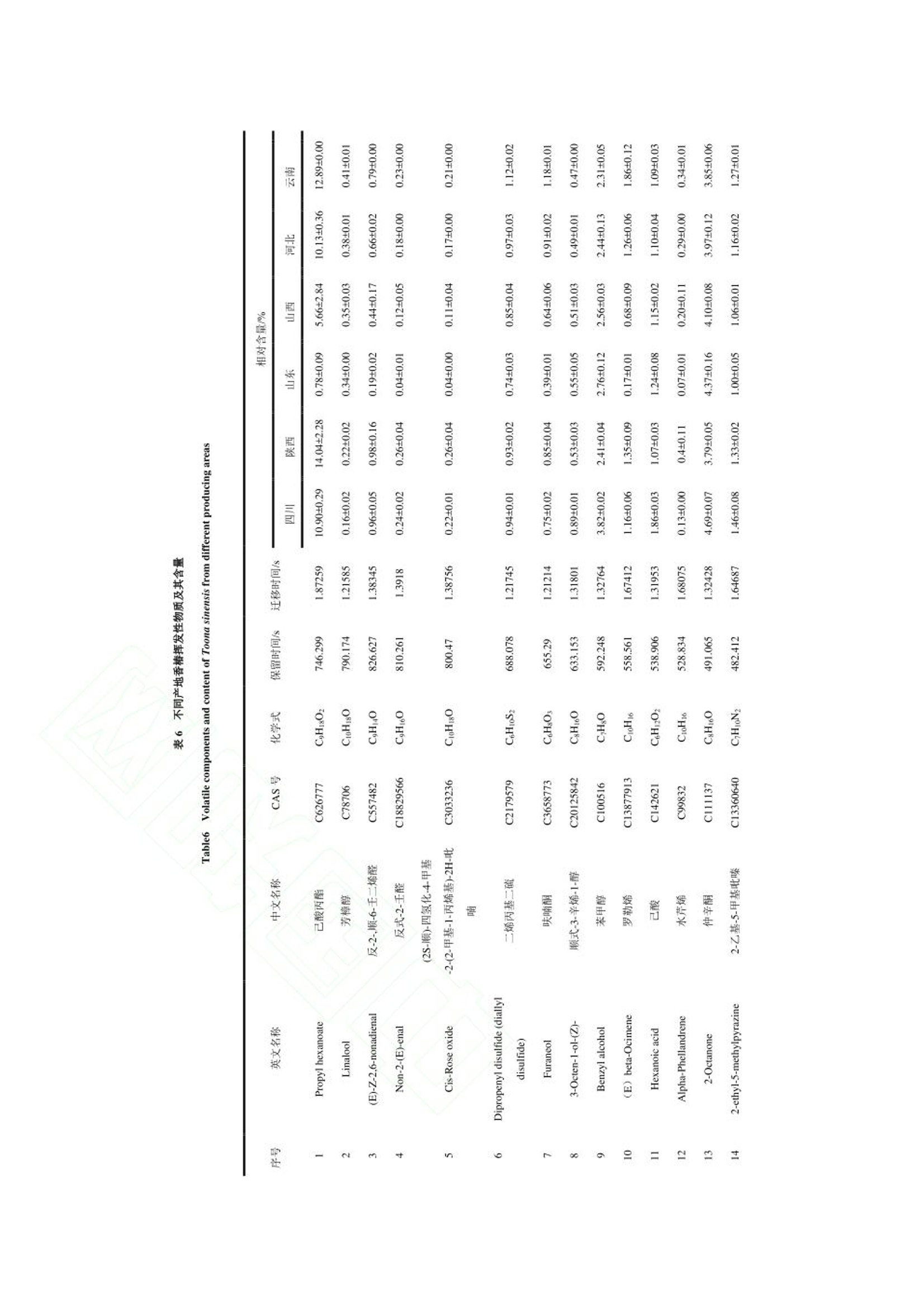
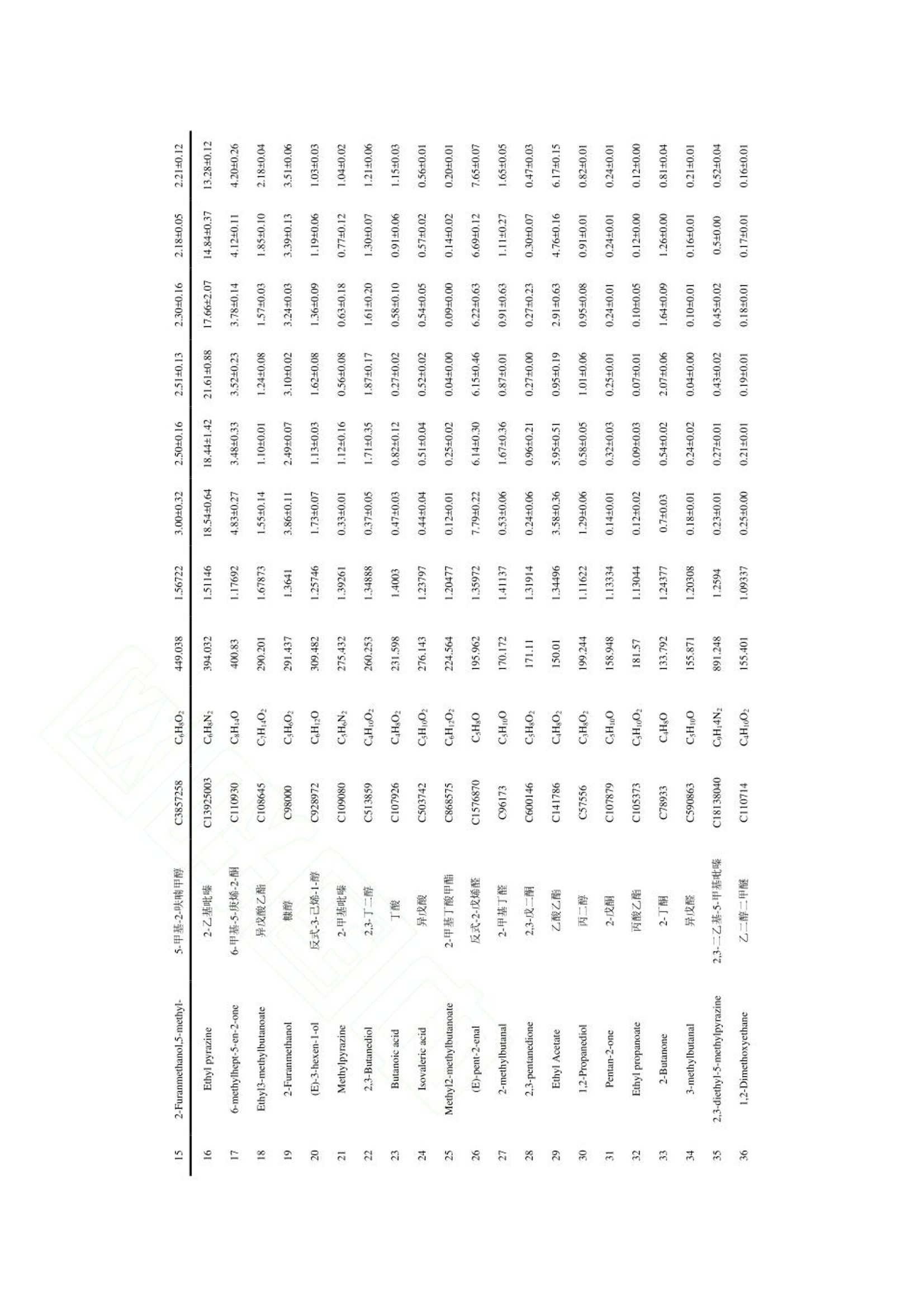
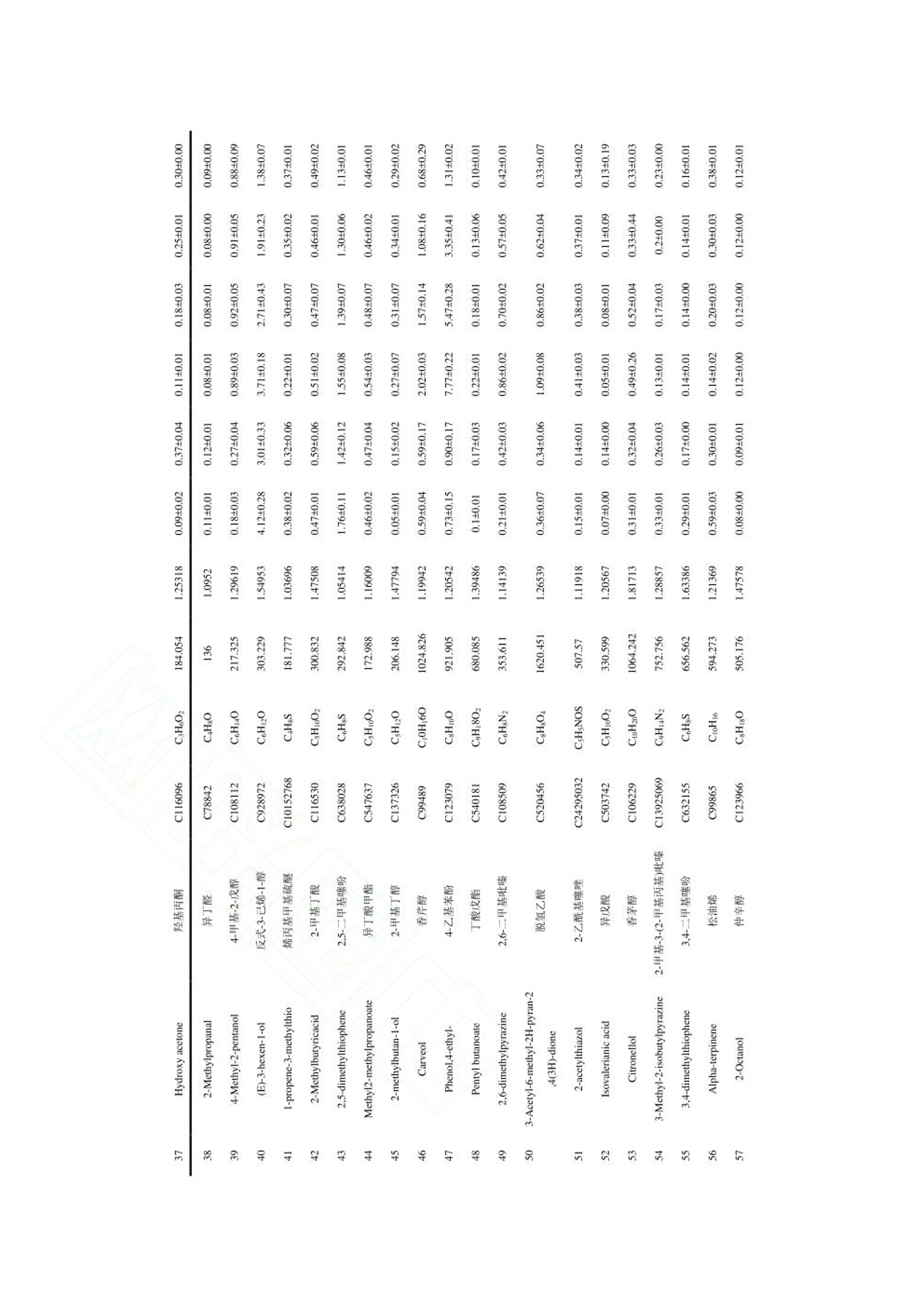
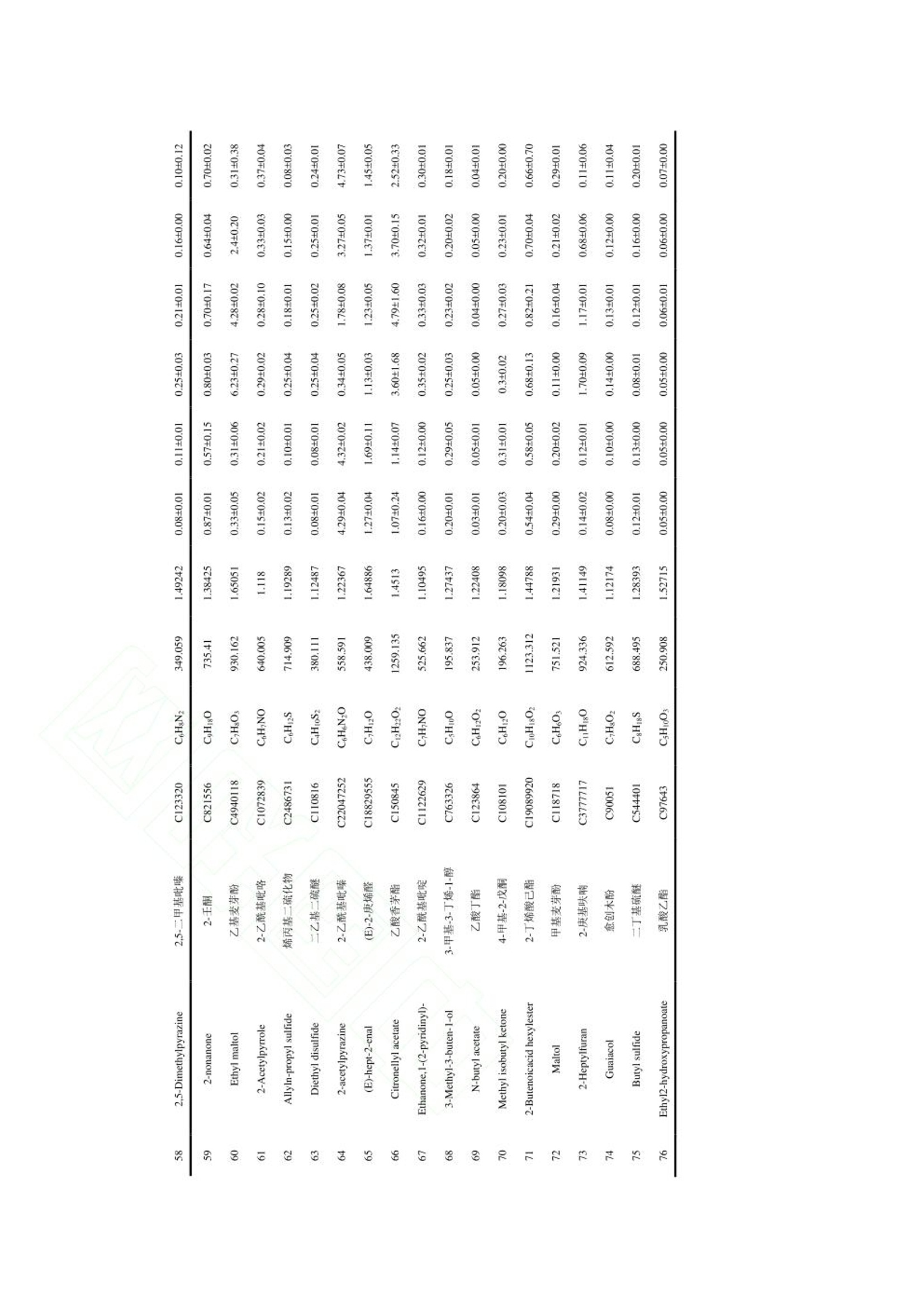
“ 河北农业大学食品科技学院”选取四川、 陕西、 山东、 山西、 河北和云南六个产地的香椿为原料, 测定主要活性成分黄酮、 多酚和皂苷的含量, 并对香椿的气味进行感官评价分析。 采用电子鼻和 GC-IMS 技术对不同产地香椿的挥发性物质进行检测, 同时结合主成分分析(principal component analysis, PCA) 和指纹图谱技术进行统计分析, 比较不同产地香椿的风味差异, 构建不同产地香椿特征风味物质 GC-IMS 数据库,以鉴别不同产地香椿的特征风味物质, 为香椿品质评价体系建立提供理论依据, 为深加工选种提供参考。德国AIRSENSE电子鼻PEN3结果分析1.电子鼻传感器响应值分析利用电子鼻对香椿的挥发性物质进行分析,结果如图 1 所示。 W1W 代表的无机硫化物响应值最大,表明香椿中无机硫化物的含量较高 六个产地香椿的 W1C、 W3C、 W6S、 W5C 和 W3S 传感器响应值几乎重叠, 表明芳香类、 长链烷烃类含量相近,W5S、 W1W、 W2W 传感器的响应值差异明显,表明各产地香椿的氮氧化合物和硫化物含量存在较大差异。对于云南昆明香椿, 除 W5S 传感器响应值以外, 其他响应值均大于其他五个产地的香椿,表明云南产地香椿的气味最浓郁。其中, W1S、W1W、 W2W 传感器的响应值显著高于其他产地香椿,表明云南昆明产地香椿的短链烷烃类、无机硫化物、 有机硫化物含量较高。 河北保定香椿的响应值均偏低,表明河北保定产地香椿的风味物质含量最低。可能是由于,4 月份河北的温度较低,不利于风味物质的合成,挥发性风味物质含量较少。2.不同产地香椿挥发性物质的 PCAPCA 能够更加直观地反映香椿挥发性风味物质和产地之间的整体关系, 选取测试稳定后第 70、71 和 72 s 的数据进行 PCA 分析。 由图 2 可知, 第一主成分的贡献率为 98.24%, 第二主成分贡献率为1.57%, 累计贡献率为 99.81%, 表明可以有效的反映原始数据的整体信息。 图中同一样品的距离较近,表明实验的重复性和稳定性较高。 利用电子鼻技术能够对不同产地香椿的风味物质进行明显区分, 四川、 陕西和山东的距离较近, 表明三个产地香椿的风味类似。 山西香椿与其他产地香椿存在明显差异,河北香椿风味物质含量最低, 云南香椿的风味较为浓郁。 上述分析表明, 产地对香椿风味的影响较大。本研究比较了六个产地香椿的活性成分,并应用感官评价、 电子鼻技术和 GC-IMS 技术对风味物质进行比较。 云南的气候有利于黄酮、 多酚和皂苷的合成, 因此, 云南香椿的主要活性成分含量最高。感官评分和电子鼻分析结果均表明, 云南香椿的风味较浓郁。 电子鼻的雷达图分析发现云南香椿的短链烷类、 无机硫化物、 醇类、 有机硫化物含量较高。 四川、 陕西和山东产地的香椿的整体气味较类似, 山西香椿与其他产地香椿风味存在明显差异, 河北香椿的挥发性物质含量最低, 云南香椿的挥发性物质含量最高, 气味最浓郁。利用电子鼻和 GC-IMS 技术相结合, 分析发现四川、 陕西、 山东、 山西、 河北和云南地区香椿的风味差异明显, 在挥发性物质含量上有各自的特征。 在今后的研究中应扩大香椿来源, 建立不同产地香椿挥发性物质数据库, 为香椿深加工提供理论依据和数据支撑。食品科学Food Science 网络首发时间:2022-09-2918:50:41网络首发地址: https://kns.cnki.net/kcms/detail/11.2206.TS.20220928.1250.006.html ISSN 1002-6630.CN 11-2206/TS 《食品科学》网络首发论文 题目 : 六 个产地香 椿 主要活 性成 分及风味特征差异分析 作 者 : 张剑辉,张梦琪,蔡世 佳 ,姜凯丽,马珞珞,马倩云 ,王颉,孙剑锋,王文 秀 网 络首发日 期: 2022-09-29 引用格式 : 张剑辉,张梦琪,蔡世 佳 ,姜凯丽,马珞珞 ,马倩云 ,王颉,孙剑锋,王文 秀.六个产 地 香椿主要活 性成 分及风 味特征 差异分 析 [J/OL].食品科学. https ://kns .cnki .net /kcms /detai l/11.2206.TS.20220928.1250.006.html 网络首发:在编辑部工作流程 中,稿 件从录用到出版要经历录用定稿、排版定稿、整期汇编定稿等阶 段。录用定稿指内容已经确定,且 通过同行评议、主编终审 同 意刊用的稿件 。排 版定稿指录用定稿 按 照期 刊特定版式(包 括 网络呈现版式)排版后的稿件,可暂不确定出版年、卷、期和页码。整期汇编定稿指出 版年、卷、期、页码均已确定的 印 刷或数字 出 版的整期 汇 编稿件 。录用定 稿 网络首发稿 件 内容必须符合《出 版管理条例》和《期刊出版管理规定》的 有 关规定;学术研究成 果 具有创新性、科学性和先进性,符合编 辑部对刊文的录用要求,不存在学术不端行为及其他侵 权 行为:稿 件内 容应基本符合国家有关书刊编辑、出版的 技 术标准,正确使用和统一规范语言文字、符号、数字、外文字母、法定计量单位及地图标注等。为确保录用定稿网络首发的严肃性,录用定稿一经发布,不得 修改论文题目、作者、机构名 称和 学术内容 只可基于编辑规范进行少量文字的修改。 出版确认:纸质期刊编辑部通过与《中 国学术期刊(光盘版)》电子杂志社有限公司签约,在《中 国 学术期刊(网络版)》出版传播平台 上 创办与纸质期刊 内 容 一 致的 网 络版,以单篇或整期出版形式,在 印 刷 出版之前 刊 发论文的录用定稿、排版定稿 、整期 汇 编定稿。因为《中国 学 术期 刊(网络版)》是国家新闻 出 版广电总局 批 准的网络连续型出版物 (ISSN 2096-4188, CN 11-6037/Z ), 所以签约 期 刊的网络版上网络首 发论文 视 为正式出版。 六个产地香椿主要活性成分及风味特征 差异分析 张剑 辉,张 梦 琪,蔡世 佳 ,姜凯丽 ,马珞珞 ,马倩云,王颉,孙剑 锋 *,王文秀*(河北 农业 大学食品科技学院,河北保定 071000) 摘 要:以 四川、陕西、山东、山西、河北和云南六 个 产地的 香 椿为研究对象,探究不同产地香椿的 主 要 活性成分和风味特征差异 。利用感官评价对香椿的整体气味进行评价,基于电子鼻 技 术和气相色谱离子迁 移谱 (gas chromatogr a phy io n mobility s pec tr ometry, GC -IMS ) 技术对六个产地的 香 椿进行挥发性成分的分 析 ,研 究不同产地香椿风味特征的差异。感官评价结 果 表明,云南香椿的气味浓郁宜 人,陕西 香椿 具有刺 激性气味。电子鼻分析结果表明,六个产地香椿的芳香类、长 链烷烃类含量相近,氮氧 化 合物和硫化物含 量存在较大差异。通过 GC -IMS 技 术共鉴定出 76种挥发性物质,主要包 括 醇类 12种,酯类 10种,吡嗪类 9种,酮类 9种 ,萜类化合物 8种,有 机 硫化物 7种,醛类7种,酸类 6种,酚类 4种以及其他类 4种。电子鼻和 GC -IMS 技术的 主成 分分 析 结 果 表明 ,云南香 椿 风味较独特,四川、陕西 和 山 东 香椿的 风 味类似 ,山西 香 椿与其他产地香椿存在差异,河北香椿的风味物质含量低。本 研 究通过电子鼻结合 GC -I MS 技术直 观地反映了产地对香椿风味的影响,为香椿深加工原料的筛选提供理论依据。 关键词:香 椿;电子鼻:挥发性物质:气 相 色谱离子迁移谱;主成分分析 Analysis of the differences in the main active components and flavor characteristics of six origins of Toona sinens i s ZHANG Ji a nhui, ZHANG Mengqi , CAI Shiji a , JIANG Ka i l i , MA Luoluo, MA Qi a nyun, WANG Ji e ,SUN Ji a nfeng , WANG Wenxiu (Co ll e g e of F o o d Science a nd T e chn o logy , Hebe i Agr i cul t ural U n ivers i ty , Baodin g , 071000, China) Abstract: The main active c omponent s and f la vor char a cter i sti c s of Toona s i nensis in different origins w e re explored by t a king Toon a si nensis from si x ori g ins of Sichuan, Sha a nxi , Sh a ndong, Shanx i, Hebei a nd Yunnan a s t h e rese a r c h o bject s . The over a l l o dor o f T o ona s inensis wa s ev a luat e d by s ens o ry ev a l ua ti o n, a nd the v olatile component s of Toona s inens i s from six orig i ns were an a lyzed based on electronic nose technology and gas chromatogr a phy ion mobil i ty s pec t r o metry (GC -IMS) technol o gy to f ind differ e nce s in f l av or profi l e. The sensory ev a lu a tio n result s showe d that the od or of Toona sinensis i n Yun n an w a s r i ch a nd pleasant , while t he odor of T oo na sinensis i n Shaanxi w a s pungent . The result s o f el e ctronic n ose analysis s how ed that the contents of aromatics and long -c hain a lkanes of Toona sinensis in the s ix ori g ins were similar , but the contents of nitrogen o xide s and s ul f ides w e r e quite different . A tota l o f 76 vo lati l e subst a nces w e re i d e n ti f ied by GC -IMS , i ncluding 12 基金项目 :河北省“三三 三 人 才工程”人才 培养资助项目(A202005002)::河北省 自 然科学基金 (C2020204166);河北省高等学校青年基金项 目 (QN2019113) 第一作者简介 :张剑辉(1996-))(ORCID:0000-0002-0183-0896), 女,硕士 研 究生,研究方向 为果蔬加 工 与 贮藏。E -mai l: zhangj i anhui1212@163.com *通信作者 简 介 :孙剑锋(1979-) (ORCID: 0000-0002-8344-4891),男,教授,研究 方 向为 食品 加 工 技术。E-mai l : ca us unjf@hebau.ed u.cn 王 文秀 (1989-)(ORCID: 0000-0002-9268-3528),女 ,副教授,研 究方向为食品快速无 损检测技 术 及装备。E -mail: godlovexiu@163.com a lcohols , 10 esters , 9 pyr a zines, 9 ketones, 8 t erpenoid s , 7 org a nic su l fi des , 7 a ldehy d e s , 6 a cid s, 4 phenol s and 4other species . The pr i n c ipal component analy s i s resul t s o f electronic nose and GC -IMS t echnol o gy showed t ha t t he flav o r of Toona sin e nsis in Yunna n w a s unique, a nd the fl a vor s o f To o na s inensis in Sich u an, Shaanxi a nd Sh a ndong were si mil a r . Toona sinens i s in Sha n xi i s different f r o m t hat i n other origins, and the c o ntent of f l a vor substances i n Toona s inensi s fr o m Hebe i i s low . With the elec t ronic nose a nd GC -IMS technolo g y, this paper intuiti v ely reflect ed t he i nfluence of the origin on the f l a vor of Toona s inensis , a nd provide d a theore t i c a l b as is for the scr e ening of deep proces si ng r a w materi a ls of Toona sinensis. Keywords: Toona s i nensi s; electronic n ose ; volatile c omponents; g a s chromatography i o n mo b i li t y spec t rometry ;pr i ncip a l component a n a ly s is 中 图分类号: TS255.1 文献标志码:A DOI: 10.7506/spkx1002-6630-20220608-082 香椿是一种常见的楝 科 植物 ,属于亚热带及温带 树 种 ,是 我 国 独 有的一种 “树生 菜”,食用和栽培 历史已达两 千 余年 凹 。在山东 、云南 、陕西等地广泛栽培,种 植过程中不需要 农 药驱虫,是 一 种 绿 色安全的蔬菜。香 椿 风 味 独特,富含黄酮 、多 酚 和 皂 苷等多种生物活 性 成分 ,具有丰富 的 营 养价值13.4和 抗 炎、抗 癌图、抗氧化等保健功效。香椿风味受品种、地域和环境等多方面因素 的 影响,直接影 响 了 香椿深加工产品的品质。因此,检测 香 椿 的 风 味 物质,辨别 不 同产地香椿的 特 征挥发性物质,对 不同产地香椿风 味 的鉴别和深加工品种 的选 择具有重要意义。 电子鼻、气相色谱嗅闻和气 相 色谱-质谱联用技 术 是目前鉴别挥发性 风味 物质最常用的技 术 18-101,在水 果 新鲜度分 析 和产地鉴别12.13]等多种领域广泛应用。气相色谱离子迁移谱(g a s chr o matogr a phy ion mobi li ty s pec t rometry, GC -IMS )是一种新型 的 风 味检 测技术 ,具有高选择性、高灵敏度和高分辨 率等优点,目前已在茶 叶 4、果蔬S 、生姜I1、酒类II7和肉类深加工181等风 味 物质检测上有所应 用,此 外在食用油掺假[19)、蜂蜜掺 假 1201、水产品鉴定 1211、咖啡豆分级22等方 面 也取得了一定的研究进展。然而, 将 GC -IMS 技术用于不 同 产地香椿风 味 差异和特 征 分析的分析较少。 本研究选取四川、陕西、山东、山西 、河北 和 云南六个产地的香 椿 为原料,测定主 要 活性 成 分黄 酮、多酚和 皂 苷的含量,并对香椿的气 味 进行感官评价分 析 。采用电 子 鼻 和 GC -IMS 技术对不 同 产地 香 椿 的挥发 性 物质进行检测,同时结合主成分分析 (prin ci pal component a naly s is, PCA ) 和 指 纹图谱 技术进行统计分 析,比较不 同 产地香 椿 的风味差异,构 建不同产地香椿特征风 味 物质 GC -IMS 数据库,以鉴别 不 同产地香 椿 的特征风 味 物质 ,为香椿 品 质评 价 体系建立提供理论 依 据,为深加工选种提供参 考。 材料与方法 1.1 材料与试剂 香椿均为红 油 香椿,树龄为 3年,种植地光照充足,土壤肥沃,大面积种 植 ,选自四川眉山、陕 西渭 南 、山 东 烟台、山 西运 城 、河北保定、云 南昆明六个产地 的头 茬香椿,取 6-9 cm 的嫩芽 ,依次 编号为 1、2、3、4、5、6,真空包装后置于 4℃冰箱中 储 存。于2022年 4月1日 取样,剪 成小且 均 匀的叶片 ,加液氮后 用组 织研磨仪研磨 得 到待测定 的 香 椿 原料 ,置于-80℃冰箱 中 随用随取 。 芦丁标准品(纯度为 99.9%) 北京索莱宝生物科技有限公司;人 参皂苷 标准 品 上 海源叶生物 科技有限公司:植物总 酚 含量试剂盒 南京碧波生物科技有 限 公司 ;高纯氮气(纯度≥99.999%)Chemtr o n 制氮机制备 :20mL 顶空进样瓶浙江欧尔赛斯 科 技有限公司 ;其他 试 剂均为分 析 纯。 1.2 仪 器与设备 SB-5200DTD 超声波清洗机 宁波新芝 生 物科技股份有限公司 :酶标仪 赛默飞世尔 科 技(中 国 )有限公司 ;研磨仪 IKA @A11 basic; 电 子 鼻 德国 AIRSENSE 公司 PEN 3 型: FlavourSpec @气相离 子迁移谱联用仪 德国 G.A .S 公司 ; MXT -5色谱柱(15mx0.53 mm, 0.53 um ) 美国 Restek 公司。 1.3 试验方法 1.3.1 主要活 性 成分测定 1.3.1.1 总黄酮含量测定 参照文献沿的方法从香椿中提取黄酮,参照文献124的方法绘制黄酮 标 准曲线 ,横坐 标 x为芦 丁 溶 液 浓 度 ,纵坐 标 y为 吸 光度。按照以下公式计算香椿中黄酮类 化 合物的含量(mg/g ): 式中 x 为根据 标 准曲 线 计算的 稀 释液中总黄酮 的浓 度 , mg /mL: v为提取液 体 积, mL; v z为选取 的待 测液 的 体积, mL; w为新鲜香 椿 质量, (5.000±0.002)g 。 1.3.1.2 植物总酚含量测定 参照植物总酚含量检测试剂盒测定,根据预实验结 果 稍作修改,将要 求 的吸取 待 测样品 50uL 改 为 吸 取 5uL, 总多酚含量 由以 下公式获得: 式中x为根据 标准 曲 线 计算的稀释液中总酚浓度, mg /mL; v 为提取 液 总 体 积, 2mL , 10 为 样品 稀释倍数 , w 为新鲜香 椿 质量, (0.100±0.002)g 1.3.1.3 皂苷含量测 定 采用香草醛-冰 乙酸湿色法测定1251,以 人 参皂 苷 作为 标 准品,横坐标 x 为 人 参皂苷质量浓度,纵 坐 标 y为吸光度,制定标准曲线。按照以下公式 计 算香 椿中 皂苷含量(mg /g ): 式中 m 为 根据 标 准曲 线 计算 的样 品测定液中皂 苷 的含量, mg /mL ; v 2为样 品 定容 体 积, mL; vi 为 比 色测定样品 体 积 , mL; m 2为新鲜香椿质量,(1.000±0.002)g。 以 上 指 标测定时 ,每个样品重复测定 三 次,用平均值±标准 差表示,计 算结果保留至小数点后两 位。 1.3.2 感官评价 香椿的嗅觉评审标准,如表 1所示。评审 小 组由 10位专业人士构成 ,在无异气息的感官品评室 内进行,总分为 10分 ,取平均值。 表11香椿感官评价标准 Table 1 Sensory evaluation criteria of Toona sinensis 气味评价标准 分值/(分) 香气浓郁持久 8-10 香气不高不低 6-8 香气较低,无杂异气 4-6 香气低微,无杂异气 2-4 1.3.3 电子鼻分 析 采用德 国 AIRSENSE 公司 PEN3 型电子鼻进行测定分 析,该电子鼻包括 10个 传 感器 ,具体性能 描述见表 2。将新鲜 的 香 椿 叶剪 成小 块 , 取 2g置 于 100 mL 烧 杯 中, 双层保鲜膜封口,放置30 min 后进行测定。 测定条件:采样时间为 1s/组 ,传感器自清洗时间为 80 s, 归零时间 为5s;样品 准备 时间为 5s ;进样流量为400 mL /min;分 析 采样时间为 80s, 每个样品做 3个 平行实验。 表2 电子鼻传感器性能 Table2Electronic nose sensor performance 阵列序号 传感器名称 传感器敏感性能描述 WIC 芳香成分,苯类 2 W5S 灵敏度大,对氮氧化合物很灵敏 3 W3C 氨水,对芳香成分灵敏 4 W6S 主要对氢气有选择性 5 W5C 烷烃类芳香成分敏感 6 WIS 对甲烷等短链烷烃灵敏 7 WIW 对无机硫化物灵敏 8 W2S 对醇醚醛酮类灵敏 Q W2W 芳香成分,对有机硫化物灵敏 10 W3S 对长链烷烃类成分灵敏 1.3.4 GC -IMS 分析 准 确称取1.1中 六个产地的香椿(2.000±0.005)g,置于 20 mL 顶空进样瓶中,封口,利 用 GC -IMS 进行测定,每组 重 复 三 次。 顶空进样条 件:孵育温度 :40℃, 孵育时间 :10min, 孵 化 转速:500 r /min ,进样 针 温度 85℃,进样量 300uL 。 GC条 件:色谱 桂FS -SE -54-CB-1柱,柱温60℃,分 析 时间 30 min ,载气 :高纯氮气(纯度≥99.999%),流速:初始为 2mL /min, 保 持 2 min, 2~20 m i n 线 性增至 100 mL /min, 保持 20 min。 IMS 条 件:漂移管温度45℃,漂移气 :高纯氮气 ,漂移流速 150 mL /mi n, IMS 检 测器温度 45℃。 1.4 数据分析 利 用 Origin2021 和 SPSS25.0对六个产地香 椿 的主要活性成分进行分 析;利用 W i nMuster1.6.2.18进行 PCA; 利 用 Flav o ur Spe c@风 味 分 析 仪内置的 NIST 数 据 库和 IMS 数据库对挥发性气 体 物质进行 定性分 析;利 用 G a llery Plot 插件进行 指 纹图谱对比 ,用于比较 不 同产地香 椿 的挥发性物质差异;利 用 SIMCA14.1进行 PCA 。 2 结果与分析 2.1 不同产地香 椿 活性 成 分分析 2.1.1 活性成分标准曲线建立 分别以芦丁、没食子酸和 人 参皂苷为 标 准品,绘制了香椿中黄酮、总酚和皂苷含量的标准曲线,线性回归方程 如 表 3所示,表 中 决定系数均大 于0.99,表明线 性 良好。 表33活性成分线性回归方程 Table3ILinear regression equation of active ingredients 活性成分 标准品 线性方程 R 线性范围/(mg/mL) 总黄酮 芦丁 y=5.6229x+0.0098 0.9963 0.0360-0.0525 总酚 没食子酸 y=2.796x-0.0049 0.9968 0.0387-0.0608 皂苷 人参皂苷 y=2.0896x+0.0891 0.9919 0.0090-0.6092 2.1.2 活 性 成分含量分析 根据1.3.1中 活 性 成分的测定方法,分 析 六个产地香椿的主要活性 成 分含量,如表 4所示。可以 发现 ,云南昆明产区香 椿 的总黄酮 、总酚 和 皂苷含量最高。这可能是由于,植 物活性成分的合 成 受光 照 、温度、水分等因素影响 1261,适当 的自 然光照有 利于 黄酮类化合物的合成1271,3-4月份云南的光照 适宜,因而有利于黄酮类 化 合物 的 合 成 。酚类物质 的 合成受环境因素影响较大 ,云南昆明产区香椿的 总酚含量较高 ,不 仅受光照等影 响 ,还与云南昆明 的 环境污染较少 ,有利于酚类的合 成 有关。此 外 ,适宜光照有 利 于皂 苷 的合成 128,云南昆明的气候为有利于香椿的生长和 皂 苷的积累。香椿的 抗 氧 化 活 性 和黄酮 、多酚和皂苷呈 正 相关291, 因 此 ,在研 发 抗氧 化 产品时首 选 云南香 椿 。 表4不同产地香椿活性成分含量 Table4 Contents of active components in T o ona s inensis from different habitats 香椿产地 总黄酮/(mg/g) 总酚/ (mg/g) 皂苷/(mg/g) 四川眉山 4.71±0.44 76.70±2.43° 33.81±0.10° 陕西渭南 5.13±0.36 61.05±0.42d 46.96±0.18 山东烟台 3.62±0.03° 36.33±0.61° 32.35±0.19 山西运城 4.02±0.01° 63.15±0.734 30.80±0.25° 河北保定 4.02±0.23° 79.22±0.80° 23.57±0.24 云南昆明 5.95±0.19 101.08±0.52" 51.31±0.22 注:以上数据根据不同产地香椿的含水率 折 算成干物质后计算所得:不同字母表示差异显著(P<0.05)。 2.1.3 感官评价结果分析 香椿感官评分结 果 如表 5所示,试验结果表明 ,云南昆明产地的香椿感官评分最高,为 9.39分,具有浓 郁的 芳香和青 草 的香 味 ,陕西香椿的气味偏高,有刺鼻的 味 道 ,能够明显区分。四 川 和 山东 产 地的香椿风 味 较温和,山西香椿气味偏低,但是 有 宜 人 的香甜味,河 北 产地 的 香椿评分最低,气味不 浓有。 表5不同产地香椿感官评分结果 Table 5 Sensory evaluation results of Toona sinensi s fr o m different habitats 产地 气味描述 嗅觉评分 四川眉山 香气不高不低,有温和的果香 7.95 陕西渭南 香气不高不低,气味持久且刺鼻 8.17 山东烟台 香气不高不低,轻微的青草味 6.94 山西运城 香气较低,有宜人的香甜味 5.29 河北保定 香气低微,轻微的甜香 3.62 云南昆明 香气浓郁,有芳香味和青草味 9.39 2.2 电子鼻结 果 分析 2.2.1 电子鼻传感器响应值分 析 利 用电 子鼻对香椿的 挥 发性物质进行分 析,结果 如 图 1所示。W1W 代 表 的无机硫化物响应值最 大 ,表明香椿中无 机 硫化物的含量较高。六个产 地 香椿的 WIC、W3C 、W6S 、W5C 和 W3S 传 感器 响应值几乎重叠,表明芳香类、长 链 烷烃类含量 相近, W5S、W1W 、W 2W 传 感器的响应值差异明显,表明各产地香 椿 的氮氧化合物 和 硫化物含量存在较大差异。对于云南昆明 香 椿 , 除 W5S 传感器响应 值以外,其他响应值均大于其他五 个 产地的香 椿 ,表明云南产地香椿 的 气味最浓郁。其 中,W1S、W1W 、W2W传感 器 的响 应值显著高于其 他 产地香 椿 ,表明云南昆明产地香椿 的 短链烷烃类、无机硫 化物 、有 机 硫 化 物含量较高。河北保定香椿的响应值均偏低,表明河北保定产 地 香椿 的风 味物质含量 最低。可能是由于,4月份河 北 的温度较低 ,不利于风 味 物质 的 合成 ,挥 发性风 味 物质含量较少。 图1不同产地香椿电子鼻雷达图 Fig.11Radar chart of electronic nose data in Toona s i nensis from different producing a reas 2.2.2 不 同产地香椿挥发 性 物质的 PCA PC A 能够更加直观地反映香椿挥发 性 风 味 物质和产地之间的整体关系 ,选取测 试 稳定后第 70、71 和 72s 的数据进行 PCA 分析。由图 2可 知,第一主 成 分 的 贡献率为 98.24%,第 二 主成分贡 献 率为 1.57%,累计贡献率为 99.81%,表 明可 以 有效的 反映 原始数 据 的整体信息。图中 同一样品的距离较近,表明实验 的 重复性和稳定 性 较高。利 用电子鼻技术能够对不同产地香椿的 风味 物质进行明显 区 分 ,四 川、陕 西和山东的 距 离较近,表明三个产地香椿的风 味 类似。山西香椿与其他产地香 椿 存在明显差异 ,河北香椿风 味 物质含量最 低,云南香 椿的 风味较为浓郁。上述分 析 表明 ,产地对香椿风 味 的影响较大。 图2不同产地香椿电子鼻 PC A 图 Fig.2 Principal component analysis diagram of electronic nose data in Toona sinensis from different producing areas 2.3 基 于 GC -IMS 分 析 不同产地香椿 的挥 发性物质 2.3.1 不同产地香椿挥发 性 物质定性和定量分 析 利 用 GC -IMS 技 术 检测了 不 同产地香 椿 的挥发 性 物质,主要信息如表 6所示。分 析发 现 ,香椿中 大多数挥发性物质的迁移时间在 1.0-1.9 ms 之间,保留 时 间为 130-1700 s 之间。结合 GC -IMS 数据文 库,共鉴定出 10类 76种 挥 发性物质,主要为 C 4-C 12的 小分子挥发 性 物质,包括醇类 12种,酯类 10种,吡嗪类 9种,酮类 9种,萜类化合物 8种,有机硫 化 物7种 ,醛类7种 ,酸类 6种,酚类 4种以 及其 他 类 4种 。其中 ,吡嗪类物质和醇类物质含量较高,但有研究表明 ,噻吩是香 椿 的主要挥发性成 分I 30],与本文的结论不同 ,可 能是由于采 摘 期不同或者采摘后包装方式不同 造 成的。 醇类物质主要 由 分解代谢产生,苯 甲 醇具有芳香味,在四川香 椿中 的相对含量最高,云南香椿中 的含量最 低 。醇类在香椿挥发性物质 中 的相对含量虽然高 ,但 是由于阈值 一 般较高 ,因 此对 风味 的 贡 献较小。酯类物质通过酯 化 反应获得 ,在山东香椿 中 相对含量仅为 4.62%,而在云南香 椿 中高达 22.89%。主要是 乙 酯类 化 合物,包括异戊酸 乙 酯 、乙 酸 乙 酯、丙酸 乙 酯和乳酸 乙 酯,具有花香、果香 和 酒 香。吡 嗪类化合物是美拉德反应的专 一 性 化合物3,阈值较 低,具有 浓 郁的烘焙香(32)、坚 果 香和 咖啡香 ,对产品 的 香气起重要作用。吡嗪类物质在陕西香 椿 中占 比 最高 ,相 对含量达 26.53%, 其中 2-乙 基吡嗪和2-乙 酰基吡 嗪 具有烘烤香气 ,使香椿具有刺鼻的气味。酮类物质 一 般是由酯类分解和醇 类氧 化 获得,在各产地香 椿 中的相对含量差异较小。其 中 ,四 川 香椿的酮类挥发性物质占比最高 ,主 要是 仲 辛酮和 6-甲基-5-庚 烯 -2-酮,具有焦香和类 似 牛奶 、乳 酪 、蘑菇的香气3。萜 类化合物主要包 含罗勒烯、香茅醇和芳樟醇等,在山西香 椿 中 的 相对含量最高。其中罗勒烯具有香甜味,香茅醇具有 玫瑰花香,芳樟醇具有浓香带甜的木青气息 ,香气柔和诱人。由 此 可见,萜类 化 合物是香椿具有宜 人 香 味 的 重 要原因。有机硫 化 物 是 香椿风 味 的主要贡 献 者341,在云南香椿中的含量最高。其中 ,二丁基 硫醚具有熟肉香气I 351,二 烯丙基 二 硫醚 、烯丙基甲基硫醚、2,5-二 甲 基噻吩和3,4-二 甲基噻吩在大蒜 中也存在I 36],因此香椿 中 呈现 出 与大蒜相似的辛辣、刺激味,这与孙 晓 健I37关于有 机 硫化物对香 椿 风 味 的分 析 结果 一 致。醛类化合物一般具有青草香气I381,在云南香椿中的含量最高,其中2-甲基丁醛具 有坚 果 香,异丁醛和2-甲基 丁 醛具有麦 芽 香和黑巧克力 的 香 味 。云南香椿中的酯类、有机硫 化 物 和 醛 类含量最高 ,风 味 最浓郁,这与感官评价和电子鼻评价结 果 相吻合。酸类物质 阈值 高 ,且在香椿中的 相对 含量较低,对整体风 味 贡献较小 ,在河北香 椿 中的含量最高。酚类物质在山东香 椿 中的含量最高 ,其 中 ,愈创 木 酚是烟熏产品的特征风 味 物质 ,具有烟草香 味 。香椿中多种挥发性物质之间的重叠使其 具有独 特的风味 ,相对含量的差异是各产地香椿具有不同风味 的 原因。 2.3.2 不同产地香椿挥发 性 物质 指 纹图谱分 析 为 了 更好的观察不同产地香椿挥发 性 物质 种 类和含量的差异,利 用 L A V 软件的 Gallery Plot 插件 选取所有峰进行指纹图谱对比 ,结果如图 3所示。图 中 颜色 的 深浅直观的表示了挥发性物质的含量多 少 ,红色 代 表浓度较高 ,黄色、白色、浅蓝色依次代表浓度变 低 。右侧是样品编号,每 个 样品做 三 个 平行。 从指 纹图 谱 可以发现,不同产地香椿的挥发 性 物质含量 存 在明显差异。在图中能够快速 找 出各个 产地的 特征 挥发性物质,四 川 香椿中的特征 挥 发性物质包括顺式-3-辛烯-1-醇、苯甲醇、已 酸、5-甲 基 -2-呋喃甲醇、丙二醇、乙 二 醇二甲醚。陕西香椿中的特 征 挥发性物质包括2-甲 基丁酸 甲 酯、异戊醛、羟基丙酮 。山东香椿中的特征挥发性物质包括 2-丁酮。山西香 椿中 的特 征 挥发性物质包括芳樟醇和异 戊酸 乙 酯河北香椿中的特征挥发性物质是丁酸 戊 酯。云南香椿中的特征挥发 性 物质包括呋喃酮、罗勒 烯 、6-甲基-5-庚 烯 -2-酮、反式-3-己烯-1-醇 、2-甲基丁醛、2,3-戊 二 酮、4-甲基-2-戊醇、2,6-二 甲基吡 嗪 、2-乙酰基噻唑、香茅醇、烯 丙 基 二 硫化物、松 油烯、二 烯丙基 二 硫、二 乙 基 二 硫醚、二 丁基硫醚 、 图3六个产地香椿挥发性物质指纹图谱 F i g.3 F i ngerprint of volat i le substances in Toona sinensi s from si x producing areas 2.3.3 不同产地香椿挥发 性 风 味 物 质 PC A 分 析 PC A 是考察多 个 变量间 相 关性的一种统 计 方法,尽可能的保留原始数据,更加直观、简单的反映 数据的信息。由图 4可 以 看出, PC 1 的 贡献率为 55.8%, PC 2 的 贡献率为21.1%,累计贡献率达76.9%,能 够很好的反映整体信息。各组样品的平行之间有重叠或距离较近,说明样品检测 的重 复 性 较好 ,各 产地样品之间 存 在距离 ,说明六个产地的香 椿能 通过 GC -IMS 技 术 进行区分。四川、陕 西和 山 东的风 味 类似 ,这与电子鼻分析结 果 一致。 图47不同产地香椿主成分分析图 Fig.4 Principal component analysis of Toona sinensis from different habitats 3 结论 本研究比较了六个产地香椿的活 性 成分 ,并应用感官 评 价 、电子鼻技术和 GC -IMS 技术 对 风味物 质进行 比 较。云南的气候有 利于 黄 酮、多 酚 和皂苷的合 成,因此 ,云南香椿的 主 要活 性 成分含量最高。感官评分和电子鼻分析结果 均 表明 ,云南香 椿的 风 味 较浓郁。电子鼻的雷达图 分析 发现云南香椿 的 短 链烷烃类、无机硫 化 物 、醇类、有 机 硫化物含量较高。四 川 、陕西和山东产地的香 椿的整体 气味较类 似 ,山西香椿与 其 他产地香椿风 味 存在明 显 差异,河北香椿的挥发 性 物质含量最低,云南香椿 的 挥发 性物质含量最高,气味最 浓 郁。 GC -IMS 技 术 鉴定出76个挥发性物质 ,主要是 C 4-C i2的小分子挥发 性 物质,包括醇类、酯类、吡嗪类、萜类和有 机 硫化物等 10种化合物。云南香椿中 酯 类、有 机 硫化物和醛类含量最高,四川 香 椿中 的醇类含量最高,陕西香 椿 中吡嗪类物 质 含量最高,山 东香 椿 中酚类含量最高,山西香椿中 的 萜 类 化 合物含量最高,河北香 椿中 酸类含量最高。 利 用 电子鼻和 GC -IMS 技术 相 结合 ,分析发现四川 、陕西、山东、山西、河北和云南地区香 椿 的 风 味 差异明 显,在挥发性物质含量上有各 自 的特征。在今后的研究中应扩大香 椿 来源,建立不同产地 香 椿 挥发 性 物质数据库,为香椿深加工提供理论依据 和 数据支撑。 表6不 同 产地香椿挥发性物质及其含量 Table6Volat i le component s and content of Toona s i nensis fr o m different producing areas 序号 中文名称 保留时间/s 相对含量/% 英文名称 CAS 号 化学式 迁移时间/s 四川 陕西 山东 山西 河北 云南 Propyl hexanoate 己酸丙酯 C626777 CyH:sO: 746.299 1.87259 10.90±0.29 14.04±2.28 0.78±0.09 5.66±2.84 10.13±0.36 12.89±0.00 Linalool 芳樟醇 C78706 CioHisO 790.174 1.21585 0.16±0.02 0.22±0.02 0.34±0.00 0.35±0.03 0.38±0.01 0.41±0.01 3 (E)-Z-2.6-nonadienal 反-2-,顺-6-壬二烯醛 C557482 CgHO 826.627 1.38345 0.96±0.05 0.98±0.16 0.19±0.02 0.44±0.17 0.66±0.02 0.79±0.00 Non-2-(E)-enal 反式-2-壬醛 C18829566 CgH6O 810.261 1.3918 0.24±0.02 0.26±0.04 0.04±0.01 0.12±0.05 0.18±0.00 0.23±0.00 5 Cis-Rose oxide (2S-顺)-四氢化-4-甲基 C3033236 CiHisO 800.47 L.38756 0.22±0.01 0.26±0.04 0.04±0.00 0.11±0.04 0.17±0.00 0.21±0.00 6 Dipropenyl disulfide (diallyl -2-(2-甲基-1-丙烯基)-2H-吡 喃 0.94±0.01 disulfide) 二烯丙基二硫 C2179579 CHioS2 688.078 1.21745 0.93±0.02 0.74±0.03 0.85±0.04 0.97±0.03 1.12±0.02 7 Furaneol 呋喃酮 C3658773 CHOs 655.29 L.21214 0.75±0.02 0.85±0.04 0.39±0.01 0.64±0.06 0.91±0.02 1.18±0.01 8 3-Octen-1-ol-(Z)- 顺式-3-辛烯-1-醇 C20125842 CgHi6O 633.153 1.31801 0.89±0.01 0.53±0.03 0.55±0.05 0.51±0.03 0.49±0.01 0.47±0.00 Q Benzyl alcohol 苯甲醇 C100516 CHO 592.248 1.32764 3.82±0.02 2.41±0.04 2.76±0.12 2.56±0.03 2.44±0.13 2.31±0.05 10 (E) beta-Ocimene 罗勒烯 C13877913 CIoH16 558.561 1.67412 1.16±0.06 1.35±0.09 0.17±0.01 0.68±0.09 1.26±0.06 1.86±0.12 1 Hexanoic acid 己酸 C142621 CH1O2 538.906 1.31953 1.86±0.03 1.07±0.03 1.24±0.08 1.15±0.02 1.10±0.04 1.09±0.03 12 Alpha-Phellandrene 水芹烯 C99832 C:oH16 528.834 1.68075 0.13±0.00 0.4±0.11 0.07±0.01 0.20±0.11 0.29±0.00 0.34±0.01 13 2-Octanone 仲辛酮 C111137 CgHiO 491.065 1.32428 4.69±0.07 3.79±0.05 4.37±0.16 4.10±0.08 3.97±0.12 3.85±0.06 14 2-ethyl-5-methylpyrazine 2-乙基-5-甲基吡嗪 C13360640 CHIoN2 482.412 1.64687 1.46±0.08 1.33±0.02 1.00±0.05 1.06±0.01 1.16±0.02 1.27±0.01 15 2-Furanmethanol,5-methyl- 5-甲基-2-呋喃甲醇 C3857258 CHO2 449.038 1.56722 3.00±0.32 2.50±0.16 2.51±0.13 2.30±0.16 2.18±0.05 2.21±0.12 16 Ethyl pyrazine 2-乙基吡嗪 C13925003 CH.N2 394.032 1.51146 18.54±0.64 18.44±1.42 21.61±0.88 17.66±2.07 14.84±0.37 13.28±0.12 17 6-methylhept-5-en-2-one 6-甲基-5-庚烯-2-酮 C110930 CgH:4O 400.83 1.17692 4.83±0.27 3.48±0.33 3.52±0.23 3.78±0.14 4.12±0.11 4.20±0.26 18 Ethyl3-methylbutanoate 异戊酸乙酯 C108645 CH4O2 290.201 1.67873 1.55±0.14 1.10±0.01 1.24±0.08 1.57±0.03 1.85±0.10 2.18±0.04 19 2-Furanmethanol 糠醇 C98000 CsHO? 291.437 1.3641 3.86±0.11 2.49±0.07 3.10±0.02 3.24±0.03 3.39±0.13 3.51±0.06 20 (E)-3-hexen-1-ol 反式-3-已烯-1-醇 C928972 CHO 309.482 L.25746 1.73±0.07 1.13±0.03 1.62±0.08 1.36±0.09 1.19±0.06 1.03±0.03 21 Methylpyrazine 2-甲基吡嗪 C109080 CsHN 275.432 1.39261 0.33±0.01 1.12±0.16 0.56±0.08 0.63±0.18 0.77±0.12 1.04±0.02 22 2.3-Butanediol 2.3-丁二醇 C513859 CaH:oO: 260.253 1.34888 0.37±0.05 1.71±0.35 1.87±0.17 1.61±0.20 1.30±0.07 1.21±0.06 23 Butanoic acid 丁酸 C107926 CaHO2 231.598 1.4003 0.47±0.03 0.82±0.12 0.27±0.02 0.58±0.10 0.91±0.06 1.15±0.03 24 Isovalerie acid 异戊酸 C503742 C,HoOz 276.143 1.23797 0.44±0.04 0.51±0.04 0.52±0.02 0.54±0.05 0.57±0.02 0.56±0.01 25 Methyl2-methylbutanoate 2-甲基丁酸甲酯 C868575 CH2O2 224.564 L.20477 0.12±0.01 0.25±0.02 0.04±0.00 0.09±0.00 0.14±0.02 0.20±0.01 26 (E)-pent-2-enal 反式-2-戊烯醛 C1576870 CH;O 195.962 1.35972 7.79±0.22 6.14±0.30 6.15±0.46 6.22±0.63 6.69±0.12 7.65±0.07 27 2-methylbutanal 2-甲基丁醛 C96173 C5H:O 170.172 1.41137 0.53±0.06 1.67±0.36 0.87±0.01 0.91±0.63 1.11±0.27 1.65±0.05 28 2.3-pentanedione 2.3-戊二酮 C600146 C5HO2 171.1 1.31914 0.24±0.06 0.96±0.21 0.27±0.00 0.27±0.23 0.30±0.07 0.47±0.03 29 Ethyl Acetate 乙酸乙酯 C141786 CjH.O2 150.01 L.34496 3.58±0.36 5.95±0.51 0.95±0.19 2.91±0.63 4.76±0.16 6.17±0.15 30 1.2-Propanediol 丙二醇 C57556 CHO: 199.244 1.11622 1.29±0.06 0.58±0.05 1,01±0.06 0.95±0.08 0.91±0.01 0.82±0.01 31 Pentan-2-one 2-戊酮 C107879 C,H:O 158.948 1.13334 0.14±0.01 0.32±0.03 0.25±0.01 0.24±0.01 0.24±0.01 0.24±0.01 32 Ethyl propanoate 丙酸乙酯 C105373 C,HO: 181.57 1.13044 0.12±0.02 0.09±0.03 0.07±0.01 0.10±0.05 0.12±0.00 0.12±0.00 33 2-Butanone 2-丁酮 C78933 CHO 133.792 1.24377 0.7±0.03 0.54±0.02 2.07±0.06 1.64±0.09 1.26±0.00 0.81±0.04 34 3-methylbutanal 异戊醛 C590863 CsHO 155.871 1.20308 0.18±0.01 0.24±0.02 0.04±0.00 0.10±0.01 0.16±0.01 0.21±0.01 35 2,3-diethyl-5-methylpyrazine 2,3-二乙基-5-甲基吡嗪 C18138040 CH:4Nz 891.248 1.2594 0.23±0.01 0.27±0.01 0.43±0.02 0.45±0.02 0.5±0.00 0.52±0.04 36 1,2-Dimethoxyethane 乙二醇二甲醚 C110714 CaHiO2 155.401 1.09337 0.25±0.00 0.21±0.01 0.19±0.01 0.18±0.01 0.17±0.01 0.16±0.01 37 Hydroxy acetone 羟基丙酮 C116096 CH.O2 184.054 1.25318 0.09±0.02 0.37±0.04 0.11±0.01 0.18±0.03 0.25±0.01 0.30±0.00 38 2-Methylpropanal 异丁醛 C78842 CAHO 136 1.0952 0.11±0.01 0.12±0.01 0.08±0.01 0.08±0.01 0.08±0.00 0.09±0.00 39 4-Methyl-2-pentanol 4-甲基-2-戊醇 C108112 CH4O 217.325 1.29619 0.18±0.03 0.27±0.04 0.89±0.03 0.92±0.05 0.91±0.05 0.88±0.09 40 (E)-3-hexen-1-ol 反式-3-己烯-1-醇 C928972 CH:O 303.229 1.54953 4.12±0.28 3.01±0.33 3.71±0.18 2.71±0.43 1.91±0.23 1.38±0.07 41 l-propene-3-methylthio 烯丙基甲基硫醚 C10152768 CHS 181.777 1.03696 0.38±0.02 0.32±0.06 0.22±0.01 0.30±0.07 0.35±0.02 0.37±0.01 42 2-Methylbutyricacid 2-甲基丁酸 C116530 CsHioO: 300.832 L47508 0.47±0.01 0.59±0.06 0.51±0.02 0.47±0.07 0.46±0.01 0.49±0.02 43 2.5-dimethylthiophene 2.5-二甲基噻吩 C638028 CHS 292.842 1.05414 1.76±0.11 1.42±0.12 1.55±0.08 1.39±0.07 1.30±0.06 1.13±0.01 44 Methyl2-methylpropanoate 异丁酸甲酯 C547637 CsH:oO: 172.988 1.16009 0.46±0.02 0.47±0.04 0.54±0.03 0.48±0.07 0.46±0.02 0.46±0.01 45 2-methylbutan-1-ol 2-甲基丁醇 C137326 C5HO 206.148 1.47794 0.05±0.01 0.15±0.02 0.27±0.07 0.31±0.07 0.34±0.01 0.29±0.02 46 Carveol 香芹醇 C99489 C0H60 1024.826 1.19942 0.59±0.04 0.59±0.17 2.02±0.03 1.57±0.14 1.08±0.16 0.68±0.29 47 Phenol,4-ethyl- 4-乙基苯酚 C123079 CgHinO 921.905 0.73±0.15 0.90±0.17 7.77±0.22 5.47±0.28 3.35±0.41 1.31±0.02 48 Pentyl butanoate 丁酸戊酯 C540181 CH:8O: 680.085 1.39486 0.1±0.01 0.17±0.03 0.22±0.01 0.18±0.01 0.13±0.06 0.10±0.01 49 2,6-dimethylpyrazine 2.6-二甲基吡嗪 C108509 CHN2 353.611 1.14139 0.21±0.01 0.42±0.03 0.86±0.02 0.70±0.02 0.57±0.05 0.42±0.01 50 3-Acetyl-6-methyl-2H-pyran-2 .4(3H)-dionc 脱氢乙酸 C520456 CgH.O4 1620.451 1.26539 0.36±0.07 0.34±0.06 1.09±0.08 0.86±0.02 0.62±0.04 0.33±0.07 51 2-acetyIthiazol 2-乙酰基噻唑 C24295032 CsHsNOS 507.57 1.11918 0.15±0.01 0.14±0.01 0.41±0.03 0.38±0.03 0.37±0.01 0.34±0.02 52 Isovalerianic acid 异戊酸 C503742 CsHioO2 330.599 1.20567 0.07±0.00 0.14±0.00 0.05±0.01 0.08±0.01 0.11±0.09 0.13±0.19 53 Citronellol 香茅醇 C106229 CioHoO 1064.242 1.81713 0.31±0.01 0.32±0.04 0.49±0.26 0.52±0.04 0.33±0.44 0.33±0.03 54 3-Mcthyl-2-isobutylpyrazine 2-甲基-3-(2-甲基丙基)吡嗪 C13925069 C,H:4N2 752.756 1.28857 0.33±0.01 0.26±0.03 0.13±0.01 0.17±0.03 0.2±0.00 0.23±0.00 55 3,4-dimethylthiophene 3.4-二甲基噻吩 C632155 CHS 656.562 1.63386 0.29±0.01 0.17±0.00 0.14±0.01 0.14±0.00 0.14±0.01 0.16±0.01 56 Alpha-terpinene 松油烯 C99865 C1oH16 594.273 1.21369 0.59±0.03 0.30±0.01 0.14±0.02 0.20±0.03 0.30±0.03 0.38±0.01 57 2-Octanol 仲辛醇 C123966 CgHigO 505.176 1.47578 0.08±0.00 0.09±0.01 0.12±0.00 0.12±0.00 0.12±0.00 0.12±0.01 58 2.5-Dimethylpyrazine 2.5-二甲基吡嗪 C123320 CHN2 349.059 1.49242 0.08±0.01 0.11±0.01 0.25±0.03 0.21±0.01 0.16±0.00 0.10±0.12 59 2-nonanone 2-壬酮 C821556 C,HisO 735.41 1.38425 0.87±0.01 0.57±0.15 0.80±0.03 0.70±0.17 0.64±0.04 0.70±0.02 60 Ethyl maltol 乙基麦芽酚 C4940118 CzHO3 930.162 1.65051 0.33±0.05 0.31±0.06 6.23±0.27 4.28±0.02 2.4±0.20 0.31±0.38 61 2-Acctylpyrrole 2-乙酰基吡咯 C1072839 CH,NO 640.005 1.118 0.15±0.02 0.21±0.02 0.29±0.02 0.28±0.10 0.33±0.03 0.37±0.04 62 AllyIn-propyl sulfide 烯丙基二硫化物 C2486731 CH2S 714.909 1.19289 0.13±0.02 0.10±0.01 0.25±0.04 0.18±0.01 0.15±0.00 0.08±0.03 63 Diethyl disulfide 二乙基二硫醚 C110816 CHioS2 380.111 L.12487 0.08±0.01 0.08±0.01 0.25±0.04 0.25±0.02 0.25±0.01 0.24±0.01 64 2-acetylpyrazine 2-乙酰基吡嗪 C22047252 CHN2O 558.591 1.22367 4.29±0.04 4.32±0.02 0.34±0.05 1.78±0.08 3.27±0.05 4.73±0.07 65 (E)-hept-2-enal (E)-2-庚烯醛 C18829555 C-HgO 438.009 1.64886 1.27±0.04 1.69±0.11 1.13±0.03 1.23±0.05 1.37±0.01 1.45±0.05 66 Citronellyl acetate 乙酸香茅酯 C150845 C:2H22O2 1259.135 1.4513 1.07±0.24 1.14±0.07 3.60±1.68 4.79±1.60 3.70±0.15 2.52±0.33 67 Ethanone,1-(2-pyridinyl)- 2-乙酰基吡啶 C1122629 CHNO 525.662 1.10495 0.16±0.00 0.12±0.00 0.35±0.02 0.33±0.03 0.32±0.01 0.30±0.01 68 3-Methyl-3-buten-1-ol 3-甲基-3-丁烯-1-醇 C763326 CsHiO 195.837 L.27437 0.20±0.01 0.29±0.05 0.25±0.03 0.23±0.02 0.20±0.02 0.18±0.01 69 N-butyl acetate 乙酸丁酯 C123864 CHO: 253.912 1.22408 0.03±0.01 0.05±0.01 0.05±0.00 0.04±0.00 0.05±0.00 0.04±0.01 70 Methyl isobutyl ketone 4-甲基-2-戊酮 C108101 CHO 196.263 1.18098 0.20±0.03 0.31±0.01 0.3±0.02 0.27±0.03 0.23±0.01 0.20±0.00 71 2-Butenoicacid hexylester 2-丁烯酸己酯 C19089920 C1oHjsO2 1123.312 1.44788 0.54±0.04 0.58±0.05 0.68±0.13 0.82±0.21 0.70±0.04 0.66±0.70 72 Maltol 甲基麦芽酚 C118718 CHOs 751.521 1.21931 0.29±0.00 0.20±0.02 0.11±0.00 0.16±0.04 0.21±0.02 0.29±0.01 73 2-Heptylfuran 2-庚基呋喃 C3777717 CuHixO 924.336 1.41149 0.14±0.02 0.12±0.01 1.70±0.09 1.17±0.01 0.68±0.06 0.11±0.06 74 Guaiacol 愈创木酚 C90051 CH.O 612.592 1.12174 0.08±0.00 0.10±0.00 0.14±0.00 0.13±0.01 0.12±0.00 0.11±0.04 75 Butyl sulfide 二丁基硫醚 C544401 CgHigS 688.495 1.28393 0.12±0.01 0.13±0.00 0.08±0.01 0.12±0.01 0.16±0.00 0.20±0.01 76 Ethyl2-hydroxypropanoate 乳酸乙酯 C97643 C5HioOs 250.908 1.52715 0.05±0.00 0.05±0.00 0.05±0.00 0.06±0.01 0.06±0.00 0.07±0.00 参考文献: [1] LIU B B , ZH A NG J F , SHI Y C . et a l . C o m pl e te c hl o ropl a s t gen ome of T oo na si nensis (Mel ia c e a e ), a goluptious “tr e e ve get a ble s '[]. Mit ocho n d r ia l DN A P a rt B,2019,4(2):3025-3026. DOI: 10.1080/23802359.2019.1666664. [2] 李辉尚,曲春红,王 晓东,等.2018年中国蔬菜市场形势分析 与 后市展望 [].农 业展望,2019,15(1): 16-21. DOI:CNKI :S U N :NYZW.0.2019-01-005. [3] LEO M D, MILELLA L . BRAC A A . et al . C e dr e l a and T o ona g e ner a: a ri ch s ou rce o f bi oa cti ve l imo n oids and tr i t er p en o i ds[J]. Ph yto chem is tr y R e v i e w s, 2018, 17(4): 751-783. DOI:10.1007/s11101-018-9557-1. [4] FU Y H, XIE Y T , GUO J M, et a l. L i m o no ids fro m the f r e sh young l eave s a nd b uds o f Toona si nens i s a nd the i r pot en t ial neuropr ote c ti ve e f f ect s[J]. J o urn a l of Ag r i cu ltu r a l a nd F ood Ch e mi s t r y, 2020, 68(44): 12326-12335. DOI :10.1021/a c s.j afc.0c 06352. [5] X U W J , L I J-H, ZH A O MM, et a l. T oo n asi nd i ynes A -F, n ew pol y a ce tyl enes f rom T oo na si nens is wi th cytotox i c an d a nti-infl am mat o ry ac tiv i t i e s[J]. F i t o t era p ia , 2020, 146. DOI :10.1016/j .f i t o te .2020.104667. [6] C A O J J , LV Q Q. ZHANG B. e t a l . Str u ctur a l ch a r act er i zati o n an d hep a t o pr o tect i v e a c t i v i t i e s o f p ol ysac ch a r ides fr om t h e l e av e s o f Too na si ne n sis (A. J us s ) Roem [J ]. C a r b ohydr ate Polymer s, 2019, 212:89-101. DOI :10.1016/j .c a rbpol .2019.02.031. [7] 刘常金,张杰,周争艳, 等 . GC -MS 分析比较3个特产香椿品种的挥发性成分 [].食品科学,2013,34(20):261-267. DOI :10.7506/spkx 1002-6630-201320055. [8] DUAN Z L , DONG S L , G A O Y W , et al. Ge ogra phic al or i g in i d enti f i ca ti o n o f tw o s a l m on i d s p e c ie s vi a f l a v o r c om p o und analy s i s u s i ng he ad spac e-g a s ch romat o gr a ph y -i on m ob i l it y s p e c t rometr y c o m bi n ed w i t h e l e c t ro ni c no s e and t ong ue []. Fo o d Res ea r c h I n t e rnati o nal , 2021,145: 110385-110385. DOI :10.1016/J .FOODRES .2021.110385. [9] HE W, WEN H, F A NG R, et al. A pp l ic a t i o n o f GC-IMS in d e t e c ti on o f f oo d fl a v o r su b s tanc es [J J . IOP C on f er en ce Seri e s : E a rth a nd E n viro n ment a l S c i e n ce , 2020, 545(1):1-7. DOI :10.1088/1755-1315/545/1/012030. [10]史冠莹,赵丽丽,王晓敏,等 .红油香椿生长期 主 要活性物质及挥发性成分动态变化规律 [].食品科学,2022,43(2): 276-284. D OI :10.7506/sp k x 1002-6630-20210112-125. [11]郭淼,惠国华,等 .基于电子鼻 与 非线性特征提取建模的猪肉鲜度快速分析方法[J ].中国食品学报,2016,16(6):218-224.DOI :10.16429/j.1009-7848.2016.06.029. [12]L DANDAN D, YINGQUN N, JIE S, e t a l . C h ar acte ri zat ion o f s pe ci f i c vo l a tile c omp on ent s i n b r a i se d p ork wi t h d iffer en t ta st es by S P ME -GC /MS a n d ele ct r on i c nose[J]. Journal of F o od P ro cessing and Pr e s e r vat i on , 2021, 45(5): 1-14. DOI :10.1111/JFPP.15492. [13] 蒋鑫妹,电子鼻技术在欧李催熟检测中应用研究 [D ]. 长春:吉林农业大学,2021:24-26. DOI:10.27163/d .cn k i .g jln u .2021.000377. [14] 李俊杰,徐元吴,陈梦娟,等 ,手筑茯砖茶加 工 过程中挥发性组分变化分析[].食品科学,2020,41(24): 144-154. DOI :10.7506/s p kx1002-6630-20191226-316. [15] YANG C , YE Z , MAO L P , et al. A n al ys i s o f v o l a tile o rgani c c om p oun d s a n d m e t a b o l it e s o f th re e c ult i v a r s o f a sp a ra gu s (Asp a ra g us offi c i n a li s L .) u s i ng E -nose, GC -IMS, an d LC -MS/MS [J]. Bi oe n gine er e d,2022,13(4): 8866-8880. DOI :10.1080/21655979.2022.2056318. [16] 郭家刚,杨松,丁 思年,等.基于气相离子迁移谱的不同产地生姜挥发性 有 机物指纹图谱分析 [].食品科学,2021,42(24):236-241. DOI :10.7506/sp kx 1002-6630-20201127-285. [17]刘 丽 丽,杨辉,荆雄,等. 基于 G C -IMS 和电子鼻技术分析贮酒容器对凤香型白酒香气成分的影响[J ].食品科学,2022.43(4): 257-263. DOI :10.7506/s pk x1002-6630-20210203-062. [18] 杜晓兰,杨文敏,黄永强,等.基于顶空气相离子迁移谱比较3种加 工 方式对番鸭 肉 挥发性风味物质的影响[J ].食品科学,2021,42(24):269-275. DOI :10.7506/sp kx1002-6630-20210305-067. [19] NATALIE G, MARKUS B, DANIEL S, et a l . Resolu t ion-opt i mize d h e a dspa c e ga s ch r o ma tog r a ph y -ion m ob ilit y spec t r o m et r y (HS -GC-IMS) f o r n on -ta rg et e d olive o i l pr ofi l ing []. A naly t i c a l an d Bi o ana l y ti c al C hem i st ry, 2017, 409(16): 3933-3942. DOI :10.1007/s 00216-017-0338-2. [20] W A NG X R ,MR K, LI Y , e t a l . Untar g et e d an d t a r ge t e d d is cr i mi n a t io n o f honey c ol le cte d b y a pi s cer ana a n d a pis me lli f e r a ba s ed o n vo l at i le s using HS-GC -IMS an d HS -SPME -GC-MS[J]. J o ur na l o f Agricul t u ra l an d F ood Chemi s t r y , 2019.67(4):12144-12152. DOI :10.1021/ac s .j a fc .9b 04438. [21] PAN W C , SOOTTAW A T B, CHIARA S, e t a l . Ch a rac ter iz a tio n o f th e F la v o r Pr ofi l e o f Bi gey e Tun a Sli ce s Tr e at ed b y Co ld Pl a sma U sin g E -Nose an d GC -IMS [J ]. Fishes,2022,7(1): 13-13. DOI :10.3390/FISHES7010013. [22]杜萍,陈振佳,杨芳,等.基于顶空气相色谱-离子迁移谱技术的生咖啡豆快速鉴别方法[J ].食品科学,2019,40(24):228-233.DOI:10.7506/spk x 1002-6630-20190429-386. [23]蒋鹏飞,高海东,赵丽丽,等 ,不同采收期香椿茶发酵前 后 活性成分、降糖活性及其挥发性成分比较分析 [].食品科学,2021,42(2):262-270. DOI :10.7506/spk x1002-6630-20200116-194. [24]宋继敏,贺志荣,赵三虎,等.香椿叶黄酮提取工艺及其生物活性研究进展[,食品 工 业,2019, 40(11):259-262. DOI :CN KI :SU N:SPGY .0.2019-11-070. [25]徐芳菲,冯惠柳,李蕾,等,黑 三 七中总 皂 苷的含 量 测定 [.人参研究,202211,33(5):15-18.DOI :10.19403/j.cnk i.1671-1521.2021.05.005. [26] BRU N O S,E D R A D A LE , DA R A . e t al. Ef f ec t o f the environm e nt o n the s e c o nd a r y metabol ic profi le o f T it h o ni a d iv e rsifo l i a : a m o d el for en v i r o nme nt al m e tabol om i cs o f pl an ts [J]. S c ient i f ic Reports, 2016,6(1):1.DOI :10.1038/s rep 29265. [27]徐文燕,高微微,何春年,等,环境因子对植物黄酮类化合物生物合成的影响[,世界科学技术-中医药现代化,2006,8(6):68-72.DOI :10.3969/j.is s n.1674-3849.2006.06.016. [28] 杨林林,张涛,杨利民,等 ,人参叶片 中 人参皂苷含量、关键酶基因表达和 生 态因子的相关性分析 [J ]. 华南农业大学学 报 ,2018,39(3): 39-47. DOI: 10.7671/j .issn .1001-411X.2018.03.007. [29] 王晓敏,史冠莹,王赵改,张乐,程菁菁,蒋鹏飞,赵丽丽,王旭增.不同产地香椿抗氧化活性及挥发性成分的差异分析 [J ].现代食 品科技,2020,36(7): 271-281. DOI:10.13982/j.mfst .1673-9078.2020.7.0008. [30] LIN S H, CHEN C K, LUO H X, et a l . T h e c o mbined e ff ect o f ozo n e treat m ent a nd p o l ye thylen e p a ck ag ing on po s th ar v e st q u a l ity an d b iodiv e r si ty of To o na s ine n s is (A .J us s .) M.Ro em[J ]. Po s t ha r ve st Bi o lo g y an d T ec hn o l og y , 2019,154. D OI:10.1016/j .p o sthar vb i o .2019.04.010. [31]SSCALONE G L , CUC U D, DE K N . et a l . I nfl u en c e of f r ee a m in o a c i d s, o l i go p e p ti d es, a n d p ol ypept id es on the fo r ma tion of p y r az ine s in m a i ll ar d m o del system s[J]. J o urnal o f Agr i c ul t ur a l a n d F o od C h e m i s try. 2015,63(22): 5364-72. DOI :10.1021/a c s.ja fc .5b01129. [32]舒垚,刘玉 兰 ,姜元荣,等.鲜花生仁烘烤温度对花生酱风 味 和综合品质的影响[.食品科学,2020, 41(11):28-35.DOI :10.7506/sp k x1002-6630-20190519-210. [331 夏季,方勇,王梦梦,等 .不同发酵处理对香菇泡菜质构及风味物质的影响[.食品科学,2019,40(20): 171-177. DOI :10.7506/sp kx 1002-6630-20190416-208. [34]ZH A I X T , GR A NVOGL M. Mi c h ael , e t a l. Ch arac te r i zat ion of t h e key a rom a Com po und s in t w o dif feren tl y dr i e d T oo n a s i ne ns i s (A . J uss ) Roem . b y means o f the molec ul a r senso ry scien c e c o nc e p t[J]. Jour na l o f Ag ri cu l tur al and Food C he mi s try , 2019,67(35): 9895 9894. DOI :10.1021/acs.j afc .8b 06656. [35] Y A NG W X, KEITH R C, LIU Y P, e t a l. C ha rac te ri za ti o n o f typi ca l p o ten t odor a nt s i n r a w an d c ook e d To o na si n e n s i s (A . J uss .) M. Ro em . by i nstr u ment al-sens o ry anal ysi s tech n i q ue s[J]. F oo d Ch em i s try, 2018,282: 153-163. DOI :10.1016/i.fo od chem .2018.12.112. [36]赵铭洋 ,王 知斌,孙延平,等 .大蒜中的有机硫化物及其生物活性研究进展[].食品与药品,2021, 23(6):565-571. DOI :10.3969/j .i ss n .1672-979X.2021.06.018. [37]孙 晓健.香椿挥发性有机硫化物的呈味特性研究 [D]. 天津:天津科技大学, 2019: 38-42. D OI :10.27359/d.c nki.gt q g u.2019.000134. [38]文 刘胜男,刘云锋,曹荣,等 ,加 工 方式对玉筋鱼 干 风味的影响 [J ].食品科学,2021,42(20): 167-172. DO I :10.7506/s pk x1002-6630-20201019-166.
确定












还剩15页未读,是否继续阅读?
北京盈盛恒泰科技有限责任公司为您提供《六个产地香椿主要活性成分及风味特征差异分析》,该方案主要用于蔬菜中营养成分检测,参考标准--,《六个产地香椿主要活性成分及风味特征差异分析》用到的仪器有德国AIRSENSE品牌PEN3电子鼻
推荐专场
感官智能分析系统(电子鼻/电子舌)
相关方案
更多
该厂商其他方案
更多