测试了外部代谢物对叶片 O 2消耗率的影响是否可以用 SDR 来衡量。具体而言,先前在对叶片 O 2消耗率的代谢物影响筛选(使用 Astec Global 的 Q2)中观察到,10 mM 脯氨酸 (Pro) 在 14 小时内引起大约两倍的呼吸速率刺激。该测量的关键方面是其持续时间(> 14 小时)及其动态性质,因为我们对速率如何随时间变化感兴趣。我调整了 SDR 设置,因此可以测量包含样品的管顶部空间中的氧气。
方案详情

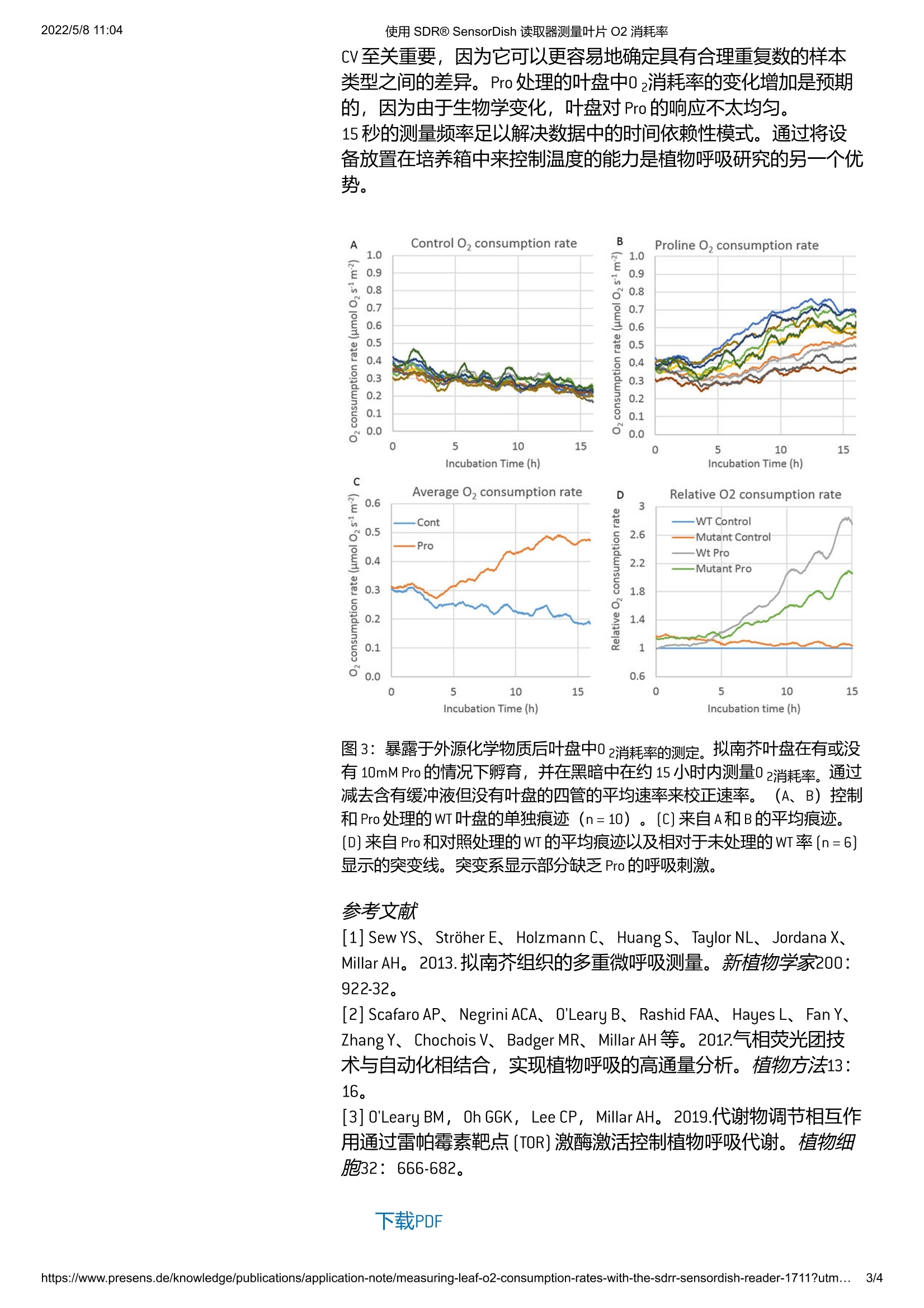
使用SDRQ SensorDish 读取器测量叶片02消耗率2022/5/811:04德 中国ISPKELISIUN SENSING 使用 SDRQ SensorDish 读取器测量叶片02消耗率2022/5/811:04 后退 使用 SDR@ SensorDish 读取器测量叶片02消耗率 采用管和02传感器点安装在螺旋盖中的SDR设置Brendan O'Leary ARC植物能源生物学中心,西澳大利亚大学,珀斯,澳大利亚 我测试了外部代谢物对叶片02消耗率的影响是否可以用SDR来衡量。具体而言,先前在对叶片02消耗率的代谢物影响筛选(使用Astec Global 的Q2)中观察到,10mM脯氨酸[Pro]在14小时内引起大约两倍的呼吸速率刺激。该测量的关键方面是其持续时间(>14小时)及其动态性质,因为我们对速率如何随时间变化感兴趣。我调整了 SDR设置,因此可以测量包含样品的管顶部空间中的氧气。 呼吸通量和光合速率是唯一常用于植物的代谢通量测量,因此两者都是了解植物生物化学和生理学的重要工具。目前存在几种可以测量植物呼吸气体交换率的技术,例如用于co2的红外线亿体分析仪和用于氧气的 Clark型02电极。这两种技术都受到低通量和短时间测量技术的影响,这阻碍了例如对植物育种者有用的大规模实验设计。澳大利亚研究委员会植物能量生物学卓越中心[PEB]一直处于开发和试验用于植物的新呼吸测量技术的最前沿。具体来说,使用0依赖荧光猝灭已被应用于多种高通量技术,例如 Astec Global的SDR SensorDish@Reader、Seahorse 或Q2。然而,这些技术在植物科学中的使用很少见,特别是海马在使用漂浮的植物组织方面的应用受到限制[1]。尽管我们已经尝试将标准 SDR与以前可用的带传感器点的玻璃板结合起来,但孔底部的点位置与涉及液体和顶空的测量不兼容。目前, PEB的许多呼吸研究都依赖于Q2。这台机器基本上使用了他们自己版本的传感器点,它们放置在螺旋顶管的盖子和一个机器人传感器臂上。Q2对各种植物组织的整体效果很好,测量能力有了很大的提高,正如 Scafaro 等人在201?年[2]中评估的那样。简单的管和盖设置也适合使用液体介质进行测量;这是一个很大的优势,因为它允许将化学物质引入呼吸分析中,从而大大扩展了它们的用途[3]。因此,我想测试 SDR是否可以适应与Q2类似的设置,带有管和传感器点帽,以及它是否具有出色的测量特性。 图1:用于叶盘呼吸测量的 SDR SensorDish@Reader设置。叶盘被切割并漂浮在固定在底架上的螺旋盖管内的缓冲介质上。帽子被拧上。放置了顶部机架适配器。特别提款权被倒置。 材料与方法 实验装置简单快速(图1)。用600uL缓冲溶液 (50 mM HEPES、10 mM MES、200 pM CaCl 2, pH 6.6]在存在或不存在10mMPro (或任何其他所需的化学物质)的情况下,留下256uL的顶部空间。七毫米叶盘被冲孔并漂浮在溶液和管盖上(n=10)。每次处理都应包括没有叶盘的空白管,因为它们对于消除大量背景噪声和提高数据质量是必要的。然后使用两个3D打印适配器[PreSens]组装SDR。一个SDR的设置大约需要15分钟。提供的盖子和管子质量很高。考虑到适配器的最小设计,该单元的组装非常坚固。在室温下在黑暗中收集氧气数据。测定以15秒的间隔进行过夜(约1?小时)。数据被导出到 Excel 进行分析。 结果 图2显示了一项实验的氧气测量值,比较了使用 SDR 记录的未处理和Pro处理的叶盘。这些值用于进一步的消耗率计算。我通过减去没有叶盘的空白管中的平均速率来校正02消耗速率,然后将速率计算为移动1.5小时窗口(图3A-B)。02消耗率轨迹随时间的平滑度是用于计算移动斜率的时间窗口的函数:窗口越大,轨迹越平滑。然而,出于本实验的目的,空白减法后剩余的噪声不是一个因素。根据 Scafaro等人,将02百分比转换为摩尔值。2017[2]。 图2:用SDR记录的未处理(左)和Pro处理(右)叶盘中的氧气测量值。一项实验的数据。 Pro 处理的叶盘的刺激呼吸清晰可见。 结果表明, SDR板与管和盖设置相结合,再现了之前使用Q2获得的结果。在对照照盘中,02消耗率随时间逐渐下降(图3A、C)。在Pro处理的圆盘中,02消耗率随着时间的推移从孵化4小时开始按预期增加(图3B、C、D)。在图3D中,我们比较了两种不同的拟南芥基因型。该测定能够检测先前观察到的系之间的表型差异,就其对外部 Pro 的反应而言,使用六次重复。 关键因素是测量之间的技术差异。与其他呼吸测量设备相比,对照处理的重复迹迹显示出较低的技术变异:变异系数为22.7%(这包括生物变异,因此潜在的技术变异甚至更低)。这种低 CV至关重要,因为它可以更容易地确定具有合理重复数的样本类型之间的差异。 Pro 处理的叶盘中02消耗率的变化增加是预期的,因为由于生物学变化,叶盘对Pro的响应不太均匀。 15秒的测量频率足以解决数据中的时间依赖性模式。通过将设备放置在培养箱中来控制温度的能力是植物呼吸研究的另一个优势。 Control O, consumption rate 图3:暴露于外源化学物质后叶盘中02消耗率的测定。拟南芥叶盘在有或没有10mM Pro 的情况下孵育,并在黑暗中在约15小时内测量02消耗率。通过减去含有缓冲液但没有叶盘的四管的平均速率来校正速率。((A、B)控制和 Pro处理的WT叶盘的单独痕迹(n=10)。[C]来自A和B的平均痕迹。 [D]来自 Pro 和对照处理的 WT 的平均痕迹以及相对于未处理的 WT率[n=6]显示的突变线。突变系显示部分缺乏 Pro的呼吸刺激。 ( 参考文献 ) ( [1] Sew YS、Stroher E、 Holzmann C、H u ang S、 Taylor N L、Jordana X、 MillarAH。2013.拟南芥组织的多重微呼吸测量。新植物学家200: 922-32。 ) ( [2]Scafaro AP、Negrini ACA、O'Leary B、 R ashid FAA、Hayes L、Fa n Y、 Zhang Y 、 Chochois V 、 Badger M R、 Millar AH等。2017.气相荧光团技术与自动化相结合,实现植物呼吸的高通量分析。植物方法13: 16。 ) ( [3]O'Leary BM, Oh GG K , Lee CP, Milla r AH。 2019.代谢物调节相互作 用通过雷帕霉素靶点 [TOR] 激酶激活控制植物呼吸代谢。植物细胞32:666-682。 ) 使用 SDRQ SensorDish 读取器测量叶片02消耗率 相关产品 https://www.presens.de/knowledge/publications/application-note/measuring-leaf-o-consumption-rates-with-the-sdrr-sensordish-reader-utm.../ 测试了外部代谢物对叶片 O 2消耗率的影响是否可以用 SDR 来衡量。具体而言,先前在对叶片 O 2消耗率的代谢物影响筛选(使用 Astec Global 的 Q2)中观察到,10 mM 脯氨酸 (Pro) 在 14 小时内引起大约两倍的呼吸速率刺激。该测量的关键方面是其持续时间(> 14 小时)及其动态性质,因为我们对速率如何随时间变化感兴趣。我调整了 SDR 设置,因此可以测量包含样品的管顶部空间中的氧气。背景:需要植物呼吸测量呼吸通量和光合速率是常用于植物的代谢通量测量,因此两者都是了解植物生物化学和生理学的重要工具。目前存在几种可以测量植物呼吸气体交换率的技术,例如用于 CO 2的红外线气体分析仪和用于氧气的 Clark 型 O 2电极。这两种技术都受到低通量和短时间测量技术的影响,这阻碍了例如对植物育种者有用的大规模实验设计。澳大利亚研究委员会植物能量生物学卓越中心 (PEB) 一直处于开发和试验用于植物的新呼吸测量技术的最前沿。具体来说,使用 O2依赖荧光猝灭已被应用于多种高通量技术,例如 Astec Global 的 SDR SensorDish® Reader、Seahorse 或 Q2。然而,这些技术在植物科学中的使用很少见,特别是海马在使用漂浮的植物组织方面的应用受到限制[1]。尽管我们已经尝试将标准 SDR 与以前可用的带传感器点的玻璃板结合起来,但孔底部的点位置与涉及液体和顶空的测量不兼容。目前,PEB 的许多呼吸研究都依赖于 Q2。这台机器基本上使用了他们自己版本的传感器点,它们放置在螺旋顶管的盖子和一个机器人传感器臂上。Q2 对各种植物组织的整体效果很好,测量能力有了很大的提高,正如 Scafaro 等人在 2017 年 [2] 中评估的那样。简单的管和盖设置也适合使用液体介质进行测量;这是一个很大的优势,因为它允许将化学物质引入呼吸分析中,从而大大扩展了它们的用途 [3]。因此,我想测试 SDR 是否可以适应与 Q2 类似的设置,带有管和传感器点帽,以及它是否具有出色的测量特性。图 1:用于叶盘呼吸测量的 SDR SensorDish® Reader 设置。叶盘被切割并漂浮在固定在底架上的螺旋盖管内的缓冲介质上。帽子被拧上。放置了顶部机架适配器。特别提款权被倒置。材料与方法实验装置简单快速(图 1)。用 600 µL 缓冲溶液(50 mM HEPES、10 mM MES、200 µM CaCl 2, pH 6.6) 在存在或不存在 10 mM Pro(或任何其他所需的化学物质)的情况下,留下 256 µL 的顶部空间。七毫米叶盘被冲孔并漂浮在溶液和管盖上(n = 10)。每次处理都应包括没有叶盘的空白管,因为它们对于消除大量背景噪声和提高数据质量是必要的。然后使用两个 3D 打印适配器 (PreSens) 组装 SDR。一个 SDR 的设置大约需要 15 分钟。提供的盖子和管子质量很高。考虑到适配器的最小设计,该单元的组装非常坚固。在室温下在黑暗中收集氧气数据。测定以 15 秒的间隔进行过夜(约 17 小时)。数据被导出到 Excel 进行分析。结果图 2 显示了一项实验的氧气测量值,比较了使用 SDR 记录的未处理和 Pro 处理的叶盘。这些值用于进一步的消耗率计算。我通过减去没有叶盘的空白管中的平均速率来校正 O 2消耗速率。然后将速率计算为移动 1.5 小时窗口(图 3A-B)。O 2消耗率轨迹随时间的平滑度是用于计算移动斜率的时间窗口的函数:窗口越大,轨迹越平滑。然而,出于本实验的目的,空白减法后剩余的噪声不是一个因素。根据 Scafaro 等人,将O 2百分比转换为摩尔值。2017 [2]。图 2:用 SDR 记录的未处理(左)和 Pro 处理(右)叶盘中的氧气测量值。一项实验的数据。Pro 处理的叶盘的刺激呼吸清晰可见。结果表明,SDR 板与管和盖设置相结合,再现了之前使用 Q2 获得的结果。在对照叶盘中, O 2消耗率随时间逐渐下降(图 3A、C)。在 Pro 处理的圆盘中,O 2消耗率随着时间的推移从孵化 4 小时开始按预期增加(图 3B、C、D)。在图 3D 中,我们比较了两种不同的拟南芥基因型。该测定能够检测先前观察到的系之间的表型差异,就其对外部 Pro 的反应而言,使用六次重复。数据质量关键因素是测量之间的技术差异。与其他呼吸测量设备相比,对照处理的重复迹线显示出较低的技术变异:变异系数为 22.7%(这包括生物变异,因此潜在的技术变异甚至更低)。这种低 CV 至关重要,因为它可以更容易地确定具有合理重复数的样本类型之间的差异。Pro 处理的叶盘中O 2消耗率的变化增加是预期的,因为由于生物学变化,叶盘对 Pro 的响应不太均匀。15 秒的测量频率足以解决数据中的时间依赖性模式。通过将设备放置在培养箱中来控制温度的能力是植物呼吸研究的另一个优势。图 3:暴露于外源化学物质后叶盘中O 2消耗率的测定。拟南芥叶盘在有或没有 10mM Pro 的情况下孵育,并在黑暗中在约 15 小时内测量O 2消耗率。通过减去含有缓冲液但没有叶盘的四管的平均速率来校正速率。(A、B)控制和 Pro 处理的 WT 叶盘的单独痕迹(n = 10)。(C) 来自 A 和 B 的平均痕迹。(D) 来自 Pro 和对照处理的 WT 的平均痕迹以及相对于未处理的 WT 率 (n = 6) 显示的突变线。突变系显示部分缺乏 Pro 的呼吸刺激。
确定



还剩2页未读,是否继续阅读?
上海奇宜仪器设备有限公司为您提供《植物叶片中O2 消耗率检测方案(其它计量仪器)》,该方案主要用于林产品中植物生理检测,参考标准--,《植物叶片中O2 消耗率检测方案(其它计量仪器)》用到的仪器有SFR摇瓶读出器、OXY-1 SMA和 OXY-1 SMA trace氧传感器、奇宜 读卡器 其他元素分析仪配件











