
细胞株开发对于生物药物 ( 如单克隆抗体 )
的生产至关重要。为了建立细胞株,单个
细胞被接种至孔板,随后增殖形成克隆,
评估其表达水平后进一步放大。将单个细
胞接种至多孔板的仪器有流式细胞仪和单
细胞分离设备。而更传统的获得单细胞孔
的方法是有限稀释。在这个方法中,梯度
稀释产生单个细胞的孔,并伴随着一定概
率的空孔和多细胞孔。
方案详情

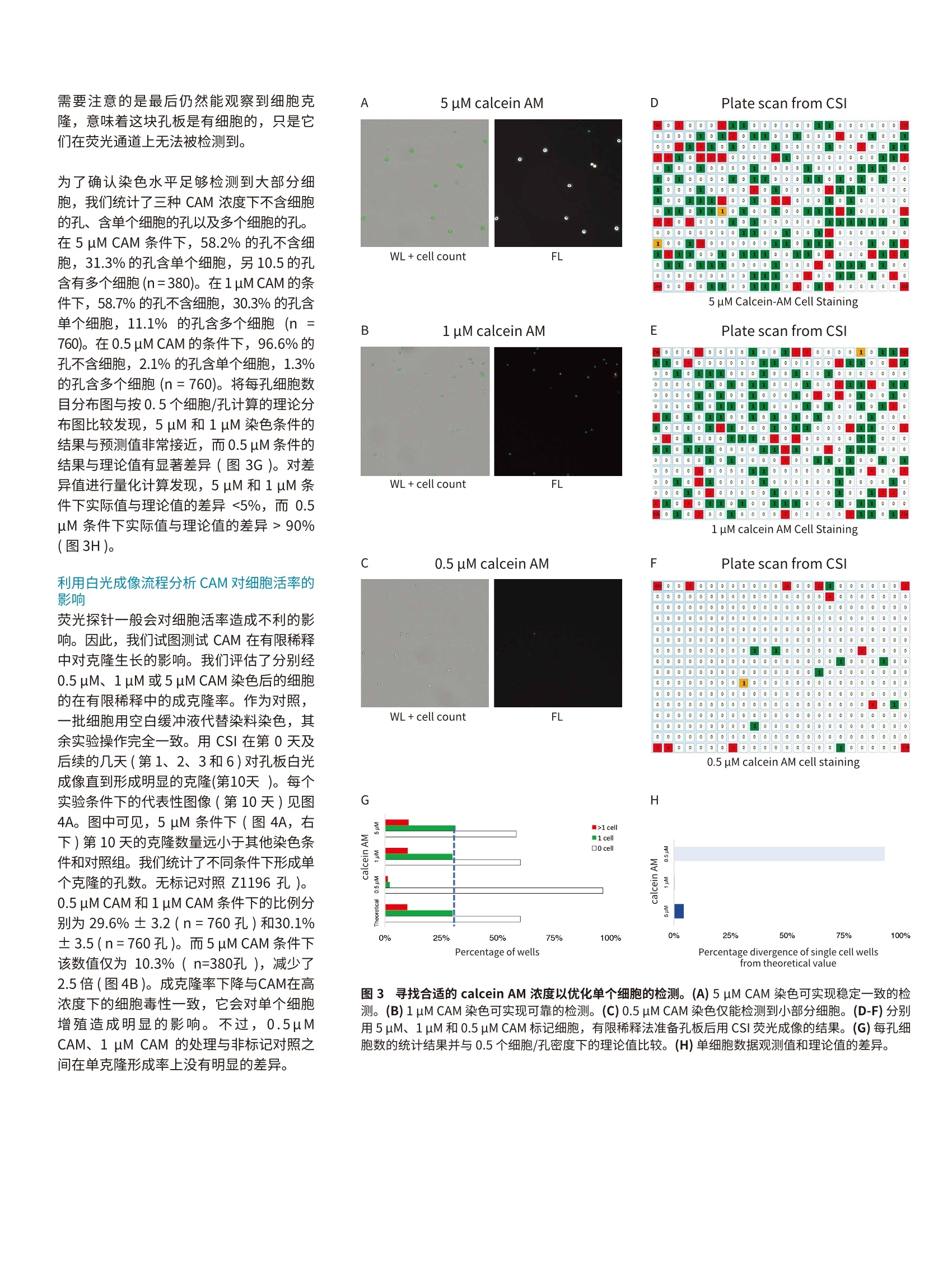
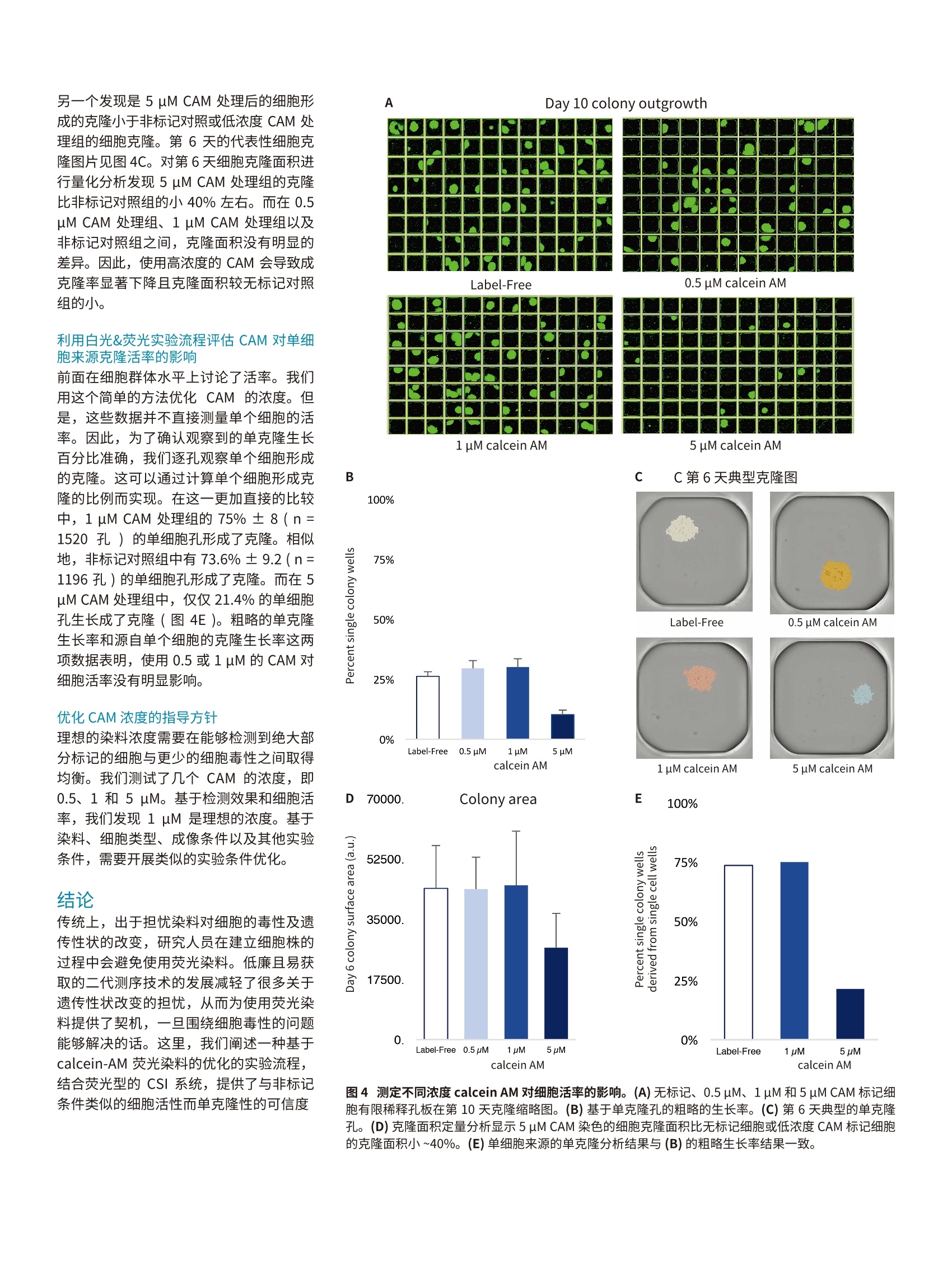
无标记单克隆验证实验流程荧光单克隆验证实验流程 Day 10 colony outgrowthA香港 APPLICATION NOTE 基于 calcein AM 的荧光成像提升单克隆性可信度 Sarmad Al-Bassam,PhD|Applications ScientistMolecular Devices 引言 细胞株开发对于生物药物(如单克隆抗体)的生产至关重要。为了建立细胞株,单个细胞被接种至孔板,随后增殖形成克隆,评估其表达水平后进一步放大。将单个细胞接种至多孔板的仪器有流式细胞仪和单细胞分离设备。而更传统的获得单细胞孔的方法是有限稀释。在这个方法中,梯度稀释产生单个细胞的孔,并伴随着一定概率的空孔和多细胞孔。 单克隆性评估对于细胞株开发非常关键,单克隆性证据是生物药物获得监管机构批准上市所必需的。目前被广泛接受的方法是第0天利用透射白光(明场)成像目视检查整孔以确认存在单个细胞。但是,第0天确切的鉴定单个细胞并不是没有挑战,比如细胞碎片和杂质可能会被误认为细胞。因此,研究人员一般在克隆形成后再评估并追溯至起始的细胞以确认单克隆性。 另一种可供选择的单克隆性验证方法是细胞接种前引入荧光标记。在本文中我们概述了白光成像实验流程与白光加荧光成像实验流程的差别。我们主要关注荧光染料的优势如单细胞的自动识别并提升单克隆性可信度。传统的荧光技术(如GFP表达体系)具有更多的优势,但因为实验流程相似故不在本文中详细讨论。不过,在基于荧光蛋白的实验流程中,评估成像设备的灵敏度很重要,因为染料一般会比荧光蛋白的信号强很多。本应用案例中,我们采用了活细胞荧光染料 calcein AM (CAM),这是一种进入活细胞后会发出绿色荧光的分子。我们建立了一种基本的实验方法,实现对单个细胞的可靠检测并维持高的活率。 材料和方法 有限稀释前对细胞标记 calcein AM 染料为了开发一个可行的细胞染色方法,我们使用了 EarlyToxTM Cell Viability AssayKit (Molecular Devices,货号R8343)。这个试剂包含有 calcein AM (CAM),,一一种可穿膜的分子,用于标记细胞活率。一日CAM进入细胞膜, AM 部分会被细胞质里酯酶水解下来,从而产生发出绿色荧光的钙黄绿素(calcein)分子。钙黄绿素在细胞质内的停留是暂时的,因为活细胞会在几小时内逐渐排出这些分子。 标记细胞并准备有限稀释 取 CHO-K1细胞 (ATCC) 用于有限稀释。CHO-K1细胞贴壁生长于35mm圆皿至汇合度达到50-75%。标记前用PBS 洗两遍细胞,然后用含有 calcein AM 的无血清培养基37℃孵育细胞40分钟。用PBS洗三遍细胞,然后用胰酶消化细胞准备计数。为了消除聚团,细胞样品用 40 um的过滤器( Corning,货号431750)过滤,随后计数(Countess, ThermoFisher Scientific)。细胞按1×106个/ml的密度重悬浮于含10% FBS 的培养基中,随后逐步稀释至0.5个细胞/孔的密度并接种至384孔板(Greiner,货号781182)。 优势 ( ·轻松检测单个细胞并自动分析图像数据,可在第0天自动确认单克隆性; ) ( 利 用活细胞荧光染料 calcein-AM确认单克隆性; ) ( 维持细胞克隆生长的高活率; ) CloneSelect Imager (CSI) 白光成像和荧 光成像 用荧光型 CSI对孔板成像。细胞接种30分钟后再成像以保证细胞沉降至孔底部。用白光加荧光成像模式对孔板成像。荧光图像采集使用300 ms 的曝光时间。含1000个细胞的阳性对照孔用于优化聚焦高度。采集后使用自动计数功能对细胞自动计数。随后用白光成像模式对孔板成像,时间点分别为第0、1、2、3、6和10天。 计算活率 为了计算粗略的成活率,在第10天统计单克隆的孔并计算其占全部孔的百分比。随后逐孔对含有单克隆的孔进行评估确认其第0天存在单个细胞以计算克隆成率(单个细胞形成克隆的百分比)。 仪器概览和工作流程 确认单细胞来源对于细胞株开发和监管审批都非常关键。两种成像策略可用于确认细胞株是否源于单个细胞。第一种是采用无标记的策略,第二种是采用荧光成像以确认细胞的策略。两种策略都需要一系列图像采集分析和报告。 无标记策略评估单克隆性 按0.5个细胞/孔的密度接种的标准有限稀释法理论上可产生30%含单个细胞的孔,不过在第0天找出这些单细胞的孔比较困难。碎片和杂质会被误认为细胞,使得细胞鉴别较为主观且容易出错。因此需要对孔板在一段时间内多次白光成像(从第0天开始),监测细胞生长成克隆的过程(图1,左列)。一旦克隆形成(通常需要6-10天),实验人员可以追溯至第0天以确认是否源自单个细胞。这个分析过程比较耗时,不过 CSI的 Loci Count功能可以通过自动检测单克隆(黄框)和关联不同时间点的图像帮助提升分析效率。另外, ReportGenerator 功能可以标记细胞区域(图1中的绿框)和杂质区域,最后导出单克隆报告可直接提交至监管机构。形成单个细胞克隆的孔在被确认源自单个细胞后被认定为单克隆,可开展进一步评估产量和放大等后续工作。 第2天 第1天 第0天 荧光标记策略评估单克隆性 评估单克隆性的另一种策略是利用荧光,这是一种可以获得高信噪比的强有力生物学工具(图1,右侧)。一种方法是采用荧光染料标记目标细胞。随后采用有限稀释接种染色的细胞至微孔板。采用荧光型的CSI 获得高分辨的荧光和白光图像。荧光成像的一个优势是可以在接种当天(即第0天)分析单克隆性。与之相对地,白光策略一般需要到克隆形成后(一般需要6-10天)才能分析单克隆性。采用荧光还可以实现准确地细胞计数,从而将繁杂的操作自动化(图2)。最后,因为只有活细胞才会被染色,所以可以消除死细胞、碎片或杂质的干扰。同步的白光成像可以进一步确认荧光检测到的为真实细胞。 荧光成像可实现自动细胞计数以确认单克 隆检测染色细胞的荧光信号可以实现客观的、可重复的自动检测和计数细胞。含单个细胞的孔被标记为绿色,而含有多个细胞的孔被标记为红色。基于预先设定的轴比值,分裂细胞的孔会被标记为黄色,而空白的孔会被标记为白色。每种分类的典型图片见图2B-E。 结果确认荧光策略更优的 Calcein-AM 浓度 确保细胞被充分地标记以己 CSI 荧光成像是标记过程中的一个关键参数。理想的标记条件是可重复的低浓度足以标记全部或绝大部分细胞而又不造成细胞毒性以免影响细胞增殖形成克隆的过程。 在一致的染色条件下比较了三种 CAM 浓度,分别是是浓度5uM, 中浓度1uM和低浓Z个细胞进行染色以确认方法有效。我们采用荧光加白光对这些孔进行扫描,曝光条件保持一致。o一些代表性的图像见图3A、B和C。图中可见,大部分细胞在5uM(图3A)和1uM CAM(图3B)浓度下可被检测到,而在0.5 uM CAM (图3C)下则不行。随后我们开展有限稀释,按0.5个细胞/孔的密度将染色细胞接种至孔板,并对孔板进行荧光&白光成像。基于荧光图像的细胞计数自动计算每个孔内的细胞数,结果见图3D-F。如图所示, 5uM和1uM CAM浓度下有限稀释产生了相似的细胞分布(图3D-E)。而 0.5 uM CAM 浓度下只有少数的孔含有单个或多个个胞(图3F)。这一结果与之前的观察一致,即0.5 uM的 CAM 无法使大部分细胞带上足够 CSI 检测的荧光染料。 ACSI 白光成像加荧光成像 1 cell >1 cell B含单个细胞的孔 C含多个细胞的孔 单克隆 非单克隆 D含分裂细胞的孔 E不含细胞的孔 非单克隆 非单克降 Artifact region 图2:荧光成像可实现自动化的细胞计数和定位。采用荧光型 CSI 系统开展荧光成像,最后结果用不同颜色展示(A)。空白孔显示为白色,单细胞的孔显示为绿色,不对称或正在分裂细胞的孔显示为黄色,多个细胞的孔为红色。单细胞(B)、多细胞(C)、不对称或正在分裂细胞(D)以及空的孔的全孔和局部放大图。注意,空孔中有白光下不容易辨别的结构,但是荧光下没有信号,因此在荧光图像的自动分析中被排除。 需要注意的是最后仍然能观察到细胞克隆,意味着这块孔板是有细胞的,只是它们在荧光通道上无法被检测到。 为了确认染色水平足够检测到大部分细 胞,我们统计了三种 CAM 浓度下不含细胞的孔、含单个细胞的孔以及多个细胞的孔。在 5 uM CAM 条件下,58.2%的孔不含细胞,31.3%的孔含单个细胞,另10.5的孔含有多个细胞(n=380)。在1uM CAM 的条件下,58.7%的孔不含细胞,30.3%的孔含单个细胞,11.1%的孔含多个细胞(n =760)。在0.5uM CAM 的条件下,96.6%的孔不含细胞,2.1%的孔含单个细胞,1.3%的孔含多个细胞(n=760)。将每孔细胞数目分布图与按0.5个细胞/孔计算的理论分布图比较发现,5 uM 和1uM染色条件的结果与预测值非常接近,而0.5 uM条件的结果与理论值有显著差异(图3G)。对差异值进行量化计算发现,5uM 和1pM条件下实际值与理论值的差异<5%,而0.5uM条件下实际值与理论值的差异>90%(图3H)。 利用白光成像流程分析 CAM 对细胞活率的影响 荧光探针一般会对细胞活率造成不利的影响。因此,我们试图测试 CAM 在有限稀释中对克隆生长的影响。我们评估了分别经0.5 uM、1 uM或 5 uM CAM 染色后的细胞的在有限稀释中的成克隆率。作为对照,一批细胞用空白缓冲液代替染料染色,其余实验操作完全一致。用 CSI 在第0天及后续的几天(第1、2、3和6)对孔板白光成像直到形成明显的克克(第10天)。每个实验条件下的代表性图像(第10天)见图4A。图中可见, 5uM条件下(图4A,右下)第10天的克隆数量远小于其他染色条件和对照组。我们统计了不同条件下形成单个克隆的孔数。无标记对照Z1196 孔)。0.5 uM CAM 和 1 uM CAM 条件下的比例分别为29.6%±3.2(n=760孔)和30.1%±3.5(n=760孔)。而5 uM CAM条件下该数值仅为10.3%(n=380孔), 减少了2.5倍(图4B)。成克隆率下降与CAM在高浓度下的细胞毒性一致,它会对单个细胞增殖造成明显的影响。不过,0.5uMCAM、1 uM CAM 的处理与非标记对照之间在单克隆形成率上没有明显的差异。 A 5 uM calcein AM Percentage of wells 图3寻找合适的 calcein AM 浓度以优化单个细胞的检测。(A) 5 uM CAM 染色可实现稳定一致的检测。(B) 1 uM CAM 染色可实现可靠的检测。(C)0.5 uM CAM 染色仅能检测到小部分细胞。(D-F)分别用5uM、1uM和0.5 uM CAM标记细胞, 有限稀释法准备孔板后用 CSI荧光成像的结果。(G)每孔细胞数的统计结果并与0.5个细胞/孔密度下的理论值比较。(H)单细胞数据观测值和理论值的差异。 D Plate scan from CSI Percentage divergence of single cell wells from theoretical value 另一个发现是5 uM CAM 处理后的细胞形成的克隆小于非标记对照或低浓度 CAM 处理组的细胞克隆。第6天的代表性细胞克隆图片见图4C。对第6天细胞克隆面积进行量化分析发现 5 uM CAM 处理组的克隆比非标记对照组的小40%左右。而在0.5uM CAM 处理组、1 uM CAM 处理组以及非标记对照组之间,克隆面积没有明显的差异。因此,使用高浓度的 CAM 会导致成克隆率显著下降且克隆面积较无标记对照组的小。 利用白光&荧光实验流程评估 CAM 对单细胞来源克隆活率的影响 前面在细胞群体水平上讨论了活率。我们用这个简单的方法优化 CAM的浓度。但是,这些数据并不直接测量单个细胞的活率。因此,为了确认观察到的单克隆生长百分比准确,我们逐孔观察单个细胞形成的克隆。这可以通过计算单个细胞形成克隆的比例而实现。在这一更加直接的比较中,1 uM CAM 处理组的75%±8(n=1520孔)的单细胞孔形成了克隆。相似地,非标记对照组中有73.6%±9.2(n=1196孔)的单细胞孔形成了克隆。而在 5uM CAM 处理组中,仅仅21.4%的单细胞孔生长成了克隆(图4E)。粗略的单克隆生长率和源自单个细胞的克隆生长率这两项数据表明,使用0.5或1 uM 的 CAM对细胞活率没有明显影响。 优化 CAM 浓度的指导方针 理想的染料浓度需要在能够检测到绝大部分标记的细胞与更少的细胞毒性之间取得均衡。我们测试了几个 CAM 的浓度,即0.5、1和5uM。基于检测效果和细胞活率,我们发现1uM 是理想的浓度。基于染料、细胞类型、成像条件以及其他实验条件,需要开展类似的实验条件优化。 结论 传统上,出于担忧染料对细胞的毒性及遗传性状的改变,研究人员在建立细胞株的过程中会避免使用荧光染料。低廉且易获取的二代测序技术的发展减轻了很多关于遗传性状改变的担忧,从而为使用荧光染料提供了契机,,一旦围绕细胞毒性的问题能够解决的话。这里,我们阐述一种基于calcein-AM 荧光染料的优化的实验流程,结合荧光型的 CSI 系统,提供了与非标记条件类似的细胞活性而单克隆性的可信度 Label-Free 0.5 uM calcein AM 5 uM calcein AM C C第6天典型克隆图 Label-Free 0.5 uM calcein AM 1 uM calcein AM 5 uM calcein AM E 100% 75%oo口 35000. 50% 17500. 25% O. 0% Label-Free 0.5 pM 1 pM 5pM Label-Free 1 pM 5pM calcein AM calcein AM 图4测定不同浓度 calcein AM 对细胞活率的影响。(A)无标记、0.5 uM、1uM和5 uM CAM标记示胞有限稀释孔板在第10天克隆缩略图。(B)基于单克隆孔的粗略的生长率。(C)第6天典型的单克隆孔。(D)克隆面积定量分析显示5 pM CAM 染色的细胞克隆面积比无标记细胞或低浓度 CAM标记细胞的克隆面积小~40%。(E)单细胞来源的单克隆分析结果与(B)的粗略生长率结果一致。 更高。在这个实验流程中,我们发现1uMCAM 是理想浓度,既能在 CSI上检测到单个细胞而又不造成细胞毒性。 在验证单克隆性上引入荧光成像的优势是它可以实现自动检测单个细胞,从而显著减少人工鉴别单个细胞的时间。单克隆性分析可以在第0天开展,从而更早地提供单克隆性信息。当然,如同所有的方法,引入荧光信号也存在一些不足。比如,很显然,它需要一些额外的样品准备操作,也需要根据不同的实验条件(细胞类型、成像条件、培养基等)优化合适的染料浓度。孔板的荧光成像也较白光成像慢,这在高通量实验中需要考虑进去。白光成像还是荧光成像哪个更适合,这取决于个人的实验流程。表1总结了两种实验流程间的一些关键差异,可帮助在这两种实验流程中做出选择。荧光型的 CSI 系统可以满足各种实验流程。 白光成像 荧光成像 何时确认单克隆性? 实验流程后期(通常为第6到第10天) 实验流程开始时(第0天) 如何确认单克隆性 软件在第10天检测克隆,然后人工回溯至第0天目视检查确认单个细胞 软件在第0天自动检测单个细胞, 然后人工复核确认。 自动检测单细胞的准确性 低-中准确性,受孔板类型、细胞类型等影响 高准确性 样品准备的操作 少 考虑的因素 实验优化 不需要 需要基于细胞类型、孵育时间和检测系统灵敏度等优化染料浓度 采集一块96孔板所需时间 CloneSelect Imager 需90秒 CloneSelect Imager 白光加荧光成像需12分钟 浏览图像确认单细胞所需时间 几小时到几天 较少,软件可自动检测单细胞 ( 全国咨询服务热线:400-820-3586 www.MolecularDevices.com.cn Email: info.china@moldev.com ) ( 上海 电 话:86-21-33721088 传真:8 6 -21-33721066 地址:上海市长宁区福泉北路518号1座501室200335 ) ( 北京 电话:8 6 -10-64108669 传真:86-10-64108601 地址:北京市朝阳区广渠东路3号中水电国际大厦612&613室10 0 124成都 电话:8 6 -28-65588820 传真:8 6 -28-65588831 地址:成都市锦江区东御街18号百扬大厦2208室610016 台北 电话:8 8 6-2- 2 6567585 传真:8 8 6-2-28948267 地址:台北市内湖区堤顶大道二段89号3楼 ) ( 传真:852-22895385 地址:香港中环皇后大道中15号置地广场公爵大厦21楼 ) 细胞株开发对于生物药物 ( 如单克隆抗体 )的生产至关重要。为了建立细胞株,单个细胞被接种至孔板,随后增殖形成克隆,评估其表达水平后进一步放大。将单个细胞接种至多孔板的仪器有流式细胞仪和单细胞分离设备。而更传统的获得单细胞孔的方法是有限稀释。在这个方法中,梯度稀释产生单个细胞的孔,并伴随着一定概率的空孔和多细胞孔。
确定




还剩4页未读,是否继续阅读?
美谷分子仪器(上海)有限公司为您提供《细胞中细胞株开发检测方案(微生物检测)》,该方案主要用于其他中细胞株开发检测,参考标准--,《细胞中细胞株开发检测方案(微生物检测)》用到的仪器有细胞生长分析系统 CloneSelect Imager
推荐专场
相关方案
更多
该厂商其他方案
更多














