在二氧化钛富集结合强阳离子交换分级的技术路线中,
SCX 分级的梯度还值得进一步优化,对于这种组分较少
的预分级方法,阶梯洗脱会是一个更好的选择。这种大规
模的磷酸化肽段富集方法对样品的起始量要求比较高,如
果样品较少的话,建议采用二氧化钛富集结合强阳离子交
换的策略,一般 2 mg 起始蛋白就能得到较多的磷酸化位
点鉴定。ThermoFisher 也提供了商业化的 IMAC 试剂盒
(Cat # 88300),鉴于 IMAC 和 TiO2 对磷酸化肽段富集
有着较好的互补性,这两者联用会对磷酸化蛋白质组的深
度覆盖达到更好的效果。
方案详情

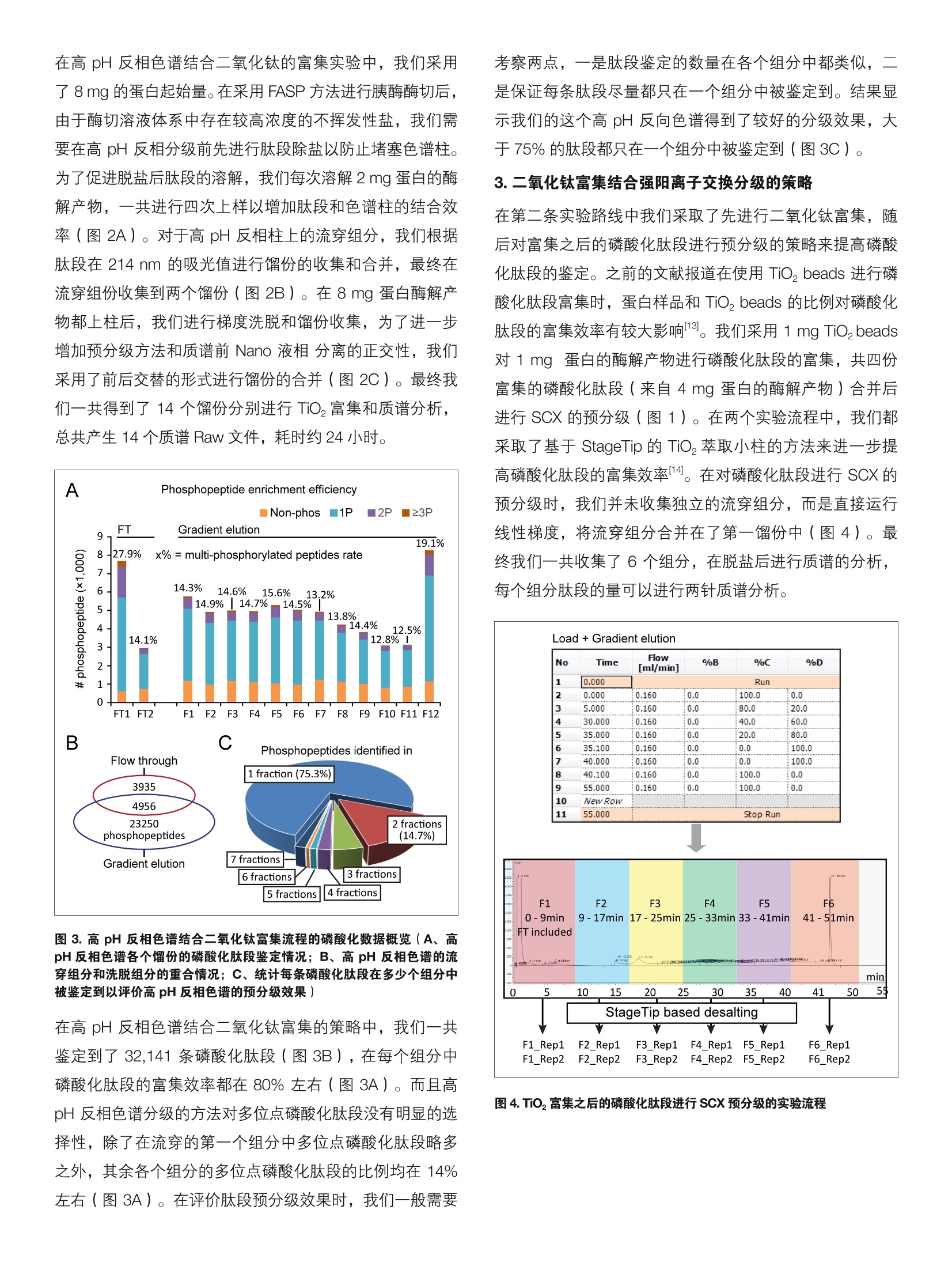
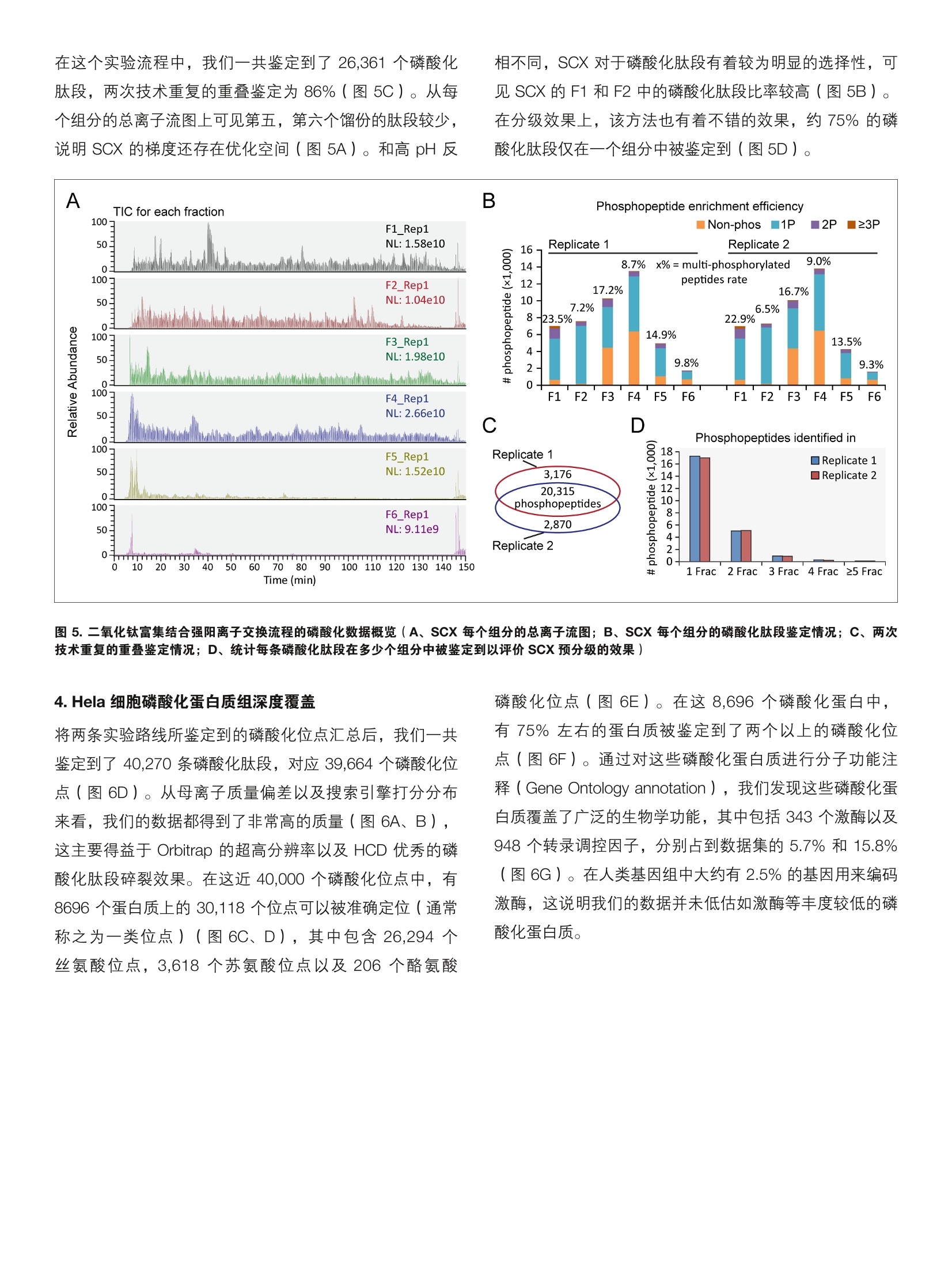
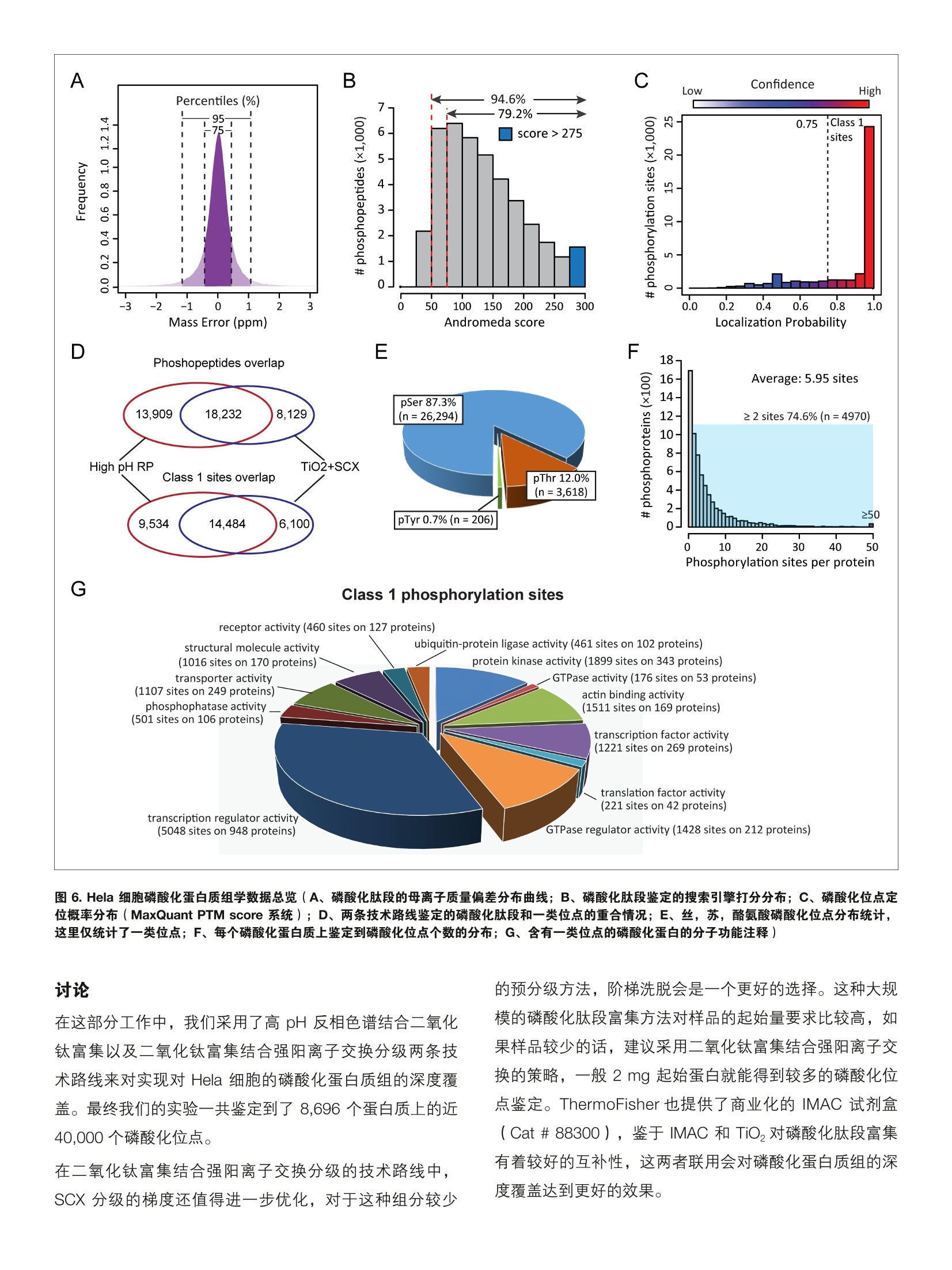
thermoscientific 基于二氧化钛富集策略的人类磷酸化蛋白质组大规模鉴定 关键词:磷酸化蛋白质组,深度鉴定,二氧化钛 前言 蛋白质磷酸化是一种非常重要的翻译后修饰,其在细胞周期、细胞增殖分化、代谢和凋亡等各个生物学过程中都起到了重要的调控作用。在真核生物中,约有1/3的蛋白质处于其磷酸化状态,不同的蛋白质其磷酸化水平差异很大,从低于1%到高达90%不等。 磷酸化蛋白质组学面临着诸多技术挑战,如:磷酸化蛋白质丰度较低且动态范围大,磷酸化肽段的离子化效率相对偏低,磷酸修饰基团的具体位置难以确定,等等。在目前的磷酸化蛋白质组学研究中,通常都需要在质谱分析前对样品中的磷酸化肽段进行富集,以消除非修饰肽段对于磷酸化肽段的鉴定抑制2。磷酸化肽段的富集方法主要包括固定化金属亲和色谱(Immobilized Metal AffinityChromatography,IMAC)3,二氧化钛 ( Titanium dioxide,TiO,)④以及基于抗体的富集方法5。其中二氧化钛方法有着富集效率高,简单易操作的优势,从而成为了目前最广泛使用的富集方法。为了进一步增加磷酸化位点的鉴定深度,通常需要对磷酸化肽段进行预分级,包括采用离子交换色谱6,高pH反相色谱7,亲水相互作用色谱谱,以及 TiO,富次富集等方法。在这部分工作中,我们采用TiO,富集结合多种肽段预分级的策略,通过 Orbitrap 采集 HCD 产生的二级碎片离子,并最终使用 MaxQuant 的PTM score 系统进行磷酸化位点的确认,从而得到了高达40,000个位点的 Hela 细胞磷酸化蛋白质组深度覆盖。 实验方法 1.样品处理 Hela 细胞用 SDT 裂解液裂解,并用 FASP 方法酶解1。TiO,富集磷酸化肽段的方法参考文献。肽段高 pH 反相色谱预分级的方法参考文献。磷酸化肽段 SCX 分级的方法参考文献1。 2.色谱条件 ( 高效液相色谱仪: Easy n L C 1200 ( Ther m oFisher Scientific ) 分析柱:自制Cg纳升升喷针柱,长度20cm, 内径75um,粒径3 um ) ( 流动办:A,0.1%甲酸/水;B, 0.1%甲酸/80%乙腈梯度:0-2 min, 4 -8% B; 2-77 min, 8-28%B; 77-90 min, 2 8-40% B; 9 0-92 min, 40-99%B; ) ( 92-100 min,99%B。 ) ( 流速:300 nL/min ) 3.质谱采集方法 质谱仪: Orbitrap Fusion Lumos (ThermoFisher Scientific) 离子源: NanoFlex;离子模式:正离子;喷雾电压:1.9Kv;离子传输管温度: 300度; S-lens RF: 30%分辨率:一级120K,二级30 K; AGC:一级4e5,二级5e4;MaxlT:一级20ms, 二级100 ms; 碰撞能量:32% 实验结果 1.Tio,富集结合多种预分级方法的磷酸化蛋白质组学策略 图1. Hela 细胞磷酸化蛋白质组深度鉴定实验流程 2.高pH反相色谱结合二氧化钛的富集方法 图2.高pH反相色谱进行肽段预分级的实验方法(A、上样方法和梯度洗脱总览;B、上样后收集和合并流穿组组;C、梯度洗脱收集,合并各个馏份) 为了尽可能对 Hela细胞的磷酸化蛋白质组进行深度鉴定,我们设计了两条样品处理的实验路线。第一条是蛋白质酶解后,首先采用高 pH 反相色谱进行肽段的预分级,随后对每个组分的肽段进行 TiO,的富集。第二条路线是蛋白质酶解后首先进行磷酸化肽段的富集,随后对富集后的磷酸化肽段再进行强阳离子交换( Strong Cation Exchange,SCX)分级,最后每个组分分别进行质谱的检测(图1)。为了进一步减小低能碎裂带来的中性丢失的问题,我们在 Orbitrap Fusion Lumos 上采用 HCD 模式来进行磷酸化肽段的碎裂,并采用 Orbitrap 来进行高分辨的碎片离子采集。在数据分析上,目前对于磷酸化位点的定位判断主要有“A score”系统 21, MaxQuant 的“PTM score” 系统和 Proteome Discoverer 的“ptmRS”系统,在这里我们采用了 MaxQuant 来进行磷酸化位点的定位,因为其能对磷酸化肽段进行总结,直接以位点为目标进行结果输出。对于磷酸化蛋白质组学来说,提高初始样本量是增加位点鉴定的有效手段,在 high pH RP+ TiO,策略中我们取用了8 mg Hela 细胞提取蛋白进行实验,而在 TiO+ SCX 的流程中我们使用了4 mg 蛋白。 在高 pH 反相色谱结合二氧化钛的富集实验中,我们采用了8 mg的蛋白起始量。在采用 FASP 方法进行胰酶酶切后,由于酶切溶液体系中存在较高浓度的不挥发性盐,我们需要在高 pH 反相分级前先进行肽段除盐以防止堵塞色谱柱。为了促进脱盐后肽段的溶解,我们每次溶解2mg 蛋白的酶解产物,一共进行四次上样以增加肽段和色谱柱的结合效率(图2A)。对于高 pH 反相柱上的流穿组分,我们根据肽段在 214 nm 的吸光值进行馏份的收集和合并,最终在流穿组份收集到两个馏份(图2B)。在8 mg 蛋白酶解产物都上柱后,我们进行梯度洗脱和馏份收集,为了进一步增加预分级方法和质谱前 Nano 液相分离的正交性,我们采用了前后交替的形式进行馏份的合并(图2C)。最终我们一共得到了14个馏份分别进行 TiO,富集和质谱分析,总共产生14个质谱 Raw 文件,耗时约24小时。 A Phosphopeptide enrichment efficiency B C 图3.高 pH反相色谱结合二氧化钛富集流程的磷酸化数据概览(A、高pH 反相色谱各个馏份的磷酸化肽段鉴定情况;B、高 pH 反相色谱的流穿组分和洗脱组分的重合情况;C、统计每条磷酸化肽段在多少个组分中被鉴定到以评价高pH反相色谱的预分级效果) 在高 pH反相色谱结合二氧化钛富集的策略中,我们一共鉴定到了32,141条磷酸化肽段(图3B),在每个组分中磷酸化肽段的富集效率都在80%左右(图3A)。而且高pH 反相色谱分级的方法对多位点磷酸化肽段没有明显的选择性,除了在流穿的第一个组分中多位点磷酸化肽段略多之外,其余各个组分的多位点磷酸化肽段的比例均在14%左右(图3A)。在评价肽段预分级效果时,我们一般需要 考察两点,一是肽段鉴定的数量在各个组分中都类似,,二是保证每条肽段尽量都只在一个组分中被鉴定到。结果显示我们的这个高 pH反向色谱得到了较好的分级效果,大于75%的肽段都只在一个组分中被鉴定到(图3C)。 3.二氧化钛富集结合强阳离子交换分级的策略 在第二条实验路线中我们采取了先进行二氧化钛富集,随后对富集之后的磷酸化肽段进行预分级的策略来提高磷酸化肽段的鉴定。之前的文献报道在使用 TiO, beads 进行磷酸化肽段富集时,蛋白样品和 TiO, beads 的比例对磷酸化肽段的富集效率有较大影响13。我们采用1 mg TiO,beads对1mg 蛋白的酶解产物进行磷酸化肽段的富集,共四份富集的磷酸化肽段(来自4mg 蛋白的酶解产物)合并后进行 SCX 的预分级(图1)。在两个实验流程中,我们都采取了基于 StageTip 的 TiO,萃取小柱的方法来进一步提高磷酸化肽段的富集效率114。在对磷酸化肽段进行 SCX 的预分级时,我们并未收集独立的流穿组分,而是直接运行线性梯度,将流穿组分合并在了第一馏份中(图4)。最终我们一共收集了6个组分,在脱盐后进行质谱的分析,每个组分肽段的量可以进行两针质谱分析。 Load +Gradient elution Flow[ml/min] %B 9oC %D 1 0.000 Run 2 0.000 0.160 0.0 100.0 0.0 3 5.000 0.160 0.0 80.0 20.0 4 30.000 0.160 0.0 40.0 60.0 5 35.000 0.160 0.0 20.0 80.0 6 35.100 0.160 0.0 0.0 100.0 7 40.000 0.160 0.0 0.0 100.0 8 40.100 0.160 0.0 100.0 0.0 9 55.000 0.160 0.0 100.0 0.0 10 New Row 11 55.000 Stop Run 图4.TiO,富集之后的磷酸化肽段进行 SCX 预级级的实验流程 在这个实验流程中,我们一共鉴定到了 26,361个磷酸化肽段,两次技术重复的重叠鉴定为86%(图5C)。从每个组分的总离子流图上可见第五,第六个馏份的肽段较少,说明 SCX的梯度还存在优化空间(图5A)。和高 pH反 相不同, SCX 对于磷酸化肽段有着较为明显的选择性,,可见 SCX的 F1 和F2中的磷酸化肽段比率较高(图5B)。在分级效果上,该方法也有着不错的效果,约75%的磷酸化肽段仅在一个组分中被鉴定到(图5D)。 图5.二氧化钛富集结合强阳离子交换流程的磷酸化数据概览(A、SCX每个组分的总离子流图; B、SCX 每个组分的磷酸化肽段鉴定情况;C、两次技术重复的重叠鉴定情况;D、统计每条磷酸化肽段在多少个组分中被鉴定到以评价 SCX 预分级的效果) 4. Hela 细胞磷酸化蛋白质组深度覆盖 将两条实验路线所鉴定到的磷酸化位点汇总后,我们一共鉴定到了 40,270条磷酸化肽段,对应39,664个磷酸化位点(图6D)。从母离子质量偏差以及搜索引擎打分分布来看,我们的数据都得到了非常高的质量(图6A、B),这主要得益于Orbitrap 的超高分辨率以及 HCD 优秀的磷酸化肽段碎裂效果。在这近 40,000个磷酸化位点中,有8696个蛋白质上的30,118个位点可以被准确定位(通常称之为一类位点)(图6C、D),其中包含26,294个丝氨酸位点,3,618个苏氨酸位点以及206个酪氨酸 磷酸化位点(图6E)。在这 8,696个磷酸化蛋白中,有75%左右的蛋白质被鉴定到了两个以上的磷酸化位点(图6F)。通过对这些磷酸化蛋白质进行分子功能注释( Gene Ontology annotation), 我们发现这些磷酸化蛋白质覆盖了广泛的生物学功能,其中包括343个激酶以及948个转录调控因子,分别占到数据集的5.7%和15.8%(图6G)。在人类基因组中大约有2.5%的基因用来编码激酶,这说明我们的数据并未低估如激酶等丰度较低的磷酸化蛋白质。 A B C Confidence Low High G Class 1 phosphorylation sites receptor activity (460 sites on 127 proteins) 图 6. Hela 细胞磷酸化蛋白质组学数据总览(A、磷酸化肽段的母离子质量偏差分布曲线;B、磷酸化肽段鉴定的搜索引擎打分分布;C、磷酸化位点定位概率分布(MaxQuant PTM score 系统);D、两条技术路线鉴定的磷酸化肽段和一类位点的重合情况;E、丝,苏,酪氨酸磷酸化位点分布统计,这里仅统计了一类位点;F、每个磷酸化蛋白质上鉴定到磷酸化位点个数的分布; G、含有一类位点的磷酸化蛋白的分子功能注释) 讨论 在这部分工作中,我们采用了高 pH 反相色谱结合二氧化钛富集以及二氧化钛富集结合强阳离子交换分级两条技术路线来对实现对Hela 胞胞的磷酸化蛋白质组的深度覆盖。最终我们的实验一共鉴定到了8,696个蛋白质上的近40,000个磷酸化位点。 在二氧化钛富集结合强阳离子交换分级的技术路线中,SCX 分级的梯度还值得进一步优化,对于这种组分较少 的预分级方法,阶梯洗脱会是一个更好的选择。这种大规模的磷酸化肽段富集方法对样品的起始量要求比较高,如果样品较少的话,建议采用二氧化钛富集结合强阳离子交换的策略,一般2 mg 起始蛋白就能得到较多的磷酸化位点鉴定。ThermoFisher 也提供了商业化的 IMAC 试剂盒(Cat # 88300), 鉴于 IMAC 和 TiO,对磷酸化肽段富集有着较好的互补性,这两者联用会对磷酸化蛋白质组的深度覆盖达到更好的效果。 ( 参考文献 ) ( 1. Cohen, P ., The o rigins of protein phosphorylation. N atCell Biol, 2002.4(5):p. E127-30. ) ( 2. Oda, Y., T. Nagasu, a nd B.T . Chait, E nrichment analysisof phosphorylated proteins a s a tool for probing thephosphoproteome. Nat Biotechnol, 2 001. 1 9 (4): p.379- 82. ) ( 3. Posewitz, M .C. and P.Tempst, Im m obilized gallium(III)affinity chromatography of phosphopeptides. A nalChem, 1999.71(14): p.2883-92. ) ( 4. Larsen, M .R., e t a l ., H ighly selective enrichment ofphosphorylated peptides from peptide mixtures using titanium dioxide microcolumns. M ol Cell Proteomics, 2005.4(7): p. 873-86. ) ( 5. Carretero, J ., et al., Integrative genomic and p r oteomicanalyses identify t argets for L kb1-deficient m e tastaticlung tumors. Cancer Cell, 2010. 1 7 (6): p. 5 47-59. ) ( 6. Olsen, J . V., e t al., Global, in vivo, and site-specificphosphorylation d y namics in si g naling ne t works. Cel l ,2006. 127(3): p. 635-48. ) ( 7. Batth, T.S., C. Francavilla, and J.V. Olsen, Off-linehigh-pH r eversed-phase f r actionation for in-depthphosphoproteomics. J Proteome Res, 2014. 13( 1 2): p. 6176-86. ) ( 8. McNulty, D.E. and R.S. Annan, H y drophilic interaction chromatography reduces the c o mplexity of the phosphoproteome and improves global phosphopeptideisolation and detection. Mol Cell Proteomics, 2 008.7(5): p. 971-80. ) 9. Zanivan, S., et al., Solid tumor proteome andphosphoproteome analysis by high resolution massspectrometry. J Proteome Res, 2008. 7(12): p. 5314-26. 10. Wisniewski, J.R., et al., Brain phosphoproteomeobtained by a FASP-based method reveals plasmamembrane protein topology. J Proteome Res, 2010.9(6): p. 3280-9. 11. Li, Q.R., et al., Complementary workflow for globalphosphoproteome analysis. Electrophoresis, 2012.33(22): p.3291-8. 12. Beausoleil, S.A., et al., A probability-based approachfor high-throughput protein phosphorylation analysisand site localization. Nat Biotechnol, 2006. 24(10): p.1285-92. 13. Li, Q.R., et al., Effect of peptide-to-TiO2 beads ratio onphosphopeptide enrichment selectivity. J ProteomeRes, 2009.8(11): p.5375-81. ( 14. Rappsilber, J., M . Mann, and Y. Ishihama, P rotocol formicro-purification, enrichment, p r e-fractionation a n dstorage o f p eptides for proteomics using St a geTips.Nat Protoc, 2007.2(8): p. 1896-906. ) A Thermo Fisher Scientific Brand S CIENTIFIC 支持手机用户) 蛋白质磷酸化是一种非常重要的翻译后修饰,其在细胞周期、细胞增殖分化、代谢和凋亡等各个生物学过程中都起到了重要的调控作用。在真核生物中,约有 1/3 的蛋白质处于其磷酸化状态,不同的蛋白质其磷酸化水平差异很大,从低于 1% 到高达 90% 不等[1]。磷酸化蛋白质组学面临着诸多技术挑战,如:磷酸化蛋白质丰度较低且动态范围大,磷酸化肽段的离子化效率相对偏低,磷酸修饰基团的具体位置难以确定,等等。在目前的磷酸化蛋白质组学研究中,通常都需要在质谱分析前对样品中的磷酸化肽段进行富集,以消除非修饰肽段对于磷酸化肽段的鉴定抑制[2]。磷酸化肽段的富集方法主要包括固定化金属亲和色谱(Immobilized Metal AffinityChromatography,IMAC)[3],二氧化钛(Titanium dioxide,TiO2)[4] 以及基于抗体的富集方法[5]。其中二氧化钛方法有着富集效率高,简单易操作的优势,从而成为了目前最广泛使用的富集方法。为了进一步增加磷酸化位点的鉴定深度,通常需要对磷酸化肽段进行预分级,包括采用离子交换色谱[6],高 pH 反相色谱[7],亲水相互作用色谱[8],以及 TiO2 多次富集[9] 等方法。在这部分工作中,我们采用TiO2 富集结合多种肽段预分级的策略,通过 Orbitrap 采集 HCD 产生的二级碎片离子,并最终使用MaxQuant 的PTM score 系统进行磷酸化位点的确认,从而得到了高达40,000 个位点的 Hela 细胞磷酸化蛋白质组深度覆盖。
确定



还剩4页未读,是否继续阅读?
赛默飞色谱与质谱为您提供《Hela 细胞中磷酸化蛋白质组学检测方案(制备液相色谱)》,该方案主要用于其他中磷酸化蛋白质组学检测,参考标准--,《Hela 细胞中磷酸化蛋白质组学检测方案(制备液相色谱)》用到的仪器有赛默飞UltiMate3000制备液相色谱
推荐专场
相关方案
更多
该厂商其他方案
更多
















