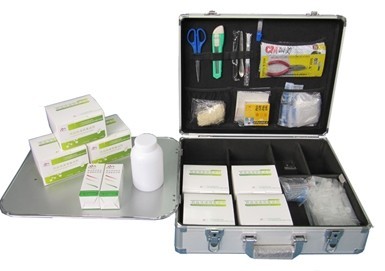
推荐厂家
暂无
暂无






2014年06月18日 发布 为适应机构改革和职能转变需要,进一步规范食品药品监督管理部门行使行政处罚权,建立统一有效的行政执法体系,在原国家食品药品监督管理局令第1号《药品监督行政处罚程序规定》的基础上,国家食品药品监督管理总局(以下简称总局)组织起草了《食品药品行政处罚程序规定》(以下简称《规定》)。 一、起草过程 起草工作从2013年7月开始。在充分调研执法过程中存在问题的基础上,总局借鉴《工商行政管理机关行政处罚程序规定》、《质量技术监督行政处罚程序规定》等相关规章,以原国家食品药品监督管理局令第1号《药品监督行政处罚程序规定》为蓝本,起草了《规定》初稿。经充分吸纳各方意见和建议、反复修改,形成本《规定》,并于2014年3月14日经总局局务会议审议通过。 二、基本框架 本《规定》共八章六十一条,基本框架如下: 第一章“总则”(共5条),包括目的和依据、适用范围、处罚原则、公民权利、处罚监督制度等。 第二章“管辖”(共11条),包括地域管辖、级别管辖、管辖权争议、指定管辖、移送管辖、移送司法、委托执法、协查义务、撤销许可证照的事权划分及程序等。 第三章“立案”(共3条),包括案件受理、立案条件、回避原则等。 第四章“调查取证”(共15条),包括调查取证的一般要求、笔录制作要求、证据的范围和要求、境外证据、证据保全、查封扣押、当事人不配合的处理、样品抽验、调查终结以及责令改正等。 第五章“处罚决定”(共10条),包括案件合议、行政处罚事先告知、听证程序、行政处罚的审批、重大、复杂案件集体讨论、行政处罚的作出、没收的程序等一般程序以及简易程序的适用范围、程序实施、案件备案等。 第六章“送达”(共4条),包括送达的一般要求、留置送达、代为送达、邮寄送达、公告送达等。 第七章“执行与结案”(共8条),包括行政处罚的执行、行政处罚的停止执行、罚款收缴要求、当场收缴罚款的一般原则及其例外、罚款的缴付、申请人民法院强制执行、行政处罚结案报告等。 第八章“附则”(共5条),包括名词解释、执法文书的印制、施行日期等。
为规范食品药品监督管理部门行使行政处罚权,保护公民、法人和其他组织的合法权益,近日,国家食品药品监督管理总局组织制定了《食品药品行政处罚程序规定》(以下简称《规定》)。《规定》于2014年3月14日经总局局务会议审议通过,4月28日以总局3号令发布,6月1日起施行。 《规定》共八章六十一条,将原来食品、药品和医疗器械、化妆品等行政处罚程序规定进行了整合,对管辖、立案、调查取证、处罚决定、送达、执行与结案等做出了明确规定。 为适应食品药品监管执法实际需要,《规定》将由食品药品监督管理部门监管的“四品一械”全部纳入适用范围,并对委托执法、授权执法等作了进一步规范。针对执法实践难题,对地方协查、立案前调查或检查取得证据的效力等作出了具体规定。将办案有关环节与相关法律法规要求对接,增加行刑衔接、境外证据要求以及当事人不配合行政执法的应对措施等内容。同时,结合办案实际,《规定》对先行登记保存物品处理、查封扣押财物处理、查封扣押补办批准手续程序、证据范围、责令改正的适用以及听证程序等内容进行了完善。 《规定》要求食品药品监督管理部门实施行政处罚遵循公开、公平、公正的原则,做到事实清楚、证据确凿、程序合法、法律法规规章适用准确适当、执法文书使用规范。食品药品监督管理部门要建立行政处罚监督制度,上级食品药品监督管理部门对下级食品药品监督管理部门作出的违法或者不适当的行政处罚决定,责令其限期改正;逾期不改正的,依法予以变更或者撤销。以下有一些食品霉菌毒素检测,过敏原检测的方法
国家食品药品监督管理总局近日组织制定《食品药品行政处罚程序规定》,将原来食品、药品和医疗器械、化妆品等行政处罚程序规定进行了整合,对管辖、立案、调查取证、处罚决定、送达、执行与结案等做了明确规定。该规定将于6月1日起施行。 为适应食品药品监管执法实际需要,《规定》将由食品药品监督管理部门监管的“四品一械”全部纳入适用范围,并对委托执法、授权执法等作了进一步规范;针对执法实践难题,对地方协查、立案前调查或检查取得证据的效力等作出了具体规定;将办案有关环节与相关法律法规要求对接,增加行刑衔接、境外证据要求以及当事人不配合行政执法的应对措施等。《规定》还对先行登记保存物品处理、查封扣押财物处理、查封扣押补办批准手续程序、证据范围、责令改正的适用以及听证程序等进行完善。

 400-860-5168转4750
400-860-5168转4750
 留言咨询
留言咨询

 400-860-5168转2758
400-860-5168转2758
 留言咨询
留言咨询
 400-831-3655
400-831-3655
 留言咨询
留言咨询