内毒素介导因子之IL-6蛋白质的特点
上一篇文章介绍了白细胞介素-6(interlenkin 6,1L-6)的产生和调节,这一篇文章介绍白细胞介素-6蛋白质的特点。从IL-6的cDNA序列中得知,IL-6蛋白有184个氨基酸残基,不同的实验室报道IL-6的相对分子质量不同,在19000~30000之间。小鼠IL-6缺乏糖化反应,人类IL-6相对分子质量不同是由于糖化的程度不同所致。在单核细胞和巨噬细胞的IL-6产物中,IL-6存在N-连接糖化和O-连接糖化反应,以及在不同的丝氨酸残基上发生磷酸化反应。人IL-6的未成熟前体由212个氨基酸残基组成,小鼠和大鼠的IL-6由211个氨基酸残基组成,牛的IL-6由210个氨基酸残基组成。其中一个典型信号肽经加工后被切除,变成184个氨基酸的成熟的IL-6蛋白。天然成熟的IL-6是单条肽链的糖蛋白,相对分子质量根据来源细胞不同而不同,这是由于翻译后经过加工所造成的。相对分子质量为23000~25000的IL-6无O-GalNAc型聚糖,而相对分子质量为28000~30000的IL-6存在N-GalNAc型聚糖和O-GalNAc型聚糖,天然IL-6有多处丝氨酸残基发生磷酸化,但是磷酸化程度在各种组织均不同。硫酸化修饰也很常见,多数在多聚糖的外链及酪氨酸残基侧链上,因此造成IL-6分子所带的电荷和相对分子质量均有不同。这种翻译后的修饰反应的生物学意义未完全阐明,对IL-6的基本生物学活性并无显著的影响,因为IL-6的生物学活性主要取决于其肽链的氨基酸序列。IL-6肽链具有4个Cys残基,位置完全保守,人和鼠的IL-6Cys残基分别位于44、50、73、83位,Cys44-Cys50和Cys73-Cys83各形成一对二硫键,处于暴露位置,具有重要作用。其中第二对二硫键的作用比第一对二硫键在维持IL-6的生物学活性上更为重要,二硫键除了可稳定IL-6的空间构象外,还可使IL-6蛋白质能够正确折叠成三维结构,以维持IL-6中受体结合区的完整性。如果人为地用化学试剂还原这两对二硫键,则IL-6的活性完全丧失。在不同物种,这两个半胱氨酸残基之间(50~73位)的9个氨基酸残基的序列相同,说明成熟的IL-6半胱氨酸富集中间区域对IL-6的生物学作用也起到关键性作用。重组技术合成的人IL-6蛋白质中,虽缺乏半胱氨酸﹐但也具有活性,说明IL-6的相关信息能够促使肽链折叠成有活性的构象,且并不一定需要半胱氨酸的存在。人IL-6分子有5个Met残基,除了Met67之外,其他均可以人为地氧化,氧化的容易程度大小依次为Met49、Met117,Met184和 Met161,其中Met161对受体结合至关重要。鼠IL-6在34和157位含有2个Trp残基,位于分子的表面,其中Trp34参与蛋白质与蛋白质的相互作用,Trp157则位于受体结合区域的附近。色谐分析显示,重组的IL-6蛋白含有较多的α螺旋,占67%,β折叠占15%,β转角占18%,其余为无序的卷曲结构。磁共振分析显示,分子的N端有15~22个残基长度的松散结构,整个分子以α螺旋紧密结构为主,Thr20-Lys46为第一组螺旋(A)、Glu80-Asn103为第二组螺旋(B),Glu108-Lys129为第三组螺旋(C),GIn156-Met184为第四组螺旋(D)。A组和B组以长的AB襟连接,形成平行排列;而C组和B组以短的禅连接,形成B组和C组反平行,D组和C组也以长的裨连接,导致C和D组也是平行排列,因此四组螺旋处于上上下下的布局中。图10-1所示为IL-6家族的结构特点。
参数原理
2023.04.17
内毒素介导因子之IL-6的产生和调节
白细胞介素-6(interlenkin 6,1L-6)是内毒素介导产生的诸多激素和介质中最重要的细胞因子。这篇文章介绍白细胞介素-6的产生和调节。活化的单核细胞是血液中IL-6的主要来源,在单核细胞向巨噬细胞分化的过程中,IL-6合成能力下降,局部组织中的IL-6主要由成纤维细胞或局部的单核-巨噬细胞产生。T细胞、B细胞、单核-巨噬细胞、成纤维细胞、角质细胞、骨髓基质细胞、内皮细胞、星型细胞、小胶质细胞、软骨细胞、血管平滑肌细胞和肾小球系膜细胞等都能够在不同条件刺激下产生IL-6。一些细胞株受到刺激后也能产生IL-6,如T细胞株(HTLV-1转化细胞)单核细胞株(U937和P388D1),骨肉瘤细胞株(MG63)、T24膀胱癌细胞株、A549肺癌细胞株、SKMG-4胶质母细胞瘤细胞株、U373星型细胞癌细胞株等。一些肿瘤细胞也能够产生IL-6,如心脏黏液瘤细胞、骨髓瘤细胞、肾上腺瘤细胞等。能刺激细胞分泌IL-6的因素包括:①细胞因子:IL-1、TNF、IL-2、TGF-β、血小板衍生生长因子(platelet-deviated growth factor,PDGF)、INF-β。②促分裂原:LPS、植物血凝素(phytahematoagglutinin,PHA)、佛波酯(phorbol 12-myristate 13-acetate,PMA).③微生物:金黄色葡萄球菌(Cowan 1),其他某些细菌﹑病毒,以及放射菌酮均可以诱导IL-6基因表达。④钙离子载体(A23187)、双丁酰cAMP,polyI:C和CHX(cycloheximide)也能够刺激IL-6合成,某些因素可抑制IL-6的分泌:①糖皮质激素﹑雌激素和环孢素A则可以抑制IL-6的产生。②IL-4和IL-13也抑制单核细胞和人外周血单核细胞(peripheral bloodmononuclear cell,PBMC)产生IL-6,但IL-4可刺激人B细胞产生IL-6。抗原和T细胞促分裂原均能刺激T细胞产生IL-6。病毒也诱导成纤维细胞和中枢神经系统的细胞产生I-6。IL-6与IL-2、TNF-α一样也有自分泌和旁分泌的效应。肿瘤患者接受IL-2或TNF-α治疗时,血液中能够快速产生有活性的IL-6。TGF-β能够诱导人成纤维细胞和小肠上皮细胞分泌IL-6。
参数原理
2023.04.17
内毒素介导因子之白细胞介素-6的结构及调节
在内毒素介导产生的诸多激素和介质中,最重要的是来自免疫系统和血管内皮细胞系统的细胞因子,主要包括肿瘤坏死因子、白细胞介素-1、白细胞介素-6、白细胞介素-8等。这篇文章介绍白细胞介素-6(interlenkin 6,1L-6)的结构。在不同条件刺激下许多细胞可产生IL-6,IL-6对免疫应答、急性期反应,肝细胞再生、造血和神经系统有多方面的作用。IL-6曾称为肝细胞刺激因子,B细胞刺激因子-2、β2干扰素,B细胞分化因子、杂交瘤/浆细胞瘤生长因子、细胞毒性T细胞分化因子、巨噬细胞-粒细胞诱导蛋白-2和相对分子质量为26000的蛋白等,从这些不同的命名中可以看出IL-6的生物学功能的多样性。一、IL-6基因人IL-6基因位于7p15~21,小鼠位于5号染色体上,长度分别为约5kb和7kb,有5个外显子和4个内含子,两者编码区的 DNA同源性为60%。人和小鼠基因的外显子1编码5'非翻译区和N端前7个氨基酸残基(其中后一个氨基酸残基由外显子1和外显子2共同编码),外显子2、3和4分别编码63、38和49个氨基酸,在小鼠则编码61、38和50个氨基酸残基,外显子5编码最后55个氨基酸残基和3'非翻译区。人IL-6 mRNA的长度为1.2~1.3kb。二、IL-6基因表达的调控在人IL-6基因的5'启动子区上游(--300bp内)有多个调控转录的元件:TATA盒;特异性的NF-IL-6(nuclear factor for IL-6a、β),也称为CCAAT元件结合蛋白(CCAAT element binding protein,C/EBPβ和γ);活化蛋白-1(activating-protein-1,AP-1);cAMP反应元件结合蛋白(cAMP response element binding protein,CREB);糖皮质激素受体(glucocorticoid receptor,GR);c-fos血清反应元件同源区(c-fos serum responsive element homology,c-fos SRE-H);NF-κB(nuclear factor κB);c-fos视网膜母细胞瘤控制元件同源区(c-fos retinoblastoma control element homology,c-fos RCE-H)等。当细胞用IL-1刺激后,NF-IL-6α、β以及NF-κB结合到IL-6的调控区的位点上,促进IL-6转录,NF-IL-6α和 NF-IL-6β形成异源性二聚体可更有效地促进表达,NF-IL-6和 NF-κB可以形成异源性二聚体,说明IL-6的启动子可以相互作用进行控制。这两个位点在IL-6的表达中起关键性作用。cAMP生成诱导剂包括PGE2,它能增强IL-6的转录。cAMP升高能增强多个调控位点的效率,如NF-IL-6和 NF-κB等。糖皮质激素在转录水平上能抑制IL-6的转录,并通过结合AP-1或NF-κB的p65亚单位,抑制这些转录因子的结合。在NF-B和NF-IL-6元件之间,存在G/C富集序列为CCACC的3个重复体,为刺激蛋白1(stimulatingprotein 1,Sp1)结合区,为NF-B和NF-IL-6提供桥接作用,并调节IL-6的转录。其他转录因子也参与IL-6的转录调节,如肿瘤抑制基因p53能抑制IL-6的转录;而突变型p53无抑制效应。野生型视网膜母细胞瘤易感基因Rb能够抑制HeLa细胞中IL-6启动子驱动的指示剂的表达。而且编码腺病毒E1A蛋白E1A289R和E1A243R的表达载体能够造成IL-6启动子驱动活性的抑制。用IL-1或TNF对转染有E1A的细胞株进行刺激不能发生IL-6的表达,其机制可能是干扰核因子结合到调控区上所致。LL-6也能够抑制髓性白血病细胞株的p53诱导的凋亡,以及抑制造血细胞Rb的磷酸化。另外,在IL-6刺激的HepG2细胞中,NF-IL-6能够取代腺病毒E1A的功能,并可以结合和刺激转染有E1A的启动子。因此,IL-6以及其作用机制是﹐IL-6能够同腺病毒表达蛋白质相互作用。IL-1可诱导IL-6的表达,并使IL-6的mRNA更为稳定。TNF刺激的细胞IL-6的mRNA的半衰期小于1h,而IL-1刺激的细胞IL-6的半衰期大于6h,其机制还不清楚。IL-6的3'非编码区AUUUA序列起到一定的作用,可能该序列能够结合特定的蛋白质,而后者能够作为mRNA降解的调节物﹐或存在其他机制。总之,许多刺激可以促使IL-6表达,可在转录水平或促使mRNA稳定水平上发生效应。不同的转录因子可以协调进行调控IL-6基因的表达。
参数原理
2023.04.14
白细胞介素- 1的生物学活性作用
(1)致热原作用:白细胞介素- 1(interlenkin 1,1L-1)是主要的内源性致热源。将IL-1注入体内,动物在5~8min内出现发热,这种早期的效应是因为IL-1能诱导下丘脑血管内皮细胞膜磷脂释放花生四烯酸,产生PGE2,和白细胞三烯,进一步作用于下丘脑温度敏感神经元引起体温升高。IL-1还能诱导内皮细胞中环氧化酶基因表达,环氧化酶介导的PGE2增加可持续几天,引起后期致热效应。IL-1引起的发热效应是机体防御的一部分,有利于提高免疫应答效应。除了发热,IL-1对中枢神经系统还有其他作用,如诱导慢波睡眠。(2)在感染性休克中的作用:在中毒性休克患者或休克动物模型中给予抗IL-1抗体或抗TNF抗体,可以有效地降低其病死率。IL-1引起的血压下降与某些小分子物质(环氧化酶产物、血小板活化因子、一氧化氮和黏附分子表达等)有关。这些物质可以抑制血管收缩、促进血管内凝血、促进中性粒细胞合成血栓烷(thromboxane)、通过诱导内皮细胞黏附因子和细胞间黏附分子促进内皮黏附等,并导致休克的发生。IL-1还是全身性炎症反应综合征发生过程中的重要炎症介质之一。(3)破坏结缔组织的作用:IL-1能够诱导成纤维细胞的增殖,诱导上皮细胞、成骨细·胞产生胶原蛋白,诱导破骨细胞,成纤维细胞和软骨细胞等释放胶原酶分解胶原蛋白。(4)IL-1能够诱导肝细胞合成一些急性时相的蛋白,并减少白蛋白.纤黏蛋白和转铁蛋白的合成。IL-1诱导的IL-6又能够诱导其他急性时相蛋白质的合成。(5)IL-1对于神经内分泌系统亦有作用。感染和炎症通过激活下丘脑-垂体-肾上腺轴(HPAA)导致血浆糖皮质激素升高,这主要是由于IL-1刺激下丘脑释放促肾上腺皮质激素释放激素(CRH),促进垂体分泌促肾上腺皮质激素(ACTH),最后导致肾上腺释放糖皮质激素入血所致。糖皮质激素浓度增加将引起免疫抑制,抗炎和代谢作用。另外,糖皮质激素具有抑制IL-1及其他细胞因子合成的作用,因此,HPAA 的激活可认为是控制IL-1产生的反馈机制。
参数原理
2023.04.14
国家药典委员会《药物制剂质量控制及标准研究培训研讨会》圆满收官!
由国家药典委员会举办的“药物制剂质量控制及标准研究培训研讨会”于昨日圆满收官!科德角国际生物医学科技(北京)有限公司在第88届中国国际医药原料药/中间体/包装/设备交易会(API China)上的精彩继续呈现!科德角国际作为细菌内毒素检测领航者,携Pyros Kinetix®Flex细菌内毒素定量检测系统及动态浊度法鲎试剂、动态显色法鲎试剂、凝胶法鲎试剂、重组鲎试剂等多款产品在展位上惊艳亮相,以满满诚意赴这场盛大的展会之约! 科德角国际以优质的细菌内毒素检测产品、热情的服务向现场的客户展现出了科德角国际蓬勃向上的企业实力、品牌形象以及未来前景。展会上,众多国内外客户对科德角国际的细菌内毒素检测产品详细、全面地了解后,纷纷借此契机与我们达成合作意向。培训研讨会完美收官,科德角国际展会精彩还在继续 !您的到来就是对我们最大的支持与认可!科德角国际欢迎您的到来!展会信息展会时间:2023年4月12日-14日展位地址:山东省青岛市世博城国际展览中心 展位号 :S6T05
企业动态
2023.04.14
细菌外膜的组成之蛋白质的介绍
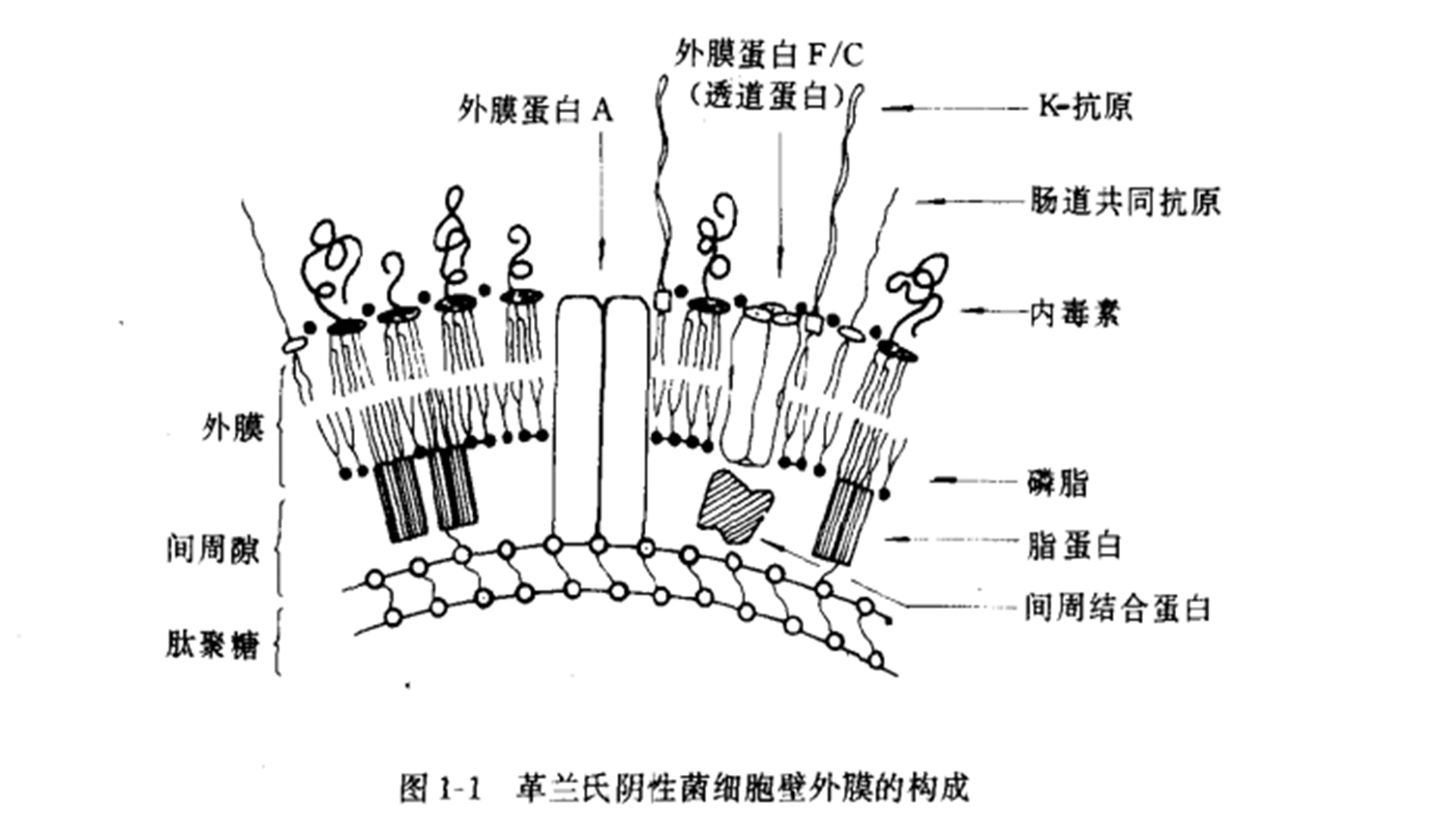
细菌外膜分子组成中的一半为蛋白质,外膜中所含的蛋白质种类较多,但仅存在几种称为主要蛋白(major proteins)的分子成为外膜蛋白的主要成分,这类蛋白质包括透道蛋白(porins)和外膜A蛋白(Outer membrane protein A,Omp A),这两类蛋白质的分子量均为35000d左右。此外外膜中还含有胞壁脂蛋白,但其分子量要小得多(7200d)。如果细菌培养环境改变,则主要蛋白的组成可发生变化,如当肠杆菌在富含麦芽糖的培养基中培养时,LamB蛋白(λ噬菌体的受体)便成为一种主要蛋白,而当细菌在无铁条件下培养时,则参与摄取铁螯合物的蛋白便成为主要蛋白。1.脂蛋白(lipoprotein):是细菌外膜的一种结构蛋白,分子量较小,约7200d,但细菌含有的量较大(7×105分子/细胞)。大约其中的1 /3称为结合脂蛋白,它通过C-末端赖氨酸的-NH2残基而与肽聚糖的胞壁酸共价交联。其余2/3为游离型脂蛋白。脂蛋白N-末端半胱氨酸残基的-SH基团被二甘油基所取代,而其-NH2基团由一个脂肪酸所酰胺化。脂蛋白的一级结构已阐明,二级结构属于α-螺旋结构。脂蛋白分子间可发生交联,故而可形成寡聚体。这一蛋白的亲水性顺序暴露于外膜的外表面,而脂质部分通过疏水链镶嵌于外膜的磷脂分子中。脂蛋白结构基因突变的菌株虽然能允许小分子量亲水性分子通过外膜;但这种突变株的细胞壁不稳定,外膜成分可以小泡形式释放出来。因而脂蛋白除作为一种结构蛋白外,还起到稳定细菌外膜—肽聚糖复合体的作用。2. OmpA蛋白:大肠杆菌OmpA蛋自单体分子量与透道蛋白相似,约为35000d,但它们在SDS中的溶解特性有明显的差异。因而当OmpA蛋白经SDS加热再经聚丙烯酰胺凝胶电泳分析时可见到其泳动速度明显地减小,OmpA蛋白的SDS“加热修饰性”现象是这种蛋白的一个很重要特性。淋球菌的Ⅱ型蛋白与布氏杆菌的Ⅲ型蛋白同OmpA蛋白具有相同的特性,故而它们可能属于同一类蛋白质。与透道蛋白不同的是,OmpA蛋白并不形成对SDS抵抗的寡聚体,虽然在外膜中OmpA蛋白间可发生交联,但在自然情况下这种蛋白质并不能形成同源性寡聚体,α-衍射研究亦证实了这一点。OmpA蛋白可与脂蛋白联结在一起。OmpA蛋白富含β-折叠结构,这样可以使外膜的厚度增加。同时OmpA蛋白可作为噬菌体的受体并可与肽聚糖层发生交联。OmpA突变株对于氨基酸的总转运率下降,亦不能转运肽类。缺乏OmpA蛋白的突变株细菌的外膜结构不稳定,并缺失细胞接合的功能。大肠杆菌OmpA蛋白氨基酸顺序已弄清,其176~187位氨基酸顺序为Ala--Val-Ala-Pro-Ala-Pro-Ala-Pro-Ala-Pro-Ala-Pro,相似于免疫球蛋白接合部的区域顺序。这一顺序将OmpA蛋白分成两个部分,N-末端部分插入到外膜中,而C-末端暴露在膜的内侧。3.透道蛋白:大肠杆菌K-12由OmpF 、OmpC及PhoE基因编码的蛋白,称为透道蛋白,因为它们可形成相对非特异性的通道或透道,而允许小分子亲水性物质通过外膜。透道蛋白缺乏的突变株已被证实可允许营养物质,抗菌素及抑制剂扩散入细胞。其他细菌所产生的透道蛋白有:鼠伤寒沙门氏菌LT2的Om-pD蛋白、大肠杆菌前噬菌体所编码的Ⅱ型蛋白或LC蛋白、含荚膜大肠杆菌所产生和K蛋白等等。4.参与特异性扩散过程的蛋白:大肠杆菌的LamB蛋白参与麦芽糖及多聚麦芽糖透过外膜。其他有TSX蛋白或T6受体蛋白(参与核苷酸的转运)、TonA(FluA)蛋白或T1、Ts受体蛋白(参与高铁血红素的摄取)、FepA蛋白(参与Fe3+-螯合物的摄取)及BtuB蛋白(参与维生素B12的摄取)等等。5.其他蛋白:有一些酶定位于外膜上,这些酶类包括磷脂酶A1及蛋白酶。另外,从明尼苏达沙门氏菌提取到了一种与内毒素有强烈亲和作用的蛋白,其性质不详。
参数原理
2023.04.13
内毒素与磷脂分子在结构上的差别简述
内毒素为细菌外膜的特征性组成成分,对于细菌外膜的结构与功能起着十分重要的作用,这里我们仅简述一下内毒素与磷脂分子在结构上的差别。(1)内毒素的类脂A部分在D-氨基葡萄糖骨架上联结6~7个脂肪酰残基,而一般的磷脂仅联结有两个脂肪酸。(2)一般的磷脂其脂酰基可为饱和或不饱和脂肪酸,而类脂A含饱和或3-羟基脂肪酸,后者中的羟基可被饱和脂肪酸进一步酰化而形成3-脂酰基脂肪酸,这是内毒素(类脂A)的特有成分。(3)内毒素在类脂A分子上的磷酸基团及核心中的KDO成分可携带多量的负电荷,因而内毒素与阳离子可发生强烈的相互作用。因此阳离子的存在对于内毒素的物理特性及生物学功能可发挥显著的影响。(4)许多革兰氏阴性菌突变株可产生不完全的内毒素结构,如rfb突变产生Ra型内毒素,这种内毒素仅含有完整的核心及类脂A分子,但缺失O-特异多糖链;rfaC突变株则产生Re型内毒素,这种内毒素分子仅含有类脂A及2~3个分子的KDO,大部分的核心成分及O-特异性多糖侧链均缺失。
参数原理
2023.04.13
直击现场丨国家药典委员会举办的“药物制剂质量控制及标准研究培训研讨会”盛大开幕,科德角国际展会现场盛
第88届中国国际医药原料药/中间体/包装/设备交易会(API China)于今日在山东青岛市世博城国际展览中心正式召开。由国家药典委员会举办的“药物制剂质量控制及标准研究培训研讨会”也于今日(4月12日)8:50拉开帷幕。 研讨会期间,作为拥有先进细菌内毒素检测能力的科德角国际生物医学科技(北京)有限公司,在展会上吸引了众多新老顾客的驻足,在川流不息的人群中,老客户前来捧场,新客户前来咨询,参观者络绎不绝。本次展会,科德角国际的全系列细菌内毒素检测产品均亮相展会现场,包括Pyros Kinetix® Flex细菌内毒素定量检测系统、动态浊度法鲎试剂、动态显色法鲎试剂、凝胶法鲎试剂、重组鲎试剂等产品,可满足顾客对细菌内毒素的检测需求。 在现场,科德角国际的技术总监及高级工程师为大家演示讲解Pyros Kinetix® Flex细菌内毒素定量检测系统的检测能力,吸引了大批观众驻足观看。科德角国际不仅细菌内毒素检测产品配套齐全,还具备高效、精准的细菌内毒素检测能力,可满足客户对各类样本类型,包括无菌工艺用水、生化类药品、蛋白质类、血清等检测需求。科德角国际始终坚持质量优先,将不断提升细菌内毒素检验检测能力,为客户提供更优质、便捷的细菌内毒素检测服务。为期三天的展会,还有两天,科德角国际欢迎大家的光临,大家的关注和期待,将坚定科德角国际迈向未来的步伐。 展会信息展会时间:2023年4月12日-14日展位地址:山东省青岛市世博城国际展览中心 展位号:S6T05
企业动态
2023.04.12
细菌外膜组成之磷脂的介绍
细菌外膜所含的磷脂成分与真核细胞膜的成分极为相似,唯一一点有意义的区别在于细菌(如鼠伤寒沙门氏菌、大肠杆菌等)外膜含有高量的磷脂酰乙醇胺。其他的成分有磷脂酰甘油及心磷脂等。根据细菌培养条件的不同磷脂中脂肪酸的组成可发生改变。外膜中正常磷脂分子处于一个动态的过程。磷脂在单层膜中的侧向扩散速度极快,其扩散常数约为3.2×10-8cm2/s,亦即每秒钟可移动3.5μm的距离。但是外膜中两叶间磷脂的交叉移动却是不常见的。磷脂是组成外膜内叶的主要分子,而外膜的外叶则是由内毒素及磷脂分子共同组成的,亦即由磷脂一磷脂所形成的双层膜结构仅局限于外膜的局部区域。由于细菌内毒素与磷脂分子在结构上具有高度的相似性,故而这种由磷脂一磷脂,磷脂一内毒素所组成的外膜结构并不影响外膜的稳定性。
参数原理
2023.04.11
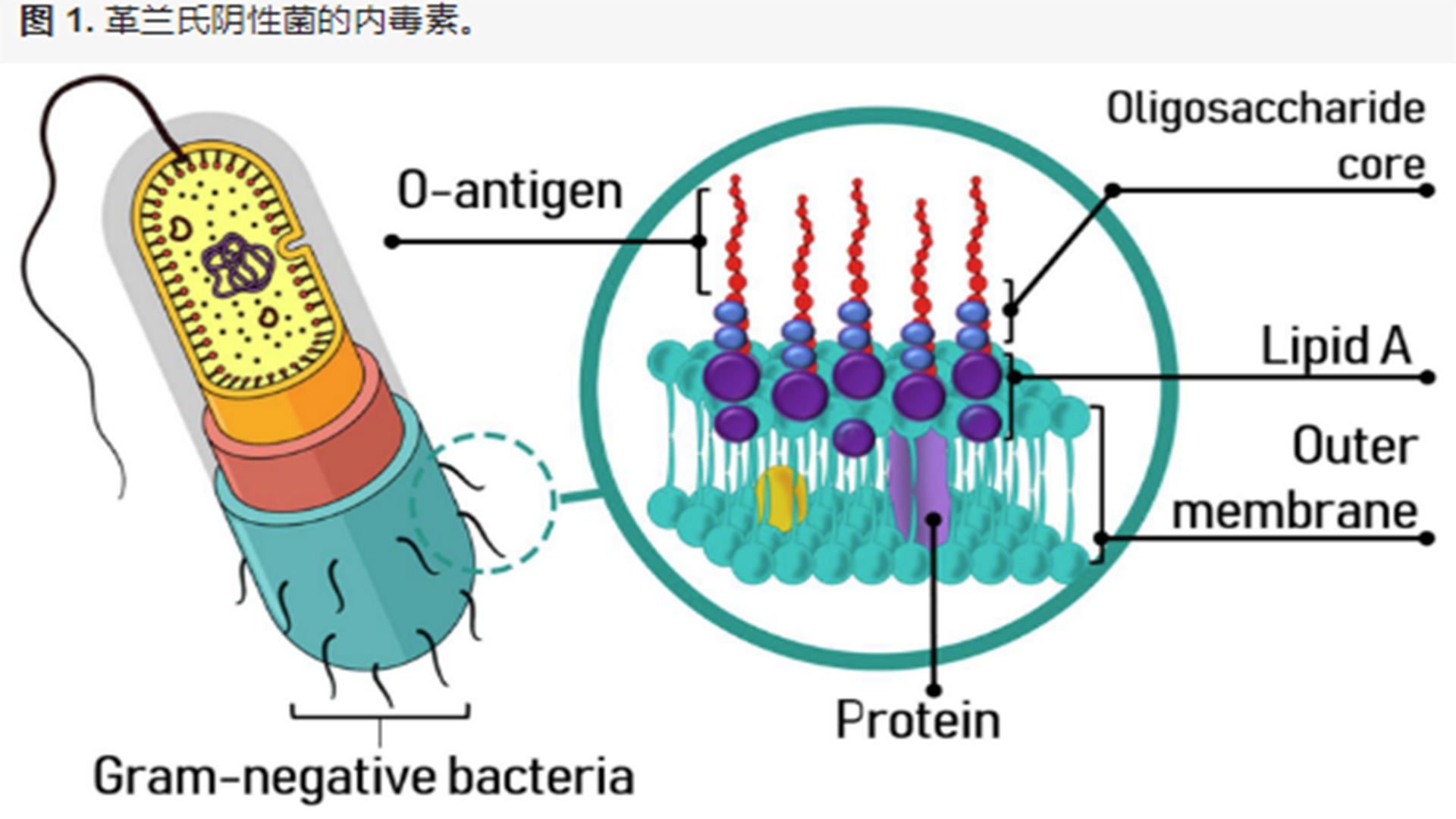
细菌外膜的组成:磷脂、蛋白质及脂多糖
所有细菌的表面均具有一层称为细胞壁的结构,其组成成分主要为肽聚糖(peptidoglycan)。肽聚糖的存在在于提供了细菌细胞壁的强度,具有机械性保护意义。革兰氏阴性细菌在肽聚糖的外侧还含有一层称为外膜(outer membrane)的“单位膜”结构,细菌内毒素即脂多糖(lipopolysaccharide,LPS)即存在于这一结构中(图1-1)。应用现代分子生物学方法,可以将细菌外膜完整地从细胞壁中抽提出来,而不受细菌其他结构及成分的影响。细菌外膜主要含有磷脂、蛋白质及脂多糖(lipopolysaccharide,LPS)。与细胞膜比较,外膜中所含的蛋白质种类甚少,但存在的总量却很高。外膜所含的磷脂种类亦很少,其中以磷脂酰乙醇胺为主。某些野型细菌(如鼠伤寒沙门氏菌)外膜中所含的磷脂量极少,甚至不足以组成外膜的一个单层。另一方面,外膜中含有一种特征性的成分即内毒素,每个菌细胞所含的内毒素分子数可达2.5×106,这些分子全部分布于外膜的外叶中,约占外膜总表面积的45%。应当指出的一点是,不同种属的细菌,它们外膜的化学组成可有不同。某些粗糙型突变株细菌外膜中的磷脂含量极高,而蛋白质成分极低,但内毒素分子数目却基本保持恒定。外膜中存在的某些蛋白质可与胞壁中的肽聚糖层发生共价交联,从而维持了整个细胞壁的稳定性。
参数原理
2023.04.11
倒计时1天丨国家药典委员会《药物制剂质量控制及标准研究培训研讨会》将于明日正式召开
第88届中国国际医药原料药/中间体/包装/设备交易会(API China)将于明日在山东青岛市世博城国际展览中心举办 。 由国家药典委员会主办的为期两天的“药物制剂质量控制及标准研究培训研讨会”也将于明日(4月12日)上午8:50正式拉开帷幕! 科德角国际生物医学科技(北京)有限公司作为受邀企业,将在展会上重点亮相PKF细菌内毒素定量检测系统、动态浊度法鲎试剂、动态显色法鲎试剂、凝胶法鲎试剂、重组鲎试剂等产品供大家咨询了解,我们的展位号是S6T05,敬请关注! 展会信息主办单位:国家药典委员会参展时间:2023年4月12日-14日展位地址:山东省青岛市世博城国际展览中心 展位号:S6T05 ▼观看下图,了解更多官方研讨会议程内容
企业动态
2023.04.11
白细胞介素- 1对造血细胞的影响
诱生内原性热原(endogeneons pyrogens,EPS)的间接作用,使内毒素引起了机体发热。诱生内原性热原之一为白细胞介素- 1(interlenkin 1,1L-1),本篇文章介绍白细胞介素- 1对造血细胞的影响。IL-1是一种高活性的细胞因子,在低于1ng/L浓度时即有很强的生物学活性。它的生物学功能与TNF相似,范围十分广泛,主要包括:参与免疫调节、介导炎症反应、调节神经内分泌系统和中枢神经系统。IL-1可以在不同水平上影响造血系统,从非成熟前体细胞到成熟髓单核细胞和淋巴细胞。红细胞生成素-1的活性是由IL-1α所介导的。IL-1本身并不诱导造血细胞增殖和分化,但其能够诱导许多类型细胞释放多种CSF(GM-CSF,G-CSF,M-CSF、IL-3),并与这些造血因子协同刺激造血细胞(特别是干细胞)增殖和分化,起到加速化疗或放疗后骨髓象的恢复及辐射防护的作用。IL-1可以作用于T细胞和B细胞,尤其是协同T细胞增殖,而IL-2启动子的AP-1转录子复合物又是IL-1协同刺激活性的靶位。淋巴细胞活化因子(lymphocyte-activating factor)分析对鉴定IL-1具有重要价值,IL-1Ra可促进TH1型细胞反应的发生;IL-1则可能促进TH2型反应的发生。IL-1的免疫调节作用有:(1)对T细胞的作用:协同亚适宜剂量有丝分裂原激活胸腺细胞和T细胞;促进胸腺细胞和T细胞增殖;表达IL-2受体,分泌细胞因子(IL-2、IL-4、IL-6、INF-γ等)。在免疫应答的早期,IL-1作为抗原呈递细胞(APC)第二信号,辅助APC激活TH细胞。IL-1还能够增强CTL细胞的杀肿瘤细胞活性,它诱生的细胞因子也有抗肿瘤作用。(2)对B细胞的作用:IL-1能促进前体B细胞增殖和分化,表达SmIgM和C3b受体,诱导B细胞产生对IL-2、IL-4、IL-5和IL-6反应的能力。(3)对其他免疫细胞的作用:增强NK细胞的杀肿瘤细胞活性,增强巨噬细胞的抗肿瘤作用,引起巨噬细胞趋化及合成IL-1、IL-6、PGE2等。IL-1对某些细胞(黑色素瘤细胞或胰岛B细胞)还有直接的细胞毒性作用。但对某些肿瘤细胞也有促生长作用。
参数原理
2023.04.10
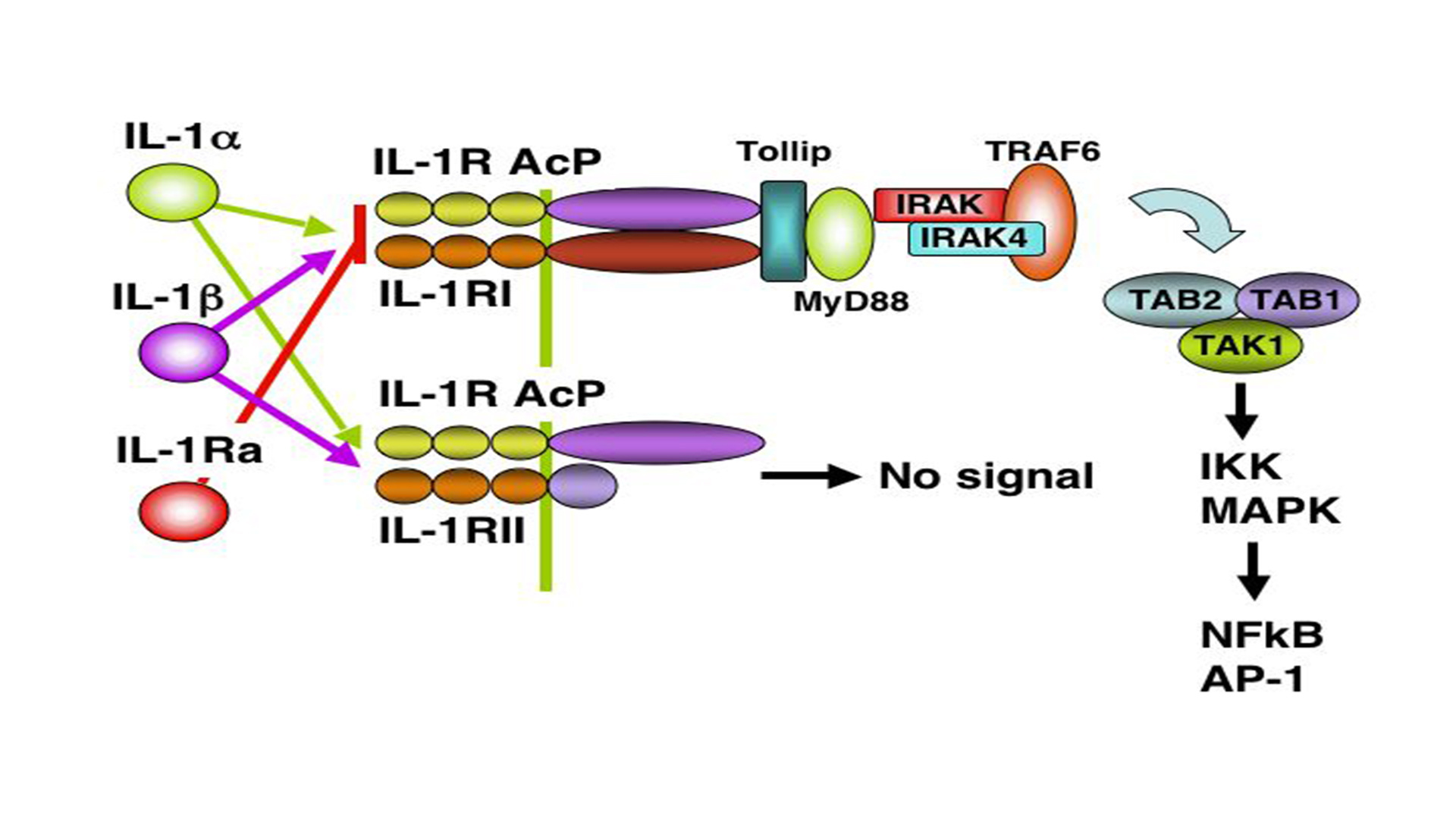
白细胞介素- 1受体分泌及调节介绍
白细胞介素- 1(interlenkin 1,1L-1)的间接作用,可使内毒素引起机体发热。本篇文章介绍IL-1的受体分泌及调节介绍。IL-1的受体有两种:IL-1RⅠ和IL-1R Ⅱ。三种IL-1都能与受体结合,IL-1Ra与受体结合后不引发信号转导效应,但可抑制IL-1α和IL-1β同受体结合。上述两种受体常常表达在同一细胞中,但不同的细胞仅优势表达某一种受体。IL-1RⅠ是相对分子质量为80000的糖蛋白,人的基因位于2号染色体长臂上。主要表达在内皮细胞、平滑肌细胞、T细胞,肝细胞、成纤维细胞、角质细胞和表皮树突状细胞等。IL-1RⅠ高度糖基化,阻止糖基化会降低其生物学活性。IL-1R Ⅰ的胞质内肽链较长,并参与信号转导,与Toll受体的胞质区显著同源,故称为Toll/白细胞介素同源区域(Toll /in-terleukin-1 homologous region,TIR),缺乏酪氨酸激酶的活性。人IL-1R Ⅰ mRNA约5kb,编码569个氨基酸残基,细胞外320个氨基酸残基构成3个免疫球蛋白样功能域,跨膜区有19个氨基酸残基,其余230个氨基酸残基在胞质内。IL-1受体辅助蛋白(interleukin-1 receptor accessory protein,IL-1RAcP)其胞外和胞质结构域与IL-1RⅠ具有同源性,IL-1与IL-1RⅠ结合亲和力较低,可使构象发生改变,并被IL-1RAcP识别,参与受体复合物的形成,能够增强其亲和力,使之发挥生物学效应。IL-1RⅡ主要表达在B细胞、单核细胞和中性粒细胞中。IL-1R Ⅱ的 mRNA约1803bp,编码386个氨基酸残基,是相对分子质量为68000的糖蛋白。该蛋白质含有5个糖基化位点,经过N-糖苷酶处理使糖链分解后,相对分子质量为55000。IL-1RⅡ细胞外的332个氨基酸残基构成3个免疫球蛋白样功能域,其胞内只有很短的29个氨基酸残基,没有信号转导功能。用抗IL-1RⅡ抗体不能阻止IL-1的信号转导,用抗IL-1RⅡ抗体能够有效地阻止IL-1的信号转导。IL-1RⅡ是一个诱骗分子,可为IL-1的自身负反馈。将IL-1RⅡ的细胞外部分与IL-1RⅠ的胞质内部分嵌合构建的嵌合受体能够与IL-1结合并能转导信、号效应。可溶性IL-1受体:健康人和某些病理组织液中可检查到IL-1R Ⅰ和 IL-1RⅡ的胞外结构部分为可溶的IL-1受体,但其具体的生物学作用不是很清楚。IL-1的信号转导途径用图9-1表示。
参数原理
2023.04.10
倒计时2天丨科德角国际即将参加由国家药典委员会举办的药物制剂质量控制及标准研究培训研讨会
2023年4月12-14日,第88届中国国际医药原料药/中间体/包装/设备交易会(API China)将在山东青岛市世博城国际展览中心举办 。期间,由国家药典委员会主办的“药物制剂质量控制及标准研究培训研讨会”也将同期召开。届时,科德角国际生物医学科技(北京)有限公司受邀将出席此次培训研讨会。 本次培训研讨会聚焦新型制剂以及注射剂、吸入制剂、生物制品等高风险制剂研究开发、生产制备、工艺控制、质控技术、标准制定等方面,药典委员、中国食品药品检定研究院、药品审评中心、药品审核查验中心等相关单位的资深专家以及长期在相关领域从事药品检验、科研、生产的专家将聚集一堂,围绕相关药物制剂技术标准、生产用原料药、药用辅料、药包材关键控制要点、质控技术应用、微生物污染控制、国内外药品相关技术法规、标准制定情况以及行业普遍关注的热点问题进行培训和深入探讨,旨在规范和指导行业开展药物制剂研发、注册、生产和质控,以保障药品的安全性和有效性。 科德角国际生物医学科技(北京)有限公司受邀参加此次培训研讨会。期间,科德角国际将在展会上重点亮相PKF细菌内毒素定量检测系统、动态浊度法鲎试剂、动态显色法鲎试剂、凝胶法鲎试剂、重组鲎试剂等产品供大家咨询了解,为大家答疑解惑。我们的展位号是S6T05,敬请关注!会议信息主办单位:国家药典委员会会议时间:2023年4月12日-13日会议地址:山东省青岛市世博城国际展览中心 展位号:S6T05▼观看下图,了解更多官方研讨会议程内容
企业动态
2023.04.10
白细胞介素-1β转化酶对IL-1β产生的调节起着重要作用
proIL-1β合成以后主要存在于细胞质内,经过加工切割后转运到细胞外。IL-1β中前半部(氨基酸1-116)也能在丝氨酸残基上发生豆蔻酰基化,但不同于IL-1a,proIL-13无膜结合型,仅有微弱的生物学活性。一些proIL-1β或存在溶酶体中,或与微管结合,这两种定位均在IL-1β的分泌中起重要作用。proIL-1β需要经过酶切后以成熟的形式分泌到细胞外,当人 PBMC用LPS(lipopolysaccharide,脂多糖)刺激24h后,培养上清液中成熟的IL-1β浓度不同,说明细胞的proIL-1β的分泌和酶切可以受到不同因素的调节。分泌的过程可受到环氧合酶(cyclooxygenase,COX)抑制剂和INF-γ的调节。proIL-1β酶切点是在天冬氨酸和丙氨酸(氨基酸位点116~117)之间,该过程由一个特异性的细胞内的半胱氨酸蛋白酶来完成,取名为白细胞介素-1β转化酶(interleukin-19-converting enzyme,ICE)。proIL-1β中另外一个酶切位点在27位的天冬氨酸残基上,酶切后可以形成相对分子质量为22000的 IL-1β。ICE的cDNA已经阐明,相对分子质量为45000的ICE前体形式经过两次内部剪切,才可以成为具有酶学活性的ICE,此时ICE是由相对分子质量为10000和20000的两条链结合并形成异源性二聚体,其中只有相对分子质量为20000的链具有酶学活性。与ICE结构相似的同源物在细胞凋亡中起到重要作用,这些同源物和ICE一起被称为ICE蛋白家族。目前将ICE称为caspase 1,根据其作用已经归类到凋亡蛋白酶(caspase)家族中。ICE家族均系由大亚基和小亚基组成的复合体,具有相似的催化位点。ICE本身能够影响ICE前体加工,由于ICE前体自身或ICE同源分子之间能够形成寡聚体,因此干扰了ICE的自身酶切。两分子的异源性ICE二聚体进一步聚合形成四聚体,prolL-1β的116位天冬氨酸是proIL-1β剪切的识别位点。ICE不剪切IL-1α前体。其他酶如弹性蛋白酶(elastase)和粒酶A(granzyme A)都能在proIL-1β的112和120氨基酸位置进行酶切,并产生具有活性的IL-1β。在细胞内和细胞外都可检测到proIL-1β的前片段(propiece),前片段可通过IL-1R介导的途径对成纤维细胞发挥趋化的生物学活性。在ICE的竞争性抑制剂存在的情况下,成熟的IL-1β的生成和分泌会减少。proIL-1β主要积聚在细胞内和细胞外,说明proIL-1β从细胞内释放不依赖于ICE的加工,胞吐可能是proIL-1β释放的一种机制,另外膜通道也是proIL-1β被释放出细胞外的途径,当ICE活性被用可逆竞争性底物抑制剂阻滞后,培养上清液中有大量prolL-1β,因此通道是proIL-1β和成熟IL-1β释放的被动分泌途径。ICE缺陷的小鼠巨噬细胞在体外受到刺激后不能释放出成熟的IL-1β。尽管中性粒细胞弹性蛋白酶和粒酶A能够酶切proIL-1β,但ICE缺陷的小鼠proIL-1β却积聚在细胞内。同时,ICE缺陷小鼠巨噬细胞的IL-1α生成下降,这与IL-1基因表达和合成能够自我进行诱导的结果一致。
参数原理
2023.04.06
白细胞介素-1(IL-1)转录和翻译两个过程的分离
白细胞介素-1(IL-1)的间接作用,可使内毒素引起机体发热,本文介绍白细胞介素-1(IL-1)转录和翻译两个过程的分离。用补体C5a,低氧、凝血等刺激可以诱导单核细胞大量合成IL-1β mRNA,但无IL-1β的翻译,说明两者并不一致。即使IL-1β mRNA已在核糖体中装配,但若无明显肽链延长,未翻译的 mRNA也会很快被降解。在内毒素或IL-1(interlenkin 1,白细胞介素- 1)刺激时,能够出现持续的高水平的IL-1β mRNA,其翻译也显著增强。其中的机制可能是,LPS(lipopolysaccharide,脂多糖)刺激后,AU富集的非翻译区域使mRNA发生稳定,不易被降解。微生物产物能够使IL-1的mRNA发生稳定,所以微量的LPS或细菌、疏螺旋体能够诱导大量的IL-1β的翻译。IL-1 mRNA的稳定性的调节说明该机制能控制IL-1的表达。在IL-1的3'区域存在多个AU富集的序列,涉及转录衰减,LPS刺激THP-1细胞同样也转录IL-1α和IL-1β,但IL-1α的转录子比IL-1β更为不稳定。INF-γ能够增强LPS诱导的IL-1生成,也可增加mRNA的稳定性,在成纤维细胞和THP-1细胞中,PMA诱导的IL-13的表达结果类似。组胺能够降低IL-1β的稳定性,但也能够增强IL-1α处理的PBMC中的 IL-1β转录。TNF通过增强转录子的稳定性从而增强纤维肉瘤细胞的IL-1β转录,TNF的效应与PKC的激活有关。负性调节因素:糖皮质激素、IL-4既降低IL-1基因的转录,也促进其mRNA的衰变,IL-4和地塞米松对IL-1的去稳定性(destability)能够被蛋白质合成抑制剂所阻滞,说明该效应需要某些蛋白质的重新合成。IL-1能够稳定自身mRNA,是通过阻止其发生去腺苷酰基化反应,即类似于趋化因子gro-α(grow-related protein-α)的作用而达目的的。在细胞中去除IL-12h后,可出现多聚A(poly A)尾部的缩短,显然说明IL-1 gro合成的是一种重要的调节物﹐能够阻止发生去腺苷酰基化。实际上,低浓度的IL-1可以刺激细胞产生大量的趋化因子,如1pmol/L的IL-1可刺激成纤维细胞合成10nmol/L的IL-18。翻译需要其他信号。运用吡啶基咪唑(pyridinyl-imidazole)化合物能够阻止IL-1β和TNF-α的合成,却不影响其mRNA的转录和稳定。吡啶基咪唑存在时,用LPS刺激PBMC 所出现的IL-1或TNF-α的mRNA表达不同于用C5a、缺氧或细胞粘连的刺激,即有丰富的细胞因子mRNA却无细胞因子蛋白。这些眯唑类药物也称为“细胞因子抗炎药物(cytokinesuppressing antiinflammation drugs,CSAIDs)”。CSAIDs中有两个能够抑制分裂原激活蛋白(mitogen activating protein,MAP)的激酶,如抑制p38激酶。在翻译起始,因子eIf-4E需要MAP使其发生磷酸化,若阻止磷酸化,翻译无法进行。因此尽管有mRNA 的转录,也无蛋白质的表达。
参数原理
2023.04.06
内毒素在高级动物体内的动力学变化及其意义
内毒素注入机体后即可见到众多生物学作用的出现。但在自然条件下细菌胞壁中存在的内毒素所发挥的作用并非如此典型。内毒素自感染的细菌释放后,将受到体内酶系统的作用而发生一系列结构及功能的改变,最终以无毒性、无活性的终产物而分泌出体外。在这一动力学变化过程中内毒素所形成的许多中间产物可发挥不同于内毒素本身的许多生物学效应(当然亦取决于中间产物产生的部位)。中间产物中有的发挥毒害作用,另外一些则可发挥有益作用。对于这些中间产物的分离、鉴定及应用人工化学合成的中间产物,则能更好地了解内毒素在体内的动力学变化及生物学作用。鲎试验(limulus test)或应用特异性抗体的放射免疫测定,已.成功地应用于与人类生活密切相关的环境及临床病材中内毒素含量的测定。但必须记住的一点是,对于临床病人内毒素检测的敏感性必须提高到1pg(10-12g/ml)的水平,并必须更深入地了解内毒素检测的意义。
参数原理
2023.04.06
科德角国际受邀参加药物制剂质量控制及标准研究培训研讨会
2023年4月12-13日,在第88届中国国际医药原料药/中间体/包装/设备交易会(简称:API China)期间,将举办由国家药典委员会主办的“药物制剂质量控制及标准研究培训研讨会”。届时,科德角国际生物医学科技(北京)有限公司受邀将出席此次培训研讨会。在培训研讨会期间,科德角国际将在展会上重点亮相PKF细菌内毒素定量检测系统、动态浊度法鲎试剂、动态显色法鲎试剂、凝胶法鲎试剂、重组鲎试剂等产品供大家咨询了解,我们的展位号是S6T05,敬请关注!本次培训研讨会聚焦新型制剂以及注射剂、吸入制剂、生物制品等高风险制剂研究开发、生产制备、工艺控制、质控技术、标准制定等方面,药典委员、中国食品药品检定研究院、药品审评中心、药品审核查验中心等相关单位的资深专家以及长期在相关领域从事药品检验、科研、生产的专家将聚集一堂,围绕相关药物制剂技术标准、生产用原料药、药用辅料、药包材关键控制要点、质控技术应用、微生物污染控制、国内外药品相关技术法规、标准制定情况以及行业普遍关注的热点问题进行培训和深入探讨,旨在规范和指导行业开展药物制剂研发、注册、生产和质控,以保障药品的安全性和有效性。 展会信息参展时间:2023年4月12日-13日展位地址:山东省青岛市世博城国际展览中心 展位号: S6T05 研讨会日程2023年4月12日1. 抗生素类药物杂质控制策略的思考(胡昌勤 中国食品药品检定研究院)2. 氨基糖苷类抗生素杂质控制策略的思考(袁耀佐 江苏省食品药品监督检验研究院)3. 药事管理新挑战——氨基酸类制剂的管理问题与规范应用(梅丹 中国医学科学院北京协和医院)4. 氨基酸类药物质量风险分析与应对策略研究(山广志 中国医学科学院医药生物技术研究所)5. 药物晶型研究技术应用及分析策略(吕杨 中国医学科学院药物研究所)6. 生物技术产品质量控制要点(赵雄 国家药典委员会)7. 生物制品生产用药用辅料的质控要点(国药集团中国生物技术股份有限公司)8.非无菌化学药品及原辅料微生物限度研究技术指导原则解读(国家药品监督管理局药品审评中心)9. 微生物快检技术在药物质控的研究应用[连敏 默沙东研发(中国)有限公司]10. 药品无菌检验用隔离器系统应用及控制要点(厉高慜 上海市食品药品检验研究院)11. 药品生产用无菌隔器系统发展现状及风险管控(东富龙生命科技有限公司)2023年4月13日12. 吸入制剂现场检查指南的解读(国家药品监督管理局食品药品审核查验中心)13. 基于风险考量的吸入制剂研发设计(金方 广州呼吸健康研究院)14. 吸入制剂质量评价关键技术及其在质量标准控制中的应用(徐玉文 山东省食品药品检验研究院)15. 基于质量控制的缓控释制剂风险应对策略(刘玉玲 中国医学科学院药物研究所)16. 新型纳米药物国内外发展现状及质控技术要求(张强 北京大学)17. 复杂注射剂质量及其风险控制策略(周建平 中国药科大学)18. 预充注射器关键质控要点及标准研究进展(俞辉 浙江省食品药品检验研究院)19. 药物基因毒性杂质控制方法与策略比较分析(杨永健 上海市食品药品检验研究院)20. 美国药典制药用水控制及标准制定情况概况(美国药典委员会中华区)21. 国内外制药用水制备及质量控制现状(中国医药工程设备协会)22. 药物制剂质量控制与标准研究中的关键分析技术进展[沃特世科技(上海)有限公司]
企业动态
2023.04.04
内毒素的分子基础、调节因子及与机体免疫系统的关系简介
一、表达不同的生物学活性的分子基础内毒素一方面表达有益作用,另一方面又可表达毒害作用,故而应用内毒素及其类脂A的化学降解片段,特别是化学合成的衍生物,可从分子水平了解内毒素(类脂A)结构中分别表达有益和毒害作用的最小结构片段。例如,已经合成了类脂A一种称为GLA-27的衍生物,这一分子系携带3个脂肪酸残基及1个磷酸基团的D-氨基葡萄糖单糖结构,不表达明显的毒性,但可发挥显著的抗肿瘤及抗病毒感染活性。这类衍生物从而可进行临床试验,应用于临床抗肿瘤及抗病毒治疗。二、内毒素诱导的内源性调节因子体内应用内毒素,可直接地或间接地刺激免疫活性细胞产生多种内源性调节因子,如肿瘤坏死因子(tumor necrosis factor,TNF),干扰素(interferons,IFNs),白细胞介素(interleukins ,ILs),集落刺激因子(colony-stimulating factors,CSFs)等。这类内源性因子可发挥免疫调节从而起到增强机体抵抗力的作用。TNF系由激活的单核巨噬细胞系统所产生的一种分子量为17KD的蛋白质。体内直接应用TNF时可见到实体肿瘤发生出血坏死,最终肿瘤消失,动物或病人得到彻底痊愈。如果以刺激剂诱导荷瘤动物或人产生内源性TNF,则可观察到肿瘤的消失现象与体内TNF水平成正相关关系。故而,深入了解这类内源性因子的产生、作用机理,特别是探索临床应用的可能性,可为临床抗肿瘤治疗找到新的方法,具有重要的现实意义。三、内毒素与机体免疫系统的相互关系我们生活在充满内毒素的环境中,自我们出生的那天起,我们就受到内毒素细菌(特别是正常肠道菌)的感染,并与内毒素的“共生”状态将持续整个人生。即使是消毒的食物亦含有内毒素,因为内毒素相当耐热,200℃干烤亦需2~4h才能使内毒素彻底破坏,因而我们不可能创造一个严格的“无内毒素”生命。动物实验已证明,所谓的“无菌动物”对内毒素及细菌感染高度敏感,因而这种动物患细菌感染时的死亡率极高,而一般的动物则对细菌感染及应用内毒素有相当的基础免疫力。这一事实说明内毒素对于机体免疫系统的发育成熟起着重要的作用。我们的祖先在几千万年的进化过程中与自然界作斗争的结果形成了我们现在的“内毒素适应状态”。故而内毒素在人类进化史上具有重要的意义。可以设想,日常生活中体内极微量内毒素的不断进入,将伴随人类整个生命过程,并成为一种具有高度活性的“外激素”(exo-hormone)。
参数原理
2023.04.04
白细胞介素-1(IL-1)的产生及调节
内毒素可通过刺激单核细胞和巨噬细胞,使其产生白细胞介素-1(IL-1)、肿瘤坏死因子(TNF)、干扰素(IFN)等炎症介质和细胞因子。本文介绍IL-1的产生及调节。IL-1主要由单核-巨噬细胞产生。其他细胞,如角膜上皮细胞、肾小球系膜细胞、内皮细胞、树突状细胞,成纤维细胞等也能分泌IL-1。但无论细胞在体内或体外,当缺乏刺激时,IL-1的基因都不表达,只有细胞激活后才能诱导合成IL-1α和IL-1β前体蛋白。这些诱导剂有:内毒素、补体分子、其他细胞因子(TNF、IFN-Y、GM-CSF、IL-1本身)等,它们能够促使其转录,但并非必然导致翻译。例如,细胞粘连可以造成IL-1 mRNA的积聚,但无IL-1的翻译,此时需要一个激发性刺激(微量内毒素)使其翻译成蛋白质。IL-1的合成可被内源性物质所抑制,尤其是前列腺素(PG)和糖皮质激素(GC)。体外单核细胞株IL-1的生成能被加入的PGE2所抑制,该抑制效应被认为是一种负反馈机制,因为用内毒素、佛波酯等刺激物质刺激时既产生IL-1也生成PGE2,后者能限制IL-1的生成;相反PG的抑制又能促进IL-1的生成。GC 抑制IL-1的合成涉及转录和翻译两个途径。肾上腺切除的动物IL-1的生成增加,说明GC是IL-1生成的抑制剂。刺激诱导IL-1生成的同时,也诱导IL-1Ra的生成,可使IL-1的作用得到平衡,另外,L-1的产生还受到自身反馈调节。细胞受刺激后可产生IL-1,同时也产生PGE2,后者可抑制IL-1的产生。除糖皮质激素外,其余物质如cAMP、TGF-β、IL-2、维生素及PGE2均能抑制IL-1的产生。总之,诱导IL-1的因素也能刺激IL-1Ra的产生以平衡IL-1的作用。但L-1和IL-1Ra的表达也可无关,如免疫复合物多聚糖常选择性地促进IL-1Ra的产生;IL-4、IL-13抑制IL-1的分泌却增加IL-1Ra的产生。
参数原理
2023.04.04
白细胞介素- 1中IL-1β的特点
白细胞介素- 1(interlenkin 1,1L-1)的基因家族成员之一为IL-1β,此文介绍IL-1β的特点。IL-1α和IL-1β有许多类似之处,也有很多不同的方面,两者的成熟体都是β折叠的三维结构,在翻译过程中与细胞骨架相结合,而不是在内质网进行。两者前体的赖氨酸残基上能发生豆蔻酰基化修饰;但在基因的表达,mRNA的稳定性,翻译、加工和分泌等的调控方面却存在显著差异。IL-1β的前体或成熟体在结合受体的亲和力方面不同于IL-1α。一旦IL-1β从细胞释放出来,即可与两个拮抗剂,IL-1R Ⅰ和IL-1Ra,竞争结合细胞表面受体,这两种拮抗剂调节着IL-1β的活性。IL-1β从细胞释放出来后表现为全身性激素样介质,而IL-1α主要在局部炎症的介质中和细胞内的活动进行调节。IL-1β的启动子区有典型的TATA盒,这一点不同于IL-1α,IL-1β mRNA 的半衰期取决于细胞类型和刺激的条件。如内毒素刺激后发生IL-1β mRNA 的短暂转录,则mRNA稳定性也增加,4h达到高峰,以后表达下降,下降是由于转录抑制子合成或mRNA的半衰期下降所致。用cAMP诱导剂或IL-1刺激人单核细胞,mRNA可持续升高24h。加入组胺或PGE2可使cAMP升高并能增强IL-1α诱导的IL-1β基因的表达和合成;但用内毒素刺激后,cAMP可降低IL-1β的合成。IL-1是自身基因表达的刺激物,用IL-1刺激细胞后,IL-1β持续升高可超过24h。在人外周单个核细胞,视黄酸可诱导IL-1β表达,但起初的前体转录子不能够产生成熟的mRNA,用环己酰胺(CHX)可抑制其翻译,增强外显子的拼接和内含子的切割,使成熟的mRNA 升高到两个数量级。IL-1β的基因调控区有cAMP反应元件、NF-κB样位点、AP-1反应元件,以及 NF-IL-6和Spi/PU.1等,具体如何调节还有待进一步阐明。
应用实例
2023.04.03
关于IL-1α的核定位、膜L-1α及作用的介绍
诱生内原性热原(endogeneons pyrogens,EPS)的间接作用,使内毒素引起了机体发热。诱生内原性热原之一为白细胞介素- 1(interlenkin 1,1L-1),白细胞介素- 1(interlenkin 1,1L-1)的基因家族成员之一为IL-1α。这篇文章我们将介绍IL-1α的核定位及位置等,见下文。一、IL-1α的核定位IL-1α能够作为自分泌生长因子,应该涉及三种机制:①ProIL-1a合成后保留在细胞内,通过某种途径结合到细胞核上直接发挥作用。②细胞内ProIL-1α在发挥配体受体复合物效应之前已与细胞内IL-1RⅠ形成复合物。③ProIL-lα或成熟IL-1α可以结合IL-1RⅠ后进行内化,转位到细胞核,其类似于类固醇受体,能促使基因表达。二、膜L-1αProIL-1α能表达在某些细胞表面上,尤其在单核细胞和B淋巴细胞受到刺激后,更为显著。大约10%~15%的IL-1α发生豆蔻酰化(myristolation)修饰,特定赖氨酸残基上发生豆蔻酰化可加速IL-1α迁移到细胞膜上,也称膜IL-1α。膜 IL-lα具有生物学活性,用抗IL-1α抗体能够中和膜IL-1α的生物学活性,而抗IL-1β抗体无此种作用。IL-1Ra能够阻止IL-1α结合到IL-1R,但对膜IL-1α的生物学活性并无影响。三、细胞内L-1α的作用其他缺乏前导序列的细胞因子,如睫状神经营养因子和FGF,通过结合到各自细胞表面受体后才能活化细胞。当IL-3蛋白质表达突变时,不能分泌到细胞外,此时细胞内的IL-3可作为自分泌生长因子发挥效应。在正常皮肤棘细胞中表达有大量ProIL-1α,能影响细胞的终末期分化。细胞表达ProL-1α的同时,也存在大量IL-1α的胞内形式(intracellu-lar IL-1Ra,icIL-Ra),可与胞内ProIL-1α竞争细胞核的结合位点,发挥效应。
参数原理
2023.04.03
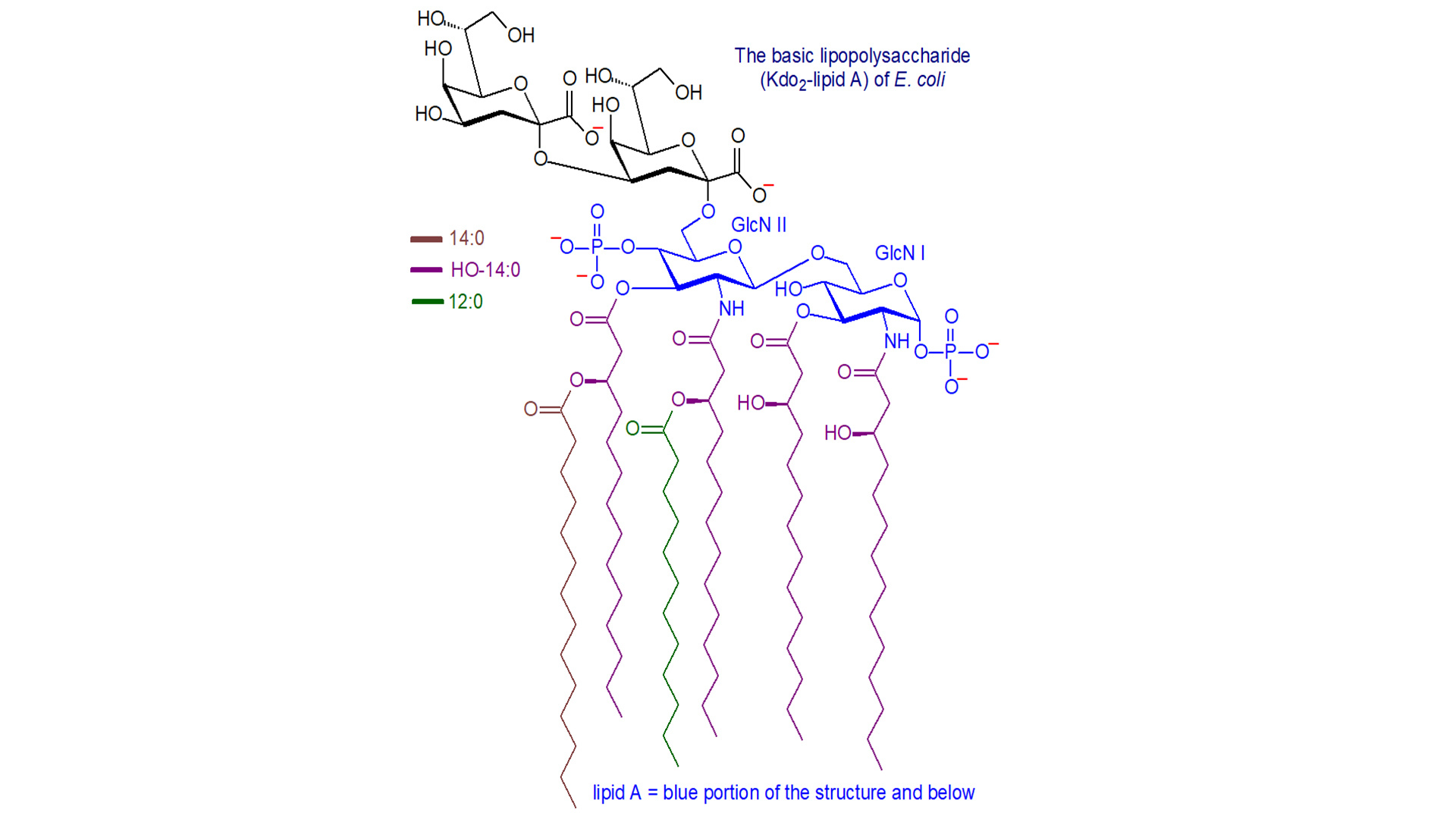
内毒素活性部位:类脂A的生物学反应介绍
内毒素的活性部位为类脂A,它可以介导几乎所有的内毒素生物学反应。类脂A为一种特殊类型的磷脂,它通过核心的KDO成分而与内毒素的多糖部分结合。应用温和酸控制水解可将类脂A从内毒素分子中裂解出来,此称为游离类脂A(free lipid A),而存在于完整LPS中的类脂A称为结合类脂A(bound lipid A),游离类脂A在自然界中是不存在的。类脂A的骨架是由一个β1’-6-糖苷键相联的D-氨基葡萄糖双糖单位所组成,骨架还原端的C1位及非还原端的C4’位均有磷酸基团所取代。骨架的羟基及氨基可由羟基脂肪酸或脂肪酰脂肪酸所取代。许多不同种属的细菌甚至在分类学上相差甚远的细菌,均具有基本一致的类脂A骨架,它们间的主要差别则是在骨架上取代脂肪酸碳原子数目或/和磷酸基团的取代不尽一致。随着细菌的进化,其所合成的类脂A结构愈为复杂,故而研究类脂A结构对于了解细菌的进化具有重要的意义。许多不同种属细菌所产生的类脂A具有较好的血清学反应性。类脂A为一种半抗原,但如与载体结合(复合抗原)则可诱导高滴度抗体的产生。由于分析与合成化学家的密切合作,肠道菌(如沙门氏菌及大肠杆菌)的类脂A已进行了全分子化学合成。化学合成的类脂A与天然类脂A在许多生物学系统中均能发挥一致的生物学反应。随着其它类脂A及其众多衍生物或同类物的化学合成,目前已有可能从分子/细胞水平上研究类脂A结构与功能的关系。
参数原理
2023.03.30
内毒素的化学结构及功能
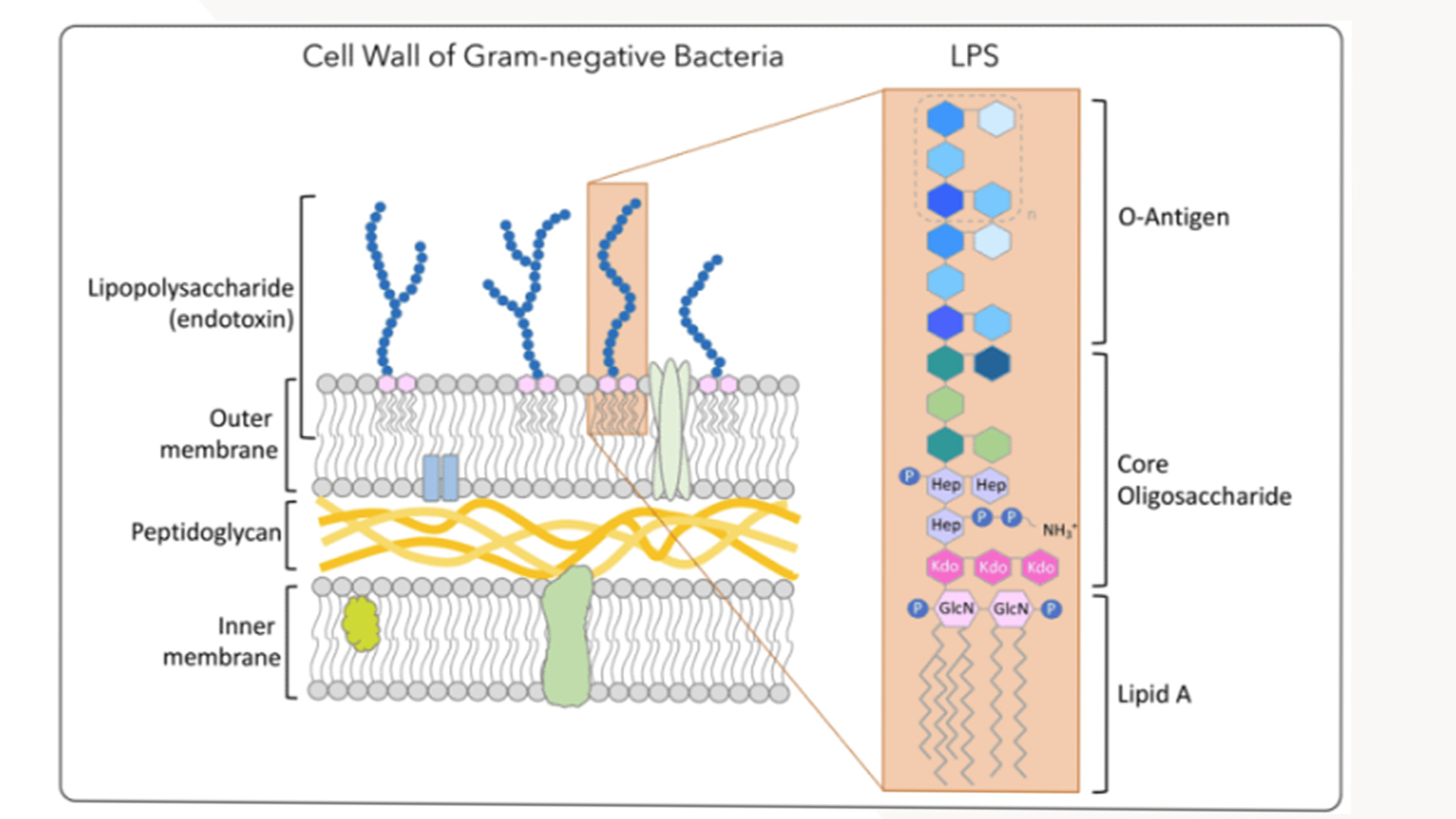
现今已经清楚内毒素(endotoxins)系存在于革兰氏阴性菌细胞壁外膜中的脂多糖(lipopolysaccharides,LPS)成分。在结构及功能上具有三个“两性”特征,即属于两性(亲水性、疏水性)分子,携带两极(正、负)电荷,及发挥两相(有益、毒害)作用。内毒素是一类具有高度活性的分子,对机体具有广泛的生物学作用,故而在革兰氏阴性菌感染的发病机制中起着十分重要的作用。革兰氏阴性菌感染时释放的内毒素或静脉注射提取的内毒素,可发生严重的致死性内毒素休克(endotoxin shock),其特征是从休克可逆期到不可逆期的转变期相极短,往往只有数分钟至2h。故而临床医生常常来不及采取有效的治疗措施。除此之外,如果体内少量应用内毒素,可观察到有显著抗肿瘤,增强机体非特异性抵抗力、抗放射及移植物对宿主的排斥反应等有益作用。内毒素在化学结构上有两部分具有不同理化性质的成分组成,即多糖成分及脂类——类脂A(lipid A),前者又可以分为O-特异性多糖链及核心寡聚糖。O-特异性多糖即先前所称的O-抗原或O-因子,由多个寡聚糖重复单位(每个重复单位含3~6个糖残基)组成。对于不同细菌产生的内毒素来讲其重复单位的数目(决定链的长短)可由0粗糙型内毒素,R-LPS)到70个以上不等。O-多糖侧链是革兰氏阴性菌及其内毒素分子中最易变异的表面抗原成分,各种不同种属的细菌其О-抗原的结构不同,故而它们之间无血清学交叉反应性。正是根据这一点,革兰氏阴性菌(特别是肠道菌>可进行O-抗原分类。应用O-抗原相对应的抗体,临床上可以快速进行细菌鉴定。核心多糖是内毒素组成成分中结构较为恒定的部分,一般由7~11个糖残基组成,其中含有内毒素的特征性成分——2-酮-3脱氧-D-甘露型辛酮糖酸(2-keto-3-deoxy-D-mannooctonate,KDO)及L-甘油型庚糖。一般讲,同一种细菌,其核心寡聚糖的变异较小,如沙门氏菌属只含一种类型的核心,而大肠杆菌属亦只存在六种核心类型。内毒素中核心寡聚糖的免疫决定基,取决于核心成分末端的糖残基结构,不同种属的细菌,甚至不同类型的微生物,只要其产生的内毒素核心结构一致,即具有血清学交叉反应性。如沙眼衣原体产生的Re-型内毒素与明尼苏达沙门氏菌R595的Re内毒素结构一致,故而它们具有交叉反应性。
参数原理
2023.03.30
内毒素的研究发展历程
大约于100年前(1892~1895年),德国Robert Koch的学生Richard Pfeiffer在研究霍乱弧菌感染的发病机理时,发现该菌可产生两种具有不同性质的毒性物质,一种为由活菌合成并释放出来,对热敏感的蛋白质成分即外毒素(exotoxin),另一种为对热抵抗,并且只有当细菌崩解后才能释放出来的非蛋白质成分,他将后一种毒性物质称为内毒素(endotoxin)。紧接着,意大利的Engenio Centanni通过自溶的方法从各种革兰氏阴性杆菌中提取到了类似的毒性物质,他称其为致热毒素(pyrotoxina),因为这类物质在表达毒性的同时始终亦表达显著的发热反应活性。同时期,德国的Hans Buchner证实从多种细菌提取得到的内毒素物质除引起发热外,可引起白细胞数目的改变,并可显著增强机体对细菌感染的抵抗力,从而Buchner开创了“非特异性疗法”或“发热疗法”。纽约的外科医师William B. Coley将加热杀死的灵杆菌和化脓性链球菌上清滤液应用于各种恶性肿瘤(特别是肉瘤)的治疗,并取得了较为满意的疗效。他将其应用的细菌上清液称为Coley氏毒素。继后,Murray J. Shear证实Coley氏毒素中发挥抗肿瘤作用的物质为内毒素。但是,内毒素化学本质的阐明是到了50年代后才开始的。德国的Otto westphal和Otto Liederitz首先介绍了提取高纯度内毒素的方法一一酚水法,使得内毒素的化学和结构分析成为可能,从而开创了内毒素化学和内毒素分子生物学研究的新时代。
参数原理
2023.03.30
内毒素生物学活性的毒性及益处
一般认为,内毒素表达生物学活性并不是直接的,而是通过与合适靶细胞的相互作用从而引起内源性介质的诱导和/或释放而实现的。已经证明肿瘤坏死因子和白细胞介素可介导内毒素的毒性和其他活性。临床医生对内毒素的兴趣主要是它的毒害作用,工作的重点则集中于预防和治疗休克。特别感兴趣的就是应用许多革兰氏阴性致病菌LPS交叉反应性抗体的免疫治疗。对于核心以及类脂A共同结构抗体保护作用的研究已证实疗效不大。除了毒性反应外,内毒素还可发挥许多对宿主有益的生物学活性。其中,诱导对感染的非特异性抵抗力、佐剂活性以及肿瘤坏死活性是很显著的。但是内毒素的高度毒性一直影响了它们治疗应用的开展,并且这也是临床应用不能深入开展下去的主要原因。随着类脂A结构的阐明以及化学合成的开展,已有可能针对这一问题采取新的方法。已合成了许多类脂A部分结构及其同类物,并且还会有更多的合成产物出现。这些制品目前正在许多实验室进行试验,其目的是找到具有低毒性但仍然保留有显著药理和免疫刺激作用的结构。合成的方法依旧会是一个令人注目的领域。
参数原理
2023.03.28
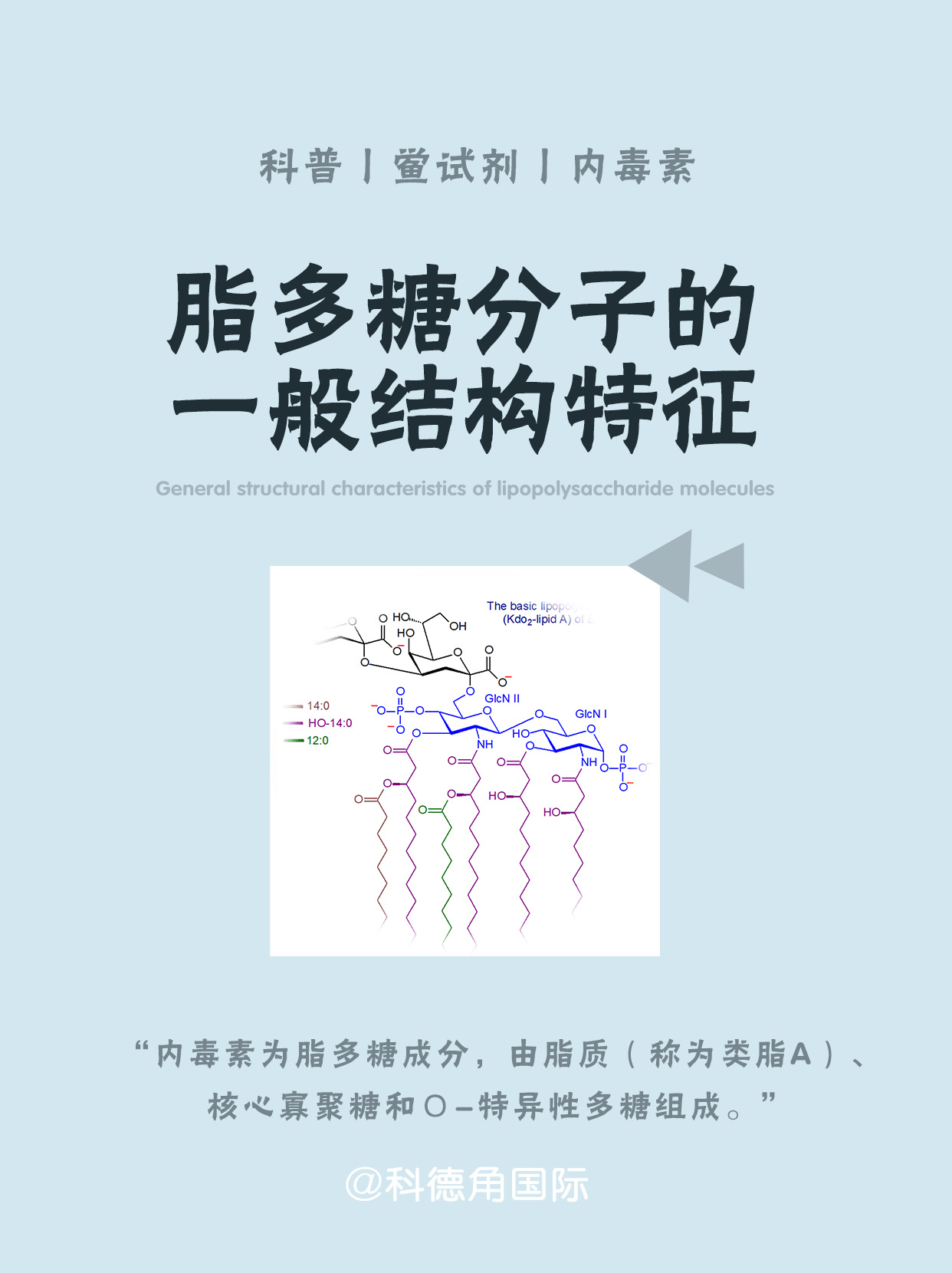
脂多糖分子的一般结构特征
革兰氏阴性菌的致病性以及革兰氏阴性菌脓毒血症时出现的毒性表现是与牢固结合在其细菌外膜中的一种大分子物质即内毒素密切相关的。内毒素介导了感染期间所出现的众多病理生理学反应。早期对革兰氏阴性菌内毒素活性分子提取的尝试得到了含有碳水化合物、脂质、蛋白质、核酸以及细菌其它产物的混合物,但对混合物中活性成分的本质仍然不知。自50年代介绍了酚水法作为提取手段后,使得对内毒素化学和生物学特性的系统研究成为可能。主要是对沙门氏菌所进行的化学研究已证实内毒素为脂多糖(lipopolysaccharides ,LPS)成分,由脂质(称为类脂A)、核心寡聚糖和О-特异性多糖组成。后一成分一般讲由相同的寡聚糖单位重复联结而成,并作为LPS分子的血清学和免疫学决定簇结构。从而已经阐明了LPS分子的一般结构特征。LPS中的内毒素活性部位为类脂A成分,这一点在50年代就已作出了推测,并在以后的二十年间得到不断证实。对于类脂A作为LPS生物学活性分子重要性的认识促进了类脂A化学结构的研究。在很早以前就已认识到许多革兰氏阴性细菌的类脂A结构具有很大的相似性。在过去的十年间类脂A的化学结构得到了全面的阐述。今天,已经非常详细地了解了肠道菌和其他细菌的类脂A结构,并且阐明的总数还在不断地增加。对类脂A及其生物合成过程中前体分子化学结构的阐明使得化学合成完全、不完全类脂A及其同类物成为可能。大肠杆菌的天然类脂A及其合成产物已被证实表达一致的化学、免疫学和生物学特性。合成品无论是现在还是将来对于结构—-―活性的研究均是极有价值的。
参数原理
2023.03.28
内毒素刺激单核细胞可产生IL-1α
我们知道了内毒素引起发热反应的原理是因为诱生内原性热原(endogeneons pyrogens,EPS)起了间接作用。而EPS又包括肿瘤坏死因子(tumor necrasis factor,TNF)、白细胞介素- 1(interlenkin 1,1L-1)、β2-干扰素(interonB2,IFN-Bz)。 现在我们就介绍白细胞介素- 1(interlenkin 1,1L-1)的基因家族成员之一:IL-1α。IL-1α基因位于2q13~21,基因大小为11kb,有7个外显子,无信号肽序列。IL-1α基因启动子区域缺乏TATA盒模体,诱导IL-1α表达涉及其上游4.2kb和近侧200bp启动子区。第一个内含子内有NF-IL-6和NF-kB序列,可调控IL-1α的表达,至于其他调控元件是否参与调控,尚有待阐明。一、IL-1α的产生大多数细胞在正常时并不合成IL-1α,只有在细胞被激活后才诱导合成IL-1α前体蛋白。相对分子质量为31000的IL-1α前体蛋白(precursor IL-1α,ProIL-1α)合成时与细胞骨架(微管)相结合,这一点与其他大多数蛋白质在内质网内进行翻译有所不同。ProIL-1α如同IL-1α一样具有活性,留滞在细胞内。IL-1β的前体蛋白缺乏活性,只有通过细胞内特异性蛋白酶切后分泌到胞外才发挥作用。一旦细胞死亡,ProIL-1α释放出来,可被细胞外的蛋白酶进行酶解。ProIL-1α也可被钙离子依赖性膜结合型半胱氨酸蛋白酶即需钙蛋白酶(calpain)活化后进行酶解。在转化细胞株,ProIL-1α以结构型表达,加入钙离子可刺激需钙蛋白酶活化,并切割 ProIL-1α产生IL-1α,所以细胞未死亡时也可有相对分子质量为17000的IL-1α的释放。细胞内的IL-1α,由于缺乏前导肽,ProIL-1α翻译后滞留在胞质内。应用免疫组化方法研究证实,用内毒素刺激单核细胞后可观察到细胞内有弥散分布的IL-1α。因为IL-la具有与细胞结合的特性,所以正常血液中检测不到L-1α。ProIL-1α作为自分泌生长因子可在细胞内ProIL-1α调节细胞分化,尤其在上皮细胞和外胚层细胞。角质细胞以结构形式生产ProIL-1α。有些学者认为,在某些细胞,ProIL-1a可作为细胞内的信使,如在内皮细胞使用IL-1α的反义寡核苷酸可延迟细胞衰老,这是一个对前列腺素具有依赖性的过程。而成纤维细胞无类似效应,说明ProIL-1a的自分泌效应是有细胞特异性的。在小鼠TH2细胞中,IL-1α是一种自分泌和旁分泌生长因子,这已被反义IL-1α寡核苷酸和抗IL-1α抗体的实验所证实。
参数原理
2023.03.28
TNF-α对肝脏和神经内分泌系统的作用
(一)肝脏TNF-α能够诱导肝脏产生急性时相蛋白,抑制白蛋白的合成,通过IL-1和IL-6还能够放大这种效应。TNF-α可直接刺激循环中脂质增加,过度的脂质生成引起急性期常见的高三酰甘油血症。TNF-α还可增加肝脏氨基酸的清除,加速糖原介导的氨基酸转运进入肝细胞,因而加速外周组织中的氨基酸进入肝脏而被降解,引起氮负平衡。TNF-α作用于肝细胞可以增加某些血清蛋白质的合成,如血清淀粉样A蛋白。由TNF-α诱导合成的蛋白质谱与IL-1诱导的相同,但不同于IL-6诱导的。由TNF-α或IL-1加上IL-6诱导衍生的血浆蛋白质联合构成对炎症刺激的急性应答。尽管急性应答的生理作用尚未完全阐明,但TNF能够增加非特异性免疫的效应。(二)神经内分泌系统只有少量 TNF-α能够穿过血-脑屏障,脑中的TNF-α主要在脑内产生。TNF-α可作用于下丘脑体温中枢和食欲中枢,引起发热和厌食。TNF-α引起的厌食能够被胰岛素抑制而与5-羟色胺无关。脑炎时脑部的炎症和水肿与TNF-α密切相关,脑脊液中高水平的TNF-α提示预后不良。TNF-α引起的炎症与多发性硬化症患者脑中的特征性空斑形成有关,抗TNF-α抗体可使实验性多发性硬化症的脑部炎症明显减轻。脑肿瘤时出现的水肿也与TNF-α有关。神经胶质细胞可被诱导产生 TNF-α,促使一些脑肿瘤患者脑部TNF-α升高,而TNF-α又可促进星形细胞增殖并在脑肿瘤周边引起毛细血管渗漏综合征,导致脑水肿。支配下丘脑调节中枢的神经也能够产生TNF-α,这些TNF-α可有神经递质的作用。TNF-α还能够促进神经生长因子的合成和分泌。TNF-α是一种可作用于下丘脑体温调节中枢某些神经细胞的内源性致热原。TNF-α与IL-1均具有这一特性,TNF-α或IL-1引起的发热与激活下丘脑细胞引起前列素合成增加有关,前列腺素合成抑制剂如阿司匹林可通过阻断TNF-α或IL-1的这一作用阻止发热。TNF-α对内分泌的作用与剂量、输入途径和宿主的新陈代谢状态以及疾病状态有关。正常动物输入TNF-α几分钟后,血清中ACTH、皮质类固醇、儿茶酚胺﹑糖原和胰岛素增加;早期有高血糖症,随后是持续的低血糖。TNF-α能够刺激体外培养的大鼠垂体细胞内cAMP含量减少;呵噪美辛(消炎痛)能够部分抑制TNF-α的这一作用,提示这一作用与前列腺素释放有关。在体外和体内,TNF-α都能够直接与垂体中的受体作用,诱导生长激素分泌。TNF-α又能够抑制下丘脑激素对大鼠腺垂体细胞产生ACTH,LH、生长激素和催乳素的刺激作用。TNF-α还能够抑制促肾上腺皮质激素释放因子诱导的ACTH分泌,TNF-α的这种作用与严重脓毒血性休克患者的死亡有关。TNF-α诱导垂体细胞产生垂体激素的不同作用可能与不同的剂量有关。小剂量有促进作用而大剂量则抑制。大鼠和牛的卵巢粒膜(granulosa)细胞能产生和分泌TNF-α,并在局部减轻促性腺激素的作用,影响卵巢类固醇的产生和滤泡的发育。TNF-α可通过增强IL-1β抑制睾丸间质(Leydig)细胞产生类固醇的效应,减弱FSH对大鼠卵巢粒膜细胞的作用,促进发情期大鼠卵巢滤泡产生黄体酮。小剂量TNF-α即可抑制滤泡产生雌烯二酮,但不影响雌二醇的产生。
参数原理
2023.03.24
TNF-α对骨、软骨、肌肉和脂肪的作用
TNF-α(tumor necrsis factor,肿瘤坏死因子)能够促进骨细胞生长和合成DNA,抑制碱性磷酸酶活性并促使骨形成受阻,因此在骨质吸收和重建中起重要作用。长期暴露在TNF-α中的成骨细胞,其功能受抑,胶原降解增加。TNF-α还可刺激软骨重吸收和抑制软骨细胞合成蛋白多糖。TNF-α能够降低骨骼肌胞质的静息电位,增加细胞内钠离子浓度,使血管内钠离子减少,这种情况在休克和危象中经常出现。肌肉对TNF-α的反应包括:糖原储备耗尽、氨基酸外流增加使蛋白质丢失、乳酸外流增加、糖转运先增加后受到抑制,此外还有肌肉蛋白的净分解。接受TNF-α注射的患者常常有类似于病毒或细菌感染时出现的肌痛。TNF-α能够抑制脂蛋白脂酶的活性,刺激脂肪溶解增加,抑制几种关键的脂肪生成酶基因的转录。所以,经TNF-α的处理,脂肪细胞会脱脂肪,外源性脂肪摄取被抑制,糖原合成脂肪的途径被阻断。总的效应是脂肪细胞和肌肉细胞释放氨基酸、乳酸和脂肪,并将这些物质分流到肝脏和其他内脏。TNF-α对肝脏中脂蛋白脂酶的活性却是促进的。TNF-α对肌肉和脂肪的作用可导致全身恶液质状态。实验动物表明,长期使用TNF-α可引起以肌细胞和脂肪细胞消耗为特征的恶液质状态,此时的恶液质是由于TNF-α诱导食欲抑制和脂蛋白脂酶合成抑制而产生的。虽然TNF-α本身可使实验动物产生恶液质,但其他细胞因子如IL-1,也与一些慢性疾病如肺结核、癌症的恶液质状态有关。
参数原理
2023.03.24