推荐厂家
暂无
暂无




 400-807-5250
400-807-5250
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-875-3707
400-875-3707
 留言咨询
留言咨询



[font=宋体]在生物学和医学领域,免疫组化和免疫分型是两种常用的实验技术,它们各自具有独特的应用和优势。虽然这两种技术都涉及到免疫学的原理和方法,但它们在实验目的、操作过程、结果解读等方面存在显著的差异。本文将对免疫组化和免疫分型进行详细的比较和讨论,以揭示它们之间的区别。[/font][font=宋体] [/font][b][font=宋体]定义区别:[/font][/b][font=宋体][font=宋体]免疫组化([/font][font=Calibri]Immunohistochemistry[/font][font=宋体])是一种利用免疫学原理,通过特异性抗体与细胞或组织中的抗原进行反应,进而通过染色或标记等方法来定位和检测抗原的技术。其主要应用于组织切片或细胞涂片的染色,以观察和研究抗原在细胞或组织中的分布、定位及表达情况。免疫组化技术可以帮助我们了解细胞或组织的类型、功能状态以及病理变化,对于疾病的诊断、预后评估以及药物研发等方面具有重要意义。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫分型([/font][font=Calibri]Immunophenotyping[/font][font=宋体])是一种通过检测细胞表面或细胞内的特定抗原,来识别和分析细胞类型的技术。该技术主要应用于对免疫细胞(如淋巴细胞、巨噬细胞等)进行分型,以了解其在免疫系统中的功能和作用。免疫分型技术可以帮助我们深入了解免疫系统的结构和功能,揭示免疫细胞在疾病发生和发展过程中的作用,为疾病的诊断和治疗提供新的思路和方法。[/font][/font][font=宋体] [/font][b][font=宋体]实验目的区别:[/font][/b][font=宋体]免疫组化主要关注抗原在细胞或组织中的定位和表达情况,而免疫分型则侧重于对免疫细胞进行分型和功能分析。从操作过程来看,免疫组化通常需要对组织或细胞进行切片、固定、染色等步骤,而免疫分型则可能涉及到细胞的分离、培养、流式细胞术等操作。从结果解读来看,免疫组化的结果主要表现为抗原在细胞或组织中的分布和表达模式,而免疫分型的结果则提供了关于免疫细胞类型、比例和功能状态的信息。[/font][font=宋体] [/font][font=宋体] [/font][b][font=宋体]应用领域区别:[/font][/b][font=宋体]免疫组化在病理学、肿瘤学、神经科学等领域有广泛应用,可以帮助医生进行疾病的诊断和预后评估。而免疫分型则更多地应用于免疫学、血液学、感染病学等领域,有助于深入了解免疫系统的功能和疾病发生机制。[/font][font=宋体] [/font][font=宋体]综上所述,免疫组化和免疫分型是两种具有不同特点和应用领域的实验技术。虽然它们都涉及到免疫学的原理和方法,但在实验目的、操作过程、结果解读以及应用领域等方面存在显著的差异。因此,在实际应用中,我们需要根据研究目的和需求选择合适的技术手段,以获取准确、可靠的实验结果。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/flow-cytometry-service][b]流式细胞检测技术服务[/b][/url],详情关注:[/font][font=Calibri]https://cn.sinobiological.com/services/flow-cytometry-service[/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b]
[font=宋体][font=宋体][url=https://cn.sinobiological.com/services/immunofluorescence-service][b]免疫荧光技术[/b][/url]([/font][font=Calibri]Immunofluorescence technique [/font][font=宋体])是在免疫学、生物化学和荧光成像系统基础上建立起来的检测技术。技术原理是根据抗体[/font][font=Calibri]-[/font][font=宋体]抗原特异结合,以荧光标记抗体示踪组织或细胞内相应抗原。免疫荧光技术因特异性强、灵敏度高和操作简便的优势广泛应用于免疫学、微生物学、病理学、肿瘤学以及临床检验等生物学和医学。[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫组化,是应用免疫学基本原理[/font][font=宋体]——抗原抗体反应,即抗原与抗体特异性结合的原理,通过化学反应使标记抗体的显色剂(荧光素、酶、金属离子、同位素)显色来确定组织细胞内抗原(多肽和蛋白质),对其进行定位、定性及相对定量的研究,称为免疫组织化学技术[/font][font=Calibri](immunohistochemistry)[/font][font=宋体]或免疫细胞化学技术[/font][font=Calibri](immunocytochemistry)[/font][font=宋体]。[/font][/font][font=宋体] [/font][font=宋体][b]区别:[/b][/font][font=宋体] [/font][font=宋体]免疫组化和免疫荧光都经过免疫原,原理相似,只是显色剂不同,免疫荧光是免疫组化技术之一。[/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、免疫组化是应用免疫学的基本原理,即抗原和抗体特异性结合的原理,通过化学反应确定组织细胞中的抗原,使标记有抗体的显色试剂显色,并对其进行定位、定性和相对定量研究。在免疫组化过程中,常用的显示剂包括荧光素、酶、金属离子或同位素。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、免疫荧光是一种不会影响抗原和抗体活性的荧光色素,被标记在抗体或抗原上,然后与其对应的抗原或抗体结合,在荧光显微镜下呈现特异性的荧光反应。免疫荧光是免疫组化技术之一,具有特异性强、灵敏度高、速度快的特点。但相对结果判断的客观性不足,技术程序复杂。[/font][/font][font=宋体] [/font][font=宋体]免疫组化与免疫荧光的真正目的均为明确病理诊断,以便患者获得精准治疗。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州拥有专业的技术人员和共聚焦显微镜等仪器平台,为客户提供高质量的免疫荧光检测服务,包括对细胞爬片、石蜡切片、冷冻切片和组织芯片等进行免疫荧光单染、双染、及多重染色等。可以为客户提供免疫荧光([/font][font=Calibri]IF[/font][font=宋体])检测服务和石蜡切片免疫组化([/font][font=Calibri]IHC[/font][font=宋体])检测服务,有需求的朋友可以来义翘官网进行查询,详情参看[/font][font=Calibri]https://cn.sinobiological.com/services/immunofluorescence-service[/font][/font]
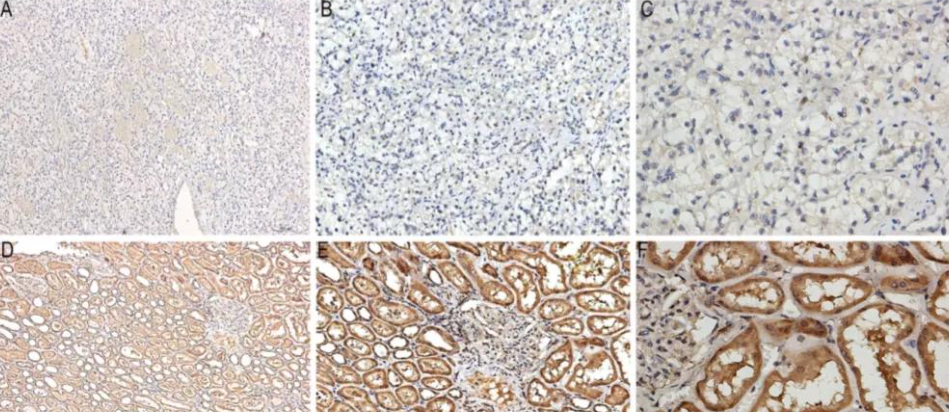
[font=Calibri][font=宋体]免疫组化技术,运用免疫学的基本原理[/font][font=Calibri]——[/font][font=宋体]抗原抗体反应,即抗原与抗体之间的特异性结合。通过化学反应,使标记在抗体上的显色剂(如荧光素、酶、金属离子、同位素)显现颜色,从而确定组织细胞内的抗原(多肽和蛋白质)。该技术不仅对这些抗原进行定位,还能进行定性和相对定量的研究。这种技术被称为免疫组织化学技术或免疫细胞化学技术[/font][/font][font=宋体][font=Calibri](immunocytochemistry)[/font][/font][font=Calibri][font=宋体]。[/font][/font][font=Calibri][font=宋体]免疫组化,简而言之,是免疫学、组织学和化学的完美结合。它利用免疫学方法对组织进行标记,再通过化学方法进行染色,从而标记出组织中的特定蛋白或一组蛋白。这项技术目前在临床病理诊断中得到了广泛应用,并衍生出了多种技术变种,如免疫细胞化学、免疫组织荧光等,为生物医学研究提供了强大的工具。[/font][/font][font=宋体] [/font][b][font=宋体]一、免疫组化技术的基本原理[/font][/b][font=宋体] [/font][font=宋体]应用免疫学及组织化学原理,对组织切片或细胞标本中的某些化学成分进行原位的定性、定位或定量研究,这种技术称为免疫组织化学技术或免疫细胞化学技术。[/font][font=宋体] [/font][font=宋体][font=宋体]众所周知,抗体与抗原之间的结合具有高度的特异性。免疫组化正是利用这一特性,即先将组织或细胞中的某些化学物质提取出来,以其作为抗原或半抗原去免疫小鼠等实验动物,制备特异性抗体,再用这种抗体(第一抗体)作为抗原去免疫动物制备第二抗体,并用某种酶(常用辣根过氧化物酶)或生物素等处理后再与前述抗原成分结合,将抗原放大,由于抗体与抗原结合后形成的免疫复合物是无色的,因此,还必须借助于组织化学方法将抗原抗体反应部位显示出来(常用显色剂[/font][font=Calibri]DAB[/font][font=宋体]显示为棕黄色颗粒)。[/font][/font][font=宋体] [/font][font=宋体]通过抗原抗体反应及呈色反应,显示细胞或组织中的化学成分,在显微镜下可清晰看见细胞内发生的抗原抗体反应产物,从而能够在细胞或组织原位确定某些化学成分的分布、含量。组织或细胞中凡是能作抗原或半抗原的物质,如蛋白质、多肽、氨基酸、多糖、磷脂、受体、酶、激素、核酸及病原体等都可用相应的特异性抗体进行检测。[/font][font=宋体] [/font][font=宋体][b]二、免疫组织化学染色方法[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、按标记物质的种类,如荧光染料、放射性同位素、酶(主要有辣根过氧化物酶和碱性磷酸酶)、铁蛋白、胶体金等,可分为免疫荧光法、放射免疫法、酶标法和免疫金银法等。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、按染色步骤可分为直接法(又称一步法)和间接法(二步、三步或多步法);与直接法相比,间接法的灵敏度提高了许多。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、按结合方式可分为抗原—抗体结合,如过氧化物酶[/font][font=Calibri]-[/font][font=宋体]抗过氧化物酶([/font][font=Calibri]PAP[/font][font=宋体])法和亲和连接,如卵白素[/font][font=Calibri]-[/font][font=宋体]生物素[/font][font=Calibri]-[/font][font=宋体]过氧化物酶复合物([/font][font=Calibri]ABC[/font][font=宋体])法、链霉菌抗生物素蛋白[/font][font=Calibri]-[/font][font=宋体]过氧化物酶连结([/font][font=Calibri]SP[/font][font=宋体])法等,其中[/font][font=Calibri]SP[/font][font=宋体]法是最常用的方法。[/font][/font][font=宋体] [/font][font=宋体][b]三、几种常用免疫组织化学方法的原理[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、免疫荧光方法[/font][/font][font=宋体] [/font][font=宋体]是最早建立的免疫组织化学技术。它利用抗原抗体特异性结合的原理,先将已知抗体标上荧光素,以此作为探针检查细胞或组织内的相应抗原,在荧光显微镜下观察。当抗原抗体复合物中的荧光素受激发光的照射后即会发出一定波长的荧光,从而可确定组织中某种抗原的定位,进而还可进行定量分析。由于免疫荧光技术特异性强、灵敏度高、快速简便,所以在临床病理诊断、检验中应用比较广。[/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、免疫酶标方法[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫酶标方法是继免疫荧光后,于[/font][font=Calibri]60[/font][font=宋体]年代发展起来的技术。基本原理是先以酶标记的抗体与组织或细胞作用,然后加入酶的底物,生成有色的不溶性产物或具有一定电子密度的颗粒,通过光镜或电镜,对细胞表面和细胞内的各种抗原成分进行定位研究。免疫酶标技术是目前最常用的技术。[/font][/font][font=宋体] [/font][font=宋体]本方法与免疫荧光技术相比的主要优点是:定位准确,对比度好,染色标本可长期保存,适合于光、电镜研究等。[/font][font=宋体] [/font][font=宋体][font=宋体]免疫酶标方法的发展非常迅速,已经衍生出了多种标记方法,且随着方法的不断改进和创新,其特异性和灵敏度都在不断提高,使用也越来越方便。目前在病理诊断中广为使用的当属[/font][font=Calibri]PAP[/font][font=宋体]法、[/font][font=Calibri]ABC[/font][font=宋体]法、[/font][font=Calibri]SP[/font][font=宋体]法等。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、免疫胶体金技术[/font][/font][font=宋体] [/font][font=宋体][font=宋体]免疫胶体金技术是以胶体金这样一种特殊的金属颗粒作为标记物。胶体金是指金的水溶胶,它能迅速而稳定地吸附蛋白,对蛋白的生物学活性则没有明显的影响。因此,用胶体金标记一抗、二抗或其他能特异性结合免疫球蛋白的分子[/font][font=Calibri]([/font][font=宋体]如葡萄球菌[/font][font=Calibri]A[/font][font=宋体]蛋白[/font][font=Calibri])[/font][font=宋体]等作为探针,就能对组织或细胞内的抗原进行定性、定位,甚至定量研究。由于胶体金有不同大小的颗粒,且胶体金的电子密度高,所以免疫胶体金技术特别适合于免疫电镜的单标记或多标记定位研究。由于胶体金本身呈淡至深红色,因此也适合进行光镜观察。如应用银加强的免疫金银法则更便于光镜观察。[/font][/font][font=宋体] [/font][font=宋体][b]四、免疫组化技术的优点[/b][/font][font=宋体] [/font][font=宋体][font=Calibri]1[/font][font=宋体]、特异性强 免疫学的基本原理决定了抗原与抗体之间的结合具有高度特异性,因此,免疫组化从理论上讲也是组织细胞中抗原的特定显示,如角蛋白([/font][font=Calibri]keratin[/font][font=宋体])显示上皮成分,[/font][font=Calibri]LCA[/font][font=宋体]显示淋巴细胞成分。只有当组织细胞中存在交叉抗原时才会出现交叉反应。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]2[/font][font=宋体]、敏感性高 在应用免疫组化的起始阶段,由于技术上的限制,只有直接法、间接法等敏感性不高的技术,那时的抗体只能稀释几倍、几十倍;现在由于[/font][font=Calibri]ABC[/font][font=宋体]法或[/font][font=Calibri]SP[/font][font=宋体]法的出现,使抗体稀释上千倍、上万倍甚至上亿倍仍可在组织细胞中与抗原结合,这样高敏感性的抗体抗原反应,使免疫组化方法越来越方便地应用于常规病理诊断工作。[/font][/font][font=宋体] [/font][font=宋体][font=Calibri]3[/font][font=宋体]、定位准确、形态与功能相结合 该技术通过抗原抗体反应及呈色反应,可在组织和细胞中进行抗原的准确定位,因而可同时对不同抗原在同一组织或细胞中进行定位观察,这样就可以进行形态与功能相结合的研究,对病理学研究的深入是十分有意义的。[/font][/font][font=宋体] [/font][font=Calibri][font=宋体][font=宋体]义翘神州提供[url=https://cn.sinobiological.com/services/immunohistochemistry-service][b]石蜡切片免疫组化([/b][/url][/font][font=Calibri][url=https://cn.sinobiological.com/services/immunohistochemistry-service][b]IHC[/b][/url][/font][font=宋体][url=https://cn.sinobiological.com/services/immunohistochemistry-service][b])检测服务[/b][/url],更多详情可以关注:[/font][/font][font=宋体][font=Calibri]https://cn.sinobiological.com/services/immunohistochemistry-service[/font][/font][/font][font=宋体] [/font][b][font=宋体][font=宋体]义翘神州:蛋白与抗体的专业引领者,欢迎通过百度搜索[/font][font=宋体]“义翘神州”与我们取得联系。[/font][/font][/b][font=宋体] [/font][font=Calibri] [/font]