







热爱生命科学


荧光显微成像技术对人们理解神经科学起了非常关键的作用。而最近一些年出现的各种超分辨显微成像技术和专门的荧光探针能够以超过以往普通光学显微镜的分辨率直接观察神经元亚细胞结构和蛋白质排列。并以直观可视方式揭示了神经细胞骨架组成、分布、运动和膜蛋白信号传导、突触下结构和功能,以及神经元−胶质细胞相互作用。同时超高分辨显微成像技术(Super Resolution,SR,下文中出现SR均指超高分辨率显微成像技术)对于许多自身免疫和神经退行性疾病模型中的分子靶点研究也提供了全新的强大工具。
今年春,Werner等科学家在美国化学学会会刊(ACS)上最新发表了一篇综述,比较详实系统介绍了超高分辨率显微技术在神经科学上的最新应用进展。我们在此文基础上进行了编译整理。因文章较长,分四期介绍。本期为第三部分内容。
5.3. 突触后室
突触受体位于突触后室,负责传递来自突触前末端的信号。它包含支架蛋白--负责锚定突触后受体的专门用于信号整合的信号分子。在神经元树突中,从主要树突轴起源并突起的小体积树突棘提供分区功能,并根据突触活动和发育阶段显示大小和形状的动态变化。树突棘是突触长时程增强(LTP)的结构相关物,因此与学习和记忆有关。要想准确观察树突棘的小尺寸、不同形状和动力学,一般要求采用超过衍射极限的分辨率并有可能进行活体成像的光学显微镜方法。第一个将活细胞SMLM应用于原代神经元的研究之一是使用碳菁染料(如Dil)可视化脊髓和丝状足。对于突触后膜结构的可视化,已经发现了一个新的膜标记试剂系列,该系列可实现神经元追踪和树突棘的可视化。
最近,通过快速SIM和增强共聚焦显微成像研究了树突棘上微小突起(称为小刺)的动力学。通过将SIM成像与计算方法相结合,进一步评估了树突棘的几何结构,证实凹面对于棘结构稳定的重要性。在树突棘中,F-肌动蛋白高度定位富集在突触后密度区(PSD)和树突棘膜上。肌动蛋白的分子速度升高已让其扩散到除棘尖外整个棘的亚区。为了分析脊髓中肌动蛋白的动力学,我们设计了一种低亲和力的光转换肌动蛋白探针,并利用像差校正光学系统对活体脑切片动力学进行了表征。通过STED显微镜观察对phalloidin-ATTO647N标记的原代神经元,可以在树突棘颈和丝状棘中观察到F-肌动蛋白的周期性片段。同年,STORM成像也显示树突棘颈和丝状棘中存在以肌动蛋白为基础的周期性膜骨架。在树突棘中,分支的F-肌动蛋白在PSD附近聚集,而延伸仅限于指状突起的尖端,并为棘突提供了基础。
通过基于监督学习的模式识别进行图像分割,可以对树突肌动蛋白组成异质性做自动分析。用SMLM也对树突F-肌动蛋白进行了同样的分析,并使用树突铂复原电镜进行了验证。使用STED显微镜在活体小鼠脑切片海马CA1神经元上进行延时拍照并结合FRAP及电生理学检查,证明在神经递质释放诱导的长时程增强(LTP)时树突棘颈部具有可塑性(宽度增加并长度减少)。使用正置STED显微镜实现了活体小鼠树突棘动力学的首次超高分辨率成像。在这里Thy1 EYFP小鼠体感皮层中的树突棘在其头部和颈部表现出形态可塑性。另外使用双光子STED成像对活体小鼠的海马树突棘动力学进行了研究,树突棘密度与早期报告相比高出2倍,并能测算几天内的树突棘蛋白周转率(图10)。
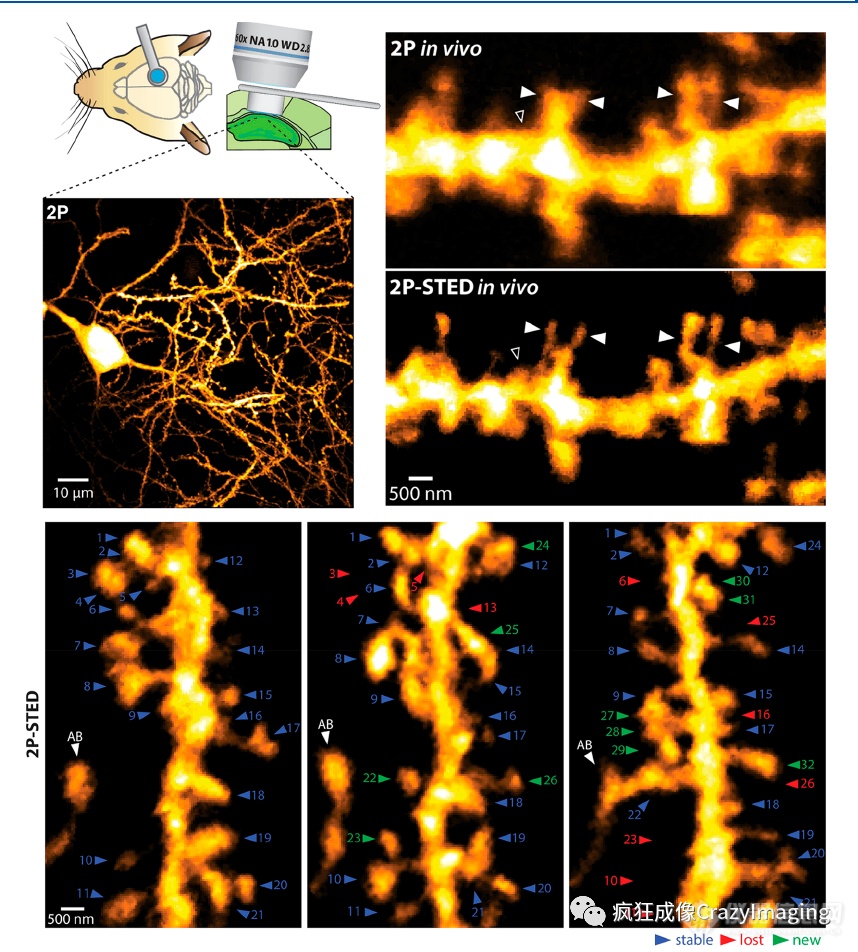
图10 体内长时程双光子STED成像--海马CA1锥体神经元树突棘蛋白周转。左上图:使用长工作距离物镜的实验方法和CA1锥体神经元的双光子整体图像。右上图:传统的双光子成像与双光子STED成像的比较,显示了总体上更高的棘突密度和更详细的形态,特别是在轴和棘突中。空的箭头标志着常规双光子成像不能显示的棘突,而填充的箭头表示双光子STED报告的棘突数量更多、形态更复杂。底部图像:在海马CA1区基底树突的一个选定区域内,连续几天(第0天、第2天和第4天)成像的树突棘周转。树突棘被连续编号。AB=接近树突的轴突(缩回的棘突用红色标记;新的棘突用绿色标记)。转载自原文参考文献 273。
此外,sptPALM揭示了富集在突触棘的突触后激酶CaMKII的空间和动力学亚群,该激酶介导钙依赖性可塑性机制。这些动力学似乎由棘肌动蛋白调节,因为Latrunculin A导致棘内CaMKII扩散显著改变。在PSD内的棘头,一个密集的蛋白质复合物含有不同的突触后支架蛋白,如PSD-95、homer1和shank3,它们排列在大小为∼80纳米的亚突触域中。根据不同的突触类型,PSD-95被动态组织为单个单元或多个纳米簇的形式。STED显微镜揭示了突触后支架蛋白负责将离子受体锚定到突触后膜上,SMLM观察到的活体原代神经元也是一样。在这里,活细胞单分子成像结合定量分析揭示了含有GluA2的AMPA-Rs(优先聚集在突触下的PSD-95簇中)的稳态调节。
而PSD-95的uPAINT成像和AMPA-Rs的spt PALM报告在70 nm大小的PSD-95纳米域内平均聚集了20个AMPA-Rs,进一步证实了上面提到的这个发现。AMPA-Rs形成纳米颗粒,并能在几分钟内动态改变其大小和形状。与突触可塑性匹配的是:动态变化是通过突触内和突触外隔室之间的AMPA-Rs在时间维度交换,通过横向扩散来实现的。这些过程通过以微球标记抗体为靶点的内源性受体的单分子追踪实验得到证实。受体运动的类型被认为是布朗扩散,与突触后元件发生短暂的、低亲和力的相互作用。单分子追踪实验中使用Atto 647N修饰的抗体揭示了谷氨酸诱导的脱敏AMPA-Rs的侧向扩散增加导致的短期可塑性。
AMPA-Rs的侧向扩散也与突触的短时程增强和长时程增强(分别为STP和LTP)有关。例如,已经证明,为了从突触抑制中恢复,脱敏受体通过侧向扩散被功能受体替换。此外,追踪实验表明,在CaMKII激活诱导LTP后,AMPA-Rs扩散到突触部位。这一过程由钙浓度升高触发,它导致CaMKII介导的stargazin(它与PSD-95一起能够调节AMPA-R的迁移率)磷酸化。进一步的研究报道,AMPA-Rs的交联导致膜上受体制动,它阻止了成功的LTP诱导。这一机制也可能导致由AMPA的致病性抗体介导的自身免疫性CNS疾病的病理生理学。与NMDA-R和mGluR5代谢受体的GluN1亚单位相比,AMPA-Rs的纳米级结构以不同的簇大小为特征。令人惊讶的是,突触前mGluR5受体表现出更均匀的分布,没有聚集行为。
通过一种新的基于敲入的基因组编辑方法观察到,代表NMDA-R总库的内源性GluN1亚单位受体被证明聚集在一个由单个受体包围的主要单簇中。在关注NMDA-R细分的NR2A和NR2B亚型时,SMLM表明,在突触发育过程中,这些亚型被分割成纳米结构域,并根据其突触比率进行重塑。关于谷氨酸受体的活动性,单分子追踪实验揭示,神经元活动优先影响AMPA-R的活动性,而NMDA-R的活动是由蛋白激酶C活动触发的,而不是由钾升高触发的。
此外,dSTORM成像表明,不同的NR2亚单位定位于不同的纳米结构域,这些纳米结构域在神经元发育过程中表现出灵活性。根据NR2A和NR2B的纳米结构,LTP的表达可以双向调节。kainate受体的单分子追踪实验也表明,突触捕获紧随着突触活性增加后发生。这里,突触激活导致的kainate受体与突触β-连环蛋白/N-钙粘蛋白复合物结合,形成短期可塑性。
作为抑制性突触的对应物,gephyrin是将GABAA(GABA-a R)或甘氨酸受体(GlyR)并入突触后膜所必需的关键锚定分子。通过对突触中gephyrin分子的PALM/dSTORM成像发现:抑制性PSD(iPSD)体积为0.01至0.1μm3,并且每个iPSD中有200−250个gephyrin分子。单分子成像进一步揭示了gephyrin分子与受体结合位点的化学计量比约为1:1.96。类似于兴奋性突触,抑制性PSD(IPSD)根据突触活动动态调节其大小。通过NMDA-R激活形成的抑制性突触LTP加剧突触gephyrin积累,从而以CaMKII依赖的方式增加GABA-AR聚集,从而诱导GABA能突触后电流的增强。相反,抑制gephyrin向突触区的募集导致GABA-AR迁移率降低,并阻止iLTP的诱导。
iLTP诱导后,gephyrin片段化为纳米结构域。gephyrin的重组降低了抑制性突触后电流的振幅变异性,证明了GABA-AR准确定位对于iLTP的真正表达非常重要。有趣的是,单粒子追踪显示,脱敏的GABA-AR甚至可以通过侧向扩散在并列的GABA能突触之间交换,为控制GABA能电流提供了另一种机制。此外,为了阐明多巴胺能突触的超微结构布局,dSTORM成像将多巴胺转运体映射到胆固醇依赖性纳米结构域,从而为更好地理解多巴胺能神经传递的病理生理过程奠定基础。
5.4.亚突触结构域中的跨突触排列
早期电生理学实验中已经发现,突触强度取决于突触前融合位点和突触后受体组织之间的空间关系,突触释放由释放位点的数量,突触小泡的释放概率,以及受体提供的突触后基本反应来决定。首先观测到的亚结构域的跨突触组织是突触粘附分子SynCAM 1位于边缘,EphB2位于PSD的中央。SynCam1在PSD中形成突触下云,可被长期抑郁症模式重塑。SMLM观察链霉亲和素的新单体变体(设计用于减少突触区域的交联和空间位阻),表明跨突触伙伴神经肽原1和神经纤维素1ß在突触处扩散受阻,形成相反的簇。这项研究还表明,另一种粘附分子LRRTM2的流动性不如神经肽1,并形成更密集、更稳定的簇。
最近揭示了兴奋性突触上活性区的细胞基质和突触后受体支架的跨突触排列,它与提供高保真突触传递的靶向神经递质释放有关。在这里,释放位点定位是通过一种基于融合到突触囊泡蛋白Vglut1的pHluorin标记和RIM1/2纳米簇的超分辨检测的新方法实现的。
多色3D定位显微镜显示RIM1/2和突触后PSD-95形成相反的纳米簇。LTP诱导导致PSD-95密度断裂增加,同时增强了纳米柱的排列,而LTD导致突触后柱的紊乱。突触前和突触后关键分子的这种纳米级排列主要由于neuroligin 1。此外,在应用STED显微镜的实时成像实验中,已经报道了树突棘体积增加和排列的纳米模块数量之间的紧密相关性。还报道了抑制性突触的亚突触结构域的纳米级排列。在这里,STED和SIM阐明了gephyrin和GABA-AR突触前亚区域的紧密联系。
此外,突触后GABA-A 受体云显示与突触前边缘结构域结合(图11)。在小鼠神经肌肉连接处,带连接褶开口的突触后乙酰胆碱受体和突触前活动区的排列已通过应用SIM成像可视化。
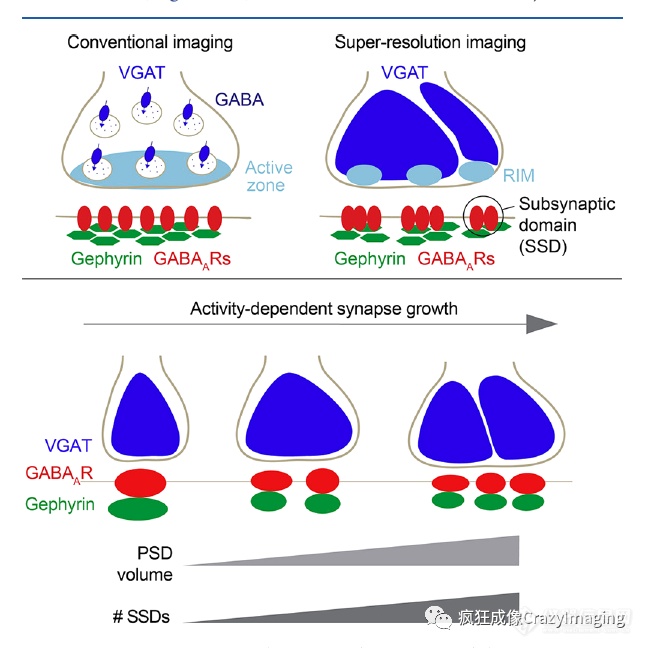
图11. 抑制性突触上的突触亚结构域。突触前的RIM元素与突触后的gephyrin支架分子以及抑制性突触的GABA-A R的突触下结构域的排列。PSD的体积和突触下域的数量随着活动相关的突触大小的变化而变化。转载自原文参考文献302。
5.5. 三联突触
星形胶质细胞是神经传递的基本调节者,神经元突触周围突触前星形细胞突起(PAPs)的吞噬产生了三联突触这一术语。PAPs能够通过传递调节分子来改变和控制突触的传递。通过dSTORM重建星形细胞突起,可以通过标记胶质酸性纤维蛋白(GFAP)和谷氨酰胺合成酶和S100b的成像来实现星形细胞的纳米级可视化。最近的一份报告应用ExM来观察脑片中突触周围的星形胶质细胞谷氨酸转运体显示,在与这些棘附近的GLT-1水平较高有关的较大的神经元树突棘中,谷氨酸的摄取效率降低(图12)。
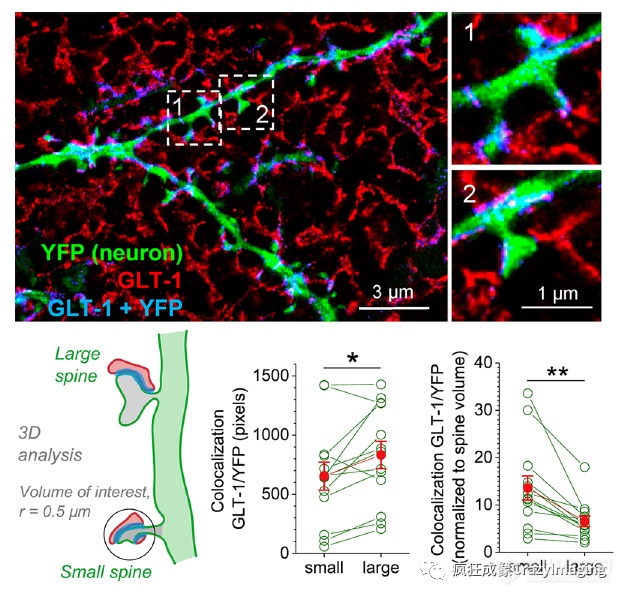
图12. 海马大脑切片中CA 1锥体神经元周围的星形细胞突起。锥体神经元的树突在Thy1-YFP小鼠系标记(绿色);星形胶质细胞则是在海马脑片上的GLT-1免疫染色显示(红色)。蓝色信号代表树突区和星形细胞突起的共同定位。更高的放大率插图见右图。左下:大棘和小棘的分类。底部中间和右侧:GLT-1和神经元YFP的共定位像素的量化。请注意右图树突棘体积归一化后的变化;红点表示平均数和SEM,p = 0.0220 (绝对GLT-1覆盖率),p = 0.00223(相对GLT-1覆盖率)。转载自原文参考文献307。
EM和STORM发现,PAPs也配备了局部翻译位点,以避免星形细胞体细胞中合成的蛋白质的长距离运输路线。最近在器官型切片中进行的3D STED显微镜研究揭示了星形细胞钙信号的结构前提。在星形细胞内检测到了海绵状结构,它包含了接近突触部位的节点和轴。钙离子瞬变的共聚焦成像与星形细胞结构的STED显微镜相结合,显示自发的钙离子瞬变紧密地映射到这些结点。因此,这些结点被认为是类似于树突棘的空间分隔作用。胶质传导物质的外渗需要提供胶质囊泡。通过将电容测量与葡聚糖摄取后星形胶质细胞内的囊泡的SIM图像相关联,发现了外吞和内吞之间的Dynamin依赖性膜中间物。
通过STED显微镜和SIM分析单个胶质小泡的特征,在星形胶质细胞中有两个小泡群,其大小和融合能力不同。Phluorin实验结合SIM确定星形胶质细胞囊泡上Syb2分子的拷贝数为25∼。此外,应用STED和TIRF显微镜对培养的星形胶质细胞中的VAMP3阳性囊泡进行了单囊水平的分析。测量结果显示VAMP3覆盖的囊泡大小约为80纳米,并提供证据表明这些囊泡参与了钙依赖性的囊泡循环。SIM成像还可以发现,突触蛋白中一种已知的参与神经元外排的v-SNARE蛋白,也普遍存在并组织在单个星形胶质细胞的囊泡上,以实现高效的外排。星形胶质细胞还通过回收proBDNF到BDNF参与促进兴奋性LTP。这里,SIM成像显示,proBDNF在体细胞区域位于囊泡大小的集群中,而沿星形胶质细胞末梢的点状模式占主导地位,以扩大BDNF对记忆的作用。为了最大限度地减少激发光的散射,通过应用被动CLARITY进行组织透明化和多光子显微镜,改善了组织深处的星形细胞成像。
通过使用SiR-actin和SiR-tublulin探针的STED显微镜和原子力显微镜(AFM)的相关方法来测量膜的拓扑结构和硬度,将星形细胞的细胞骨架和膜的生物物理特性联系起来。(未完待续)
本文由超高显微技术应用工程师郭连峰、黄梓彤编译
(受篇幅限制,未将参考文献列出)
相关阅读:
[来源:疯狂成像CrazyImaging]

2022.07.12

2024.07.17

超23亿!北京首批医疗设备购置项目公布,涉及CT、DR、基因序列仪等
2024.07.16

3i流式快讯|凯普瑞生物完成数千万Pre-A+轮融资!聚焦流式诊断
2024.07.15

2024.07.15

2024.07.15
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~