







热爱生命科学


近年来,CRISPR被认为是最简单高效的基因编辑方式,也成为了生物技术发展史上进展最为迅猛的新兴技术之一。2022年6月,正值CRISPR发文十周年,Nature Biotechnology 同步发表了一篇名为《Knock-in on CRISPR's door》的Reviw,梳理了10年来科学家们对CRISPR基因编辑技术不断探索突破的成果[1]。

图1. 2022年6月Nature Biotechnology 发文
基于CRISPR的基因疗法如火如荼基因治疗(Gene Therapy)是指将外源正常基因导入靶细胞,以纠正或补偿缺陷和异常基因引起的疾病,以达到治疗目的。基因治疗以其一次给药终生治愈遗传疾病的独特潜力让一切不可能变为有可能。截止今日,通过对clinicaltrials.gov检索,全球已有56项基于CRISPR的临床试验正在进行,中国就有21项,占到3成以上。目前大部分的基因疗法为体外疗法(ex vivo),即细胞在体外通过CRISPR编辑后再输注到体内发挥功能,常见疾病如肿瘤免疫疗法CAR-T,遗传性疾病如地中海贫血,镰刀状贫血症血红蛋白遗传病等在内的各种血液病。与之相对的即体内疗法(in vivo)则是直接将治疗基因递送到患者病患部位,从而治疗疾病,目前已在先天性黑蒙、遗传性甲状腺转淀粉样变性和遗传性血管性水肿等疾病表现出巨大潜力。
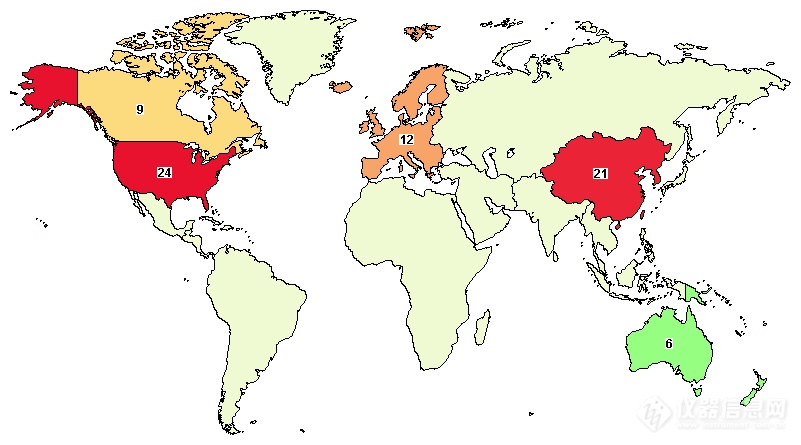

图2. 全球CRISPR临床试验分布热点图
图源:clinicaltrials.gov
基因编辑的发展历程早期基因编辑--ZFN和TALEN基因编辑技术主要发展了三代,早期的两代基因编辑主要以ZFN和TALEN为主,这两种基因编辑技术相对简单,可以理解为“基因剪刀”——切割特定 DNA 序列的限制酶。但ZFN技术存在很明显的缺点,如容易脱靶,且可能产生一系列不可预测的基因突变,引发细胞毒性。TALEN技术的出现,在一定程度上优化了ZFN技术存在的脱靶问题,具有设计简单,特异性和活性更高的优点,因此成为基因功能研究和基因治疗研究中有力的工具。美中不足的是,由于TALEN针对不同靶点,每次都需重复构建融合蛋白,因此会造成一定的工作繁琐。第三代基因编辑--CRISPRCRISPR/Cas9是继ZFN、TALEN之后出现的第三代“基因组定点编辑技术”。CRISPR/Cas9 系统由两部分组成,分别是Cas9 蛋白和guide RNA(single-guide RNA,sgRNA)。Cas9蛋白具有解旋酶活性,可以将DNA链解旋,同时具有核酸内切酶活性,可以切割DNA链。其原理是核酸内切酶 Cas9 蛋白通过向导 RNA (guide RNA, gRNA)识别特定基因组位点,并对双链 DNA 进行切割造成 DSB后,通过HDR和NHEJ实现基因的定向敲除或插入。
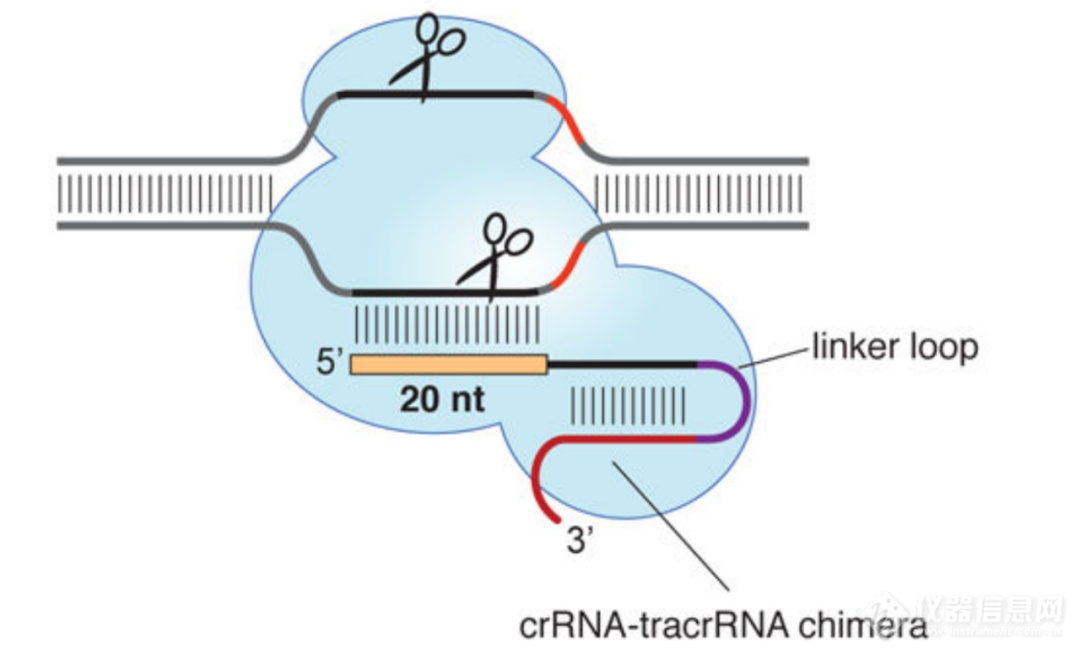
图3. CRISPR/Cas9 示意图[2]
相比于传统的ZFN和TALEN技术,CRISPR/Cas9技术更为简单,只需要构建针对特定位点的sgRNA,而且效率也比前面几种技术更高,在疾病治疗研究中发挥越来越重要的作用。然而,CRISPR/Cas9系统仍然存在着一定的局限性,这种局限性主要体现在功能发挥时系统对DNA上PAM序列的依赖性以及切割时潜在的脱靶效应。因此科学家们在CRISPR/Cas9的基础上开发了更加高效且广谱的精准基因编辑工具—单碱基编辑技术BE(Base Editor)和精准基因编辑工具PE(Prime Editors)。单碱基编辑技术BE(Base Editor)单碱基编辑技术是一种基于脱氨酶与CRISPR/Cas9系统融合形成的技术。2016年哈佛大学David Liu实验室首次报道开发出CBE单碱基编辑工具,通过将SpCas9与胞嘧啶脱氨酶(cytidine deaminase, CyD, 如APOBEC1)融合,可以在一定的突变窗口内实现胞嘧啶(C)到胸腺嘧啶(T)的单碱基转换(图4)[3]。2017年10月底,该实验室进一步开发出ABE单碱基编辑工具,实现了从腺嘌呤(A)到鸟嘌呤(G)的精确转换(图5),为基因编辑提供了新的研究工具[4]。
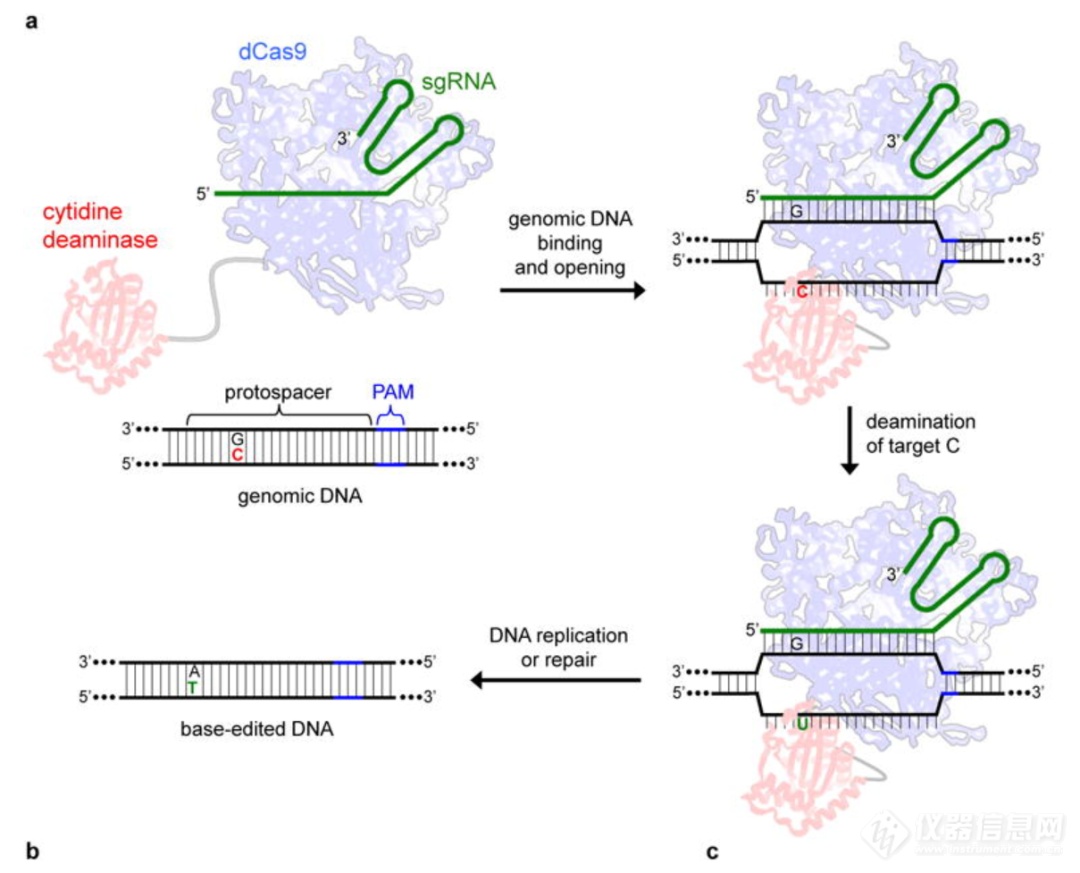
图4. CBE示意图[3]
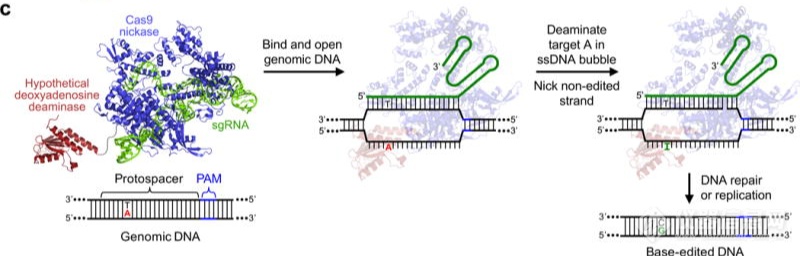
图5. ABE示意图[4]
相比于CRISPR/Cas9技术,BE技术可以既不引入DNA双链断裂,又不需要重组修复模板,整体提高了编辑的安全性和精准性,而且其效率远远高于由发生DSB引起的HDR和NHEJ修复方式,对于许多点突变造成的遗传疾病具有很大的应用潜能。近年来,多个实验室也发表了类似的工具,并在这些工具的基础上进行了更为深入的改造与优化。邦耀生物科学家团队以不同单链DNA脱氨酶结构域与Cas9切口酶相结合为基础,开发全新一代的DNA碱基编辑工具—超高活性的HyCBEs和双碱基编辑器A&C-BEmax以及等多种碱基编辑新工具,提高了编辑活性并拓宽靶点范围,以实现更广泛、更精确的基因编辑,相关研究成果也发表在Nature Cell Biology、Nature biotechnology等国际著名期刊[5]。
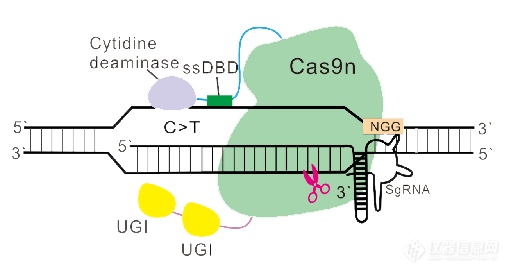
图6. 超高精度碱基编辑器HyCBE示意图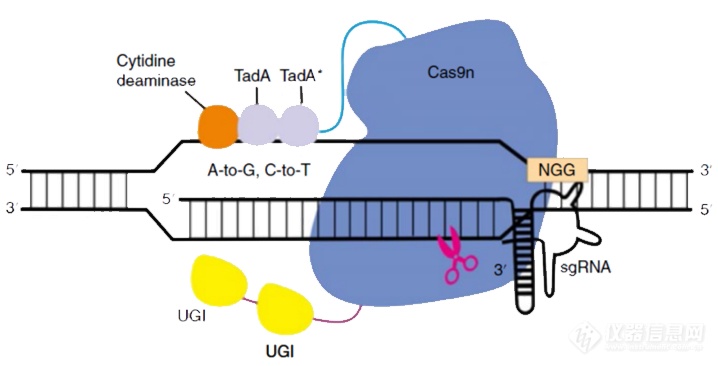
图7. 双碱基编辑器示意图精准基因编辑工具PE(Prime Editors)
2019年10月21日,哈佛大学David Liu实验室开发出了全新的精准基因编辑工具PE (Prime Editors)[6],PE是以CRISPR/Cas9系统为基础,在两方面加以优化:1. pegRNA:pegRNA(prime editing guide RNA)是一段改造后的sgRNA,它在传统sgRNA的3'末端增加了一段RNA序列。这个RNA序列包括一段引物结合位点(Primer-binding site, PBS),用于与被切割的目标DNA链互补;还包括一段进行逆转录的模板(RT template)的序列,它与切口下游的DNA序列同源,且在RT序列上存在有相应的编辑突变(如点突变或插入缺失突变)。
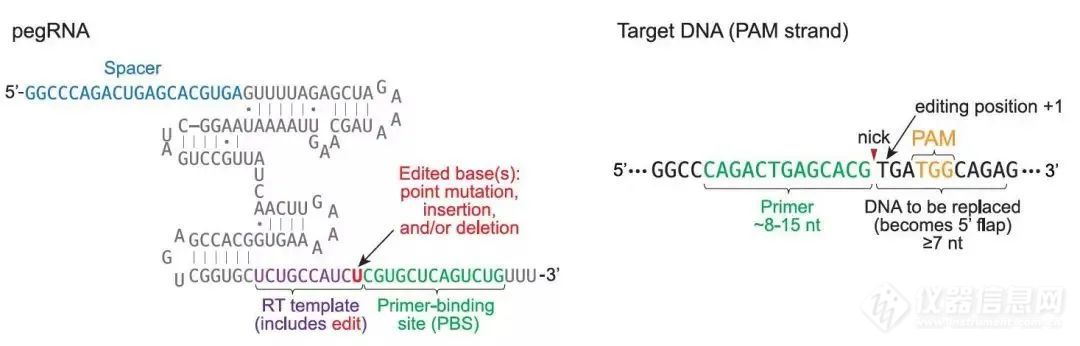
图8. pegRNA的改造[4]2.融合蛋白:将nCas9(H840A)与M-MLV逆转录酶融合。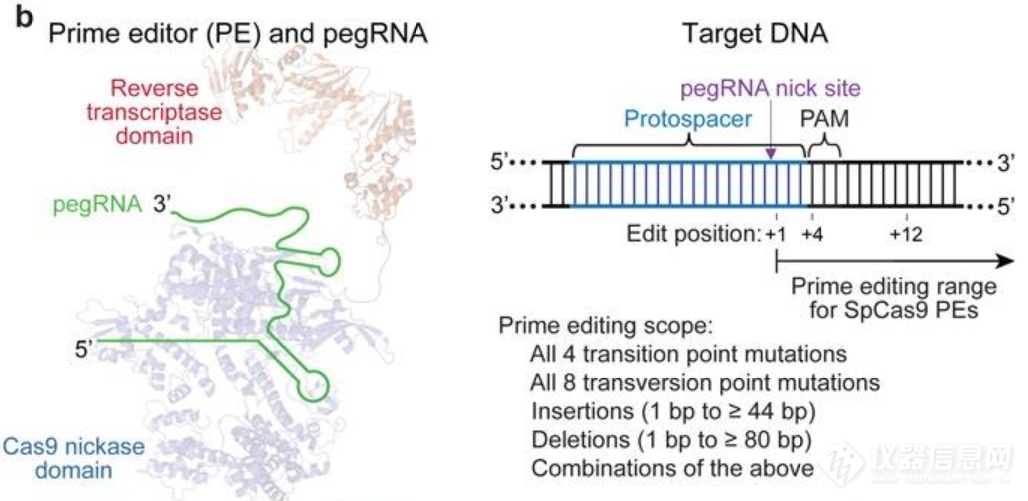
图9. PE结构示意图[4]
在pegRNA的引导下,融合蛋白会到达基因组上的目的序列,并对含PAM的靶DNA链进行切割(pegRNA的非互补链)。此后,PBS序列与被切割的目标DNA链互补配对,逆转录酶即从端口空缺处启示逆转录。逆转录产物(DNA)即包含我们所期待的编辑突变。这段逆转录DNA会入侵并进入基因组DNA,发生整合,并进行切口的修复。只要RT序列允许,那么就可以采用此原理完成碱基的点突变(任意转换或颠换)以及片段的插入和缺失。
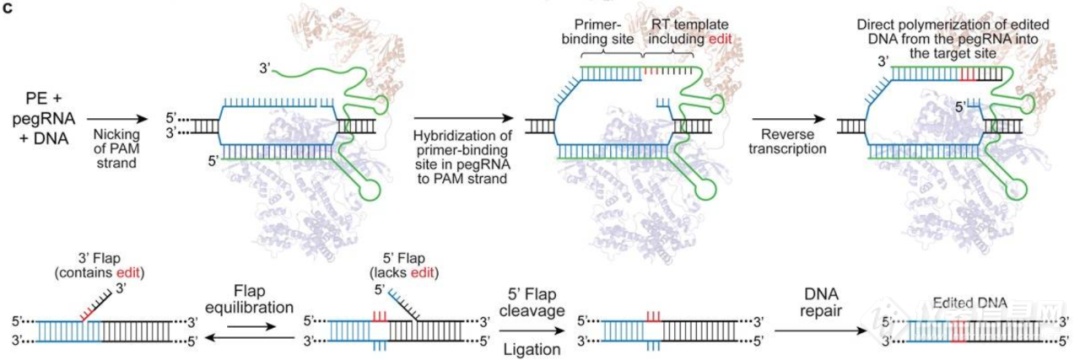
图10. PE原理示意图[4]
相比于其它基因编辑工具(采用ZFN,TALEN,CRIPSR/Cas9等产生DSB进行HDR或NHEJ修复或通过base editing系统进行单碱基编辑),PE的优势在于可以在不依赖DSB的前提下,能够实现更精准的编辑,更广的试用范围。但同时相比CBE和ABE,PE的劣势也随之体现,编辑效率不如前者,并且产生随机Indels的可能也会随之提高。
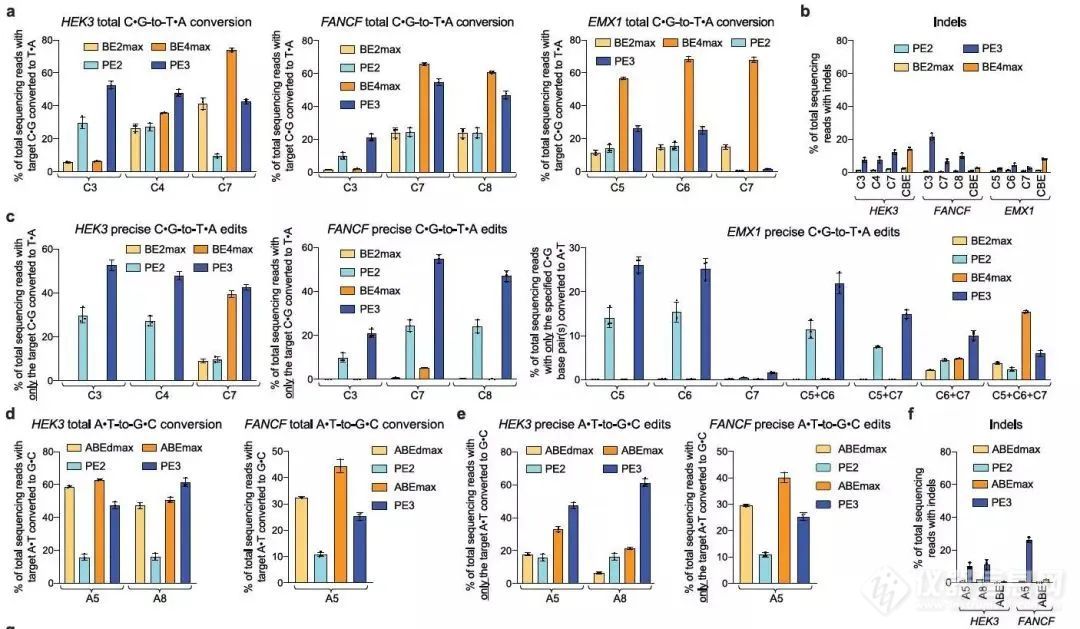
图11. PE与ABE、CBE的效率比较[6]
最后,除了上述几种基因编辑工具以外,科学家们还发现了除Cas9外的Cas家族的其它一系列蛋白,如 Cas12、Cas13、CasX等。这些新的发现有望使基因疗法能够解决更广泛的遗传疾病,推动生物医学的基础研究和临床基因治疗研究。
[来源:邦耀实验室]

2022.07.13

2022.07.12

2024.09.30
「生命科学、生物技术与诊断展区」一站领略前沿,共绘未来科技蓝图
2024.09.30

「实验室设备核心零部件展区」研创“零”界突破,光电融合科研新时代
2024.09.30

2024.09.30
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~