祝贺健新原力赋能RNAimmune公司创新型呼吸道合胞病毒mRNA疫苗的临床试验IND获得FDA批准
点击蓝字,关注我们近日,RNAimmune(达冕生物)公司自主研发的创新型呼吸道合胞病毒(Respiratory Syncytial Virus, RSV) mRNA疫苗的临床试验申请 (Investigational New Drug, IND)已获得美国食品药品监督管理局(FDA)正式批准。这款冠名为RV-1770的mRNA疫苗将在近期于美国开展临床一期试验,用以评价其在健康受试者使用后的安全性和针对呼吸道合胞病毒(RSV)的免疫效能。健新原力作为达冕生物在该疫苗创制过程中的CDMO合作伙伴,对这项里程碑式的突破进展表示热烈祝贺并深感荣幸!内容来源于健新原力赋能RNAimmune公众号 2023年12月18日,健新原力发布公告,宣布健新原力赋能RNAimmune公司RSV mRNA疫苗的临床试验IND获得FDA批准!迈安纳作为健新原力的合作伙伴,特别献上热烈的祝贺!这是对迈安纳全球领先的INanoTM mRNA包裹平台的再次认可。在药物速递领域中,特别是mRNA类药物领域,迈安纳将一如既往地贡献可靠有力的强大支持,随着迈安纳的不断进步,未来迈安纳将成为更优秀的合作伙伴。关于我们迈安纳(上海)仪器科技有限公司是一家拥有多项发明专利技术,专注于解决RNA纳米药物递送行业痛点的整体解决方案本土提供商。公司不仅可提供从实验室到产业化的核酸(包括mRNA, siRNA, CRISPR/Cas9, SAM RNA, CircRNA等)-LNP全系列封装设备!更可提供整体解决方案中的技术支持。作为上海市闵行区重点引进的项目,迈安纳已在上海莘庄工业区投资数千万元,建成了国内首家集核酸药物装备研发制造和核酸递送工艺开发为一体的创新中心。该中心具备GMP级递送工艺开发实验室和十万级无尘核心组件装配区。迈安纳自主研发生产的INanoTM全系列产品已获得欧盟CE认证和美国FCC认证。目前迈安纳已服务于国内上百家顶尖生物制药公司以及科研学术机构,并已成功助力多个客户相继获得中国,美国,巴西,澳大利亚等mRNA类药物IND临床批件,进入临床和商业化生产。
企业动态
2023.12.19
喜报!祝贺迈安纳合作伙伴斯微生物编码细胞因子IL-12的mRNA注射液获得临床试验默示许可
图片来源于斯微生物微信公众号2023年6月8日,斯微生物微信公众号发布公告,宣布其自主研发的编码细胞因子IL-12的非复制mRNA注射液SW0715临床试验申请(IND)获得国家药品监督管理局(NMPA)临床试验默示许可。迈安纳作为斯微生物的合作伙伴,特别献上最热烈的祝贺!About Micro&Nano关于迈安纳迈安纳(上海)仪器科技有限公司开始于2018年,正式成立于2020年初。是一家拥有多项发明专利技术,专注于解决RNA纳米药物递送行业痛点的整体解决方案本土提供商。公司不仅可提供从实验室到产业化的核酸(包括mRNA,siRNA,CRISPR/Cas9,SAMRNA,CircRNA等)-LNP全系列封装设备!更可提供整体解决方案中的技术支持。作为上海市闵行区重点引进的项目,迈安纳已在上海莘庄工业区投资数千万元,建成了国内首家集核酸药物装备研发制造和核酸递送工艺开发为一体的创新中心。该中心具备GMP级递送工艺开发实验室和十万级无尘核心组件装配区。迈安纳自主研发生产的INano™全系列产品已获得欧盟CE认证和美国FCC认证。目前迈安纳已服务于国内数百家顶尖生物制药公司以及科研学术机构,并已成功助力多个客户相继获得中国,美国,巴西,澳大利亚等mRNA类药物IND临床批件,进入临床和商业化生产。
企业动态
2023.06.14
聚乙烯亚胺-环糊精纳米粒用于siRNA和DOX的共递送
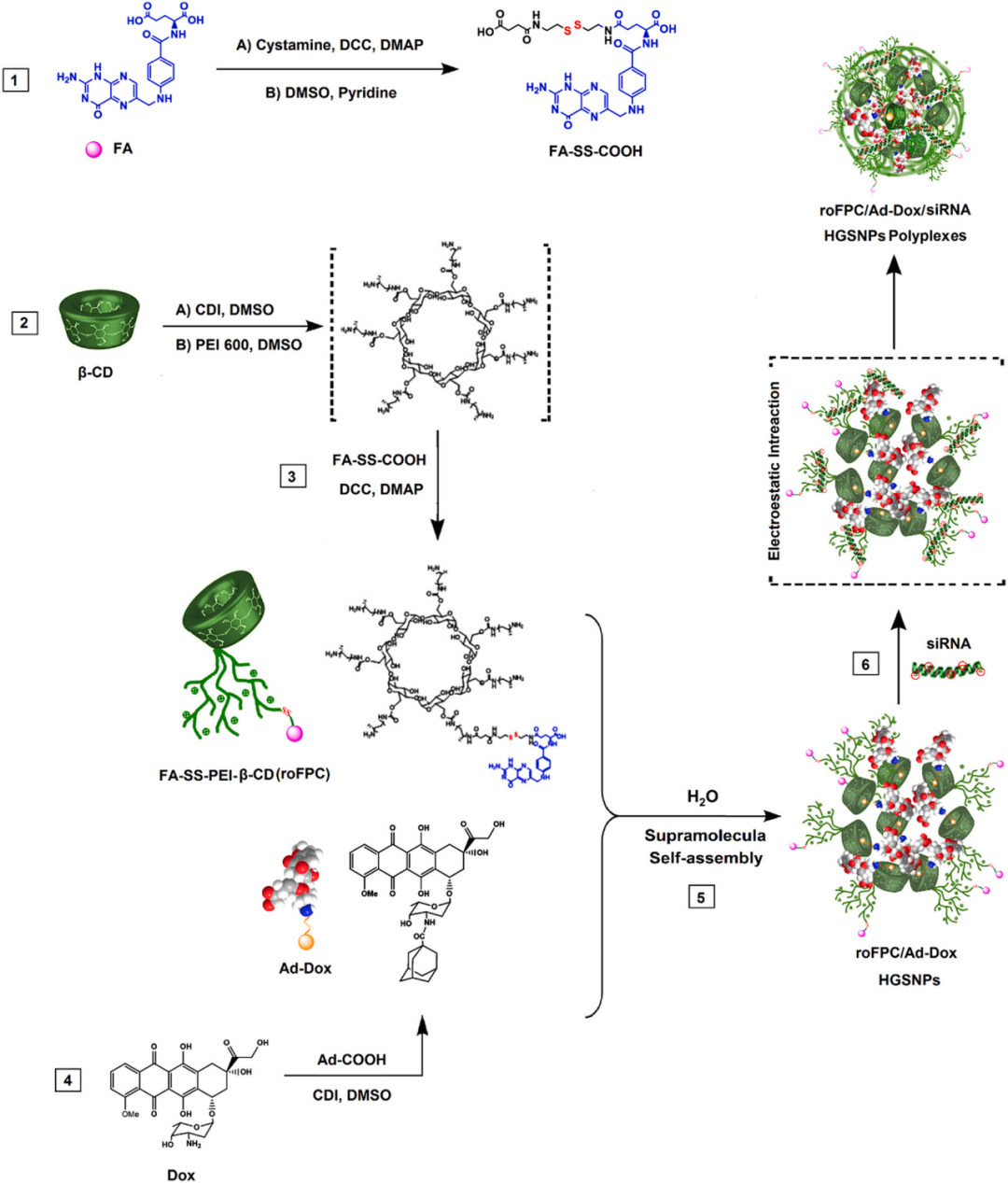
简介癌症仍然是世界上主要和突出的死亡原因,在过去的几十年里,越来越多的实验疗法专注于癌症治疗。化疗是治疗癌症的一种有效方法。然而,由于肿瘤的高度复杂性和分子异质性,单一的治疗方法不足以抑制癌症的进展。使用特定药物和基因的联合治疗成为了一种治疗恶性肿瘤的有利方法,以较低的剂量给予化疗药物,然后减少副作用和提高疗效。还可以降低抗药性和癌症复发的风险。阿霉素(Dox)是一种破坏DNA的化疗药物,已被用于治疗多种恶性肿瘤。这种药物通过抑制拓扑异构酶II和抑制DNA复制而显示出高度的细胞毒作用,从而诱导细胞凋亡、抗增殖和抑制肿瘤血管生成。此外,拓扑异构酶的过度表达是Dox高毒性和非选择性靶向的一个重要因素。因此,如果与其他癌症治疗方法联合使用以减少剂量和其他多种副作用和风险,则该药物的毒性可以降低。人端粒酶逆转录酶(HTERT)是人端粒酶促进肿瘤细胞增殖和侵袭的主要亚基。因此,靶向端粒酶逆转录酶是预防和治疗端粒酶依赖性肿瘤的一种潜在策略。小干扰RNA(SiRNA)可用于实现癌基因调控因子表达的特定基因沉默,HTERT siRNA可以抑制癌症的进展。尽管具有巨大的潜力,但杂乱无章的siRNA片段会被内源性酶迅速降解,并且由于其高度亲水性和多阴离子特性而几乎不能穿过细胞膜。因此,通过促进细胞摄取来克服这些限制对siRNA递送至关重要。最近,几个纳米颗粒平台已经被建立为高效的非病毒siRNA载体。在各种纳米载体中,环糊精(CD)被认为是一种很有前途的基于寡核苷酸的治疗的天然聚合物。此外,CD修饰的聚阳离子表现出很好的生物相容性,并且可以直接与治疗性核酸形成稳定的聚合物。这些修饰的聚阳离子还具有两亲性,当核酸分子凝聚在结构中时,可以有效地促进纳米结构的形成。基于CD的主客体超分子纳米组装结构由于其简单的自组装方式和合适的结合类似物的结合能力而能够有效地包裹药物并控制其释放。这种相互作用可以用来偶联具有低载药量和低包封率的纳米粒的功能部分。Scheme 1. roFPC/Ad-Dox HGSNPs的形成示意图和roFPC/Ad-Dox/siRNA HGSNPs复合体的概念示意图合理设计添加叶酸的氧化还原敏感递送载体可以通过阻止高分子阳离子聚合物的积累来减少对细胞的毒性,并通过受控的细胞内释放和细胞膜上FRS的有效循环来提高转基因效率。因此,本研究开发了氧化还原敏感folate-appended-polyethylenimine-β-cyclodextrin (RoFPC) 主客体超分子纳米粒(HGSNPs),用于靶向联合递送Dox和HTERT siRNA到乳腺癌细胞系(MDAMB-231、MCF-7)以及标准细胞系MCF-10(Scheme1)。将β-CD与支化的PEI (MW600(bPEI-600))进行交联,以降低细胞毒性并保持当前对纳米载体的细胞转染率。然后,将PEI-βCD(PC)星形阳离子聚合物用叶酸通过氧化还原敏感的共价二硫键修饰成rFPC,然后将客体金刚烷偶联阿霉素(Ad-Dox)与宿主roFPC组装成rFPC/Ad-Dox HGSNPs。HTERT siRNA通过带正电荷的PEI-600片段与带负电荷的hTERT siRNA之间的静电作用而结合,得到药物和基因共递送的roFPC/Ad-Dox/siRNA HGSNPs复合体。该共递送载体结合了Dox增强型基因转染、良好的水溶性和生物相容性的抗肿瘤特性,具有显著增强的血液相容性,并特别针对仅在低N/P水平的叶酸受体阳性细胞,以促进有效的细胞凋亡用于癌症治疗。(1)RoFPC/Ad-Dox HGSNPs表征如图1所示,通过核磁共振氢谱证明中间体和最终聚合物的合成成功。图1.A.DMSO-d6中Dox、Ad-COOH、Ad-Dox、PC、FPC/Ad-Dox和roFPC/Ad-Dox的核磁共振氢谱。B.RoFPC/Ad-Dox的ESI-MS分析。C.在D2O中1:2(主客体)的Ad-Dox和roFPC混合物的2D-NOESY核磁共振波谱。(2)RoFPC/Ad-Dox/siRNA HGSNPs的表征开发siRNA分布载体的一个重要要求是与游离siRNA形成稳定的络合物的能力。聚合物-siRNA复合体(多聚体)被浓缩为胶体NPs,用于细胞内化。HTERT siRNA可以通过静电作用与阳离子载体结合。用凝胶电泳法检测roFPC/Ad-Dox/siRNA HGSNPs的基因结合能力。如图3A所示,随着N/P比的增加,游离siRNA在第一通道显示出主要的迁移率,而条带迁移率和强度逐渐降低(通道2-7,图2A)。在所有通道中,siRNA的浓度保持不变。当N/P比达到16:1时,siRNA完全集中在hGSNPs的表面,可以作为后续实验的合适N/P比。在N/P比为16:1的最后一条通道上涂抹10 mM的GSH,以测定roFPC/Ad-Dox/siRNA HGSNPs表面二硫键的断裂。图2 A.琼脂糖凝胶电泳法分别在N/P比为1:1、2:1、4:1、8:1、16:1的情况下对roFPC/Ad-Dox/siRNA进行琼脂糖凝胶电泳。B.以16:1的N/P比从roFPC/Ad-Dox/siRNA中释放siRNA。将制备的纳米载体与不同水平的GSH孵育24 h,进行琼脂糖凝胶电泳。C.roFPC/Ad-Dox(A)和roFPC/Ad-Dox/siRNA(B)的透射电子显微镜成像,N/P=16,siRNA=100 nm。D.不同N/P比形成的roFPC/Ad-Dox/siRNA的颗粒大小和Zeta电位。E.roFPC/Ad-Dox(A)和roFPC/Ad-Dox/siRNA(B)的DLS,N/P=16,siRNA=100 nM。结果表明,在roFPC/Ad-Dox/siRNA HGSNPs中,通过还原剂断裂氧化还原触发的二硫键,嵌入的siRNA可以从表面释放出来,并且siRNA条带的强度得到了改善。在琼脂糖凝胶电泳系统上,以N/P比16:1,在不同水平的GSH存在下,对roFPC/Ad-Dox/siRNA HGSNPs进行siRNA释放试验(图2B)。如图2B所示,当GSH水平增加时,带的迁移率和强度成比例地增加。透射电子显微镜成像还证明,当暴露于GSH时,roFPC/Ad-Dox/siRNA HGSNPs结构崩塌,随后发生显著的形态变化,表明GSH引发了roFPC/Ad-Dox/siRNA HGSNPs的分解。此外,载药hGSNPs的电位和颗粒大小如图2C,D所示。当比例大于8时,hGSNPs显示正电荷和均匀的颗粒尺寸。透射电子显微镜显示,roFPC/Ad-Dox HGSNPs呈球形,典型尺寸为150 nm,而凝聚的roFPC/Ad-Dox/siRNA HGSNPs更致密、更小。有效地将siRNA压实成颗粒尺寸在100 nm左右的小hGSNPs,有利于细胞内化。DLS也证实了hGSNPs的大小变化和均匀分布(图2e)。研究表明,直径为100-200 nm的聚合物纳米粒子在防止吞噬吸收方面具有最好的性能,而直径为300 nm的纳米粒子也非常适合细胞摄取和一般运输。这些结果表明,roFPC/Ad-Dox可以与siRNA形成具有良好颗粒大小和正电荷的siRNA缩合物,有利于细胞内吞。(3)溶血实验图3.A.rFPC在31.2 5-10 0 0 μg/mL浓度范围内的红细胞溶血百分率。B不同N/P比(16、25、30、35)的roFPC/Ad-Dox/siRNA HGSNPs的溶血百分率。图3A显示载体浓度达500μg/mL时,溶血率仍低于5%,几乎没有浓度依赖的溶血效应。图3B显示HGSNPS在pH=7.4时表现出与阴性对照相似的溶血活性(细胞凋亡图4为固定浓度的siRNA ( 100 n M )和Dox ( 0.5μg / m L )处理组的结果。从游离Dox处理组到roFPC / Ad-Dox / siRNA处理组,两细胞株的细胞凋亡率均呈递增趋势。hTERT mRNA的沉默会影响正常的细胞活动,这解释了为什么hTERT siRNA转染导致肿瘤细胞快速凋亡和细胞存活率下降。纳米复合体在HepG2细胞中诱导hTERT基因的显著沉默、细胞生长抑制和主要细胞凋亡。与游离Dox组、PC/Ad-Dox组和PC/siRNA组相比,PC/Ad-Dox/siRNA HGSNPs中化学药物和基因药物的有效协同作用诱导了两种细胞的高度显著的凋亡。这种非常高的细胞凋亡率归因于有效的靶向递送和与MCF-7细胞相比,MDA-MB-231细胞对化学药物和基因药物的摄取要高得多。图4.A,8B。流式细胞仪检测细胞凋亡率:MDA-MB-231、MCF-7及各处理组细胞细胞摄取试验检测rFPC/Ad-Dox/siRNAHGSNPs (N/ P = 16, siRNA = 100 nM, Dox = 0.5 μg/ mL)在三种细胞系中的摄取效率,并与正常的MCF-10A细胞进行比较。在细胞摄取实验中,通过固有的Dox荧光(红色)检测到细胞内的信号,并用绿色荧光标记FAM标记的siRNA。培养4h后,在MDA-MB-231和MCF-7细胞中,与非靶向HGSNPs孵育的细胞相比,经roFPC/Ad-Dox/siRNA HGSNPs孵育的细胞显示出更强的Dox(红色)和siRNA(绿色)荧光强度。此外,如图5A,B所示,MDA-MB-231细胞对roFPC/Ad-Dox/siRNA的摄取比MCF-7细胞高得多。与MCF-7细胞相比,MDA-MB-231细胞具有更多的表面FRs,因此更高比例的FR靶向HGSNP通过受体介导的内吞作用被摄取,从而导致更高的细胞摄取。有趣的是,FR靶向HGSNPs的高细胞内化只发生在过度表达FRS的癌细胞中,而不是在细胞表面FRS表达较低的健康细胞中。当细胞与游离FA和roFPC/Ad-Dox/siRNA HGSNPs同时孵育时,细胞对roFPC/Ad-Dox/siRNA HGSNPs的摄取受到影响和抑制。因为游离FA能与roFPC/Ad-Dox/siRNA HGSNPs竞争,降低细胞对roFPC/Ad-Dox/siRNA HGSNPs的摄取,显示FA对HGSNPs具有特异性的肿瘤靶向性。这一观察结果表明,靶向配体与药物递送载体的交联可以显著提高药物递送的潜力,并在癌症治疗中有效地靶向肿瘤。此外,对阳性(siRNAFAM和Dox)细胞的定量流式细胞术测量也显示了类似的结果(图5E)。靶向HGSNPs比非靶向HGSNPs和游离Dox更有效地将siRNA和Dox转运到细胞内。此外,siRNA和Dox-荧光细胞在低倍共聚焦图像中的分布相似,与它们的荧光强度的差异无关,而在高倍共聚焦图像中,它们在细胞质中的分布相似。图5 A. 细胞摄取结论综上所述,我们将化疗药物的主客体相互作用和siRNA缩合的静电相互作用相结合,制备了具有刺激响应性的roFPC/Ad-Dox/siRNA HGSNP。以一种简单的方法制备roFPC/Ad-Dox超分子复合体,然后将hTERT siRNA缩合成具有合适颗粒大小和表面正电荷的水溶性复合体,从而在MDA-MB-231和MCF-7乳腺癌细胞上协同递送药物和基因,即可构建HGSNPs。在FR介导的内吞作用后,由于共递送系统中可还原的二硫键连接,FA基团从载体上分离,导致结合的FRs释放,随后FRs从细胞质循环到细胞膜表面,促使FR持续介导的内吞作用实现增强的基因转染。此外,roFPC的主客体结构允许持续的pH依赖的细胞内药物释放,以及同步和有效的基因转染。有效的hTERT siRNA转染在hTERT mRNA和蛋白表达水平上均有较强的基因抑制作用,导致主要癌细胞的凋亡,同时提高了Dox的治疗效果。因此,hGSNP可能成为未来癌症治疗的潜在共递送载体。文章来源:Mousazadeh Hanieh. Stimulus-responsive drug/gene delivery system based on polyethylenimine cyclodextrin nanoparticles for potential cancer therapy. Carbohydrate polymers, 2022, 276, 118747.
企业动态
2023.06.14
表观PKa在包裹siRNA和mRNA的纳米粒子研制中的重要性
简介聚合物和脂质纳米颗粒已被广泛用作递送siRNA和mRNA的载体。我们总结了纳米粒子电荷和可电离性在与RNA复合、与生物成分结合、从内体逃逸以及将RNA释放到细胞质中的关键作用。强调了纳米颗粒的表观pKa对其有效性和毒性的重大影响,以及在开发用于RNA的主要配方中优化pKa的重要性。我们还讨论了在纳米粒子中微调pKa的可行性,以及该方法在优化RNA递送系统中的应用。1、基于RNA的治疗药物的给药系统RNAs正在迅速发展成为一类新的用于可成药分子包括蛋白质、RNA和基因组的治疗策略。。尤其是用siRNAs和mRNAs可用于治疗多种疾病已经引起了广泛的关注。siRNAs是一种21-25bp的双链非编码RNA,能诱导细胞质中目标mRNAs的特异性切割。siRNAs相对较小,分子量约为14 kDa,而mRNAs是长的单链RNA,分子量范围从300 kDa到5000 kDa。siRNAs是化学合成的,而mRNAs是通过体外转录合成的。在进入细胞后,mRNAs表达编码的蛋白质,以产生快速但短暂的治疗效果。与传统的基于病毒载体的疫苗相比,mRNA疫苗产生的抗原对免疫系统而言更加自然,因而诱导更佳的T细胞反应。基于RNA的疗法非常有前景,因为它们不需要核转运,而且与基于DNA的药物相比,突变风险较低。应将完整形式的siRNAs和mRNAs送入靶细胞以发挥其治疗作用。然而,负电荷和RNA的大小阻碍了它们进入细胞。此外,裸露的RNA在人体内很容易受到RNA酶降解和肾脏清除的影响。外源RNA也可以被先天免疫系统检测到并触发免疫反应。因此,一个高效和安全的递送系统对于将基于RNA的疗法从实验室转移到临床是至关重要的。纳米粒子的化学修饰和包埋是克服体内生物屏障的常用方法。纳米颗粒已经被广泛地用于递送质粒DNA、寡核苷酸和RNA。带正电的纳米材料与阴离子RNA形成纳米颗粒,以保护RNA不受核酸酶的影响,并帮助结合和穿透带负电的细胞膜。然而,需要克服的两个主要挑战是内体逃逸和RNA从纳米颗粒中解离。在不同类型的纳米材料中,脂质和聚合物因其安全性、灵活性和效率而成为最常用的运送RNA的纳米材料。纳米颗粒的大小、形状、表面电荷、比表面积、电离常数和聚集性是决定纳米颗粒的有效性和安全性的关键特征。因此,这些特性的优化对于开发成功的RNA纳米颗粒配方至关重要。含有可电离胺基头部的纳米颗粒是一种很有前途的RNA递送平台。酸解离常数(pKa)是纳米粒子可电离头基最重要的物理化学性质之一。pKa决定了纳米粒子的电离和表面电荷,这极大地影响了它们的稳定性、效力和毒性。它们的生物学性能取决于阳离子纳米颗粒与带负电荷的血液蛋白和细胞膜的相互作用。此外,表面电荷影响纳米颗粒的细胞摄取、内体释放和生物分布。2、表观pKa-基础知识和测量技术表观pKa是由实验确定的分子或纳米颗粒的值。该值是体系中电离(质子化)基团和非电离基团数目相等时的pH值。根据表观pKa可以估计纳米粒子中组装的纳米材料的表面电荷和离子相互作用。纳米粒子的表观pKa是纳米粒子中所有电离基团和去离子基团的平均比率的结果。因此,表观pKa不是任何单个分子的内在pKa值。随着pH值的降低,纳米颗粒的可电离胺基从去质子态转变为质子态。这一转变在表观pKa值附近非常迅速地发生。表观pKa值受各种非共价相互作用和环境参数的强烈影响,如离子强度、介电常数、疏水相互作用、π-π堆积相互作用和相邻电荷的存在。此外,可电离配体修饰的纳米粒子的表观pKa值随纳米粒子的大小和形状而变化。这些结构和环境因素会影响纳米粒子的实际电离。因此,纳米颗粒的表观pKa通常低于纳米颗粒中单个分子或单体的pKa。3、表观pKa的测定纳米颗粒的表观pKa可以用不同的技术来测量。酸碱滴定法和2-(对甲苯胺基)-6-萘磺酸(TNS)荧光法是测定空白纳米粒表观pKa的常用方法。在酸碱滴定(又称电位滴定)法中,首先将空白纳米颗粒悬浮在0.1M盐酸溶液中,然后加入0.1M氢氧化钠或0.5M氢氧化钾溶液进行滴定。滴定曲线两个等值点中点对应的pH值即为pKa值。TNS荧光法非常灵敏,已被广泛用于测量LNPs的pKa。TNS在水溶液中是非荧光的,但在与阳离子脂类或聚合物结合并移动到疏水环境中后显示出强烈的荧光。随着pH值的降低,TNS和可电离表面的相互作用增加,导致了荧光的稳定增加。在特定的pH值下,所有的可电离基团带电荷,荧光值达到最大。进行TNS荧光试验前,首先准备一系列的pH值在3-10的buffer溶液(150mM的NaCl,10mM的硼酸溶液,10mM的磷酸溶液,和10mM的柠檬酸溶液)。制备空白纳米粒,并且稀释在每种溶液中。TNS溶于DMSO中,浓度为300μM,将2μl的TNS溶液玉100μl的空白纳米粒混合。测定激发光325nm,发射光435nm条件下的荧光值。图1B展示了荧光值与pH值之间的曲线。编辑图1. pKa测定方法原理图4、基于纳米粒子的RNA递送中的表观pKa表观pKa值反映了纳米粒子的电荷相互作用,这显著影响了它们的生物活性,因为纳米粒子的带正电荷的分子可以与体内带负电荷的蛋白质和细胞相互作用。带负电荷的RNA通过静电相互作用与可电离的阳离子纳米材料缩合形成纳米颗粒,从而保护RNA免受核酸酶降解。具有最佳pKa的纳米粒子在生理pH值时携带微量的电荷,从而防止体内非特异性结合和毒性。此外,纳米粒的最佳pKa在内体逃逸和RNA释放到胞浆中以发挥治疗效果方面发挥重要作用(图2)。毒性,低效的内体逃逸,以及细胞质中纳米颗粒与RNA的不充分解离是与纳米颗粒的电荷状态相关的主要挑战,这些挑战可以通过调节表观PKa来克服。因此,表观pKa是提高包裹RNA的纳米颗粒效率的最重要参数。编辑切换为居中图2.通过可电离纳米颗粒的内体逃逸将RNA输送到细胞质中5、脂类纳米粒在siRNA传递中的表观pKa脂质纳米粒( LNPs )是目前临床上最先进的RNA递送系统。LNPs由可电离阳离子脂质、磷脂、聚乙二醇( PEG ) -脂质和胆固醇的混合物组成。虽然可电离脂质是LNPs的主要成分,也是最重要的成分,但其他成分也会影响LNPs的稳定性和功能。通过系统地改变1,2-二苯氧基-3-二甲氨基丙烷(DLinDMA)的结构,采用合理的设计方法开发了MC3脂质。每条尾巴上的两个双键是DLinDMA高基因沉默活性的原因。脂类的饱和程度影响LNPs的相变温度。尾部的双键数量从0增加到2,降低了相变温度,增强了脂类的融合性。后来,在DLinDMA的linker中引入了一个缩酮环,从而开发了DLin-K-DMA脂质,使其沉默活性提高了2.5倍。通过在缩酮环和可电离的胺之间引入额外的亚甲基,进一步提高了活性,得到了DLin-Kc2-DMA(Kc2)类脂。开发高效脂质的另一种方法是筛选一个大的类脂分子组合库。种种研究表明,调节LNPs的pKa可以用来实现细胞特异性活性。细胞摄取的增加并不总是与沉默活动的增加相关。LNP在进入细胞之前不应该解离,它们必须逃离内体,以完整的形式释放siRNA,才能产生沉默效应。基因沉默活性与pKa的相关性比与颗粒大小和siRNA的包封率更高。pKa值在6-7的LNPs展现了良好的基因沉默,而pKa在3-6的LNPs的稳定性和细胞摄取效率较低,导致沉默效率更低。6、用于mRNA递送的脂质纳米粒的表观pKa与传统疫苗相比,开发基于mRNA的疫苗要快得多,使我们能够迅速对病毒爆发做出反应。最初设计用于siRNA递送的LNP可以被修饰以递送mRNAs。例如用于siRNA递送的C12-200 LNP,改变脂质比例和结构对其进行优化,优化后的LNP表达mRNA的能力相比原来的LNP增加了7倍。除了表观pKa外,两种LNP具有相似的形态特征,优化后的LNP的表观pKa从7.25变为6.96。有趣的是,这两个LNP在siRNA传递中显示出相似的效力,突出了siRNA和mRNA优化配方参数的差异。编辑表1.用于RNA递送的高效脂类和聚合物编辑切换为居中表1.用于RNA递送的高效脂类和聚合物编辑切换为居中表1.用于RNA递送的高效脂类和聚合物7、用于RNA递送的聚合物纳米粒子的表观pKa各种阳离子的、可电离的、可生物降解的和电荷可变的聚合物已被用于制备用于有效递送RNA的纳米颗粒。聚合物的物理化学性质(尺寸、表面电荷、稳定性、包埋性和毒性)可以通过改变可电离基团或改变聚合物的大小来优化。聚乙烯亚胺(PEI)因其内体逃逸能力而被广泛用于DNA和RNA的输送。胺的质子化在早期的内涵体中产生质子海绵效应。然而,PEI在生理条件下带有正电荷,它与生物分子的相互作用会导致显著的毒性。因此,已经用各种生物材料对PEI进行了修饰,以降低其毒性。壳聚糖是RNA递送中另一种性质良好、用途广泛的聚合物。壳聚糖可通过调节分子量和脱乙酰度,调节pKa在6.2 ~ 7.0之间。由此可见,壳聚糖基纳米粒在递送siRNAs和mRNAs方面是安全有效的。而且,由于壳聚糖的每个亚基都有两个羟基和一个胺基,因此可以很容易地对壳聚糖进行改性,以满足RNA递送的具体要求。研究了广泛应用于RNA递送的三嵌段共聚物中pKa与siRNA递送效率之间的关系。通过调节疏水胺单体的数量和类型,合成了一系列pKa值在5.2~7.0之间的三嵌段共聚物。pKa为5.8~6.2的共聚物具有较好的基因沉默效果。pH响应型聚合物是另一种很有前途的RNA载体。pH响应是可电离基团可逆去质子化和质子化的结果。pKa是反映纳米粒子在不同pH值下的电离状态的重要参数。具有最佳pKa值的纳米颗粒通过对内体pH的响应显示出最大的疗效。由该聚合物制成的siRNA纳米颗粒在体内表现出优异的抗癌活性。在纳米结构中保持最佳的pH敏感性对于产生最大的内体逃逸和RNA效率是非常重要的。8、纳米颗粒的pKa调节聚合物纳米粒子的表观pKa可以通过对单体进行化学修饰、改变共聚物中不同单体的摩尔比或改变聚合物的相对分子质量来调节。通过控制不同单体的聚合,可以合成另一系列聚合物。纳米探针的急剧pH变化与其表观pKa密切相关。LNPs的表观pKa不仅取决于单个脂类的pKa,而且还取决于所有脂类的摩尔比。每种脂类都有不同的pKa,可以通过改变其头基和疏水尾部来改变。因此,调整LNPs表观pKa的一个策略是对脂类进行化学修饰。另一种策略是使用两种或两种以上具有不同pKa值的脂类的混合物,并调整它们的比例,以获得所需的表观pKa。结束语和未来展望RNA治疗成功的关键要求是克服RNA到达作用位点前可能降解的细胞外和细胞内屏障。虽然纳米粒子被广泛用于保护RNA不被降解,但是纳米粒子的包封是限制治疗效果的主要瓶颈。内体逃逸还没有完全被理解,它因细胞类型的不同而不同。编辑pKa对纳米颗粒的不稳定性、效力和毒性的影响人们普遍认为,纳米颗粒的结构和物理化学性质在递送RNA方面起着重要作用。然而,有效递送RNA的结构要求并不是决定性的,而且大多数活性脂质的结构特征非常不同(表1)。相比之下,纳米颗粒的表观pKa是预测纳米颗粒包裹RNA效率的可靠标准。纳米粒的表观pKa与其疗效和毒性有很高的相关性。表观pKa在最佳范围内的纳米颗粒显示出有效的内体逃逸和治疗效果(图2)。将表观pKa作为纳米粒子开发的设计标准将有助于发现有效和安全的RNA疗法。优化pKa值为6.2-6.5的LNPs被发现对肝脏递送siRNAs是有效的。最佳pKa在6.6-6.9范围内的LNPs在IM注射mRNAs后产生非常有效的免疫反应。不同细胞的内吞过程不同,因为细胞的增殖状态因其生理作用而不同。表观pKa应根据靶组织和疾病情况进行优化。总体而言,最佳的pKa值取决于几个因素,包括载体的结构、靶组织和递送途径。因此,很难推荐一个普遍的pKa值的纳米粒子用于RNA传递。但是,pKa值6-7是开发用于RNA疗法的纳米颗粒的理想范围。文献来源:Patel et al. The Importance of Apparent pKa in the Development of Nanoparticles Encapsulating siRNA and mRNA. Trends in Pharmacological Sciences, 2021, 42(6): 448-460.迈安纳(上海)仪器科技有限公司专注于解决RNA纳米药物递送行业痛点的整体解决方案本土提供商。公司不仅可提供从实验室到产业化的核酸(包括mRNA,siRNA,CRISPR/Cas9,SAMRNA,CircRNA等)-LNP全系列封装设备!更可提供整体解决方案中的技术支持。迈安纳自主研发生产的INano™全系列产品已获得欧盟CE认证和美国FCC认证。目前已服务于国内数百家顶尖生物制药公司以及科研学术机构,并已成功助力多个客户相继获得中国,美国,巴西,澳大利亚等mRNA类药物IND临床批件,进入临床和商业化生产。
企业动态
2023.06.09
阴离子脂质纳米粒优先将mRNA递送至肝网状内皮系统
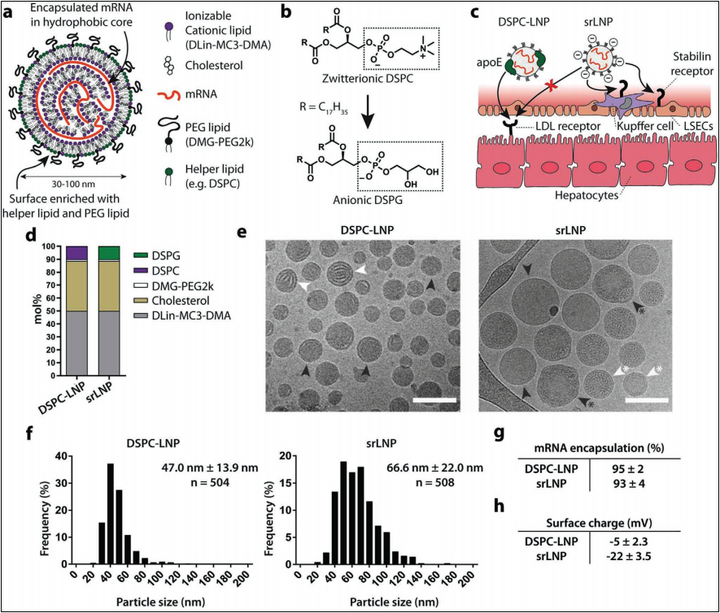
摘要脂质纳米粒(LNPs)是体内递送外源RNA至靶细胞的先进非病毒载体技术。系统递送平台技术,如Onpattro,通过静脉给药靶向至肝实质细胞。然而,系统给药递送RNA至肝细胞以外的细胞组织挑战巨大。本文基于广泛的纳米粒体内分布和清除机制的理解,合理设计了一种基于LNP的mRNA递送系统,可以优先靶向至肝网状内皮系统(RES)。胚胎斑马鱼,小鼠给药实验证明该递送系统可以显著增加在肝脏,特别是肝RES细胞中mRNA的表达。该肝RES靶向递送系统仅需要改变Onpattro处方中的单一脂质,将LNP表面电荷从中性转换至负电荷。这项技术不仅为治疗RES细胞类型起关键作用的肝脏特异性和系统性疾病提供了新的机会,也证明先进的RNA疗法的合理设计必须以所涉及的主要纳米生物相互作用的充分理解为前提。1、介绍LNPs的肝细胞靶向是通过吸收可溶性的载脂蛋白E(apoE)在血液循环中的LNP的表面,apoE进而促进LNP与肝细胞窦状表面高表达的低密度脂蛋白受体(LDLr)结合。ApoE-LDLr的结合导致LNP内吞和进一步的RNA细胞内递送。RNA在细胞内的释放通过可电离阳离子脂质在内涵体中的质子化和后续的内涵体膜破裂而增强。除肝细胞(大约占肝脏总体积的80%)外,肝脏由非实质肝细胞,包括Kupffer细胞(KCs)和肝窦内皮细胞(LSECs)组成。连接肝动脉、门静脉和中央静脉的肝血管或肝窦,主要由LSECs(约70%)和KCs(20%)组成。这两类细胞共同组成了肝RES,其主要作用是通过清除血液中的大分子废物和病原体来维持血液稳态。特别是LSECs,它是一种特化的清除性内皮细胞(SECs),是人体内具有最高内吞活性的细胞。这些细胞负责清除内源性大分子,如氧化低密度脂蛋白和透明质酸,以及血液传播的病原体。在很大程度上,LSEC对大分子废物和病原体的清除是通过一系列在LSEC管腔膜上表达的清除受体(如透明质酸和稳定素受体)介导的。作为治疗靶点,LSECs在肝脏稳态、急性损伤后的再生以及各种肝脏疾病,如肝硬化和肝癌的发病机制中发挥着重要作用。此外,作为抗原提呈细胞,LSECs是肝脏适应性免疫和全身免疫耐受的关键调节因子,因此是很有前途的免疫治疗靶点。本文合理设计阴离子LNPs,优先靶向和转染肝脏RES,即清道夫受体LNPs (srLNPs)。利用胚胎斑马鱼(Danio rerio)作为一种方便、准确、经济的体内模型,定性地描述了LNP在细胞分辨率和实时水平下,在体内的生物分布、mRNA递送和外源性荧光蛋白的表达,,特别关注LNP在SECs、巨噬细胞和胚胎肝细胞中的相对摄取和mRNA表达。此外,我们证实了清道夫受体,稳定素-1和-2,介导了阴离子LNP被RES的摄取。最后,我们验证了小鼠肝脏RES中LNP优先介导的mRNA转染,并证明了stabilin-2在哺乳动物LSECs中阴离子LNP摄取和处理的关键重要性。2、结果2-1 阴离子srLNPs的设计和表征通常,LNP由5部分构成,疏水核心由可电离阳离子脂质,胆固醇和核酸药物组成,LNP表面(脂质-水界面)富含辅助性磷脂,如DSPC和脂质PEG接合物。我们将Onpattro中的两性离子DSPC换成结构最接近的阴离子类似物DSPG,使LNP表面带阴离子而最小化破坏LNP的整体结构。阴离子表面电荷反过来会在LSECs中通过稳定素途径介导LNP的和摄取,同时抑制肝细胞apoE-LDLr之间的相互作用,从而重构LNP的靶向和RNA递送。本文中含DSPG的LNPs定义为srLNPs,基于Onpattro脂质处方的LNP定义为DSPC-LNPs。冷冻电镜显示两者均有典型的电子致密核心结构。DSPC–LNPs (47.0 ± 13.9 nm)中观察到无定形和层状的核心结构,srLNPs (66.6 ± 22.0 nm)包含无定形、单层和多层结构。两种配方的粒径均远低于大小依赖的吞噬作用的粒径阈值,及无障碍通过肝上皮细胞(无限制地通过肝细胞)的窗口值(180 ± 41 nm)。两者地包封率均>95%。然而重要的是,相比DSPC-LNPs(zeta 电位≈-5mV)srLNPs表面有明显的负电荷(zeta 电位≈-20mV),表明DSPG存在于脂质-水相地交界面。编辑切换为居中图1:srLNPs的设计和表征2-2 LNPs在胚胎斑马鱼中的生物分布之前,我们已经证明,静脉注射的阴离子纳米颗粒(大小从10到150 nm不等,涵盖各种化学成分)可以迅速和广泛地被注射给受精后(days postfertilization)两天的的胚胎斑马鱼的尾端造血组织(CHT),后主静脉(PCV)、和尾端静脉(CV)中的SECs清除。为评估LNP的体内分布,含有荧光脂质探针(DOPE-LR,0.2 mol%)和包裹了荧光标记的mRNA(Cy5标记)的两种LNP被注射给2dpf的野生型斑马鱼。共聚焦成像显示了两种LNP-mRNA在注射后1.5h(hpi)不同的生物分布模式。在DSPC-LNPs中,颗粒大多自由循环,脂质和mRNA均局限于胚胎的血管系统,且均匀分布于整个血管系统(图2c-d)。此外,一小部分DSPC-LNPs在CHT的血驻留巨噬细胞中积累,表明被RES低水平识别和摄取(白色箭头,图2d)。srLNPs大部分在1.5 hpi从血液循环中清除,在SECs和PCV, CHT和CV定居的血驻留巨噬细胞中高度选择性累积(图2e-f)。srLNPs在斑马鱼胚胎的清除血管中的选择性累积与之前报道的阴离子脂质体,聚合物囊泡,无机纳米粒的摄取类似。它们是通过稳定素清道夫受体介导被摄取的。将srLNPs注射给stab1-/-/stab2-/-双敲除斑马鱼胚胎。在这些突变胚胎中,1.5 hpi,srLNPs主要停留在循环系统。一少部分累计在CHT血液驻留巨噬细胞中(图2g),表明srLNPs被斑马鱼胚胎中SEC的非巨噬细胞摄取,主要是通过稳定素受体介导的。DSPC-LNPs的类似实验则显示生物分布没有改变,大部分的纳米粒仍然留在循环系统中(图2h)。在所有情况下,脂质和mRNA的荧光探针在1.5 hpi均完全共定位。表明在血液循环,细胞识别和早期细胞摄取阶段,mRNA均稳固地存在于DSPC和srLNPs的核心。编辑图2:DSPC-LNPs和srLNPs在2dpf斑马鱼胚胎给药后1.5h中的生物分布2-3 mRNA-LNP在胚胎斑马鱼内的递送和表达我们使用LNP包载cy5标记的EGFP mRNA,用于研究在斑马鱼体内的分布和表达。如图3b, c所示,在1.5 hpi,srLNPs主要分布在SECs和在斑马鱼PCV, CHT和CV中的血驻留巨噬细胞。而在色素细胞中观察到的微弱的绿色荧光,则是由于斑马鱼胚胎在GFP通道的自发荧光。在24 hpi,在SECs和血驻留巨噬细胞中观察到强烈的eGFP绿色荧光。这与类似的脂质系统递送eGFP-mRNA的表达时间一致。eGFP荧光的成熟和荧光发生在共孵育2-7h后,并且在24h内持续增加。在stab1-/-stab2-/-变异胚胎中,在24 hpi eGFP在血驻留巨噬细胞中有表达,但在SEC中无表达,证明巨噬细胞对阴离子纳米粒的摄取不仅依赖于稳定素受体途径。在DSPC-LNP介导的mRNA递送中,在24 hpi,eGFP的荧光广泛分布在2天龄的斑马鱼胚胎中。结合该组在1.5 hpi,缺乏明显的mRNA细胞内聚集,表明DSPC-LNP组低水平的非特异性的细胞内摄取,相应的mRNA在包括SECs和血驻留巨噬细胞等一众细胞中表达。编辑图3:在mpeg1: mCherry 转基因斑马鱼胚胎中srLNP的生物分布,eGFP-mRNA递送,和eGFP表达。2-4 在年长斑马鱼胚胎中的肝靶向和mRNA表达我们构建了apoE靶向的DOPC脂质体(含有5%的Chol-NH-apoE)。通过静脉注射,apoE靶向的DOPC脂质体在4天龄斑马鱼胚胎的肝脏中有明显信号(图4c, d),而非靶向性的DOPC脂质体仍自由循环(图4e, f),证明apoE介导的纳米粒识别和摄取途径在4天龄的斑马鱼中是存在的,功能化的,和可开发的。在肝脏内部,apoE靶向的纳米粒不仅可以被肝细胞摄取,并且可以描绘出肝细胞六角形的形态。之后,我们将DSPC-LNPs和srLNPs注射入4天龄的斑马鱼胚胎中。sr-LNPs介导的eGFP表达主要是在RES细胞中,肝脏特异性的mRNA表达并未观察到,表明在斑马鱼中稳定素介导的srLNPs的识别和摄取超过任何竞争性的apoE介导的LNP处理过程。DSPC-LNPs组的eGFP表达水平很低,在肝脏中也没有优先累积(1.5 hpi),或增强的肝脏特异性的mRNA表达(24 hpi)。DSPC-LNPs和人apoE预孵育1h,确实在斑马鱼肝脏中增加了eGFP mRNA的表达,尽管在1.5 hpi没有明显增强肝靶向。表明DSPC-LNPs在肝细胞介导的mRNA表达可能可以通过apoE介导的识别和摄取途径而增强,内源性的apoE介导的LNP处理方式,在斑马鱼胚胎中是相对低效的。编辑图4:apoE靶向脂质体在4天龄斑马鱼胚胎中的生物分布编辑图5:DSPC-LNP在4天龄野生型胚胎斑马鱼中的生物分布和表达(与人apoE共孵育或未共孵育)2-5 LNP介导的小鼠体内mRNA的递送和表达接下来,我们评估了LNP在小鼠体内的生物分布和蛋白表达模式,聚焦于在肝脏,哺乳动物最大的RES器官生物分布和表达。为了评估LNP在RES细胞和组织中的生物分布,制备了含有不可交换的,荧光脂质探针DiD的LNP-mRNA,允许我们可以相对独立地评估细胞特异性的LNP靶向和相应的mRNA表达。在2 hpi,相比骨髓和脾脏中的RES器官,DSPC-LNPs和srLNPs在小鼠肝脏均有大量的LNP聚集。然而,srLNPs在所有肝细胞类型中都有明显增强的细胞摄取(图6c)。srLNPs在小鼠LSECs和KCs中分别有大约5倍和3倍的靶向增强(图6d)。证明LNP-mRNA递送系统中加入阴离子DSPG不仅总体上增加了肝脏的趋向性,并且导致了在肝RES细胞中的优先靶向和摄取。之后,我们使用LNP包载mCherry-mRNA,srLNPs相比DSPC-LNPs显著增强了在RES细胞中的递送。然而在肝细胞中,两种LNPs的表达均高于肝RES细胞。肝脏细胞特定的靶向和相应蛋白表达水平之间的明显不一致可能是由于肝细胞和肝RES细胞之间非常不同的生理和功能差异。LSECs和KC有非常强的内吞/吞噬能力(尽管LNP摄取率高,但mRNA仍发生显著降解)。虽然使用mRNA的表达或敲除作为LNP靶向的间接评估是很常见的,我们的实验证明,尤其是在肝脏中这种间接的读取是很差的LNP靶向性的预测指标。最后,为了验证稳定素介导的肝脏RES靶向,srLNPs静脉注射入stab2-/-敲除小鼠,LNPs靶向LSECs有80%的减少,LSEC特定的mRNA表达有50%的减少。相比之下,敲除稳定素-2对靶向KCs(表达稳定素-2但可能涉及其他的LNP识别和摄取受体)仅有少量影响。编辑图6:静脉注射后LNP在不同肝细胞中的摄取和功能化mRNA递送总结本文基于对纳米-生物相互作用的广泛理解,合理设计了可以优先靶向肝RES的LNP-mRNA平台。我们发现在SECs中,稳定素介导的识别和摄取在各种阴离子纳米粒中占据主导地位。优先递送mRNA至肝脏的ECs,可以通过使用胆甾醇油酸酯或氧化的胆固醇成分而实现。这些系统可能通过电荷或稳定素介导的方式增加LSECs的摄取,在氧化LDL和乙酰化LDL系统中均可观察到。LNP介导的递送RNA至脾脏可以通过在Onpattro处方中加入阴离子磷脂18PA(40 mol%),因为其近乎中性的电荷和脾脏缺乏稳定素表达,因此这种脾脏的趋向性不大可能通过电荷或稳定素依赖的方式。这项研究强调LNP组成,生物物理特征,LNP超结构,和LNP体内命运的复杂相互作用。对于新LNP设计,广泛理解LNP的化学和生物特性是必须的。LNP的体内评价受限于传统动物模型大规模研究的高昂花费和可实施性,本文证明胚胎斑马鱼可以成为LNP研发管线的有力补充。参考文献:Roy et al. Anionic Lipid Nanoparticles Preferentially Deliver mRNA to the Hepatic Reticuloendothelial System. Advanced Materials. 2022, 34, 2201095.
企业动态
2023.06.09
迈安纳 INano平台成功助力用户开发新型四价正痘病毒疫苗
四价mRNA疫苗激发针对牛痘和猴痘病毒抗原的有效免疫应答2022年人类猴痘病毒感染的全球暴发引起了公众对人畜共患疾病人际传播威胁的卫生关注。鉴于有证据表明,包括牛痘和骆驼痘在内的其他正痘病毒也报告对人类具有传染性,并且存在天花从实验室意外逃逸的风险,此迫切需要开发一种具有广泛预防正痘病毒的痘病毒疫苗,以储备以应对未来的紧急情况。在这项研究中,我们构建了一种新的痘病毒候选疫苗mRNA-ALAB-LNP,编码牛痘病毒抗原A27、L1、A33和B5。单次免疫后,小鼠即产生强效的抗L1特异性抗体,和中等程度的抗A33-、抗A27 -和抗B5特异性抗体反应。第二次接种后,四种抗原的抗体反应均显著增强,IgG滴度均>5 logs,其中抗A33的 IgG滴度最高。实验结果01mRNA分子的设计与合成设计了一个常规的mRNA序列,包含帽结构、5'UTR非翻译区、CDS翻译区、3'UTR非翻译区和PolyA 结构。CDS翻译区表达4个串联的VACV抗原分子(A27, L1, A33, B5)被连接体分离,mRNA分子命名为mRNA- ALAB。在完整的mRNA序列的5'端添加一个T7启动子和在3'端添加一个BspQI限制性内切酶切割位点(图1A)。用BspQI酶切质粒可以有效地线性化质粒模板(图1B)。以线性化质粒为模板,通过体外转录反应合成了mRNA-ALAB分子。琼脂糖凝胶电泳和HPLC-SEC分析表明,合成mRNA具有良好的完整性(图1C)和纯度(图1D)。图1: mRNA-ALAB的结构设计和制备02mRNA-ALAB-LNP的制备和表征本研究中,使用迈安纳微流控设备INano L进行脂质和RNA的充分混合,空载LNP和包载了RNA的LNP的粒径分别为75nm和84nm(图2B),PDI图2: mRNA-ALAB-LNP的准备和表征图3: 转染mRNA-ALAB-LNP后四种靶蛋白的表达03mRNA-ALAB-LNP疫苗在小鼠中诱导了强效的抗原特异性结合抗体反应为了研究mRNA疫苗的免疫原性,6-8周龄BALB/c小鼠以2周间隔肌肉注射2次疫苗(图4A) ,每次注射剂量为20ug。于首次注射前3天、第14天(首次注射后2周)、第28天(首次注射后4周)和第42天(增强注射后2周),采血取样,检测抗原特异性结合抗体(图4B-4E)。第二次免疫后45 d取脾进行细胞免疫评价。在第一次免疫后,诱导了强效的抗L1特异性和中等的抗A33 -、抗A27 -和抗B5特异性抗体反应,并且针对所有四种抗原的抗体反应随着时间的推移而增加。同时,加强免疫后4种抗原的抗体水平显著升高。这些结果表明,mRNA -ALAB- LNP疫苗能够诱导强效的抗原特异性结合抗体反应。图4:mRNA-ALAB-LNP在小鼠体内引起强效抗体反应04mRNA-ALAB-LNP疫苗免疫血清展现了强效的痘病毒中和活性为了确定mRNA -ALAB- LNP疫苗产生的抗体是否具有病毒中和活性,我们用100 CCID50 VACV病毒和增强疫苗注射后2周的灭活血清孵育,以检测中和活性。通过观察和分级细胞病变效应(CPE)来计算血清中和活性。病毒对照(VC)和空载LNP免疫血清,在1:80的稀释下,未表现出中和活性,感染的BSC-1细胞显示出明显的CPE(图5A)。相反,mRNA -ALAB- LNP接种小鼠的免疫血清,在1:80和1:640和1:1280的稀释下,在感染的BSC-1细胞中未见CPE,显示出细胞免受病毒感染的保护(图5A)。在本实验中,mRNA -ALAB- LNP的平均中和抗体滴度可达1431 (图5B)。图5:mRNA-ALAB-LNP诱导出抗牛痘病毒的强效中和抗体05mRNA-ALAB-LNP疫苗在小鼠体内诱导抗原特异性细胞免疫反应为了探讨mRNA疫苗是否能诱导小鼠特异性细胞免疫应答,在增强针注射45 d后收集小鼠脾细胞,分别用ELISPOT法检测针对6种抗原肽文库A27、L1-1、L1-2、A33、B5-1、B5-2的特异性IFN-γ阳性T细胞。对所有四种抗原均检测到特异性IFN-γ应答,且应答显著高于空白LNP免疫对照组(图6A)。A27肽库和A33肽库对IFN-γ的刺激水平较高,分别为904个点/百万细胞和27747个点/百万细胞。与抗A33的总特异性IgG应答最高一致(图3D),对A33肽库的应答中IFN-γ应答也最高(图6B)。图6:mRNA-ALAB-LNP诱导小鼠细胞免疫应答(n=4)06mRNA-ALAB-LNP接种小鼠血清显示针对猴痘病毒同源抗原的高水平交叉结合效应将mRNA-ALAB-LNP免疫小鼠的免疫血清依次稀释,与4种蛋白A29、M1、220 A35和B6孵育,检测交叉结合抗体滴度。ELISA结果显示,首次免疫后对猴痘抗原A35、M1、222、A29和B6均有较强的血清IgG应答,且随着免疫时间的延长,抗体滴度逐渐升高。(图7A- 223 7D)。抗A29抗体平均滴度从2040 (初次免疫后2周)增加到4440 (初次免疫后4周),抗M1抗体从74520 (初次免疫后2周)增加到184680 (初次免疫后4周),抗A35抗体从2520 (初次免疫后2周)增加到9000 (初次免疫后4周),抗B6特异性抗体从5880 (初次免疫后2周)增加到10920 (初次免疫后4周)。此外,增强免疫2周后,4种抗体水平均显著升高,其中抗A29、抗M1、抗A35和抗B6抗体滴度分别达到110000、2430000、558000和1782000。总之,这些结果表明,编码牛痘抗原(A27、L1、232、A33和B5)的mRNA-ALAB-LNP疫苗在小鼠体内诱导了针对各自猴痘抗原(A29、M1、A35和B6)的等效或更好的交叉反应抗体。(图7 A-7D)。图7:mRNA-ALAB-LNP可诱导针对MPXV抗原的强效交叉反应抗体。总结综上所述,本研究基于牛痘病毒抗原A27, L1, A33、B5,开发了一种新的四价mRNA-ALAB-LNP疫苗,具有潜在的抗正痘病毒的潜力。该候选疫苗对牛痘病毒和猴痘产生了显著的抗体应答。这些数据证明了mRNA-ALAB- 282 LNP疫苗设计的可行性,并提供了其作为广泛的正痘病毒候选疫苗的潜力的初步证据。文献来源:Su et al., A Quadrivalent mRNA immunization elicits potent immune responses against vaccinia and monkeypox viral antigens – a step closer to a broad orthopoxvirus vaccine. bioRxiv. Doi: 10.1101/2023.04.23.537951.
应用实例
2023.05.16
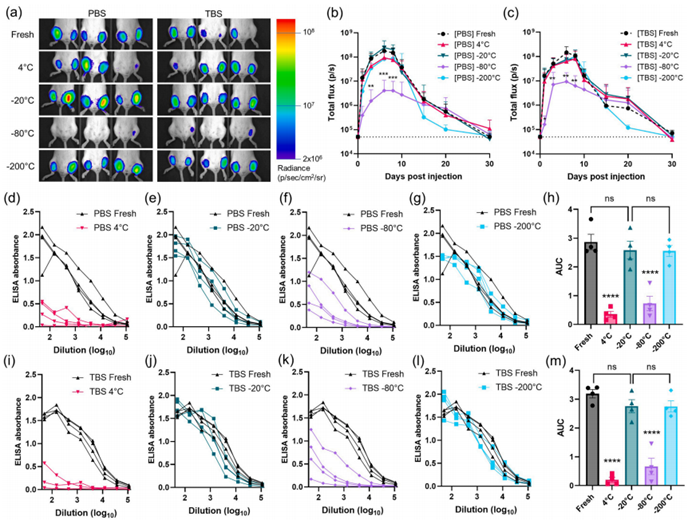
脂质纳米粒-自复制RNA疫苗储存条件优化
脂质纳米粒-自复制RNA疫苗储存条件优化1、 简介RNA分子递送实验可以追溯到1978年,当时用脂质体将编码兔球蛋白的mRNA体外转染给小鼠淋巴细胞。从那时起,可离子化的脂质和RNA递送技术的进步导致美国食品和药物管理局(FDA)在2018年批准了第一个基于siRNA的脂质纳米粒子(LNP)疗法,Onpattro (Patisiran)。到2020年初COVID-19大流行发生时,几个包裹mRNA的LNP配方已经进入临床试验阶段。2020年12月,FDA为辉瑞-生物技术公司(BNT162b2)和Moderna公司(mRNA- 1273)的COVID-19疫苗颁发了紧急使用授权(EUA),这两种疫苗都利用加载编码病毒尖峰蛋白的mRNA的LNPs作为免疫原。目前,各种RNA产品的LNP配方,包括寡核苷酸(如siRNA、miRNA、反义寡核苷酸等)、碱基修饰的RNA、序列优化的RNA以及来自阿尔法病毒、黄病毒、麻疹病毒和横纹肌溶解病毒的自复制RNA,正处于临床开发的不同阶段,应用范围从疫苗到癌症治疗。虽然两种获批的COVID-19的mRNA疫苗结构相似,但BNT162b2使用磷酸盐缓冲液(PBS)作为溶剂(含20% w/v蔗糖),而mRNA-1273使用tris-HCl缓冲液(TBS;含8% w/v蔗糖)。据报道,这两种配方在这些蔗糖缓冲液中都能有效的地保持疫苗的稳定性和有效性,但储存温度和寿命的范围很广;mRNA-1273在-20℃下可储存6个月,而BNT162b2在-70℃下浓缩可以储存6个月,最近的数据表明在-25℃至-15℃下储存两周也很稳定。关于关键储存参数(如冷冻保护剂、分散剂、温度等)对LNP-RNA疫苗的影响,公众的认识是有限的。在数量有限的已发表的研究中,发现有几个常见的参数会影响储存结果。糖基冷冻保护剂,如蔗糖、海藻糖和甘露醇,可以提高LNPs在冻融和冻干期间的稳定性。在不同的水溶剂(如水、盐水)或与有机溶剂(如乙醇)混合构成的LNP在提高LNP-RNA的稳定性方面显示出轻微的效果。然而,最主要的变量似乎是储存温度,从液氮中的速冻到4℃的冷藏,其中不同的配方适宜的储存温度也不尽相同。我们以前报道过一种由TT3(一种类似脂质的可电离分子)、DOPE、胆固醇和DMG- PEG2k组成的制剂,该制剂加载了编码荧光素酶的mRNA,成功地在液氮中闪冻,并在5% w/v蔗糖或海藻糖中储存长达3个月。另一方面,由不明的可离子化脂质、DSPC、胆固醇和DMG-PEG2k组成的制剂,加载了编码SARS-CoV-2小鼠适应株的受体结合域(RBD)的mRNA,在室温下至少保持了7天,在4℃可能会更久。另一项研究发现了咪唑修饰的脂质,似乎通过添加醚键和允许π-π堆叠的胺基头部形成高度稳定的RNA负载结构;这种LNP能够在4℃下保持RNA的完整性和功能达25周,在25℃下保持18周,在37℃的PBS中保持3周而不需要冷冻保护剂。LNP- RNA疫苗的保质期范围很广,其确切原因仍然未知。此外,许多关于LNP- RNA稳定性的研究都集中在使用报告基因(如荧光素酶、GFP)编码的mRNA的功能测量上,而不是直接评估疫苗的免疫原性,并且缺乏将LNPs的结构完整性与疫苗活性联系起来的分析。我们研究了冷冻保护剂、缓冲液类型(磷酸盐和三缓冲盐水)和储存温度对自复制RNA负载的LNP(LNP-RNA)疫苗的结构和功能维持的影响。2. 结果蔗糖对维持LNP-RNA的结构和功能完整性的影响脂质纳米颗粒(LNPs)是利用微流控系统将乙醇中的脂质有机相与水中的水相repRNA混合,诱导包裹自复制RNA的LNPs自组装(LNP-RNA)。LNPs的制备采用了可电离的脂质胺基与RNA磷酸盐2:1的比例(相当于可电离的脂质:RNA质量比为2.9:1)。将得到的颗粒透析到pH7.4的PBS或含有0%、5%、10%或30% w/v蔗糖的TBS中,以测试缓冲剂和冷冻保护剂的影响。然后将颗粒储存在4℃、-20℃、-80℃或-200℃(在液氮中闪冻)。7天后,在25℃解冻LNP- RNA,并使用动态光散射(DLS)测量其流体力学尺寸和多分散性。与各自的缓冲液和蔗糖浓度中新制备的LNPs作为对照。如表1所示,无论缓冲液和蔗糖浓度如何,在-80℃储存LNPs会导致颗粒聚集和高的多分散性指数,而在其他温度(4℃、-20℃和-200℃)下储存则保持LNPs的尺寸分布与新制备颗粒相当。值得注意的是,在PBS和TBS储存的LNPs的缓冲液中没有糖,导致粒度分布增加了20-50纳米,表明了蔗糖的低温保存效果。当LNPs从-80℃的储存中解冻时,LNPs的平均PDI明显增加到0.9左右,而新制备样品的PDI为0.3左右。新制备的LNP-RNA,在-20℃、-80℃和-200℃储存后,其平均包封效率保持在90%左右,而在4℃储存的颗粒显示出明显下降到70%以下(P ),颗粒外可检测到的RNA有所增加(P )。总的来说,在确定LNPs的结构保留方面,温度似乎比0-30% w/v范围内的蔗糖浓度起着更主导的作用。表1 脂质纳米颗粒的动态光散射(DLS)评估。(n = 3).由于储存在0% w/v的蔗糖中似乎可以保持颗粒的整体物理完整性,尽管流体力学尺寸略有变化,需要确定糖的存在对于保持体内的疫苗效力是否有影响。为此,我们在LNPs上装载了编码稳定的HIV Env SOSIP三聚体免疫原(称为N332-GT2)的repRNA,该免疫原是为靶向启动HIV env尖峰的N332超级位点的B细胞。疫苗颗粒在含有0%、5%或10% w/v蔗糖的PBS中在-20℃储存一周,然后解冻并在小鼠体内注射,4周后通过ELISA评估血清抗体滴度(图1)。随着蔗糖浓度的增加,抗体产生有增加的趋势。虽然储存在0% w/v蔗糖的PBS中的LNPs(图1a)能够诱发针对免疫原的抗体产生,但其水平明显低于新制备的疫苗(p = 0.0118)和储存在10% w/v蔗糖中的疫苗(p = 0.0185,图1d)。储存在5% w/v蔗糖中引起的抗体滴度与新疫苗没有统计学上的明显差异(p = 0.1069),但在一些动物中呈现出反应较弱的趋势(图1b)。然而,用储存在10% w/v蔗糖中的LNP-RNA接种的动物产生的血清抗体稀释曲线与用新制备的LNP-RNA接种的小鼠很好地重叠,没有统计学上的显著差异(p = 0.9959,图1c,d)。图1. 缓冲液和蔗糖浓度对脂质纳米颗粒疫苗储存的影响。由于我们观察到在PBS和TBS中的PDI测量值最低,而且在10% w/v蔗糖中储存的抗体反应最可靠,我们决定在后续研究中使用这一浓度的蔗糖。缓冲液对LNP-RNA体内性能的影响我们对储存在不同条件下的LNPs进行了体内RNA表达的观察。制备了携带编码萤火虫荧光素酶的repRNA的LNPs,LNP-RNA在10% w/v蔗糖的PBS或TBS中透析。然后将LNPs在4℃、-20℃、-80℃或-200℃(液氮)储存7天,再解冻用于注射。在注射当天,制备新样品并在10% w/v蔗糖的PBS或TBS中进行透析。将LNPs注射到小鼠的左右腓肠肌中,然后用IVIS Spectrum全动物成像系统对荧光素酶的表达进行纵向生物发光成像(图2a-c)。正如我们之前对该系统的研究所预期的那样,荧光素酶的表达在大约7-10天内迅速攀升,然后在大约30天后慢慢向基线衰减。与图中所示的颗粒分布数据一致,储存在-80℃的PBS或TBS中的LNPs表现出10至100倍的荧光素酶峰值信号,表明RNA的传递明显减弱(ppeak = 0.0003)。在其他温度下储存在PBS和TBS中的LNPs,尽管表现出与新制备样品相似的颗粒分布,但与新制备的颗粒相比,在注射后第7天的峰值时间点,通常产生约2至4倍的低信号。此外,储存在-200℃的样品在第15天和第20天之间显示出早期表达的衰减。与新制备样品表现最接近的是在10% w/v蔗糖的PBS中制备的LNP,并储存在-20℃(ppeak = 0.8777),表明这种条件可能最佳保留LNP的结构和功能。我们接下来评估了LNP-复制子疫苗的免疫原性,这些疫苗加载了编码N332-GT2 HIV免疫原的repRNA,并在10%蔗糖的PBS或TBS中储存7天,温度为4℃、-20℃、-80℃或-200℃(液氮)。用回收的LNPs对小鼠进行注射,4周后通过ELISA评估血清抗体反应(图2d-m)。与其他储存条件或新制备LNPs相比,储存在4℃或-80℃的疫苗显示出抗体反应的急剧下降(图2d)。相比之下,PBS和TBS制备的疫苗在-20℃(图2e和j)和-200℃(图 2g和l)诱发的抗体滴度与新制备的疫苗没有统计学差异。虽然结果非常相似,但根据发光报告和抗体反应的统计,我们将重点缩小到分析在PBS中制备的LNPs,而不是TBS(图2h和m)。图2. 在不同条件下储存的包裹RNA的LNPs给药后的体内转染和抗体滴度反应。对LNP稳定性的定性评估虽然动态光散射(DLS)提供了关于颗粒大小分布和流体力学尺寸的定量信息,但在多分散的样品中,信息往往偏向于较大的颗粒或聚集物。为了进一步了解颗粒结构,我们接下来对从不同储存温度下回收的样品进行了透射电子显微镜(TEM)和低温电子显微镜(cryo-EM)成像。TEM和低温电镜图像都显示,在新制备的样品和那些在4℃或-20℃储存一周的样品中,LNPs的直径约为45nm,分散相对单一(图3a-c和f-h)。然而,在-80℃或-200℃储存后解冻的样品(在液氮中闪冻)显示LNPs明显聚集或融合成大的结构(图3d,e和i,j)。图3. 储存7天的LNPs的低温电子显微镜(Cryo-EM;顶行)和透射电子显微镜(TEM;底行)图像。不同温度下储存的LNP-复制子疫苗的免疫原性为了进一步了解储存对LNP-RNA疫苗效力的影响,我们评估了用新制备的颗粒与储存在不同温度下的LNPs进行免疫后的免疫反应的其他数据。LNPs搭载了编码N332-GT2 HIV免疫原的repRNA,在10% w/v蔗糖的PBS中储存在4℃、-20℃、-80℃、-200℃中7天,然后解冻并与新制备的样品一起给小鼠注射。在注射后第2周,取小鼠腘窝淋巴结(腓肠肌注射部位的引流结)以评估生发中心(GC)反应(图4a-e),收集脾细胞以使用ELISpot评估T细胞反应(图4f)。对从引流的腘窝淋巴结中回收的细胞进行流式细胞分析发现,虽然储存在4℃、-20℃和-200℃的疫苗诱发了突出的GC B细胞反应,但储存在-80℃的疫苗并没有引起与对照动物有统计学差异的反应(P = 0.9619,图4a和c)。尽管诱导了GC B细胞的分化,但储存在4℃或-200℃的疫苗未能培养出有意义的抗原特异性GC B细胞群,这些细胞能与重组HIV Env三聚体探针结合,只有储存在-20℃的疫苗能引起强烈的抗原特异性GC B细胞反应,与新制备的疫苗所引起的反应一致(图4b和d)。滤泡辅助性T细胞(Tfh)反应不明显,在任何一组中都没有统计学差异(图4e)。与GC数据相反,所有的疫苗都能诱导脾脏中产生IFN-γ的抗原特异性T细胞反应,组间差异不大(图4f)。基于这些结果,我们选择-20℃冷冻作为我们LNP-RNA疫苗配方的最佳储存条件。图4. 储存温度对疫苗免疫原性的评价。我们发现在使用新制备、储存在-20℃和储存在-200℃的疫苗免疫后,肌肉中的IFN-γ、KC、MCP-1、RANTES、IP-10、IL-10、IFN-β、IFN-α和IL-6水平有类似的增加。相比之下,储存在4℃或-80℃的疫苗显示出更多的沉默反应。在-20◦C下冷冻的LNPs和在4℃下解冻的LNPs的保质期我们接下来评估了LNPs在更长时间内储存的稳定性。LNPs装载了编码萤火虫荧光素酶的repRNA,并在-20℃的10% w/v蔗糖的PBS中储存了7天或30天。然后,我们将解冻的颗粒或新制备的给小鼠分组进行静脉注射,并通过IVIS成像评估30天内肌肉的生物发光信号。如图5a,新制备的疫苗和储存的疫苗之间没有统计学意义(P>0.2)。接下来,我们制备了装载有编码N332-GT2免疫原的复制子的LNPs,并在解冻前将其储存7、14或30天,以便在小鼠体内肌肉注射。然后在接种疫苗后六周对小鼠进行放血,用ELISA法对血清中的抗体滴度进行量化。储存到30天的疫苗对HIV免疫原产生的抗体反应与新制备的疫苗相当(图5b-e)。图5. 在冷冻或解冻状态下长期储存的LNP-RNA疫苗的保质期。我们验证了在10% w/v蔗糖的PBS中的LNP-RNA疫苗可以在-20℃储存至少30天而不失去效力后,我们就研究了LNPs在解冻后的冷藏(4℃)下储存的保质期。这种实验设计模拟了临床环境,即冷冻疫苗解冻后供病人服用,剩余的剂量储存在4℃,以便在其他时间服用。为此,在10% w/v蔗糖的PBS中制备了装载有编码N332-GT2免疫原的LNPs,在-20℃储存7天,然后在室温下短暂解冻,再放入4℃的冰箱中储存7、14或30天。在4℃解冻的LNPs和新制备的LNP疫苗被肌肉注射到小鼠身上。疫苗接种后4周收集小鼠血清,用ELISA法定量检测抗体滴度。如图5f-j所示,疫苗诱导的抗体滴度与从-20℃解冻后在4℃的储存时间增加之间存在明显的负相关。在解冻后4℃储存一天就会产生很强的抗体滴度,虽然已经有下降的趋势,但在统计学上与新鲜样品没有区别(图5f;p1d = 0.4615)。解冻后保存7天的LNPs未能使5只动物中的2只血清转化(图5g;p7d = 0.0014),这种抗体反应的衰减在4℃保存14或30天后仍在进一步持续(图5h-i)。LNP-RNA疫苗的冻干处理冷冻干燥已被证明对LNP- RNA制剂具有挑战性。为了确定影响冻干LNP-RNA颗粒稳定性的主要因素,我们选择了三个因素来测试冻干:冷冻温度、冷冻保护剂浓度和样品浓度。为此,对制剂进行了冷冻、冻干和再水化,以进行颗粒分布和流体力学直径的DLS评估。我们测试了在-20℃的初始冷冻以及-80℃和使用液氮在-200℃的瞬间冷冻,这些都是冻干时更常用的冷冻温度。在-20℃冷冻后被冻干并重新悬浮的颗粒能够保持0.272的多分散指数(PDI),而-80℃和-200℃组的颗粒显示出聚集,PDI达到0.710(-80℃)和0.517(-200℃)(图6a)。颗粒的大小也从平均流体力学直径(通过强度分布)421纳米(-20℃)增加到877纳米(-80℃)和1219纳米(-200℃)。我们观察到随着温度的升高,颗粒有变小的趋势。在-20℃储存的疫苗显示平均流体力学直径为421纳米,但在统计学上与新制备样品没有区别(P = 0.1858)。我们接下来测试了冷冻保护剂浓度对LNP-RNA冻干的影响(图6b)。在PBS、10% w/v蔗糖或30% w/v蔗糖中制备疫苗颗粒,并在进行冻干之前在-20℃冷冻。然后将干燥的颗粒在去离子水中重新水化,进行DLS评估。在这里,我们发现在PBS中冻干的样品与用蔗糖冷冻保护的样品之间有明显的区别。与新制备的平均PDI为0.233的LNPs相比,PBS样品的平均PDI为0.638,10% w/v蔗糖样品为0.165,30% w/v蔗糖样品为0.235,这表明在蔗糖存在的情况下,粒子的单分散程度更高。与新制备样品相比,PBS中颗粒的平均流体力学尺寸明显增加,平均为613纳米,而新制备样品平均为96纳米(p )。在10% w/v蔗糖中的冻干导致平均粒径轻微增加到144纳米,但这种差异没有统计学意义(p = 0.7957)。最后,30% w/v蔗糖样品的平均粒径为94.0 nm,从统计学上看,这与新制备样品最接近(p > 0.9999)。我们评估了LNP-RNA浓度对冻干的影响。在这里,我们将相同质量的LNP-RNA冷冻并冻干,在-20℃的PBS中增加10% w/v蔗糖的体积,并将冻干的颗粒重悬浮在同等体积中进行DLS评估。选择10% w/v的蔗糖浓度而不是30% w/v的蔗糖浓度是为了适应重悬浮适合体内给药的最终蔗糖浓度;事实上,在低重悬浮中存在过量的蔗糖导致水合疫苗的粘稠度不适合下游分析和体内给药。图6c显示,虽然配方中没有统计学上的明显差异,但随着LNP浓度的降低,PDI和流体力学尺寸有下降的趋势。图6. 冻干的LNP-RNA制剂的评价。最后,我们将新制备的和冻干的LNPs与编码萤火虫荧光素酶的repRNA装载在一起进行肌肉注射,使用IVIS生物发光成像系统评估体内转染效率(图6d-e)。在这项研究中,我们选择了被发现能最好地保持粒子结构的LNPs置于10% w/v的蔗糖中,在进行冻干前以3.3 ng/μL的浓度冷冻在-20℃。在给药后的第1天,新制备的和冻干的LNP-复制子都显示出强烈的荧光素酶表达,但冻干颗粒的信号是新制备样品的50%左右(p = 0.0191)。综上所述,我们调查了有助于维持冻干颗粒的大小和分布的三个参数。通过优化和结合这些因素,我们能够改善冻干和重悬后LNP-RNA结构和分散性的保留。3. 讨论本研究旨在阐明自复制RNA负载的脂质纳米颗粒(LNP-RNA)在常用的储存条件下(通过低温保护剂浓度、缓冲剂类型和维持温度)发生的物理变化,以及这些差异与体内转染和疫苗效力的关系。我们在本研究中采用的特殊LNP配方包括两种可电离的脂质(TT3和Lin-MC3-DMA),我们发现这两种脂质在肌肉和体液免疫反应中结合起来能有效地进行转染,还有5mol%的DMG-PEG来补充接近中性的LNP的稳定性。使用这种配方,我们发现磷酸盐和三类缓冲液都适合储存LNPs,而蔗糖是一种重要的冷冻保护剂,可以维持repRNA有效载荷的结构完整性、物理稳定性或活性。最主要的因素是储存温度。发现最佳的蔗糖浓度为10% w/v(图1),与其他已发表的生物材料的低温保护工作相似。蔗糖不是均匀地分散在整个样品中,而是在非冷冻状态下沿着脂质双分子层的表面形成一个薄片,并使材料不与冰直接接触。根据经验,10% w/v的蔗糖使这些过程能够有效地促进颗粒结构的保留而不发生聚集。动态光散射(DLS)是一种常用于评估颗粒稳定性和流体力学尺寸分布的技术。然而,仅仅依靠DLS提供的散射数据在准确性方面可能会产生误导,特别是对于100纳米以下的多分散颗粒,强度和数量分布都不能提供准确的信息。因此,我们还进行了透射电子显微镜(TEM)和低温电子显微镜(cryo-EM),以充分捕捉LNPs从储存中解冻后的物理状态。有趣的是,在-20℃储存能够保持LNP的结构完整性,而从-80℃解冻颗粒后,观察到不可逆的聚集。其他研究也报道了LNP-mRNA配方在这些较低的温度下是稳定的(如BNT162b2的-70℃储存COVID-19疫苗)。我们假设携带repRNA与mRNA的LNPs之间的这些差异可能反映了RNA分子与纳米粒子中的脂质在分子水平上的包装结构的潜在差异或与mRNA与repRNA所用的N:P比率的差异相关的粒子稳定性的差异,导致对冷冻/解冻过程的不同敏感性。基于阿尔法病毒的自复制RNA比疫苗中使用的典型mRNA大10倍,并可能以不同于较短的mRNA的方式与LNP核心组织在一起。此外,我们采用了2:1的N:P比例将repRNA有效地包装在LNPs中,具有约90%的RNA封装效率和有效的体内输送,而文献报道相同的N:P比例可以将mRNA分子的封装效率降低到只有40%。此外,-80℃提供了一个介于-20℃缓慢冷冻和-200℃快速冷冻之间的中间地带。从室温冷却到-20℃预计会引起缓慢但短暂的冷却,产生分散在未冻结的液体和蔗糖片中的大冰晶(液体+冰相),而-200℃闪冻预计会瞬间形成固体冰,几乎没有冰核(固相)。相反,与-20℃相比,从室温冻结到-80℃预计会有一个加速的冷却速度,因为水能够在-40℃以下冻结而不成核。因此,所产生的状态将有一个较小的冰晶体混合的玻璃相,其中的颗粒和蔗糖分子都集中在其中。与大晶体相比,较小的冰晶体有更大的界面面积,这对低温保存是不利的。此外,颗粒在玻璃相中的集中可能进一步促进不稳定颗粒的聚集。因此,我们假设,加载了repRNA的LNPs在冷冻到-80℃或从-80℃解冻时更容易发生聚集,这是因为当加载repRNA而不是mRNA时,颗粒的独特结构特性和在这个温度和冷却速度下形成的冰相类型的混合。LNP结构的维持(通过光散射和TEM的形态分析确定)不一定是储存后体内效力的可靠指标。例如,将LNP-RNA储存在4℃,根据DLS和电子显微镜的结果,与新制备的样品相比,能够保留颗粒的物理状态(表1和图3b和g),但在使用报告repRNA或编码抗原的repRNA进行活性研究时,未能发挥可靠的功能(图2和4)。这一结果表明,虽然4℃的储存环境足以使LNP保持完整,但封装的repRNA分子却受到负面影响。图5f-j中对解冻后保质期的测试结果进一步支持了这一观点,有效储存并解冻为4℃储存的疫苗,在4℃储存一天后,疫苗效力下降。为计算RNA分子的理论裂解率而进行的一项研究预测,一个4000个核苷酸的mRNA分子在无RNAse条件下储存在5℃时,其半衰期为941天,但更长的repRNA更容易被水解裂解。虽然这种反应在冷冻温度下并不令人担忧,但防止RNA降解是冷藏中必须的,尽管LNPs可能提供RNA分子的保护层;在我们保存在4℃的LNP-RNA样品中看到的功效下降和变化,可能是由于这种降解反应造成的。我们注意到的另一个现象是,虽然4℃储存能够保持相对较高的转染率(图2b和c),但其产生体液反应的下游功效却明显降低(图2i)。可能RNA序列对转染有影响,尤其是长的repRNA,其核苷酸序列的差异可能影响其在LNPs内的包装,进而影响其在冷冻和解冻过程中的稳定性。我们假设,在4℃储存后,RNA从颗粒中漏出,可能导致LNPs的内部包装结构发生变化,变成一种炎症较少的状态,或在注射部位送入细胞的repRNA减少,可能导致先天免疫反应减弱。与4℃储存相比,闪冻到-200℃的LNPs在体内基因表达方面表现适中(图2),尽管这种储存方案在电子显微镜下显示出严重的聚集(图3e和j)。这种聚集可能是电子显微镜下样品制备步骤的结果--如在TEM的网格上干燥或在低温EM中经历另一轮闪冻。闪冻LNP-RNA的这种脆弱性或对解冻后处理的敏感性可能表明了未知的材料特性,而我们在新制备、4℃储存或-20℃储存的样品中没有观察到这些特性。再加上用于冷链运输的液氮维护是不切实际的,闪冻似乎不是一个合适的储存选择。总的来说,在10% w/v蔗糖的PBS中的LNP-RNA疫苗在-20℃储存至少30天,物理上(图1、3c和h)和功能上(图2、4和5)都保持良好。对于我们的LNP-RNA系统,-20℃可能是一个足够高的温度,以提供一个理想的冰核温度和缓慢的冷却速度,以帮助保留颗粒结构,同时也是一个足够低的温度,以抑制RNA因水解裂解事件而降解。一个更理想的解决方案是将LNP-RNA疫苗冻干为干粉状,并在室温下保持良好。然而,这一努力被证明是具有挑战性的,文献中几乎没有关于LNP-repRNA制剂冻干的成功报道。我们在图6中的结果显示,虽然几个参数的优化能够改善制剂的结构维护,但体内转染效果不如新制备的LNPs。可能是冷冻干燥的疫苗使RNA分子在再悬浮过程中更容易被降解或在体内与血清蛋白相互作用。最近,一种有效的冻干方法被报道,使用一个优化的冷冻步骤和两个独立的升华和解吸干燥循环,将mRNA疫苗以干粉形式稳定地储存在4℃,长达24周。4. 结论鉴于COVID-19的流行,疫苗的长期储存和冷链运输已成为成功转化和使用负载RNA的脂质纳米颗粒(LNP-RNA)的关键步骤。同时,我们逐渐意识到,关于LNP-RNA的物理特性、储存条件和疫苗效力之间的关系的信息非常匮乏。在这里,我们研究了疫苗在不同的储存条件下(通过低温保护剂的浓度、缓冲液的类型和储存温度)会发生什么样的物理变化,以及这些变化与体内疫苗效力的关系,同时使用编码报告蛋白(如荧光素酶)的RNA和实际HIV免疫原。最终,我们发现LNP-RNA疫苗在-20℃的PBS中以10% w/v蔗糖稳定地储存了至少30天。此外,我们发现携带复制体的LNPs也可以被冻干,并保留良好的体内生物活性。文献来源:Kim Byungji, etc. Optimization of storage conditions for lipid nanoparticle-formulated self-replicating RNA vaccines. Journal of controlled release. 2022, 353: 241-253.
企业动态
2023.04.21
迈安纳GMP级INano P中试平台再次助力企业客户开发新型LNP递送系统用于新冠疫苗的研发
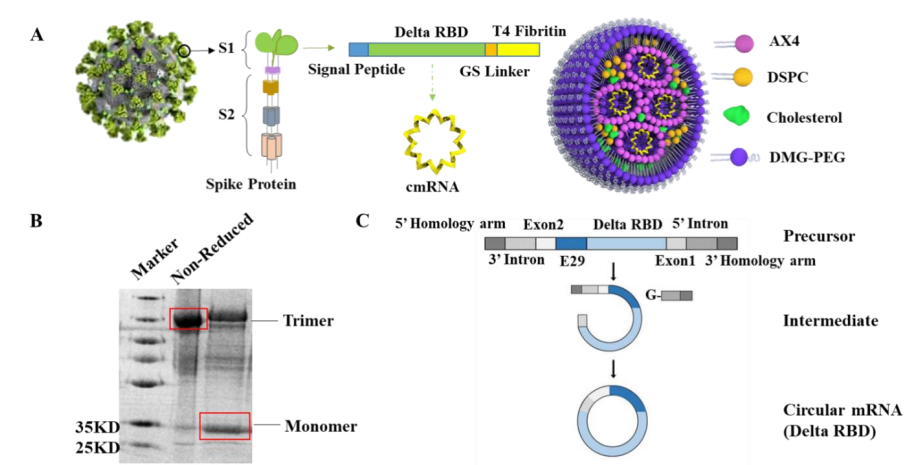
可生物降解的LNP递送环状mRNA用于抵抗SARS-COV2 delta变异株的感染。图1:cmRNA-LNP的构建近日,CureMed公司在预印本平台bioRxiv发表了一篇微流控设备(INanoP, Micro & Nano (Shanghai) Biologics Co. Ltd.)包封环状mRNA(cmRNA)制备新冠疫苗的论文。该文设计了一种新型可生物降解的可电离阳离子脂质AX4(分支尾部含有8个酯键)。基于AX4形成的LNP相比商业化的MC3-LNP在体内的清除速率更高。同时,在体内可以诱导强效的免疫激活,持续产生中和抗体,激活CD4+T细胞和CD8+T细胞。同时,使用微流控混合制备的环状mRNA-LNP具有良好的理化稳定性,粒径85nm左右,PDI=0.1,及良好的温度稳定性(4℃储存6个月或反复冻融6次后,产生中和抗体的效力与新鲜配制的疫苗相当)。图2:理化表征和清除速率图3:稳定性表征迈安纳有幸为本研究提供了GMP级微流控中试生产设备INanoP系统,这也是该用户使用迈安纳INano平台以来第二次公开发表研究和项目进展。在此特别祝贺我们的用户CureMed公司取得如此有应用前景的技术成果!同时也鼓舞了我们作为平台合作方陪伴客户继续挑战新型递送技术的信心。在药物递送领域中,迈安纳将一如既往地贡献可靠有力的强大支持——从设备到工艺的整体解决方案。文献来源:Huang et al. Delivery of Circular mRNA via Degradable Lipid Nanoparticles against SARS-CoV-2 Delta Variant. bioRxiv. 10.1101/2022.05.12.491597
企业动态
2023.03.23
强强联合丨迈安纳与马尔文帕纳科达成战略合作,助力核酸药物产业化发展!
近日,全球材料及生物物理领域微观分析领导者,英国思百吉集团全资子公司----马尔文帕纳科(以下简称“马尔文帕纳科”)和核酸纳米药物递送整体解决方案的领军企业迈安纳(上海)仪器科技有限公司(以下简称“迈安纳”)在迈安纳上海总部签署了双方的战略合作协议。双方将在解决方案开发、人才培训、学术交流及市场开拓等方面持续深入合作,共同助力核酸药物产业化发展!迈安纳&马尔文帕纳科 战略合作签约仪式马尔文帕纳科作为粒度分析仪器的开创者,多年来深耕于颗粒表征领域,在脂质药物载体等纳米药物方面拥有成熟的生物物理表征仪器和解决方案,迈安纳作为核酸纳米药物递送技术平台的领跑者,专注于解决RNA纳米药物递送行业痛点的整体解决方案,双方将合力为核酸药物领域提供更精准权威的检测设备,提供更完善的解决方案,助力核酸药物的研发以及商业化进程!马尔文帕纳科中国区医药与食品行业销售总监叶飞先生就签署与迈安纳的战略合作表示:“迈安纳作为核酸药物包封以及工艺的整体解决方案的领导者,为国内外众多核酸药物企业和科研院所提供了专业的设备和解决方案,我们很高兴能够与迈安纳签署此次战略合作协议!马尔文帕纳科与迈安纳多年来凭借在纳米药物递送领域专业的仪器和专业服务,已有多次合作和深入的技术交流,双方都深谙用户需求。通过本次战略合作,相信双方能针对未来行业发展需求,在产品和服务上不忘初心,持续研发,推出解决行业痛点的一系列解决方案,为核酸药物行业的蓬勃发展做出努力。”迈安纳总经理吴刚先生就签署与马尔文帕纳科的战略合作表示:“马尔文帕纳科是一家拥有悠久深厚技术底蕴和全球战略胸怀的国际化企业,在受到全球疫情严重影响下,马尔文帕纳科积极调动资源,尽量缩短货期,这一切都体现了马尔文帕纳科对于中国市场的重视和支持,今日迈安纳与马尔文帕纳科达成战略合作,我们深感荣幸!在推动核酸纳米药物递送行业技术发展的道路上一路走来,我们始终与马尔文帕纳科相互交流,深入技术沟通,持续为核酸药物行业用户提供更好的整体解决方案和服务。今日迈安纳与马尔文帕纳科的战略合作,展现了双方对核酸药物行业,特别是mRNA领域未来产业化发展的信心,更坚定了迈安纳加速国际化脚步的决心。”马尔文帕纳科中国区医药与食品行业销售总监叶飞(左)、迈安纳总经理吴刚(右)及双方企业代表出席此次签约仪式。关于迈安纳迈安纳(上海)仪器科技有限公司开始于2018年,正式成立于2020年初。是一家拥有多项发明专利技术,专注于解决RNA纳米药物递送行业痛点的整体解决方案本土提供商。公司不仅可提供从实验室到产业化的核酸(包括mRNA, siRNA, CRISPR/Cas9, SAM RNA, CircRNA等)-LNP全系列封装设备!更可提供整体解决方案中的技术支持。作为上海市闵行区重点引进的项目,迈安纳已在上海莘庄工业区投资数千万元,建成了国内首家集核酸药物装备研发制造和核酸递送工艺开发为一体的创新中心。该中心具备GMP级递送工艺开发实验室和十万级无尘核心组件装配区。迈安纳自主研发生产的INano™全系列产品已获得欧盟CE认证和美国FCC认证。目前迈安纳已服务于国内数百家顶尖生物制药公司以及科研学术机构,并已成功助力多个客户相继获得中国,美国,巴西,澳大利亚等mRNA类药物IND临床批件,进入临床和商业化生产。 关于马尔文帕纳科马尔文帕纳科的技术被各个行业和组织的科学家和工程师用来解决一系列难题,如最大程度地提高生产率、开发更高质量的产品及帮助产品更快速地上市。凭借广泛的行业知识和技术及应用专业技术,马尔文帕纳科仪器旨在帮助用户更好地了解各种各样的材料,从蛋白质和聚合物、颗粒和纳米颗粒悬浮液和乳状液,再到喷雾剂和气雾剂、工业散装粉末、矿物和高浓度浆类样品及固体,例如金属和建筑材料、塑料和聚合物。 英国马尔文仪器公司和荷兰帕纳科公司宣布合并,新公司名为马尔文帕纳科,总部位于阿尔默洛(荷兰)和马尔文(英国),全球拥有 2,000 多名员工。 合并后的公司将成为材料表征市场上强有力的竞争者和创新者,并且将充分利用两家公司各自在建筑材料、制药、金属、矿业及纳米材料等终端市场中的优势。 遍布全球的应用实验室以及受强大分销商网络支持的全球销售和服务网络将确保提供良好的客户支持水平。马尔文帕纳科隶属于制造提高生产率的仪器和控制设备的英国思百吉集团。
企业动态
2022.09.30
mRNA-LNP疫苗的设计考量
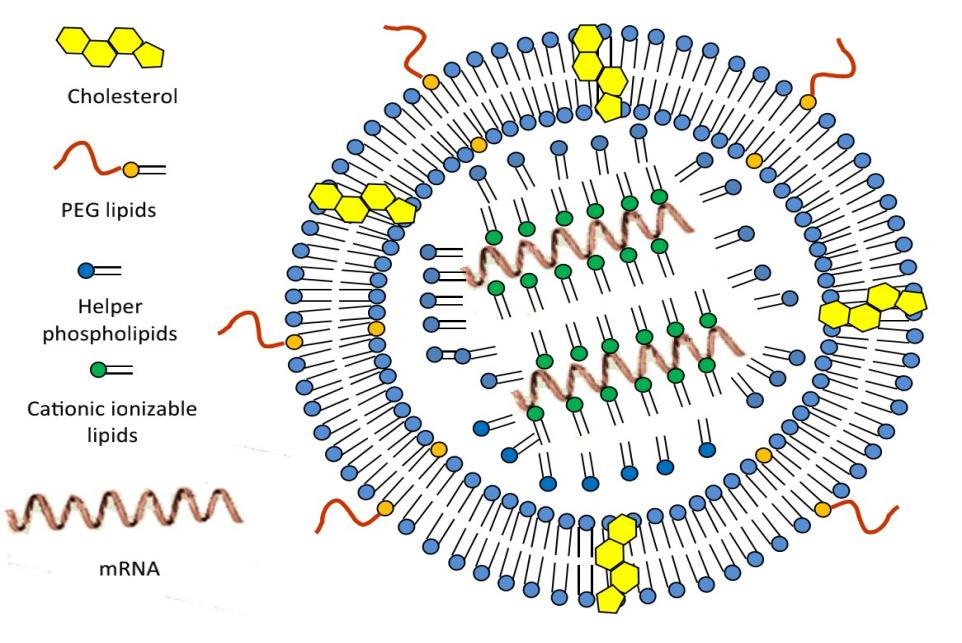
随着SARS-CoV-2 mRNA-LNP疫苗的成功,mRNA 脂质纳米颗粒(LNPs)被推入核酸疗法的中心舞台 。mRNA疫苗的优势在于平台的模块化和快速大生产能力。。然而,设计优化mRNA-LNP疫苗时,需要平衡其有效性、稳定性和毒性,这时往往有多种选择。本文就最关键的考察因素提供了建议。输入文字输介绍一般来说,mRNA-LNP设计由几个要素组成:(1)mRNA序列设计和核苷酸修饰选择;(2)优化LNP配方以封装和递送mRNA;(3)长期储存。目前,对mRNA-LNP的评估基于表达编码mRNA的能力、细胞内RNA传感器识别外源mRNA的免疫原性、LNP制剂的稳定性和毒性。这些均根据给药途径和治疗目标进行检查。重要的是,用于全身给药的最佳治疗性mRNA-LNP的设计不同于最佳肌肉内给药的mRNA-LNP疫苗。我们将关注有效mRNA-LNP疫苗的表达、稳定性和毒性的优化设计,根据文献、我们已有的经验以及最近批准的两种SARS-CoV-2 mRNA疫苗,即Moderna的mRNA-1273和辉瑞/BioNTech的BNT162b2进行总结。1.优化 mRNA-LNP 疫苗的 mRNA 序列和修饰mRNA是蛋白质编码DNA的翻译和细胞质中核糖体产生蛋白质之间的中间步骤。(有语病)目前用于疫苗的RNA主要有:非复制的mRNA和病毒衍生的、自我扩增的RNA。传统的基于mRNA的疫苗包括编码目标抗原的序列, 5ʹ和3ʹ非翻译区(UTRs),而自扩增RNA不仅编码抗原,还包括病毒复制序列,促使 RNA在细胞内扩增和增加蛋白表达。体外转录(IVT)mRNA是由一个包含T7、T3或Sp6噬菌体RNA聚合酶的线性DNA模板产生的。所得到的产物应该包含一个开放阅读框,编码目标蛋白质,侧翼UTRs,一个5ʹ帽和一个poly(A)尾。mRNA序列和修饰选择的主要考虑因素是:(1)编码mRNA的表达;(2)由于细胞内RNA传感器将mRNA识别为外来实体而产生的免疫原性;(3)mRNA稳定性。这些可通过修饰核苷酸的引入、序列修饰和mRNA加帽方式控制(图1)。图1 优化 mRNA-LNP 疫苗的 mRNA 序列和修饰(1)核苷酸修饰核苷酸修饰被认为是mRNA治疗领域的最重要突破之一。未修饰的mRNA分子被细胞内的RNA传感器识别,从而激活先天免疫。虽然通过佐剂激活先天免疫在疫苗接种时可能是有利的,但这些先天免疫反应也可能对mRNA治疗有损害,因为它们显著降低了mRNA翻译。2005年,Kariko及其同事进行的一项开创性研究表明,掺入天然存在的化学修饰核苷(如假尿苷(Ψ)、硫尿苷(s2U)和5-甲基胞苷(m5C)),可显著降低mRNA的免疫原性。更重要的是,一些研究表明,修饰核苷的掺入提高了RNA分子的稳定性,并增加了蛋白质翻译,包括已在mRNA-1273和BNT162b2中使用的N1-甲基假尿苷修饰。相比之下,CureVac的候选疫苗CVnCoV通过序列优化和未修饰的核苷实现稳健和平衡的免疫反应。然而,初步的2b/3期数据表明,该候选疫苗的效果明显低于辉瑞/BioNTech和Moderna的相关mRNA疫苗)(NCT04652102)。虽然CureVac候选疫苗的功效较差可归因于包含未修饰的核苷,但应考虑候选疫苗之间的其他一些差异,例如非编码元件和储存条件的差异(见表1)。因此,在考虑核苷酸修饰时,在由未修饰核苷驱动的潜在先天佐剂反应和由修饰核苷引起的蛋白质表达增强之间需要权衡。目前,两种FDA授权的mRNA疫苗都包含修饰的核苷酸。表1 三种SARS-CoV-2 mRNA-LNP疫苗的mRNA和LNP制剂成分的比较(2)mRNA加帽mRNA加帽通过与真核翻译起始因子4E(eIF4E)结合,显著提高翻译效率和细胞内mRNA稳定性。体外转录(IVT)mRNA的加帽通常使用帽类似物进行,它可以在IVT过程或转录后添加。然而,mRNA可以反向加帽,导致快速降解和翻译不良。为避免反向5'帽掺入,已开发出抗反向帽类似物(ARCA),可确保正确的加帽方向。为了提高ARCA的性能,多年来进行了进一步的改进,最近开发的“CleanCap”类似物在mRNA公司中最常用。因此,对于有效的mRNA-LNP疫苗,需要加入稳定的、正确定向的帽。(3)UTR 选择UTR的选择也应予以考虑,因为编码序列两侧的5ʹ和3ʹUTR元件深刻地影响了mRNA的稳定性和翻译。5'UTR特征如起始密码子和二级结构可能会折损核糖体募集、扫描和起始密码子识别,因此应予以避免。总之,5'UTR序列对蛋白质表达至关重要,而3'UTR可能影响mRNA半衰期。这两者都是疫苗关注的关键问题。这些调控序列可以来自病毒或真核基因,并大大增加治疗性mRNA的半衰期和表达。例如,β珠蛋白3'UTR和β-珠蛋白3'UTR稳定剂的重复被广泛用于稳定mRNA。(4)开放阅读框(ORF)设计由于细胞传感器的识别,ORF序列设计还对mRNA的翻译效率和免疫原性产生重要影响。除了前文提到的核苷酸修饰之外,用细胞质中含有丰富同源tRNA的常用同义密码子替换稀有密码子是增加mRNA蛋白质产量的一种常见做法,尽管这个模型的准确性受到了质疑。序列优化的另一种形式是富集鸟嘌呤-胞嘧啶(GC)含量,这已被证明可以提高体外的稳态mRNA水平和体内的蛋白质表达,并且已被CureVac用于其最近的SARS-CoV-2mRNA疫苗候选疫苗CVnCoV(NCT04652102)。此外,mRNA序列可以通过改变密码子组成或引入修饰的核苷来正向调节,但这些形式的序列工程也决定了二级结构,这种二级结构可以通过水解影响mRNA降解。导致翻译和蛋白质同时折叠的动力学和准确性,以及在替代阅读框中存在的隐性T细胞表位的表达。所有这些因素都可能潜在地影响免疫反应的大小或特异性。据报道,专门设计的算法可以为最大碱基堆叠区域设计最佳mRNA序列,从而提高mRNA稳定性。(5)Poly(A)尾Poly(A)尾通过降低RNA核酸外切酶活性而有助于mRNA翻译和稳定性。因此,一个多聚(A)的最佳长度必须直接从编码的DNA模板或使用poly(A)聚合酶添加到mRNA中。密码子的使用还对蛋白质的翻译有影响,poly(A)尾与poly(A)结合蛋白(PABP)结合,后者募集eIF4G和eIF4E,增加对mRNA帽的亲和力并促进环状mRNA结构和有效翻译。PABP也被证明参与microRNA介导的翻译抑制。关于poly(A)尾的长度还没有达成共识。虽然有人认为较长的poly(A)尾(120-150个核苷酸)增加了mRNA的稳定性,但PABP介导的翻译抑制的双重作用需要进一步优化。例如,Lima等人证明了具有高翻译效率的mRNA实际上具有短的poly(A)序列(33-34个核苷酸)。由IVT产生的mRNA可以通过两种方式进行多聚腺苷酸化:要么通过编码所用DNA模板上的poly(A),要么在IVT后通过poly(A)聚合酶酶促添加到mRNA。在DNA质粒上编码poly(A)尾确保产生确定的poly(A)尾长度,而mRNA的酶促多腺苷酸化产生不同长度的poly(A)尾,因此不太有利。2. 用于mRNA递送的脂质纳米颗粒(LNPs)脂质纳米颗粒是基于脂质的智能的纳米大小的载体,用于将mRNA输送到细胞。除了在系统循环中保护mRNA不受RNA酶的影响外,这些颗粒状的纳米载体可以通过与早期内涵体的脂质双分子层融合而有效地在细胞内递送mRNA。(1)LNP 配方LNP,即mRNA载体,既能保护mRNA有效载荷免于降解,又能使它们有效地递送到靶细胞中。通常,LNP是一种脂质制剂,由各种比例的中性结构脂质、胆固醇、PEG-脂质和可离子化脂质组成。可电离脂质可电离的脂质被认为是最重要的成分,通常将不同的mRNA-LNP区分开来。筛选可电离脂质库以找到最佳脂质,可增强表达并在mRNA-LNP疫苗中提供更好的免疫反应,同时保持低毒性的特征。可电离的脂质包括:(1)可电离的头部基团,(2)接头区域和(3)烃链(图2a)。虽然可电离脂质结构各不相同,但已经出现了一些用于mRNA-LNP疫苗的有效可电离脂质的共同基础。图2 LNP 配方注意事项mRNA-1273和BNT162b2疫苗各自包含不同的可电离脂质,但它们都含有一个氨基醇头基,pKa分别为6.75和6.09。Moderna的一项研究声称,在mRNA疫苗后引发适应性免疫反应的可电离脂质pKa的最佳范围是6.6-6.9,而6.2-6.6的pKa范围已被证明是IV递送后蛋白质表达的最佳范围。有趣的是,这与mRNA-1273可电离脂质的pKa一致,但与BNT162b2不一致。接头区域将头部基团与脂烃尾部连接起来,也因其对RNA-LNP体内活性的影响而受到关注。目前假设接头区域有助于头部基团pKa和RNA-LNP内体逃逸潜力。对连接器区域优化的研究是一个持续的过程。已经设计并筛选了具有各种接头结构的可电离脂质文库,以了解它们更有效地递送RNA-LNP的能力。此外,还应考虑可电离脂质的脂质尾部。脂质结构(以及因此的LNP结构)通过改变内体逃逸、储存期间的稳定性和毒性来影响表达效率。有趣的是,研究声称各种不饱和度和疏水尾的对称性与更有效和更稳定的LNP之间存在相关性。例如,支链烃类脂尾可能会产生更锥形的结构,从而增强内体逃逸。此外,酯键被引入脂质烃链以改善可电离脂质的药代动力学特性。FDA批准的第一个可电离脂质DLin-MC3-DMA(MC3)由于其给药后的较长组织半衰期而引起了一些关注。这推动了可生物降解的可电离脂质的发展,以改善脂质代谢并防止毒性。在烃尾和接头区域中引入一个或多个酯键,导致酯酶在体内裂解,从而改善脂质的药代动力学特性,并降低毒性。各项研究均在不断试图寻找链中的最佳酯键位置。假设将这些键放置得太靠近头部基团-接头区域会通过改变头部基团pKa降低整体LNP功效。因此,最好将它们定位在脂质尾部的更下游。目前,mRNA-1273和BNT162b2都含有带有可生物降解键的支链烃尾(图2b)。聚乙二醇(PEG)脂类聚乙二醇脂质提供胶体稳定性,防止蛋白质(卵磷脂)与纳米粒子结合,从而减少网状内皮系统(RES)对纳米粒子在系统循环中的清除,从而实现更长的系统循环 。PEG脂质较低的融合性能阻碍mRNA的内体释放。PEG脂质还可以通过防止LNPs在溶液中的物理聚集来提高其储存稳定性,否则LNPs的粒径就会增大,从而进一步导致封装的mRNA过早释放。图3 脂质纳米颗粒(LNPs)的成分示意图磷脂类磷脂通常是中性的,如DSPC和DPPC,它们为LNPs提供双分子层结构的稳定性。它们还在LNPs的融合性和生物分布(降低毒性)方面发挥作用。DPPC是一种天然的肺部表面活性剂,是肺部剂型的首选脂质。通过将DSPC(另一种饱和磷脂,其脂质转化温度(Tm)明显高于55℃)与DPPC(Tm为41℃)相结合,可以改变封装的mRNA的释放特征。图4 从脂质纳米颗粒(LNPs)内的脂质蛋白中释放治疗性mRNA的假设性细胞释放。pKa 阳离子可电离脂质的酸解常数胆固醇胆固醇是一种中性脂质,通过提高其硬度和防止治疗成分的泄漏来增强双分子层的稳定性。此外,当在最佳浓度中使用时,它被认为在LNPs的膜融合和基因转移中发挥作用。(2)LNP制备mRNA在低pH值的水缓冲液中制备,pH值~4.0,并与疏水性脂质的乙醇溶液进行微流体混合,形成低分散性的不稳定LNPs,其中含有25-50%的乙醇并且混合后的样品pH值低。LNPs需要立即使用切向流过滤(TFF)进行透析或缓冲液交换或浓缩,之后使用0.2 μm的无菌级过滤机进行无菌过滤,并装入无菌容器。完成后的药物产品可以是冻干的形式,也可以是直接的成品形式(图5)。图5 脂质纳米颗粒(LNPs)的制造工艺流程及其相关的关键工艺参数和关键质量属性传统的乙醇注射和薄膜水化方法被微流体混合装置所取代,因为微流体混合装置具有均匀的窄粒径分布和较高的包封效率。水相和乙醇相的初始混合产生pH 5.5的预体,质子化可电离脂质(pH 3. 解决mRNA疫苗稳定性的严峻现实(1)mRNA稳定性完整的mRNA分子对其作为疫苗的效力至关重要。即使是轻微的降解反应,在mRNA链的任何地方,都会严重影响翻译,从而导致靶抗原的不完全表达。脂质(如脂质纳米颗粒,LNP)和蛋白质(鱼精蛋白,一种天然存在的碱性/阳离子聚合物)用于增强细胞内mRNA递送。配制的mRNA疫苗的这些关键成分调节mRNA在体内的分布,帮助mRNA分子进入细胞,并影响蛋白质抗原表达和免疫原性以及安全性。此外,它们可能会影响储存过程中的mRNA稳定性。在一项理论研究中预测当mRNA掺入阳离子脂质制剂中时,mRNA的裂解速率会增加。基于这些考虑,这些赋形剂的性质、质量和供应商,以及配方制造工艺的设计,可能会影响配制mRNA候选疫苗的药物稳定性,包括mRNA的化学稳定性及其复合物的胶体稳定性。(2)监管准则2020年6月,FDA在“COVID-19疫苗开发和许可指南”中规定所有质量指示试验的资格/验证数据应提交BLA(生物制剂许可证申请)。对于疫苗许可,当保持在推荐的储存温度时,应使用至少三个由不同疫苗批次制成的最终批次的最终容器来证明疫苗在其最终容器中的稳定性和有效期。EMA将用于传染病的mRNA疫苗视为生物医药产品的药物。这些药物由人类医药产品委员会(CHMP)负责,并遵循集中程序通过EMA获得上市批准。这是临床试验申请(CTA)的一部分。IMPD包含有关mRNA分子本身以及降解产物(即产物杂质)和工艺杂质的信息。最后,要求提供关键mRNA产物稳定性参数的数据,其中mRNA组分的稳定性指示参数为:mRNA完整性,含量和效力以及药物特性,包括pH值,外观和药物产物的微生物状态。有关生物原料药和最终药物产品的规格和稳定性测试的详细信息。(3)长期保存mRNA-LNPs的长期储存和稳定性是制剂设计中的一个主要考虑因素,鉴于其高度的临床相关性和对疫苗分布以及最终价格的影响,尚未彻底探索这一点。Moderna的mRNA-1273的开发速度令人惊讶,这是第一个进入临床试验的SARS-CoV-2 mRNA疫苗。从第一个病毒基因组发表开始,仅用了两天时间就完成了疫苗序列,生产第一剂疫苗用了25天,直到第一个参与者在1期临床研究(NCT04283461)中接种了63天。然而,扩大规模以满足全球疫苗需求具有挑战性。由于室温下mRNA-LNP的不稳定性,目前批准的mRNA疫苗(BNT162b2为-80°C,mRNA-1273为-20°C)的超低储存要求是系统限制。为了找到最佳的LNP冷冻条件,已经进行了几项研究。目前,人们普遍认为,冷冻LNPs时,应在mRNA-LNP配制后添加冷冻保护剂,如蔗糖或海藻糖。目前,mRNA-1273和BNT162b在最终产品预稀释中都含有10%的最终蔗糖浓度。值得注意的是,虽然蔗糖目前在两种授权的COVID-19 mRNA疫苗中用作冷冻保护剂,但初始温度要求不同,Moderna的mRNA-1273储存在-15°C至-20°C,辉瑞/BioNTech的BNT162b2储存在-60°C至-80°C。稳定性和长期储存对于 mRNA-LNP 制剂至关重要。根据杜克大学全球健康创新中心的分析,预计 2021 年计划生产 41 亿剂 mRNA-LNP 疫苗,请注意,今年整个 SARS-CoV-2 疫苗前景预计为 120 亿剂。在超低温下储存这些疫苗的要求具有挑战性。当前的一个假设声称,关键点是 LNP 内的 mRNA 链稳定性,而不是载体稳定性。因此,虽然 mRNA 结构和修饰的算法优化可以提高稳定性,但目前最好的疫苗应该用蔗糖等冷冻保护剂配制,并且仍然需要在非冷冻温度下保持 LNP 稳定性的新解决方案。入文输入文字输结论有效的 mRNA-LNP 的成功设计包括需要根据治疗目的做出的多种考虑和选择。虽然成功的 mRNA-LNP 没有单一的配方,但在分析目前已知的成功 mRNA 疫苗时,确实出现了一些共同点。修饰核苷和mRNA序列优化是最大化的蛋白表达所必需的;至于LNP载体,目前批准的mRNA-LNP疫苗具有相似的脂质比例;稳定性和长期储存对于LNP制剂至关重要,蔗糖溶液常用作冻干稳定剂。综上所述,mRNA-LNP 疫苗是一种有效的模块化疫苗平台,可以快速生产新疫苗,应根据治疗靶点进行优化设计。入文文献来源:1. Edo Kon et al. Principles for designing an optimal mRNA lipid nanoparticle vaccine. Current opinion in biotechnology. 2022, 73: 329-336.2. Ramachandran Sivakumar et al. Delivery Strategies for mRNA Vaccines. Pharmaceutical Medicine. 2022, 36: 11-20.3. Crommelin, D et al. Addressing the Cold Reality of mRNA Vaccine Stability. Journal of pharmaceutical sciences. 2021,110: 997–1001.
企业动态
2022.06.06
喷洒叶片即可实现对植物细胞的基因递送
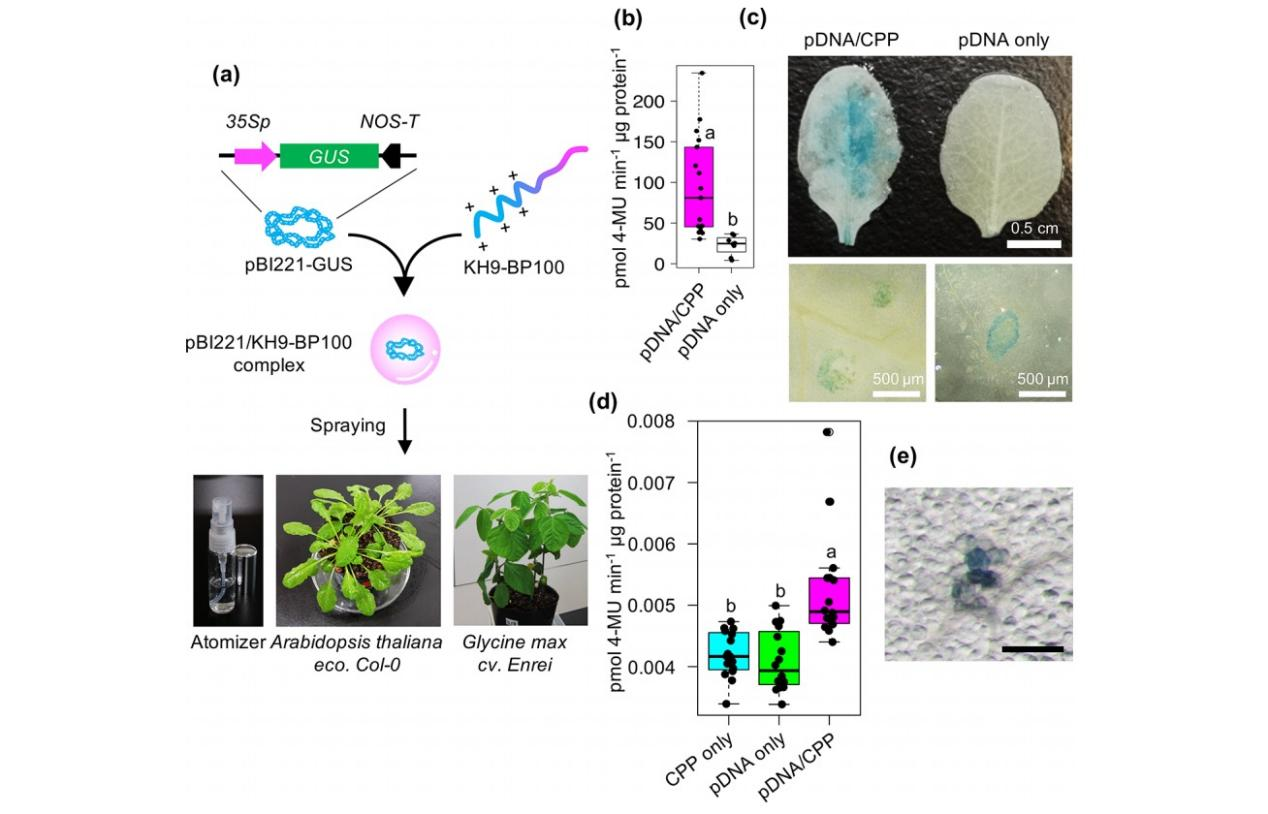
一、简介由于上游生产成本高,包括植物再生过程困难和优选植株的后续繁殖,采用传统的转基因方法对作物进行工业规模的品质改良是不经济的。转基因作物也引起了公众对人类、动物和环境的生物安全问题的关注。因此,通过叶面喷施,高通量地递送生物活性分子可以作为一种优越的作物改良技术。该技术可以快速、简单地将合适的生物分子导入植物细胞中,而无需昂贵、费力、生物分子转运技术。例如,叶面喷施裸双链DNA片段和小干扰RNA ( small interfering RNAs,siRNAs ),可以在不永久改变植物基因组的情况下,对植物的代谢性状和经济性重要特征进行改造。在目前的研究中,我们设计了一种叶面喷雾技术,将核酸/肽纳米载体引入植物细胞的胞浆、细胞核和叶绿体中,为多肽生物分子复合体在植物体内的大规模递送提供平台。我们通过喷雾施药评价了天然衍生和人工合成CPPs的细胞穿透能力。影响喷雾效率的因素包括缓冲体系、保卫细胞密度和叶片表皮毛密度。叶面喷施基于CPP的质粒DNA ( pDNA )或siRNA复合物可显著提高核酸在植物细胞中的传递效率。有趣的是,siRNA分子成功靶向于叶绿体,通过可喷雾的CTP / CPP纳米载体介导的过程抑制叶绿体表达蛋白的功能。我们的多肽核酸复合体喷洒平台在农业条件下可以对栽培作物的商业重要特性和代谢性状进行高效广泛的基因改造。二、结果与讨论1. 喷雾给药后CPPs的细胞渗透效率图1. 喷施后CPPs在叶片中的细胞渗透和转运不同的CPPs在植物细胞中表现出不同的转运水平。荧光素四甲基罗丹明(TAMRA)标记的CPPs,如两性的BP100、阳离子非两性的赖氨酸/组氨酸(KH9)和非两性的精氨酸(R9)及其d构型(dR9),在注射浸润后对各种植物细胞表现出中等至较高的渗透效率。此外,人工设计的含有周期性α-氨基异丁酸(Aib)的CPPs,如KAibA(Ala)、KAibG(Gly)和KAibK,在植物和动物细胞中显示出明显改善的细胞穿透能力和稳定性。为了测试这些CPPs在喷洒时的细胞渗透效率,我们将含有0.1 μg/ml的CPPs溶液喷洒到拟南芥(拟南芥生态型Col-0)的叶片上,并通过共聚焦激光扫描显微镜(CLSM)比较喷洒后不同时间点植物细胞中的TAMRA荧光(图1a)。CPPs的细胞渗透效率指的是TAMRA-CPPs的不同荧光强度,即在喷洒后被吸附并转运到叶细胞中。喷洒后,14.8-29.1%的TAMRA标记的CPPs到达植物叶片的表面。在喷洒了TAMRA标记的BP100、KH9、R9和dR9的植物中,叶片正面(上部)的表皮细胞的荧光逐渐增加(图1b, c)。然而,TAMRA标记的人工CPPs KAibA、KAibG和KAibK对这些细胞的渗透效率较低(图1b、c)。我们还观察到喷洒了TAMRA标记的KH9、R9和dR9的叶片的护卫细胞有强烈的TAMRA荧光,这表明这些阳离子CPPs被动地通过气孔渗入叶片,并高度聚集在气孔下腔中(图1a-c)。与其他被检查的CPPs相比,TAMRA标记的dR9表现出更高的腭裂中叶的渗透效率。(图1d,e)2. 核酸/CPP复合物的转染效率图2 将质粒DNA/CPP复合体喷洒后转染到植物细胞中我们将不同的BP100衍生的阳离子CPPs和Cy3标记的pBI221形成复合物。将所得复合物的溶液喷洒到过量表达黄色荧光蛋白(YFP)的转基因拟南芥植物的叶片上,并在喷洒后2小时通过CLSM检查Cy3标记的pBI221在叶细胞中的荧光(图2a)。与只喷洒了Cy3标记的pBI221和Cy3标记的pBI221/BP100复合物的叶片相比,在喷洒了四个Cy3标记的pBI221/BP100衍生的阳离子CPP复合物的表皮细胞中,观察到Cy3荧光信号明显增强 (2- 5倍) (图2b)。这些Cy3标记的pBI221/阳离子CPP复合物进入转染的细胞并定位到细胞质中(图2c-l)。然后我们分析了不同的Cy3标记的pBI221/阳离子CPP复合物在大豆和番茄叶细胞中的转染效率。与拟南芥叶细胞中的结果一致,所有四个Cy3标记的pBI221/阳离子CPP复合物在喷洒后在大豆叶细胞中显示出明显高于Cy3标记的pBI221仅或Cy3标记的pBI221/BP100复合物的转染效率(图2m)。在番茄叶细胞中,只有KH9-BP100在喷洒后表现出较高的质粒DNA分子转染效率(图2n)。在BP100的任何一端或两端添加生物分子结合域都会影响其细胞穿透能力以及接合生物分子的相互功能。在以前的研究中,KH9-BP100比R9-BP100在注射器浸润后表现出更高的DNA分子转染植物细胞的效率。目前的结果表明,在所有四个阳离子结构域融合的BP100 CPPs中,N端融合的KH9-BP100为通过叶面喷洒将外源DNA分子运输到植物细胞提供了最有效的工具。此外,我们在不同组织中对荧光蛋白高表达的拟南芥和番茄的Cy3荧光成像表明,KH9-BP100在促进生物大分子载体的长距离运输和稳定Cy3-质粒DNA分子的同时,在喷洒后从叶片转运到其他植物组织中具有辅助作用。然而,KH9-BP100在喷洒后有效地将生物分子输送到植物中的相当大的输送能力会受到叶片特征的影响,如气孔密度、毛细血管的外观和叶片结构的差异。此外,细胞外角质层成分的复杂性和叶细胞的细胞壁成分的硬度可以关键性地决定不同植物物种中叶面应用的生物分子/CPP复合物的转染效率。3. 叶面喷洒质粒DNA/CPP复合物在植物细胞中进行转基因表达图3 基于细胞穿透肽的DNA载体在叶面施用后对植物细胞的吸收效率为了验证基于多肽的叶面喷洒技术在植物细胞中的基因传递效率,我们以不同的N/P比率生成了β-葡萄糖醛酸酶(GUS)报告基因表达载体pBI221与高效CPP KH9-BP100的质粒DNA/CPP复合物(图3a)。水溶液中pBI221/KH9-BP100复合物的流体动力学直径从190nm逐渐下降到79nm,而所形成的复合物的表面电荷在增加N/P比率时逐渐增加。在不同的N/P比率下,增加KH9-BP100的添加量以形成pBI221/KH9-BP100复合物,复合物溶液的pH值略有下降。质粒DNA分子在pBI221/KH9-BP100复合物溶液中在静电场中的移动性随着N/P比的增加而逐渐下降。在N/P比=2.0时形成的pBI221/KH9-BP100复合物的AFM成像显示了完整的、单分散的球形复合物。根据不同N/P比形成的质粒DNA/CPP复合物的理化性质和形态外观,我们选择在N/P比=2.0时形成的pBI221/KH9-BP100复合物溶液进行喷雾应用。Silwet L-77和其他农业表面活性剂通过破坏复杂的角质蜡层和植物叶片的第一层表皮,以及诱导气孔吸收外来分子,促进生物分子和纳米结构在多变的叶片表面的运输。将经Silwet L-77稀释的质粒DNA/CPP复合物喷洒到拟南芥和大豆叶片上,可显著增强转染后叶片细胞的GUS活性(图3b−e)。DNA/CPP复合物在大豆叶片中的转染效率远远低于拟南芥(图3b,d)。拟南芥和大豆可能在细胞表面组成、细胞对外来分子的反应、纳米颗粒摄取机制或转基因表达机制方面存在差异。4. 喷洒siRNA/CPP复合物诱导植物细胞基因沉默图4 可喷涂多肽-siRNA对植物细胞基因表达的抑制作用使用RNA干扰(RNAi)技术对植物重要性状进行工程化处理有很多益处,因为这种方法可以非转基因的方式完成。以前用高压喷雾法将游离的双链小干扰RNA(siRNA)分子应用于植物细胞,成功地抑制了目标mRNA分子的水平。此外,最近的研究表明,将小RNA分子与纳米载体如CPP17、三维(3-D)DNA纳米结构和碳纳米管相结合,提高了基因沉默效率和RNA分子浸润后在植物细胞中的稳定性。因此,我们开发了一种高通量的喷雾应用技术,将siRNA/CPP复合物引入植物细胞,以实现高效的基因敲除(图4a)。我们合成了27bp的siGFPS1 RNA双链,这对沉默转染植物细胞中GFP变体(GFP、增强型GFP[eGFP]和黄色荧光蛋白[YFP])的表达有潜在的优越活性。双链的siGFPS1 RNA分子与KH9-BP100复合物形成264nm的带负电荷的siRNA/CPP复合物,N/P比=2.0。这些球状的siRNA/CPP复合物显示了预期的siRNA分子在静电场中的凝胶阻滞模式。为了测试siGFPS1在植物细胞中的基因沉默活性,我们将含有siRNA/CPP复合物的溶液喷洒到过表达YFP的转基因拟南芥叶片上。将siGFPS1/KH9-BP100复合物溶液喷施于过表达YFP的植株上,显著降低了植物细胞中YFP的荧光(图4b、c),并导致喷施后3天叶片中YFP蛋白水平下降45.5%(图4d、e) (DAS)。此外,我们观察到在3 DAS后,喷洒siRNA/CPP复合物的转基因拟南芥叶片中YFP转录水平下降了54.1% (图4f)。这些结果表明,叶面喷施后siGFPS1/KH9-BP100复合物能有效诱导植物细胞的转基因沉默。5. 喷雾应用生物大分子传递到叶绿体图5 通过基于多肽的叶面喷洒将质粒DNA和siRNA分子靶向递送至叶绿体基于纳米粒子的定向生物分子传递到质体(包括叶绿体)是一种不断发展的质体工程的生物技术工具。在叶片浸润后,质粒DNA在叶绿体内被特异性释放,这一过程由基于CTP/CPP的簇状DNA递送系统和单壁碳纳米管介导。利用表面修饰的镉基纳米粒子,生物活性化合物可以选择性地转运到叶绿体中,以微调植物细胞的氧化状态。这些技术为操纵植物细胞的细胞器功能提供了可行的基于纳米粒子的平台。为了研究基于CTP/CPP的生物大分子通过喷洒进入质体的效率,我们产生了质粒DNA与CTP KH9-OEP34和CPP BP100在N/P比=1.0时的簇状复合物,这些质粒DNA携带有叶绿体特异的Renilla荧光素酶(Rluc)表达盒pPpsbA::Rluc。将得到的复合体在喷洒液(5%蔗糖+0.05%Silwet L-77)中,通过喷洒的方式施用于拟南芥叶片,并在喷洒后72小时内测量叶片中的Rluc活性(图5a)。与喷洒仅含有质粒DNA分子或N/P比值=1.0时形成的质粒DNA/CTP复合物的叶片相比,喷洒后24-72小时,质粒DNA/CTP复合物在拟南芥叶片中的转染效率逐渐提高(最高为7.6倍,平均为2.7倍)(图5b)。这些结果表明,使用基于肽的叶面喷洒,核酸分子可以有效地定向到叶绿体。由多肽载体运送到叶绿体的siGFPS1 dsRNA分子可能解离成单链反义RNA,随后与目标eGFP转录本形成RNA双链。这些反义的siGFPS1/eGFP RNA双链随后被叶绿体RNase III内切酶裂解,导致eGFP转录本的丰度降低,eGFP在叶绿体中的积累减少(图5c-g)。在DNA复制和转录启动过程中,解离的反义siGFPS1链也能与解开的转质体中eGFP基因的互补DNA序列结合。最后,反义siGFPS1/eGFP DNA异源双链在解决R环复制体的碰撞和启动转质体中高转录的eGFP表达盒的转录中抑制了质体RNase H1的内切酶活性。一个有效的方案来改善一个特定的具有经济意义的代谢途径,导致植物中个别的代谢物的合成,需要多种可控调节剂的综合组合,以完全控制共存于不同细胞区的分叉反应。例如,生物合成的异戊烯基二磷酸酯的生物合成,是异戊烯类最终产品的核心中间体,在植物中有两条不同的途径,一条是细胞膜上的甲戊酸(MVA)生物合成途径,另一条是质体上的磷酸甲硫醇(MEP)途径。具有吸引力的是,这两种不同途径中的限速酶的催化活动可以被外源性的生物大分子调控或生化损害。这两条不同的途径中的催化活动可以被外源性的生物分子所调节或生化损害。功能性肽基载体具有以下能力:(1)识别不同的生物大分子和化合物;(2)有效地将输送的货物运入植物细胞;(3)选择性地将指定的分子输送到特定的细胞区,特别是线粒体和质体。然而,复杂的细胞渗透/细胞器靶向肽的序列工程和大规模生产,以及优化生物大分子/肽复合物的生理外观,有可能使我们基于肽的喷洒技术的生物技术功能最大化。此外,设计一个由无人机技术、物联网(IoT)和这种喷雾技术组成的综合平台,可以实现有效的智能耕作和精准农业。三、结论我们证明了可以使用基于多肽载体的喷洒方式将生物分子成功地应用于植物,而不需要昂贵的设备和繁琐的制备程序。在叶面喷洒后,亚微米大小的核酸/肽复合物通过守护细胞转运到植物细胞中。这种基于多肽纳米载体的可喷洒的DNA递送平台对不同的植物物种都很有效。此外,利用我们的靶向肽为基础的生物大分子喷雾应用系统,成功地将siRNA分子输送到植物细胞中,特异性地诱导叶绿体中的基因沉默。我们的高通量多肽-核酸复合体喷洒技术能够在农业条件下对植物的重要经济性状和代谢过程进行全面的工程设计,而无需引入转基因。文章来源:Thagun Chonprakun. Non-transgenic Gene Modulation via Spray Delivery of Nucleic Acid/Peptide Complexes into Plant Nuclei and Chloroplasts. ACS nano, 2022, 16 (3): 3506-3521.
企业动态
2022.05.27
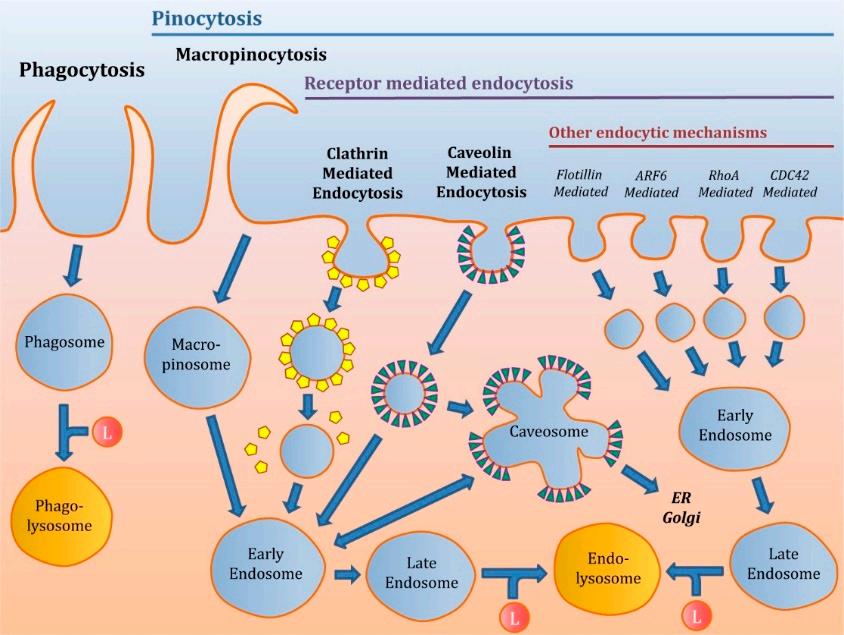
纳米粒子入胞途径和影响因素
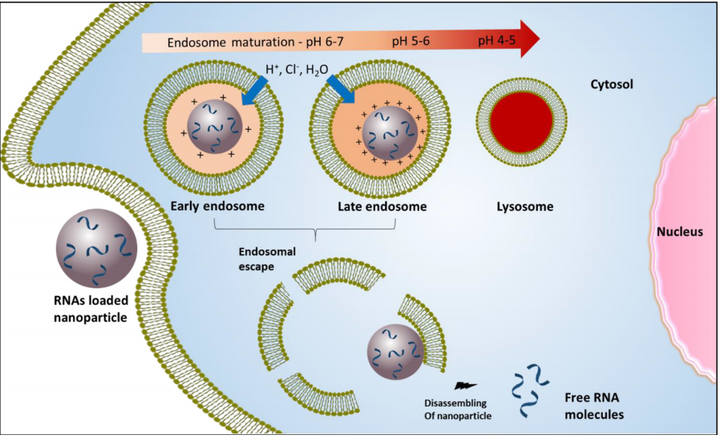
一、简介纳米医学已成为最近几年生物医学领域发展最为迅速的研究领域之一。纳米颗粒( Nanoparticles,NPs )和亚微米颗粒分别是指尺寸为1 - 100和100 - 1000nm的材料,由于它们具有很高的比表面积和体积比,可以与生物系统以非同寻常的方式相互作用。由于这种特性,加上可以通过修饰其周围化学基团从而实现多任务性质的可能性,使纳米粒子化合物在纳米医学的诊断和治疗方面具有很高的应用潜力。有关摄取机制的研究很重要,摄取机制不同,纳米粒子的命运也是不同的。例如,胞吞 在某些过程中非常重要。在这种情况下,小窝蛋白介导的内吞(Caveolin-Mediated Endocytosis, CVME )起主要作用。此外,许多药物可以被设计成到达特定的细胞器发挥治疗作用,摄取途径是药物能否发挥作用的决定因素。CVME摄取的纳米颗粒即是这种情况,它涉及内质网和高尔基体复合体,可用于靶向这些细胞器并携带某些特定药物。此外,根据所使用的纳米粒子和细胞的种类,摄取机制还可以减少内涵体降解和增大释放到细胞质中的药物量。因此,CVME似乎避免了某些细胞的溶酶体系统,与此同时其他作者表示巨胞饮体更有可能在不被溶酶体降解的情况下释放药物。本文概述了不同类型的纳米颗粒进入细胞内部的机制。二、内吞机制的分类不同内吞机制示意图1.吞噬作用吞噬作用指细胞通过大小在微米级别的囊泡(有较大的质膜表面积)摄取经过调理的微粒物质和溶质。但吞噬作用极少被用做纳米粒的摄取机制。2.胞饮作用胞饮作用是指包含溶质和粒子的液体被囊泡摄取,但是胞饮作用的囊泡尺寸要比吞噬作用过程中产生的囊泡小。这种内吞的机制可以分为巨胞饮和受体介导的内吞(Receptor-mediated endocytosis, RME)。2.1 巨胞饮巨胞饮允许通过大的液泡来摄取原料,大小不一,称为巨胞饮体。当巨胞饮体内化后,PH逐渐降低并且内涵体的标志开始出现。随后,酸化后的巨胞饮体既可以与晚期内涵体融合,也可以与溶酶体结合或者将它们运送的物质回收循环到细胞膜上。2.2 受体介导的内吞(RME)受体介导的内吞是纳米粒子进入细胞内部最常见的一种途径。受体介导的内陷开始于连接在纳米粒子上的配体与细胞膜上特定的受体结合,结合后会引发构象改变导致质膜内陷,产生早期内涵体,RME有不同的类型,下图是与纳米粒摄取最相关的一种:受体介导吞机制示意图2.2.1 网格蛋白介导的内吞(Clathrin-Mediated Endocytosis,CME)网格蛋白介导的内吞发生在特殊的质膜区域,同时也是网格蛋白被招募的区域。受激动剂和其受体的相互作用,导致网格蛋白被组装为多边形将囊泡包裹起来形成网格蛋白包被小泡。网格蛋白包被小泡的大小在70-150nm,网格蛋白包被小泡的大小取决于细胞的种类。然后囊泡内化,脱掉包裹在外层的网格蛋白,并且与其他的囊泡融合形成早期内涵体,之后早期核内体转变为晚期核内体并与溶酶体融合。2.2.2 小窝蛋白介导的内吞(CVME)小窝蛋白介导的内吞由60-80nm的细胞膜内陷,并吸收细胞外液成分构成。蛋白质会参与这种内吞途径,比如小窝蛋白-1(caveolin-1)在脂质筏中与胆固醇结合,与CME不同的是小窝蛋白-1被摄取后不会与液泡分离。小窝蛋白囊泡形成后会与其他的小窝蛋白囊泡融合形成具有多腔结构的溶洞体,通过双向的方式进一步与早期内涵体融合。从这点看来囊泡结构可以根据细胞的种类移动到光滑内质网或者高尔基体转运网。2.2.3 其他途径除了上述的机制外,还有一些不需要网格蛋白和小窝蛋白的途径,例如Arf-6,Rho-A (或者IL2Rb依赖途径),筏蛋白,或者依靠CDC42(CLIC/GEEC)的内吞。但是这些机制对纳米粒子的摄取并没有明显贡献。三、纳米粒子逃离内体的机制1.质子海绵效应由于内体酸化,纳米粒子的非离子化氨基吸收质子,引发氯离子进入内体,导致内体渗透压升高,水通过渗透作用进入内体,从而导致内体破裂,纳米粒子逃离内体。2.伞状效应纳米粒子可电离性脂质质子化,产生电荷排斥,导致结构扩大,内体发生破裂。3.直接融合纳米颗粒可以与生物膜直接融合,由于膜应力和内膜张力的诱导,会在内体的表面形成孔隙,纳米粒子可以从孔隙离开内体进入细胞。四、纳米粒子的物理性质对细胞摄取的影响目前有一些已知的因素可以对纳米粒子的摄取,内吞途径和其在细胞内的命运产生极大的影响。其中最重要的几个因素有纳米粒子的大小,电荷,形状和刚性。1.大小一般认为,纳米粒内化进入非吞噬型细胞的粒径比最优摄取效率的小粒子要大将近50nm,这取决于纳米粒的类型,金纳米粒是这样的情况。并且很难建立一种粒径和内吞途径之间的模型关系,因为粒子可以与特定的受体相互作用从而引发一种或者另一种通路,并且可以在表面成簇导致整体尺寸增大。然而,根据报道纳米粒子的尺寸高达150nm时大多通过CME和CVME内化,而通过这种方式内化的纳米粒子的最大尺寸为200nm,而250nm到3mm的纳米粒子的最佳摄取途径是巨胞饮和吞噬作用。2. 电荷电荷在纳米粒子摄取中会起到相关的作用。由于细胞表面带负电荷,因此阳离子纳米粒子更容易内化到细胞中,而中性和负电荷纳米粒子被不同细胞内化的效率更低。并且电荷也会影响摄取通道,负电荷纳米粒子更容易通过CVME被摄取进细胞,而阳离子纳米粒子更喜欢通过CME进入细胞。3. 形状关于纳米粒子的形状(球形,圆柱体,椭圆,棒,圆盘)是否会影响摄取的程度和内吞的途径并没有统一的意见。因此,一些学者认为球形的纳米粒子例如金纳米粒子或者聚乙二醇化的纳米粒子具有更高的摄取速率,与此同时,另一些学者提出细长的纳米粒子的内吞效果要优于球形纳米粒子。造成这些差异的原因尚不清楚,但是研究中使用的不同类型的细胞可能是导致这种差异的原因之一。4. 刚性与柔性纳米粒子相比,纳米粒子的刚性似乎可以增加纳米粒子的内吞。此外,刚性纳米粒子更容易被CME吸收,而柔性纳米粒子易被巨胞饮内化。5. 其他因素除了上述的因素之外,还有其他可以影响纳米粒子摄取速率的因素,比如与血清蛋白的相互作用和其亲脂性。并且纳米粒子和血清蛋白的相互作用会在纳米粒子的表面形成蛋白冠状结构,从而导致尺寸增长,这可能会影响纳米粒子和细胞之间的相互作用。另一方面,亲脂性纳米粒子可以通过与细胞膜的脂质部分直接相互作用从而通过被动扩散进入细胞。为了合成更高效的纳米粒子,这些因素可作为关键的设计参数加以考虑,以便合成更高效的纳米颗粒。五、总结由于纳米粒子的化学性质提供了多种研究方向,包括通过修饰其表面的末端基团使其能够定向到靶细胞。因此将纳米粒子用作不同的治疗化合物((小分子药物,siRNA等。)的载体变得非常普遍。为了成功递送治疗药物,纳米粒子必须先被目标细胞摄取。内化机制对纳米粒子及其搭载的药物非常重要,因为它可以帮助改变其细胞内的命运。大部分纳米粒子主要通过受体介导的胞吞作用被摄取。不同类型的纳米粒子化学性质不同,导致它们的内吞途径不同。此外,对于同一类型的纳米粒子,表面化学基团或修饰不同的配体以增加细胞靶向性也会明显改变进入其细胞的机制,因此很难对一些具有不同化学性质的纳米粒子进入细胞的速率和程度以及药物的递送做出预测。除此之外,对于同一化学个体,不同类型的细胞按照不同的机制摄取纳米颗粒。这种现象可能与不同来源的细胞细胞膜外部的脂质、蛋白质和糖的组成不同有关。未来,成功的纳米粒子转运设计应基于更透彻地了解与纳米粒子摄取相关的功能基团,以及靶向基团与被用于选择性转运纳米粒子和细胞药物到特定细胞的受体结合产生的优先通路。然而,尽管有新知识可以参考,对于新设计和修饰的纳米粒子来说进行试错测试似乎仍是研究纳米粒子被细胞机制的途径唯一可行的方法。文献来源:Darío Manzanares and Valentín Ceña. Endocytosis: The Nanoparticle and Submicron Nanocompounds Gateway into the Cell[J]. Pharmaceutics, 2020, 12(4) : 371-371.
企业动态
2022.05.27
喜报!祝贺迈安纳合作伙伴斯微生物新冠疫苗再次获得我国临床批件
图片来源于斯微生物微信公众号2022年4月29日,斯微生物发布公告,宣布其自主研发迭代的新冠病毒mRNA疫苗获得国家药监局批准,将开展临床试验。迈安纳作为斯微生物的合作伙伴,特别献上最热烈的祝贺!这也是迈安纳的INano™ mRNA包裹平台再次获得我国药监局的认可。在药物递送领域中,特别是mRNA类药物领域,迈安纳将一如既往地贡献可靠有力的强大支持——从设备到工艺的整体解决方案。
企业动态
2022.05.11
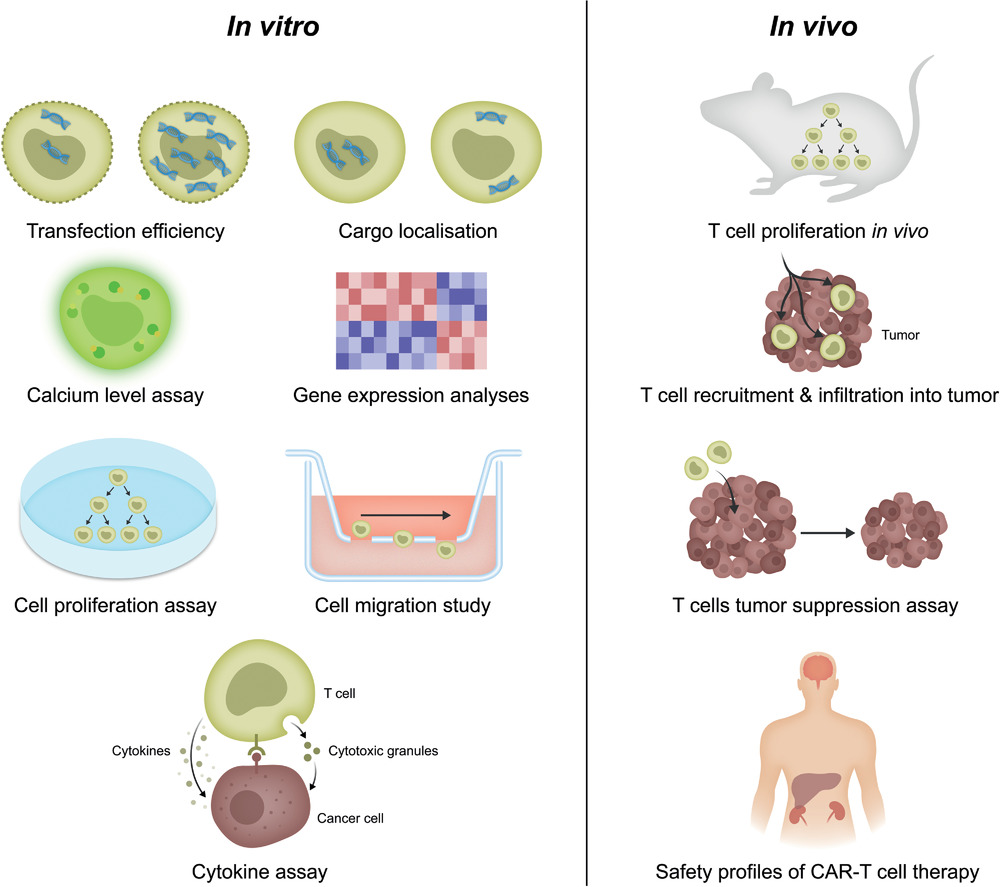
促进CAR-T转染的材料 —— 生物评价实验
一、体外试验1.转染效率转染效率指被货物成功转换或改造的细胞比例。高的转染比例是非常重要的一个参数,尤其对于起始细胞数量比较低的情况。分别编码荧光或生物发光蛋白(如GFP和luciferase)的DNA可以克隆到CAR的转基因用于鉴别被转染的细胞。转染效率可以通过计算成功表达荧光或生物发光蛋白的细胞比例来评估。另外,可以通过优化各种试验条件,如DNA-试剂的比例、孵育时间等。GFP是最常使用的报告系统,可以使用荧光显微镜或流式细胞仪来观察。流式细胞术相比荧光显微镜有更高的灵敏度和通量。在关于T细胞转染的大部分文献中,转染效率没有考虑死细胞因而人为增加了转染效率。我们鼓励采用更加客观的方式,包括考虑死细胞,因为细胞活性也是评估转染技术是否合适的重要考量。另外,转染后的时间也应该明确,因为货物不会稳定地整合入基因组,转染效率会随着细胞分裂而降低。这对于稳定转染CAR-T细胞的应用是一个有利的考量。2.货物定位一个典型的转染过程涉及3-4个步骤:货物包装,跨膜转运,细胞内释放,转运进入细胞核。货物的位置很大程度上影响它们是否能够履行其预期的功能。例如,对于基因编辑,货物必须定位在细胞核。因为对于长期稳定的基因表达和基因编辑,货物必须进入细胞核,并整合入基因组中,因此货物的定位可视化将会非常有用。另外,对于siRNA介导的基因沉默或蛋白瞬时表达,药物必须被递送进入细胞质中。荧光共聚焦显微镜是最直接的和普遍使用的评估货物定位的方法。货物通常用荧光染料染色,细胞核用DAPI染色,从而可视化荧光信号的共定位。可以通过一些方法改善货物在细胞核的定位,如使用细胞核定位信号和微管相关序列。3.细胞增殖试验细胞倍增时间是细胞治疗的一个重要考量。这是因为初期可以使用的细胞数量有限,在危重病人或老年人中健康细胞的数量可能非常少。因此,转染后细胞扩增是非常重要的,并且这个过程耗时耗力。因此,由于转染导致的细胞倍增时间的增加是有害的,可能也表明了细胞压力,衰老或耗竭。转染技术不能明显干扰细胞增殖,因为这会继而延长CAR-T的治疗时间,从而大幅增加治疗成本。细胞数量可以通过显微镜计算存活率得到,但是不能提供细胞分裂速率随时间的变化。CFSE是一种常用的确定T细胞增殖速率的荧光标记。使用CFSE染料标记细胞后,每一代子细胞中的荧光信号逐渐减半,通过流式细胞仪可以跟踪T细胞的增殖。4.细胞扰动在转染过程中,T细胞可能会经历不同程度的扰动,进而影响它们的关键生理特性,如基因表达。评估细胞扰动有以下几种方式。钙离子调节不同的细胞功能,作为第二信使参与多种细胞通路活动。细胞质中的钙离子水平通常维持在100*10-9M,远低于在内质网和线粒体及细胞外环境的钙离子水平(两者分别在µM和mM范围)。细胞内荧光钙水平的持续增加是细胞压力的表现,可能会引起应激反应相关的信号通路。在转染过程中,货物通过机械穿孔或电流渗透的方式被引入细胞。这些过程在细胞膜上形成了孔道,钙离子将会顺着浓度梯度进入细胞质中。细胞内钙浓度的水平的增加和高水平的持续时间是膜孔恢复稳态所需时间的指标。一种定量评估钙压力的方法是使用荧光指示剂,如Fura-2,Indo-1和Fluo-4,并计算荧光扣除背景荧光之后的变化。另一种观测细胞内钙水平的方法是通过使用基因编码的荧光蛋白,如基因编码的钙指示剂(GCaMP)。相比化学指示剂,基因编码的荧光蛋白不会造成细胞毒性,更适合长期观测,但挑战是质粒构造必须被优化以确保蛋白可以稳定表达。5.T细胞激活和细胞因子试验稳健的T细胞激活是细胞快速扩增的先决条件。T细胞早期激活标志物CD69可用于确定是否该生物特性被转染影响。活化后,T细胞分泌一系列的效应细胞因子,如IL-2,TNF-α,IFN-γ(可以通过ELISA试验检测)。另一个更复杂的方法,多参数细胞因子染色不仅可以用于测定细胞因子的产生,还可以测定特定细胞亚型的功能标记分子。但该实验方法的缺点是灵敏度低,需要大量的实验方案优化。6.T细胞特异性抗原特异性的T细胞可以增强疗效和确保安全性。MHC多聚体技术可以用于测量修饰后的CAR受体/T细胞受体(TCR)和递呈在MHC分子表面的特定肿瘤抗原之间传导的免疫信号。这种单细胞试验使用多种MHC-I或MHC-II分子亚基(二聚体到八聚体)分别验证与表达CAR的CD8+或CD4+TCR之间的免疫作用。最常用的四聚体技术是将四个生物素化肽-MHC糖蛋白链与链酶亲和素主链连接在一起。在一众免疫学评价技术中,如ELISpot,细胞内细胞因子染色,标记物分泌试验等,MHC四聚物染色可以改善抗原识别信号的特异性。而且不像前述提到的功能性试验依赖抗原诱导的细胞因子或标记物表达,它是一种直接的滴定方法。不同的试剂如荧光探针,DNA条形码,重金属标记被用于锚定在多聚物上,之后使用多种检测技术如流式细胞仪,测序,质谱流式细胞术等实现抗原特异性T细胞的识别。但一个重要的限制是MHC四聚物对不同T细胞的敏感性不同。例如,MHC-II与CD8+TCR细胞的结合力比MHC-I与CD4+TCR的亲和力更强。而与T细胞结合的低亲和力会折损评估免疫反应的能力,降低标记效率。因此该技术需要调节细胞数量实现T细胞反应的稳定检测。7.T细胞迁移实体瘤对于CAR-T疗法仍然是一个巨大的挑战,一个挑战是CAR-T细胞的肿瘤浸润性差。T细胞能够响应生物分子迁移,而T细胞的迁移是一个非常重要的考量,因为T细胞对化学引诱剂的敏感性和迁移能力影响它们的效力,尤其是对实体瘤的效力。如果T细胞可以在实体瘤里迁移更快更均一,将可能实现更好的临床效果。Transwell试验是评价细胞迁移的常用方法,该方法使用一个填充了两种介质的小室,一种介质是趋化因子如IP-10,另一种是结合了CXCR3受体的化学引诱剂,通过多种膜分开两种介质。T细胞培养在小室上层,一旦感知到趋化因子的化学梯度,将会迁移到小室下层。培养一段时间后,上层小室被移开,迁移到膜上的细胞数量可以在显微镜下通过血球计数确定。膜孔的大小需要谨慎选择,避免细胞的非特异性转移。如果使用了荧光标记的T细胞,可以通过荧光显微镜观察随时间变化的迁移行为。8.T细胞毒性试验T细胞通过分泌细胞毒性颗粒移除肿瘤。因此评估转染后CD8+ CAR-T细胞的细胞毒功能是非常重要的。该实验可以通过混合细胞膜染料(如PKH-26或红色荧光蛋白)标记的肿瘤细胞和表达生物荧光或荧光蛋白的CAR-T细胞,共孵育一段时间后,通过流式细胞术评估细胞的体外杀伤能力,肿瘤细胞计数,和CAR-T细胞繁殖能力。CAR-T细胞和肿瘤细胞的微流控共培养可以用于该实验。二、体内试验1. T细胞增殖虽然大量的CAR-T细胞被输入病人体内,但并不是所有都可以存活。实现持续性的抗肿瘤作用,需要CAR-T细胞在体内持续增殖,提供长期保护。然而,肿瘤微环境可能会抑制T细胞的增殖,探明CAR-T细胞能否在肿瘤内继续增值,发挥有效的抗肿瘤效应,是非常重要的。具有荧光标记的转染T细胞可以抽取外周血并计数得到。对于肿瘤浸润的T细胞,可以通过肿瘤切片、消化,并通过流式细胞术确定数量。2. T细胞招募和肿瘤浸润CAR-T细胞必须浸润实体瘤,并释放细胞毒性颗粒或效应细胞因子才能发挥作用。肿瘤浸润细胞的数量多和空间分布均一是一个良好的预后生物标记。将肿瘤组织切片,在胶原酶中消化,通过过滤肿瘤悬浮液可以得到单分散的肿瘤浸润T细胞。被过滤的细胞通过荧光抗体如抗-CD4抗体、抗-CD8抗体,进行染色,使用流式细胞术可以检测CD4+辅助T细胞和CD8+细胞毒T细胞的比例。进一步检测T细胞在肿瘤中的分布,可以将肿瘤组织切薄片,并用荧光抗体进行染色,使用共聚焦成像观测肿瘤浸润细胞在肿瘤组织和细胞外间质中的分布。然而,显微镜的穿透力限制可能意味着更深区域的浸润细胞难以检测。Boissonnas等提议使用双光子活体镜检和免疫荧光可以检测肿瘤外周和深层区域的T细胞。空间转录组学等新兴技术也可以帮助提供肿瘤组织中新的免疫细胞和癌细胞类型的空间图。3. 肿瘤抑制试验成功的CAR-T疗法必须抑制肿瘤成长,增加存活率。使用注射了肿瘤细胞或病人来源的移植瘤动物模型可以评估CAR-T细胞的体内肿瘤抑制效果。肿瘤大小可以通过非侵入性的CAR-T体内成像,或荧光/生物发光标记的癌细胞来确定。在动物被处死之前,通常会观察肿瘤生长的进展。之后,肿瘤从动物体内移出,称重,用卡尺测量大小。肿瘤组织也可以通过TUNEL染色,激光共聚焦显微镜观测凋亡癌细胞的数量。4. CAR-T疗法的安全性试验虽然CAR-T疗法是治疗癌症的很有前景的疗法,但它可能会造成严重的副作用和毒性。由于CAR蛋白在健康细胞中的低表达水平,临床和临床前试验中报道的导致健康组织损伤的靶向/非肿瘤毒性是主要的副作用。安全性评价可以通过两种方式评估。第一种是测定血液中细胞因子的水平。主要的细胞因子是IL-6,它与细胞因子释放综合征和神经毒性有关。第二种是检测CAR-T细胞在健康组织中的浸润。动物处死后,获取肾脏和肝脏,这些组织使用苏木精/伊红染色,其他的抗体用于检测CAR-T的浸润和器官损伤。转染后CAR-T细胞的生物学评估试验三、展望过去20年,各种各样的转染技术被开发。病毒载体和大面积电穿孔被用于产生FDA批准的CAR-T产品。微纳米技术的进展也期待可以加速转染方法的发展。为了增强在临床转化的作用,需要细胞内递送的技术克服这些挑战。首先,载体必须可以运送更大和更复杂的货物,甚至可以在不同的环境下,高特异性地同时递送多种货物。其次,随着CAR-T疗法地流行,高通量细胞转染地需求将不可避免地增加,尤其是对于自体CAR-T产品。第三,随着特定肿瘤和免疫细胞类型及它们在肿瘤免疫治疗中的相互作用的相关单细胞测序数据的增加,优化转染条件对于提高通量和降低成本是必须的。最后,随着CAR-T产品需求增加的预期,重要的是可以实现按GMP认证的方式进行转染技术的放大。
企业动态
2022.05.09
重磅新闻! 辉瑞新冠mRNA疫苗32.9万页完整审评文件被披露
Public Health and Medical Professionals for Transparency是一家非营利性组织,由公共卫生专家、医学专家、科学家和新闻工作者组成,旨在通过获取和传播FDA批准COVID-19疫苗所依据的数据。(获取的任何数据将会公布在组织网站上。https://phmpt-org.translate.goog/?_x_tr_sl=en&_x_tr_tl=zh-CN&_x_tr_hl=zh-CN&_x_tr_pto=op,sc)该组织对这些数据不持任何立场,只是希望公开这些数据,以便独立专家进行审评和分析这些数据。在辉瑞疫苗被FDA批准用于16岁以上人群使用4天后,该组织即向FDA提交了一份信息自由法案请求,要求FDA公开辉瑞COVID-19疫苗生物产品文件中的所有数据。随后,该组织正式起诉了FDA没有公布这些数据。该组织最终赢得了此次诉讼,现在该组织网站上可以查看法庭文件和从FDA获取的辉瑞疫苗相关文件。这些审评资料详尽展示了辉瑞疫苗非临床研究(如:mRNA序列、制剂处方)和临床研究的数据依据,便于独立专家进行审评和分析。更重要的是,为新药研发提供了学习的资料。 关注迈安纳公众号回复“文件” 可以下载上述150份完整审评文件
企业动态
2022.03.07
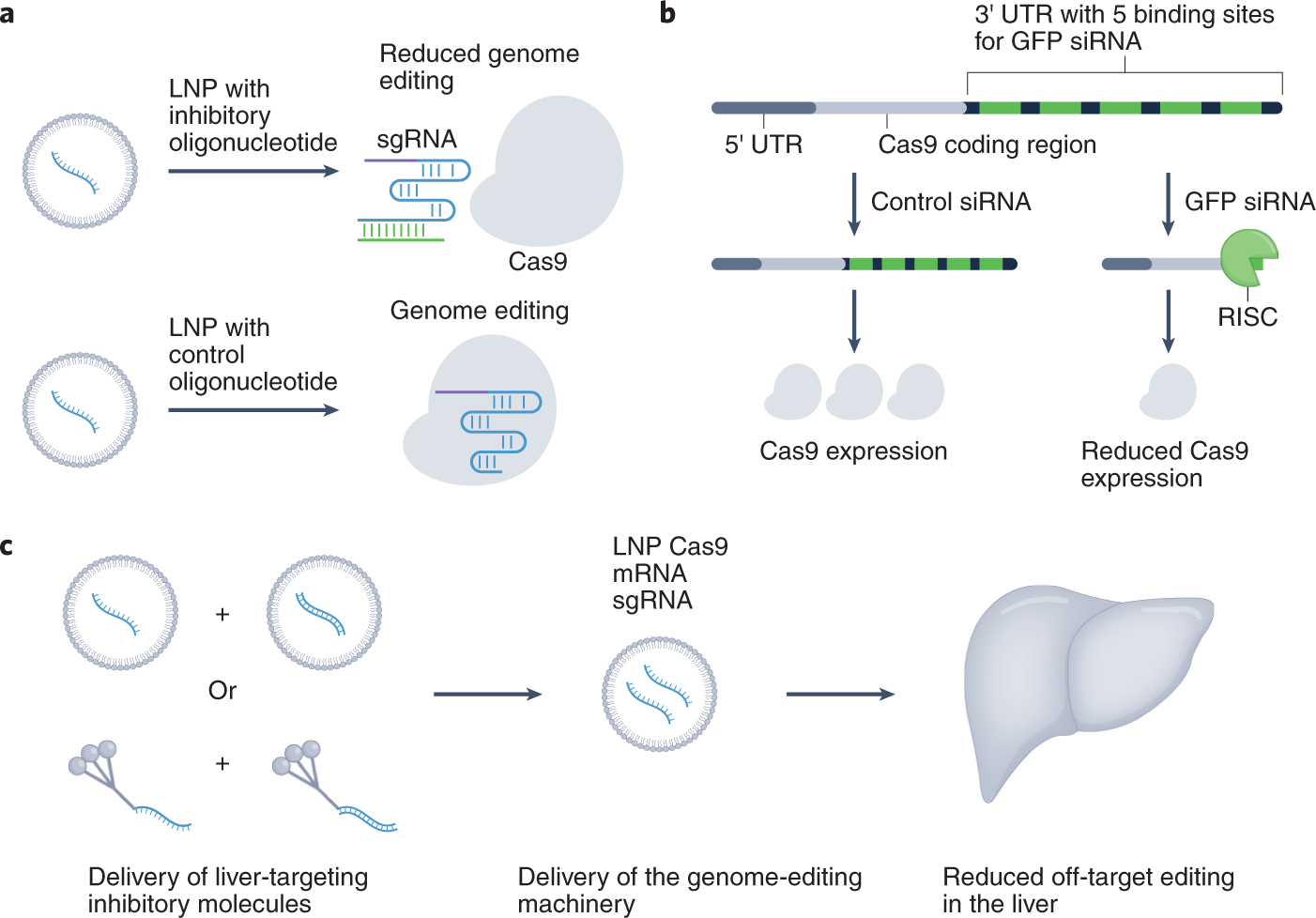
抑制Cas9在肝脏的活性,可提高基因编辑在肺脾的靶向性
抑制性寡核苷酸减少基因编辑在肝脏中的脱靶效应COVID-19疫苗使用脂质纳米粒(LNPs)递送mRNA,使得mRNA技术的医学和社会效益被世人认识。mRNA也被用于诱导细胞表达外源蛋白用于基因编辑,蛋白替代疗法和免疫治疗。在基因编辑中,尤其是CRISPR编辑,实现疾病细胞的特异性靶向编辑,避免对其他细胞的基因改变是非常重要的。因为通过静脉注射的LNPs,一大部分(30-90%)会蓄积在肝脏,因此在肝脏的脱靶编辑需要最小化。本文发现通过寡核苷酸破坏sgRNAs的二级结构或与靶向Cas9 mRNA的siRNA联合,脂质纳米粒可以减少Cas9在成年小鼠肝细胞介导的基因插入和缺失,而增强在肺部和脾脏介导的基因编辑。在患有急性肺炎的SpCas9小鼠模型中,系统递送抑制sgRNA(靶向细胞间黏附分子2,ICAM-2)的寡核苷酸,之后递送该sgRNA,可以减少ICAM-2缺失突变在肝细胞中的比例,增加在肺上皮细胞中的比例。在野生型小鼠模型中,LNPs递送抑制性寡核苷酸,之后递送降解Cas9的siRNA,及Cas9 mRNA/sgRNA,减少了ICAM-2缺失突变在肝细胞中的比例,但没有减少在脾上皮细胞的比例。表明,抑制性寡核苷酸和siRNA对细胞特异性的Cas9疗法有调节作用。因此,抗CRISPR分子和LNPs递送基因编辑器的结合可以降低基因编辑在肝脏的脱靶效应。然而,目前大部分的基因编辑技术需要多种成分,因此优化LNPs的设计用于顺序递送或同步递送多种成分对于人体内的基因编辑是更重要的。不仅是基因编辑,多种核酸药物的递送还可以用于克服在肿瘤和其他疾病中的关键递送难题,改善疗效。而且,LNPs可以通过主动和内生靶向机制,倾向于接近特定的器官和细胞类型,使得基因编辑在新型疾病类型中的应用成为可能。本文参考自:Sago, C.D., Lokugamage, M.P., Loughrey, D. et al. Augmentedlipid-nanoparticle-mediated in vivo genome editing in the lungs and spleen bydisrupting Cas9 activity in the liver. Nat Biomed Eng 6, 157–167 (2022).
参数原理
2022.03.07
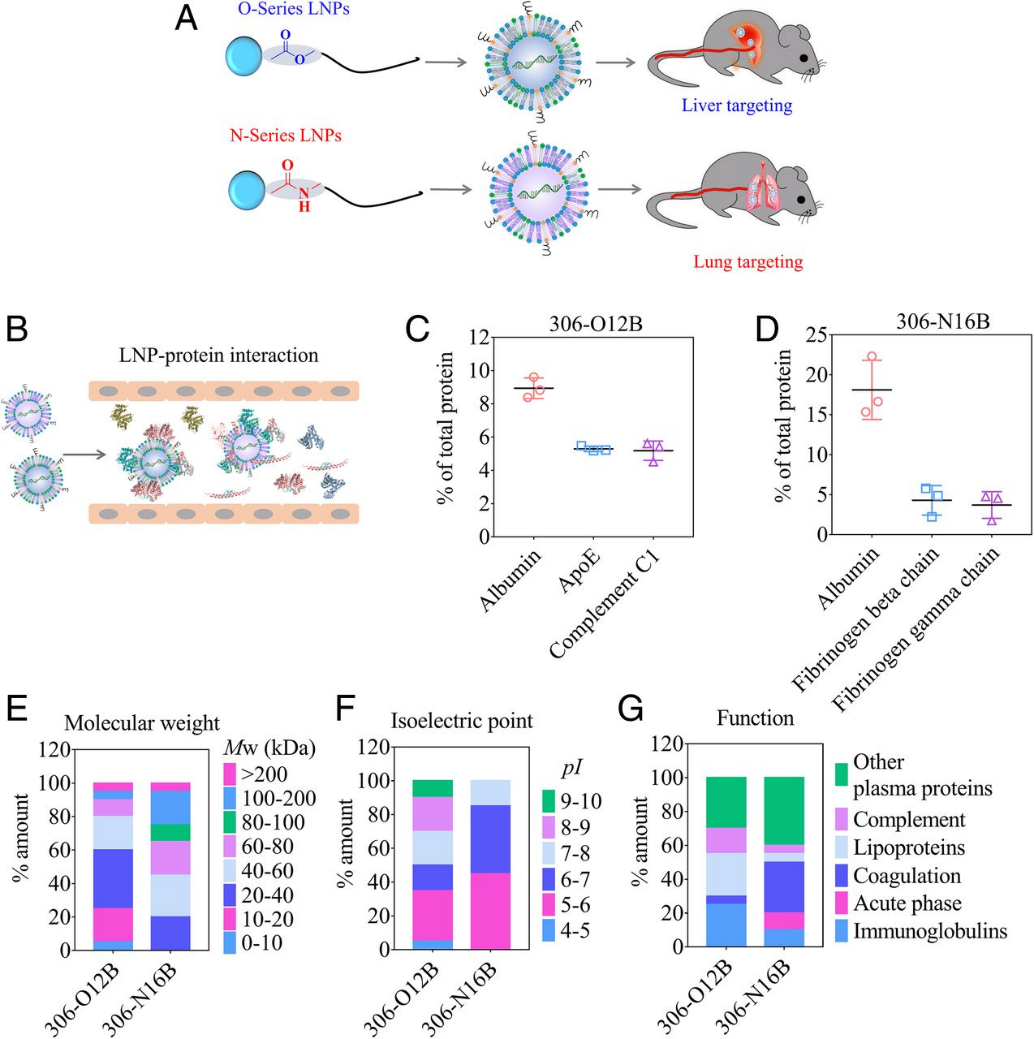
肺靶向-脂质纳米粒的设计和研究
本月,在:Proceedings of the National Academy of Sciences(美国国家科学院院刊)上发表了一篇关于成功将mRNA靶向递送至肺脏内的论文。本文设计了一系列的N-脂质纳米粒(LNP),可以特异性调节LNP表面的蛋白冠组成,从而将mRNA靶向递送至肺脏内。LNP蛋白冠蛋白质组学研究++1. 靶向LNP研发的痛点之一是对纳米粒子和生物活性成分之间的相互作用理解不全面而难以预测新设计的LNP在体内的靶向行为。进入体内后,纳米粒子的外层会迅速覆盖一层血浆蛋白,称为蛋白冠,蛋白冠重塑了纳米粒子表面特性,极大程度影响了纳米粒子与器官和细胞之间的相互作用。2. 脂质尾部的长度,不饱和度,分支程度对mRNA递送效率的影响已有很大进展,但脂质尾部结构对LNP体内选择性的影响还缺乏深入研究。3.本文通过氨基头部和丙烯酰胺脂质尾部之间的加成反应,合成了一系列含有酰胺键的脂质(N-系列脂质),结合之前合成的尾部含酯键的脂质(O-系列脂质)研究了不同尾部结构对LNP的体内定位影响。结合蛋白质组学研究,本文发现一旦进入血液中,LNP可以选择性控制特定血浆蛋白的吸附作为靶向配体,进而指引LNP到达相应器官,其中O-系列脂质LNP进入肝脏,基于N-系列脂质的LNP靶向肺脏。4. 本文比较了两种LNP表面吸附血浆蛋白的种类,在数量排名前20的蛋白中,有14种是不同的蛋白。O-系列脂质LNP表面吸附更多的载脂蛋白E(ApoE),这与Apo-E介导的LNP递送至肝脏的报道是一致的。N-系列脂质LNP表面蛋白冠最多的是血清蛋白,纤维蛋白原-β,纤维蛋白原-γ。而纤维蛋白原涂层可以改善内皮细胞的黏附和内皮化。++本文参考自:Proceedings of the National Academy of Sciences Feb 2022, 119 (8) e2116271119; DOI: 10.1073/pnas.2116271119
参数原理
2022.03.04
促进CAR-T转染的材料——三种新方向
一、微流控转染微流控技术用于免疫细胞转染微流控技术指在微米级别进行流体控制,已经用于细胞加工和诊断。具有不同机制的微流控平台已经被开发用于细胞转染,如微注射、细胞挤压、剪切应力、涡旋脱落、确定性机械操作、压缩力、激光、电场。然而,只有少数微流控技术被报道可以成功转染原代免疫细胞(因为原代免疫细胞对转染的抵抗性)。类似于电穿孔,微流控转染可以同时递送不同的药物入胞,如寡核苷酸、大分子复合物(蛋白、碳水化合物)、小分子药物、染料。不像宏观装置,微流控利用微观的膜破裂力,从而可以保留较高的细胞活性。据报道使用微流控菱形微压缩可以产生快速的细胞机械变形,使用GFP质粒可以成功转染30%的SU-DHL-1间变性大淋巴瘤细胞。微流控挤压也能将抗原直接递送进入B细胞,并使B细胞保持较高的活性。微流控电转染通过温和的电脉冲促使细胞通过几十微米的狭窄的微孔道,因而细胞毒性更低。随着对CAR-T产品的需求增加,随之而来对高通量细胞转染的需求也会增加。微流控技术采用连续流和并行模式,相比传统的转染方法更易实现高通量。利用T-junction微孔道中的延伸循环流,悬浮细胞显著拉长,细胞膜变得不连续,从而可以高效摄取纳米材料。另外,超声可以辅助微流控设备实现对原代干细胞和外周血单核细胞(PBMCs)的高通量转染,通过平行和重复的处理转染效率可以进一步提高,这得益于细胞和微尺度膜破坏力之间的接近减少了生物分子扩散进入细胞的时间。同时微流控转染在CAR-T细胞中形成的生物学扰动更少。一项研究发现相比对照组,电穿孔导致促炎因子IFN-γ、IL-2的转录水平分别升高200倍、75倍,而微流控细胞挤压组,这些基因的表达仅升高10倍。更重要的是,转染方式的选择可能会影响CAR-T细胞的治疗效果。虽然,电穿孔和微流控挤压可以达到相当水平的肿瘤浸润,但微流控技术处理的CAR-T有更好的治疗表现。虽然微流控技术可以提供高通量转染满足细胞大生产的要求,但是运营成本可能会很高。必须保持在微流控孔道中自由悬浮的药物有相对高的浓度,从而可以允许细胞膜孔瞬间开放时足量的药物入胞而实现强效的细胞表达。寡核苷酸类,如DNA,mRNA,siRNA合成相对低廉,但热敏性药物如酶、抗体可能会带来大量的生产和运行成本。虽然微转染对细胞相对温和,微流控通道可能会因为灰尘、细胞、和蛋白的非特异性吸附而阻塞,从而导致转染的中断,造成细胞的损失。对于健康细胞很少的病危病人,这种情况将会给自体CAR-T细胞治疗造成很多不利。现有证据表明实现有效的肿瘤治疗,被转染的CAR-T细胞的质量比数量更重要。鉴于此,是否采用高通量细胞处理值得重新审视。二、纳米粒转染纳米粒用于细胞转染纳米粒是粒径在几十到几百纳米的粒子。近年来,纳米粒子由于可编程的特性,已经广泛用于生物医疗诊断,药物递送,造影剂,抗菌剂等。不同大小、形态、和材料组成的纳米粒子已经被设计用于递送不同的药物如:DNA,mRNA,siRNA,蛋白和小分子药物进入不同环境的不同细胞。细胞可以利用不同的内吞机制摄取纳米粒子,如:网格蛋白介导,小窝介导,胞饮作用,胞吞作用。纳米粒子内吞入胞后,它们会困于酸性溶酶体中,到达细胞质之前被释放,再进入目标位点。虽然纳米粒子用于CAR-T细胞转染和改造方兴未艾,但这方面的文献尚少。除了具有吞噬作用的巨噬细胞和中性粒细胞,其他免疫细胞不能从细胞外液中主动摄取材料,因此将纳米粒子递送进入原代免疫细胞并不简单。类似于电转染和微流控技术,纳米粒可以递送不同种类的药物进入细胞(只要药物可以通过静电吸引或共价交联与纳米粒子结合)。生物活性物质被包载或被装载入固体纳米粒,纳米载体被免疫细胞摄取,药物进而在细胞内释放。由于良好的稳定性,脂质纳米粒是用于免疫细胞转染的理想载体。Harashima等基于可电离的阳离子脂质(YSK12-C4)构建了一种包膜型纳米粒,可以将siRNA成功递送进入鼠DCs。基于此,他们用此载体递送siRNA进入人源免疫细胞系包括Jurkat(T细胞),THP-1(单核细胞),KG-1(巨噬细胞),NK-92(自然杀伤细胞NK),实现了高效的基因沉默效率(96%,96%,91%,75%)。粒径小,稳定性高,低聚集性都有利于这些载体的细胞摄取。然而,在KG-1和NK-92细胞上观察到了明显的细胞毒性,这可能是由于阳离子脂质头部造成的细胞膜破裂。还需要进一步的研究减少基于脂质的纳米粒的纳米毒性。除脂质外,聚合物也可用于递送货物进入免疫细胞。聚乙二醇-聚乳酸嵌段共聚物(PEG-PLA)纳米粒子被用于递送细胞毒T细胞相关分子-4的siRNA进入CD4+和CD8+T细胞,瘤内递送siRNA增加了细胞毒CD8+T细胞的数量,改善了肿瘤浸润T细胞的抗肿瘤免疫效应。PEG化的聚乳酸-羟基乙酸共聚物(PLGA)纳米粒子可以将抗原递送入DCs,并成功激活CD8+T细胞(Figure b)。Smith等基于可生物降解的聚(β-氨基酯)(PBAE)生产出针对CD19+B细胞的CAR-T细胞(Figure c),这些T细胞可以快速地摄取聚合物纳米粒,在2周时间内维持CAR转基因的高表达,显著改善了淋巴瘤动物模型的生存率。但是,聚合物纳米粒子还要注意阳离子聚合物和基因材料之间的稳定性,体内蓄积(不可降解的聚合物),毒性代谢产物等问题。除了固体纳米粒包裹系统,基于自组装设计的纳米粒也用于转染货物的递送。Yu等使用低分子量的(800Da)聚乙烯亚胺(PEI)和低代数聚酰胺自组装的纳米粒(Figure d)递送质粒DNA,自组装的纳米粒在Jurkat细胞上展现了有效的基因转染和低的细胞毒性,有希望用于CAR-T细胞治疗。同时由于自组装的形成机制,制备程序相对简单,可实现可控释放,但粒子的不稳定性也应该被解决。纳米粒子的一个特别优势在于其可规避病毒载体的免疫原性和电穿孔导致的生物扰动和低转染效率。另外,由于可设计的特征,通过可调节的合成和构造过程,可以改善纳米粒的靶向性和转染效率。Mostaghaci等发现对纳米粒子的不同表面修饰显著影响了与细胞/组织的相互作用,产生不同表现的细胞毒性、免疫激活、降解、和转染。Smith等使用靶向T细胞的抗CD-3e多肽片段、微管相关序列、核定位信号分子功能化的纳米粒,借助微管的作用,递送基因货物进入细胞核。然而,可设计的纳米粒并不总是完美的,Smith团队也发现这种转染方法存在一定的脱靶效应,循环中的中性粒细胞和单核细胞也可以摄取这些纳米粒子,尽管数量远低于目标T细胞。此外,外部因素,如温度也可以影响纳米粒的转染速率。Harashima等发现装载siRNA的脂质纳米粒(LNP)在低温(4℃)条件下的转染效果不佳。可能原因是在低温条件下,靶细胞膜和LNP之间发生的膜融合,减少或抑制了细胞内化。同时,含有对酸/低PH,热,光和磁场敏感的连接键的纳米粒-货物复合物也被构造用于刺激响应的基因递送。相比其他的转染方式,纳米粒子可以减少CAR-T疗法的花费,尤其是用于大生产和转染不同的CAR转基因。许多基于金属的纳米粒子可以通过一步法合成,微流控设备也被认为可以简化纳米粒合成流程,这些可能有助于降低大生产的费用。然而,纳米粒子只能同时递送少数几种货物,当用于递送基因编辑CRISPR/Cas9,纳米粒子的处方组成和合成将会变得更复杂,并且需要更多的试剂和纯化步骤。考虑到GMP生产的需求,这无疑显著增加了纳米粒子用于临床应用的花费。因此,纳米基因递送很大程度上依赖于货物的类型和应用场景,尽管此领域有丰富的文献支持,还没有产品可用于临床细胞转染,可能就是由于难以满足GMP的要求。纳米粒是用于免疫细胞转染的理想工具,尽管已有FDA批准的药物如Onpattro(递送siRNA入肝)。最重要的挑战是货物胞内释放的不可控。经典的入胞途径是纳米粒被摄取进入酸性的内涵体中,但酸性环境可能会降解敏感型货物如DNA。虽然在纳米粒和货物之间引入PH敏感键可以最小化这种局限,但从内涵体释放后,调节DNA进入细胞核仍然是困难的。实验结果显示使用纳米粒进行原代免疫细胞转染仅仅可以实现中等程度的效果(约10—30%的效率)。另一个问题是纳米粒的细胞毒性,尤其是含有金属成分或阳离子脂质成分的纳米粒。为了克服货物在细胞内的不可控释放和运输,经常需要高浓度的纳米粒子,这将导致细胞凋亡,氧化压力,代谢异常,基因表达的改变和细胞器完整性的破坏。大量金属核心纳米粒可能会造成在体内蓄积和器官毒性,大量阳离子脂质(如阳离子头部)可能会破坏细胞膜,导致细胞裂解和坏死。另外,还需要进一步研究纳米粒子如何造成非特异性的目标免疫细胞的增殖或增殖抑制,以及影响疗效。现有研究表明纳米粒相关的转染影响免疫细胞的增殖,而且这种影响与纳米粒类型相关。年老细胞摄取和转运纳米粒的效率显著更低,而且它们也会面临更多的纳米粒造成的生物学扰动压力。然而,来自年老病人(癌症主要发病人群)的免疫细胞转染研究还很少。纳米粒转染免疫细胞的临床应用还需要更多的研究以降低细胞毒性和改善货物在细胞内的释放。三、高比表面积纳米结构转染高比表面积纳米结构转染由于过去几十年纳米构造技术的发展,如气液固纳米线合成和原子层沉积,大量的高比表面积纳米结构包括纳米枪,纳米针,纳米线,纳米吸管已经被设计用于细胞内货物的递送。这些纳米结构直径在几百纳米,高度在几微米。区别于其他转染方式的一个典型特征是它们可以与细胞在10-100nm的尺度上相互作用。高度局部化的相互作用和大的比表面积使得这些纳米粒可以应用更直接和强效的外部刺激,如机械力、热、电场(相比微流控)用于细胞质转染。同时,将细胞与纳米粒的交互界面降低到如此小的一个尺度,生物扰动水平降低,细胞活性得以保留,因此更适用于转染敏感型细胞如原代免疫细胞。由于这些特征,各种高比表面积的纳米结构(不同的大小、形状、材料,配合电场和磁场)已经被用于电生理学记录,调节细胞核形态,细胞内取样。类似于其他的物理转染方式,高比表面积的纳米结构可以用于递送不同种类的货物,例如聚核苷酸,蛋白,量子点。10年之前,Park实验组首次提出使用垂直排列的硅纳米线可以将生物药物转导入细胞。纳米线表面包覆核酸和多肽,将免疫细胞培养在表面修饰的纳米线上。这种技术可以成功转染多种免疫细胞,如DCs,B细胞,T细胞,巨噬细胞和NK细胞。纳米结构转染细胞最大的优势在于生物干扰最小,给药后细胞仍能维持非常高的细胞活性(>90%)。纳米结构可以通过几种不同的机制实现货物的细胞内递送,包括直接渗入,局部增强的内吞,外部机械力的加持下的机械穿孔。最近10多年的研究发现,纳米结构的直接渗透是一个低频率的事件,纳米结构-纳米电穿孔的耦合是最常报道的免疫细胞转染方式。最近一项纳米电穿孔技术使用中空纳米管产生高度局部化的电场,形成瞬时的膜孔,将带电荷的货物直接注射进入目标细胞(Figure c)。通过调节试剂的浓度,电脉冲持续时间和电压可以精确控制剂量。不像大面积的电穿孔和微流控电穿孔,纳米-电穿孔所用的电压在量级上更小,从而最小化电流造成的生物学扰动。除了使用电场,Xu等研发了一种基于Au/Ni/Si的磁性纳米枪,可以在磁场的作用下精确地被引入靶细胞,实现高通量的货物递送。相比于传统的非病毒细胞内递送方式,磁性纳米枪展现了更高的无差别的细胞活性(>90%)和转染效率(>80%)。许多选择自体CAR-T治疗的肿瘤病人,通常已经处于肿瘤的晚期,可能没有足量的细胞用于转染。因此纳米结构可以最大限度保留CAR-T细胞的生物学特性,在此方面的应用有很大的价值。然而,高比表面积的纳米结构的转染方法仍然受限于复杂的生产工艺和通量的限制。纳米结构的构造和表征通常涉及多个步骤,如光刻和等离子/化学蚀刻,需要专门的培训和昂贵的设备。最近,Cao等通过利用聚碳酸酯膜和电场实现了非毒性的纳米-电穿孔,有希望成为一种更便宜和简便的纳米-电穿孔技术用于CAR-T细胞改造。大部分使用纳米结构实现细胞内递送的文献没有报道转染通量。Chang等报道使用3D纳米通道电穿孔芯片转染黏附的心肌细胞和纤维细胞,通量为每平方厘米40000个细胞,这个通量是低于其他的转染方法的。CAR-T疗法的更广泛应用,需要这些技术可以进入临床试验,这将会要求转染方法有更高的通量和最小的细胞扰动。文献来源:Kumar, A. R. K., Shou, Y., Chan, B., K., , Tay, A., Materials for Improving Immune Cell Transfection. Adv. Mater. 2021, 33, 2007421. https://doi.org/10.1002/adma.202007421
参数原理
2022.03.04
促进CAR-T转染的材料——病毒转染和电穿孔
一、病毒载体转染病毒转染是目前应用最广泛的转染技术之一。慢病毒和逆转录病毒由于他们相对良好的转染能力和可用性在实验室和临床中广泛应用。据报道,大约94%的临床级别的T细胞生产使用病毒载体(54%使用慢病毒,41%使用逆转录病毒)。根据它们的作用机制,病毒载体可以分为膜融合(单纯疱疹病毒),受体介导的胞吞作用(脊髓灰质炎病毒),直接注射感染免疫细胞(趋向性)。病毒载体可以高效地将转基因整合进入宿主基因组,实现长期的CAR转基因表达。相比其他的转染方式,生产病毒载体是昂贵的和困难的。同时,从生物学和工程学角度看,病毒转染也阻碍CAR-T疗法成为可负担的和安全的治疗方式。第一个生物学障碍是随机的转基因插入。当插入发生在转录活跃的基因或原癌基因启动子附近时,就有诱导癌症的风险。腺相关病毒(AAVs)虽然不会随意的插入到基因组中,但也有致癌的风险。第二个障碍是使用病毒载体产生毒性。病毒载体可以增强宿主细胞的免疫原性反应。据报道病毒转染会导致原代干细胞的炎症反应、代谢、细胞周期相关的基因表达发生显著改变。转染方法可能会显著影响细胞因子的产生,免疫反应相关基因的表达,表明转染方法和过度活跃的CAR-T细胞之间的潜在相关性。第三个障碍是病毒转染导致的低细胞活性。相比其他转染方式,病毒转染的细胞内钙水平显著增加,表明细胞应激水平的增加。从工程角度看,病毒载体难以递送大分子量的核酸,也难以同时递送不同的货物。CAR随着共刺激结构域和分子开关的加入(改善它们的功能性、持久性和安全性),变得更大更复杂,而大部分病毒载体的载荷上限是7-15kbp。最新的基因编辑技术如CRISPR需要不同组分(gRNA,Cas9 mRNA/蛋白)的同时递送,而大部分的病毒载体一次只能递送一种聚核苷酸。但使用不同的病毒载体又给生产、给药造成了很大的困难(药物在细胞内适时的协同释放)。同时,相比物理转染和纳米材料,病毒转染的GMP生产更复杂。此外,昂贵的病毒载体制造成本限制了对不同患者来源的细胞进行转染能力的高通量筛选和优化。二、电穿孔转染电穿孔技术使用高压(10-几百伏特)在细胞膜上瞬时穿孔,此时货物通过概率和被动扩散从细胞外液进入胞浆中。目前商业化的转染设备有预设的程序,但是没有电流参数的信息(如电场强度、频率、波形),这使得通过单细胞RNA测序快速获得的新型细胞类型的转染优化颇具挑战。相比病毒载体,电穿孔可以同时用于聚核苷酸和蛋白的转染。但是当货物分子过大时,它们将无法通过膜孔扩散。另外,带电荷的货物可以通过电泳力进入细胞。电穿孔技术已经用于递送DNA和mRNA实现CAR蛋白的瞬时表达。特定细胞标记的细胞分选可以通过流式细胞仪观测,使用荧光信号进行筛选。分离转染的细胞可以检测是否转染的基因在一段时间内是稳定的,下游使用成功转染的细胞可以获得更高的抗肿瘤效果。同时电穿孔可以同时递送不同类型的货物,因此兼容现行的基因编辑技术。据报道外源的纳米粒或生化制剂难以转染原代免疫细胞如DCs,但电穿孔技术可以成功地将mRNA递送入小鼠DCs。然而,电穿孔技术导致的恶劣条件可能会影响细胞的生物学功能。据报道电穿孔转染显著增加了细胞的应激水平,延迟了原代免疫细胞的扩增时间,诱导异常的细胞因子水平和基因表达。相比病毒转染,电穿孔的转染效率较低,由于DNA整合进入宿主细胞基因组的概率更小,CAR的表达会随着时间而降低。对此,电穿孔转染需要更高的给药浓度,这进而导致细胞毒性的增加。电穿孔导致的生物学扰动可能来源于应用强力的、非同源电场造成的焦耳热和低细胞活性。同时在电穿孔过程中电场的变化会导致不同膜孔的形成,这些膜孔的开放时间窗不同,从而导致一个细胞群的转基因表达不同。为了保持细胞在电穿孔过程中的活性,一些公司在电转染装置中引入孔径在几厘米到几毫米之间的微流控芯片(如4D核转染比色皿),从而可以降低所需的电压和产生的焦耳热。
参数原理
2022.03.04
用于CAR-T转染的材料——前言
a. CAR-T疗法相关出版物的数量以指数增长嵌合抗原受体T细胞(CAR-T)疗法使用基因工程改造的T细胞识别和结合肿瘤相关抗原,如CD19和表皮生长因子受体(EGFR),释放细胞毒性颗粒和效应细胞因子杀伤肿瘤细胞。CAR-T疗法在表达CD19的B细胞恶性白血病上取得了巨大的成功,5种产品(来自诺华的Kymriah,凯特和吉利德的Yescarta和Tecartus,百时美施贵宝的Breyanzi和Abecma)已经被FDA批准用于临床。目前,ClinicalTrials.gov网站上至少有500项临床试验是关于基因工程改造的免疫细胞用于癌症的治疗。尽管在B淋巴细胞白血病方面取得了巨大进展,CAR-T疗法在大生产、安全性和经济可负担方面仍然面临巨大的挑战。技术困难之一是胞内递送寡核苷酸和蛋白等生物分子进入细胞核,转染敏感的原代T细胞。FDA批准的金标准是使用病毒载体和电穿孔,但这些方法转染效率低,可能会干扰细胞增殖、代谢和基因表达。新型的技术,如微流控技术、纳米粒、高比表面积的纳米结构可以克服这些挑战,并且可以提供通用的和高通量的递送策略。这篇文章讨论了传统和新型的用于免疫细胞转染材料的优缺点,和商业化发展。为了增强转染技术的表征和临床应用,一系列体内外实验和相关的操作方法被推荐。本文旨在促进发展新型材料用于临床CAR-T细胞的大生产。b. CAR-T疗法的大生产过程嵌合抗原受体免疫细胞的转染和大生产CAR-T细胞生产流程:第一步:白细胞分离,将白细胞和其他血细胞分开。第二步,T细胞分离,将具有特定生物标志物的T细胞亚群,如CD4+(辅助T细胞),CD8+(细胞毒T细胞),CD25+(调节T细胞)从外周血单核细胞(PBMCs)中分离出来。第三步,T细胞激活,使用细胞因子IL-2刺激,并使用包被了CD3/CD28抗体的磁珠(磁珠在此处充当人工合成的抗原提呈细胞)激活T细胞。第四步,基因编辑,使用病毒,电穿孔或新型的技术,如微流控技术、纳米粒、高比表面积的纳米结构转染细胞。第五步,T细胞扩增,在生物反应器中培养被转染的细胞2-3周获得107-9个细胞。第六步,T细胞冷冻。第七步,注射给药。除了CAR-T细胞,过继性免疫细胞疗法如,树突状细胞(DCs),巨噬细胞和自然杀伤细胞(NK)在临床也取得了进展。其中一种方式是使用肿瘤浸润淋巴细胞(TILs)。通常癌症病人体内的肿瘤反应性免疫细胞数量不足,TIL疗法从癌症病人体内分离肿瘤反应性免疫细胞,体外扩增,再回输到患者体内,增强抗肿瘤免疫活性。之前的研究使用TILs配合标准的淋巴消耗调理和细胞因子治疗在免疫抑制环境最小的患者中取得了较好的临床效果。但TIL疗法对黑色素瘤之外的肿瘤疗效有限,并且会造成脱靶效应(正常细胞也表达相应的抗原)。此外,增强的细胞因子风暴和肿瘤的免疫抑制环境也制约着TIL在临床中的应用。NK细胞由于其固有的抗肿瘤免疫活性而成为基于细胞的癌症免疫治疗的一个有吸引力的选择。NK细胞的过继性转移可以不依赖主要组织相容性复合体(MHC)提呈和肿瘤抗原限制而作用于肿瘤细胞。FDA批准NK-92细胞进行临床试验,促进了对NK细胞体外扩增的临床效益的测验。虽然基于NK细胞疗法的临床前试验和I期临床试验被认为更安全(副作用最小,免疫排斥更少),但它们的临床效果和更短的细胞寿命致使广泛的临床应用受到质疑。CAR-NK细胞能改善NK细胞的持久性和在体内的抗肿瘤活性和功能。另外,NK细胞可以产生多种细胞因子,如白介素(IL)-3,干扰素-γ(IFN-γ),粒细胞-巨噬细胞集落刺激因子,这些细胞因子的毒性更低,同时诱导细胞因子风暴的几率也更低。一项针对复发或难治性的非霍奇金淋巴瘤和慢性淋巴细胞白血病的I/II期临床试验显示,表达抗CD-19的CAR-NKs能够在64%的患者体内诱导完全的免疫反应。然而,难以体内扩增,长期监测的免疫记忆的可编程性,NK细胞的持久性和在实体瘤内的浸润,仍制约着CAR-NK疗法的发展。抗原提呈细胞如DCs和巨噬细胞在改造T细胞成为抗原特异性T细胞的过程中至关重要。DC细胞疗法使用肿瘤特异性抗原离体激活DCs细胞,进而激活T细胞杀伤特定的肿瘤。使用离体工程化的DCs辅以细胞因子疗法可以适时地激发免疫反应移除肿瘤。同时研究发现CAR-DCs和CAR-T的联合使用相比单一疗法可以增强T细胞的细胞毒性,增加细胞因子的表达水平。通过腺病毒转染产生的嵌合抗原受体-巨噬细胞可以诱导抗原特异性的吞噬作用,趋化因子和细胞因子的分泌,促进移植瘤小鼠中肿瘤的消除。Batu Biologics和Carisma Therapeutics分别研发了CAR-DCs和CAR-巨噬细胞。转染表现很大程度上取决于转运货物跨过细胞膜和进入细胞内目标位点的效果。转染过程可以分为4步。第一步是准备用于递送的药物,如寡核苷酸和蛋白。药物的准备方法根据转染方法的不同而不同。基于病毒载体的转染使用病毒包衣包裹核酸,基于纳米粒子和聚合物应用带正电荷的包衣/载体促进与带负电荷的细胞膜之间的相互作用。物理学方法如微流控技术,电穿孔不需要任何特别的准备,此时裸露的药物自由地悬浮在溶液中。第二步是药物的跨膜转运。病毒载体基于病毒感染的机制使用直接注射或膜融合递送药物入胞。纳米粒介导的转染通过药物与细胞膜之间的静电结合或共价结合促进药物的内吞。在磁转染中,外部磁场促进药物的入胞。物理转染方法包括电穿孔和纳米结构通过控制电流和磁力在细胞膜上暂时开孔以递送药物。第三步是药物在细胞内的释放。聚合物和纳米粒子可以设计含有刺激敏感的化学键,在暴露于酸性的溶酶体环境,或外部磁场,光线,超声的激发下,药物响应释放。其他的作用机制,如基因组或线粒体整合需要药物运送到不同的细胞器区域。但mRNA和siRNA可以忽略这一步骤,它们在细胞内释放后,在细胞质中就可以发挥作用。文献来源:Kumar, A. R. K., Shou, Y., Chan, B., K., , Tay, A., Materials for Improving Immune Cell Transfection. Adv. Mater. 2021, 33, 2007421. https://doi.org/10.1002/adma.202007421
参数原理
2022.02.16
喜报丨迈安纳入围2021年Q4科学仪器优秀新品
“科学仪器优秀新品”评选活动2021年度第四季度入围奖评审已经结束,经专业编辑团初审、网络评审团初评,2021年度第四季度的入围奖名单现已确定。迈安纳(上海)仪器科技有限公司自主研发生产的纳米药物生产系统:INano™ L榜上有名。快速纳米药物制备系统INano™L图片节选自仪器信息网此处应有掌声仪器信息网自2006年发起“科学仪器优秀新品”评选活动。截至2020年度,“科学仪器优秀新品”评选活动已经成功举办了15届。每年评选出的年度“优秀新品奖”受到越来越多的仪器用户、国内外仪器厂商以及相关媒体的关注和重视。经过10余年的打造,该奖项已经成为国内外科学仪器行业最权威的奖项之一,获奖名单被多个政府部门采信。
企业动态
2022.02.10
年度钜惠丨迈安纳芯片新春感恩活动
新品
2022.01.19
新型环状mRNA瘤内递送用于免疫调节和癌症治疗
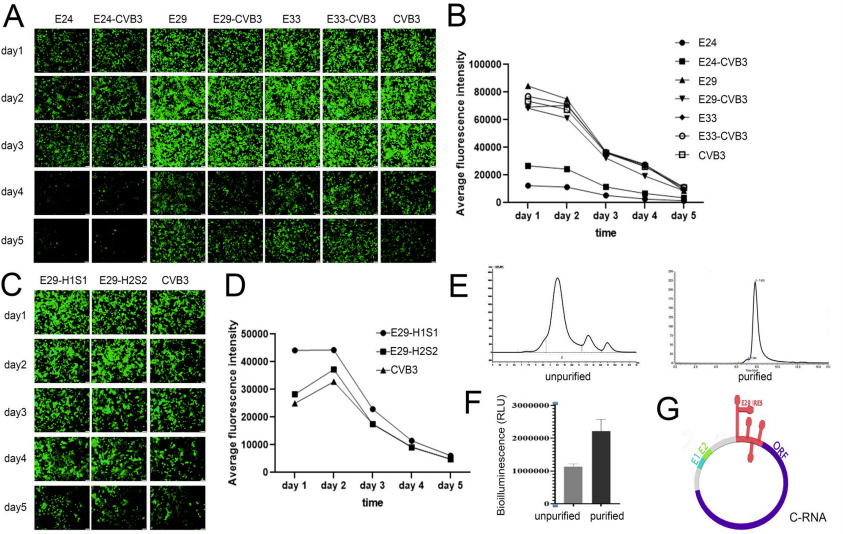
原文地址:https://doi.org/10.1101/2021.11.01.466725近来,一些聚焦于环状mRNA的研究,证明其在体外可以产生强效和持久的蛋白表达。尽管大部分真核生物中的环状mRNA被认为是非编码RNA,但一些环状mRNA被认为可以编码和表达蛋白。这些环状mRNA在体内大多是通过索尾插接的机制形成。经过几十年的发展,环状mRNA可以在体外通过不同的方式合成,包括T4连接酶催化的连接,化学策略用于5’和3’端的交联,核酶策略用于分子内共价键的形成和环状mRNA的产生。1992年,M.Puttaraju和Michael D.Been报道,基于鱼腥藻I组内含子,他们发明了I组内含子-外显子置换系统(PIE)以实现核酶催化的体外自主剪切,并可以形成一个外显子-外显子共价连接的环状RNA。在这种情况下,外源核苷酸序列插入外显子和内含子位点之间,产生包含外源RNA片段的环状RNA。基于此PIE系统,R. Alexander Wesselhoeft等人做出了一系列优化,增加同源臂和间隔序列产生更大的环状RNA,增加内部核糖体进入位点(IRES)增加蛋白翻译效率。他们筛选了不同病毒来源的IRES元素,发现IRES CVB3是一种高效的cap非依赖的翻译元件。更重要地,他们发现这种类型的CVB3 IRES驱动的环状mRNA相比线型mRNA可以有更强效和持久的蛋白表达。他们进一步发现环状mRNA经过HPLC纯化后,免疫原性非常低,表明纯化的环状mRNA可能适合体内应用。然而,还需更多的研究证明环状mRNA适合临床应用。本研究中,我们基于Echovirus 29来源的IRES,同源臂,和间隔RNA构建了一种新型的环状mRNA,C-RNA。我们首次证明,编码一系列细胞因子的环状mRNA能够直接用于瘤内给药,调节瘤内的和系统性的抗肿瘤免疫反应,增强抗PD-1抗体的免疫效应,最终实现肿瘤的消除。1. C-RNA的构建和确认本研究中,包含了T7启动子,PIE系统,IRES和新型RNA间隔序列的载体用于环状mRNA的合成。Fig.1A和1B表明,IRES E24, E29, E33诱导中等或强效的的EGFP表达。基于E29的C-mRNA在HEK-293T细胞中介导的蛋白表达可以持续11天以上。如Fig.1G所示,本研究中C-mRNA由E29 IRES,蛋白编码区域,间隔序列和Exon2-Exon1接合区域组成。此外,我们发现HPLC纯化后的C-mRNA相比未纯化的,在A549细胞中有更高的蛋白表达(Fig.1E和Fig.1F)。这个结果表明对于C-mRNA,HPLC纯化不论是对去除免疫原性还是促进蛋白表达都是至关重要的。Fig.1 C-RNA的构建和确认2. C-RNA指导体内外蛋白表达接下来,本研究证明了C-RNA可以指导几种不同的蛋白的表达。如图Fig.2A所示,在肌肉注射6h,24h之后,小鼠肝脏和注射部位都保持高水平的荧光素酶活性,表明C-RNA主要靶向于肝脏,并且介导高水平的蛋白表达。荧光素酶的表达可以在注射部位持续9天以上,表明C-RNA可以介导持续性的蛋白表达。此外,我们还研究了C-RNA介导分泌蛋白和跨膜蛋白的表达能力。Fig.2B显示RNA转染24h之后,两种跨膜细胞因子IL-15 CD8α和IL-15 GPI在细胞膜上显著表达。Fig.2C显示SARS-Cov2的受体结合区(RBD)C-RNA转染293T细胞24h后,在细胞培养上清液中检测到高水平的分泌型重组RBD三聚物蛋白。同时,我们用脂质纳米粒(LNP)包裹的RBD C-RNA转染小鼠,在小鼠血清中检测到高水平的RBD三聚物蛋白。总之,C-RNA能指导胞内蛋白、分泌型蛋白和跨膜蛋白的体内外表达。Fig.2 C-RNA指导体内外蛋白表达3. 瘤内注射C-RNA实现在肿瘤组织中的特异性表达2017年,Yanping Kong等人报道肿瘤细胞可能通过过度激活的内吞途径,摄取大小在57-1620bp的DNA。基于此,我们推测环状mRNA可能也可以通过同样的机制被肿瘤细胞摄取。Fig.3A显示,C-RNA瘤内注射6h后观察到明显的生物荧光,而其他注射方式,皮下注射,皮内注射,肌肉注射,腹腔内注射和静脉注射则没有荧光。Yanping Kong等报道这种对裸露DNA的摄取与肿瘤细胞的类型有关。Fig.3B显示C-RNA在A549,NCI-H358,MC38移植瘤模型中均能有效表达,表明其在多种肿瘤中表达的潜能。Fig.3 瘤内注射C-RNA实现在肿瘤组织中的特异性表达4. 瘤内注射C-RNA实现高效持久的蛋白表达Fig.4A显示C-RNA相比线型mRNA在293T细胞中可以介导更高水平和持久的蛋白表达。之后我们比较了两者在体内的表达差异,Fig.4B和4C显示在注射4,24,48,72,96h后,C-RNA组比线型RNA组有更强的荧光活性,并且荧光的消减更缓慢。Fig.4 瘤内注射C-RNA实现高效持久的蛋白表达5. 优化C-mRNA处方促进瘤内递送和蛋白表达2007年J Probst报道通过皮肤注射时,Ca2+影响裸露线型mRNA的胞内递送。本研究我们使用不同的组分作为C-RNA的溶剂,包括0.9%NaCl,PBS,1X TE缓冲液,林格氏液,其中林格氏液展现了最强的荧光素酶表达(Fig.5A)。林格氏液中含有CaCl2, NaCl, KCl and NaHCO3, 我们分别移除一种成分,观察对蛋白表达的影响。结果显示CaCl2,KCl对C-RNA的胞内递送影响最大。Fig.5优化C-mRNA处方促进瘤内递送和蛋白表达6. 编码细胞因子的C-RNA促进抗PD-1抗体介导的肿瘤抑制细胞因子对于肿瘤微环境的调节至关重要。本研究中我们分别制备了编码IL-15,IL-12,GM-CSF,IFN-α2b的C-RNA。Fig.6B显示转染293T细胞24h后,这些细胞因子的表达水平较高。之后,每个转染组的上清液被收集并转移到外周单核细胞(PMBC)的培养液中用于评估分泌的细胞因子的活性。如Fig.6C所示,细胞因子组合可以显著上调PMBC中CD69阳性的CD4+,CD8+ T细胞的比例。接下来,编码多种细胞因子的C-RNA混合物使用林格氏液作为溶剂,比较它们对B16F10移植瘤小鼠的作用。Fig.7A和7B显示联合治疗组(细胞因子组合+抗PD-1抗体)对肿瘤生长抑制效果显著,延长了小鼠生存时间。同时,我们在MC-38移植瘤小鼠模型中再次验证细胞因子组合和抗PD-1抗体的协同效应有效抑制了肿瘤生长,改善了最终生存率,3/8的完全响应率(Fig.7C和7D)。Fig.6编码细胞因子的C-RNA促进抗PD-1抗体介导的肿瘤抑制-1Fig.6编码细胞因子的C-RNA促进抗PD-1抗体介导的肿瘤抑制-27. 编码细胞因子的C-RNA通过T细胞浸润和激活以抑制肿瘤生长我们按照Fig.8A图示进行两种方法的联合治疗,使用流式细胞仪分析肿瘤浸润性T细胞。Fig.8B显示联合治疗显著增加了CD45+T细胞比例,表明C-RNA协同抗PD-1抗体促进了整体白细胞的肿瘤浸润。Fig.8C显示抗PD-1抗体仅实现0.6%的浸润型T细胞,而联合治疗组达到6%的肿瘤浸润。Fig.8D显示细胞因子组合,或细胞因子组合+抗PD-1抗体组的CD69+ T细胞占总CD4 T细胞的比例高达80%,而抗PD-1抗体单一疗法组的比例为60%。总之,联合治疗不仅导致更多的免疫细胞,尤其是T细胞募集到肿瘤部位,并且T细胞的激活程度更高,从而产生更强效的抗肿瘤效应。Fig.8 编码细胞因子的C-RNA通过T细胞浸润和激活以抑制肿瘤生长8. 总结本研究构造了一种新型的环状mRNA,可以实现E29驱动下的蛋白的高效表达。这种环状mRNA相比线性mRNA更稳定,可以介导更高效、更持久的蛋白表达。HPLC纯化的C-RNA在免疫原性细胞中的表达增加,可能是由于具有免疫原性的5’-ppp内含子片段的移除,表明C-RNA作为一种治疗策略体内应用的安全性。进而,多种蛋白,包括胞内蛋白,跨膜蛋白,分泌型蛋白的成功表达,表明C-RNA可以作为一种通用型的表达载体。相比线性mRNA,C-RNA瘤内注射后可以实现更高效和持久的蛋白表达。瘤内注射编码四种细胞因子的C-RNA的组合,显著激活了肿瘤浸润型T细胞,协同免疫疗法抑制了肿瘤生长。C-RNA由于其制备简单,有效的蛋白表达有望成为mRNA疫苗或其他疗法的一种有效平台。
参数原理
2022.01.13
精彩回顾丨迈安纳参加第四届新型疫苗研发与产业化论坛
大会背景:VacCon2022第四届新型疫苗研发与产业化论坛于1月7日至8日在成都富力丽思卡尔顿酒店顺利召开。60余位疫苗/中和抗体/小分子新冠药物领域政府监管机构专家、科研专家科学家及领军企业负责人,600+位专业听众汇聚一堂,共论行业政策新趋势,探索新型疫苗未来新方向。精彩回顾:迈安纳应用科学家李菁在核酸疫苗专场演讲作为本届论坛的嘉宾,迈安纳(上海)仪器科技有限公司应用科学家李菁做了专题报告:《助力核酸疫苗从实验室走向产业化**实践》。报告中分别从mRNA疫苗发展,mRNA递送系统等方面进行了分析汇报。LNP是目前核酸递送应用最广泛的制剂。迈安纳所开发的INano核酸疫苗包裹制备平台可以实现mRNA—LNP疫苗从实验室的处方筛选到中试验证,和大规模的cGMP生产(可达120L/hr)。迈安纳主研的微流控技术不仅用于包裹mRNA,也用于包裹自复制RNA,环状mRNA,和基因编辑。同时,不仅可以用于制备LNP,还可用于脂质体,聚合物纳米粒,LPP等的制备。产品制剂的稳定性,均一性,批次的一致性都得到有效保障。迈安纳核心技术不仅仅在于仪器平台的建立,更重要的是对于工艺的理解,即“Know how and Process Secret”。迈安纳的展位前气氛热烈,新老客户相继莅临,咨询交流的专家学者络绎不绝。迈安纳将不负众望,秉承专利化的技术,精密的工艺,为客户提供高质量服务和有力支持!关注迈安纳,了解更多资讯↑↑↑
企业动态
2022.01.13
多种疫苗对新冠病毒Lambda变异株的免疫有效性考察,斯微生物的疫苗表现较为良好
本文节选自中国食品药品检定研究院的研究人员发表的文章《Reduced sensitivity of the SARS-CoV-2 Lambda variant to monoclonal antibodies and neutralizing antibodies induced by infection and vaccination》,由于水平有限,详细内容,请参考原文。COVID-19的大流行,在First报道之后短短几个月时间内,短时间就造成了前所未有的全球性公共健康危机。多种治疗策略已经用于COVID-19,如抗病毒疗法、抗传染治疗、抗促炎细胞因子疗法,被动免疫,单克隆抗体等。其中最有效的方法仍然是安全有效的疫苗途径。Spike蛋白是COVID-19病毒包膜上主要的受体结合蛋白,新冠病人超过90%的中和性抗体靶向Spike蛋白的受体结合区RBD。SARS-CoV-2 Lambda变异,首先在秘鲁被发现,截至2021年9月22日已经在42个国家被检测到。此变异株除S蛋白D614G骨架外,产生的突变位点包括G75V, T761, Del246-252, D253N, L452Q, F490S和T859N。其中Del246-252是位于N端结构域的特有突变。L452Q和F490S是位于抗体识别区域的抗原突变位点。L452R突变被报道增强了病毒的感染能力、融合性,和复制能力。F490L突变导致病毒对某些中和抗体产生耐药性,F490S突变可能会影响现存疫苗的有效性。图1:SARS-CoV-2-Lambda变异株的Spike蛋白结构细胞感染性实验显示相比D614G突变株,Lambda变异株显著增强(P图2:Lambda变异株的感染性分析单克隆抗体中和实验显示,12种单克隆抗体中5种抗体对Lambda变异株的中和保护效应降低或消失。其中,mAb 9G11的保护效应下降了41.7倍,mAb AM180的保护效应几乎消失下降了243倍,mAbs R126, X593和AbG3分别降低了7.7倍、129.2倍、16.9倍。抗体中和效应的降低主要归因于L452Q和F490S的突变。图3:中和抗体用于Lambda变异株的抗原性分析 康复期患者血清的中和实验显示,14份不同患者来源的血清对Lambda的中和能力与D614G相比略有下降(1.3倍)没有显著差异(P图4:康复期患者血清用于Lambda变异株的抗原性分析进一步,疫苗免疫血清对Lambda变异株的中和保护效应被检测。疫苗来源为:mRNA疫苗(斯微生物,艾博生物),灭活疫苗,Ad5腺病毒载体疫苗。mRNA疫苗结果显示:针对Lambda的变异株,斯微、艾博的免疫效应分别降低1.5倍、2倍;针对RBD区域的L452Q和F490S突变假病毒,斯微、艾博的疫苗免疫效应分别降低1.5倍和1.6倍、3.2倍和3.5倍;针对L452Q+F490S联合氨基酸突变假病毒,斯微、艾博的免疫效应分别降低1.9倍、3.8倍。针对G75V突变位点,斯微的疫苗免疫效应增强了1.5倍;针对T761突变位点,艾博的疫苗免疫效应增强了1.5倍。灭活疫苗、腺病毒载体疫苗对Lambda变异株的中和能力分别下降了2倍、2.5倍。图5:疫苗免疫血清用于Lambda变异株的抗原性分析最近,2种假病毒相关的研究显示BNT162b2疫苗对Lambda的中和能力分别下降了3.0倍和1.5倍,mRNA-1273疫苗下降了2.3倍。来自中国的疫苗与BioNTech和Moderna的疫苗对Lambda变异株有相当水平的保护力度,而其中斯微生物的疫苗表现较为良好。同时,虽然疫苗免疫的血清对Lambda变异毒株中和能力有所下降,但抗体滴度仍然较高,因此Lambda变异病毒对现行疫苗的免疫效力没有显著的影响。原文链接:https://doi.org/10.1080/22221751.2021.2008775
企业动态
2022.01.05
迈安纳荣获2021中国生物医药供应链最佳品牌服务商
2021年10月11-12日,2021上海(闵行)生物医药产业创新峰会在上海虹桥祥源希尔顿酒店召开,此次会议汇集多位生物药企高层、工程师和研究人员及逾千位的业内同仁共同探讨生物医药的生产工艺与发展。精彩瞬间2021星耀榜颁奖典礼本次会议揭晓了由”医麦客-星耀研究院“联合行业专家评选的2021第三届星耀榜获奖企业名单,迈安纳被评选为“2021中国生物医药供应链最佳品牌服务商”,迈安纳商务总监曹琦受邀出席颁奖仪式。论坛主持10月12日第三届全球生物药cdmo高峰发展论坛上,迈安纳创始人吴刚受邀主持核酸药物生产工艺与质量分析的研讨会。嘉宾们精彩的演讲掀起了浓郁的学术交流氛围,讨论和提问环节主持人调动嘉宾积极交流提问,整场研讨会掌声不断,精彩非凡。展台现场掠影左右滑动查看更多关于迈安纳迈安纳(上海)仪器科技有限公司是一家专注于解决微纳米药物递送行业痛点的整体解决方案提供商,已申请多项发明专利。公司朝气蓬勃,目标远大,并且拥有强大的技术团队,包含芯片设计制造,机械自动化,软件,流体力学专家,应用专家,工程团队,以及gmp法规专家和覆盖全国的销售体系和售后团队。公司主要创始人均在制药行业拥有将近二十年的从业或服务经验。上海迈安纳inano系列纳米药物制备平台我们在上海设有总部和研发中心,并且在苏州建有小型生产基地和应用实验室。目前我们可以提供纳米载药和微球载药的整体解决方案,提供从实验室到商业化生产的整体解决方案。目前,迈安纳已服务于上百家生物制药公司以及学术机构,并已成功助力多个客户药物进入临床阶段。
企业动态
2021.10.14
重磅!迈安纳高质量重大项目落地上海闵行
10月11日,迈安纳于2021上海(闵行)生物医药产业创新峰会上完成重大项目签约仪式。迈安纳拟在上海莘庄工业区投资数千万元,建设国内首家高标准的集核酸药物装备研发制造和核酸递送工艺开发一体的创新中心。项目背景在10月11日开幕的2021上海国际生物医药产业周系列活动“2021上海(闵行)生物医药产业创新峰会”上,最新揭牌的“南虹桥智慧医疗创新试验区”和“浦江基因未来谷”分别布局闵行一北一南,吸引总投资超过20亿元的10个重大项目现场签约。今年1-8月,闵行区规上生物医药工业企业工业总产值190亿元,同比增长26.6%,是战略性新兴产业工业总产值增速的两倍。继今年先声药业、康方生物、正大天晴、迈安纳、华大基因等近30个高质量重大项目落地闵行后,会上又集中签约了因美纳、安睿迈博、贝壳社等10个有影响力的生物医药重大项目,总投资超20亿元。据悉,到2023年,闵行力争实现生物医药制造业年度工业总产值350亿元,生物医药产业营收规模超过550亿元,上市企业6-8家。迈安纳项目落地迈安纳(上海)仪器科技有限公司作为中国本土独一家专注于提供核酸药物行业递送工艺和装备的整体解决方案的高科技公司,突破了国外卡脖子技术,目前已经服务国内外近百家核酸药物企业和科研院所,并成功助力国产mRNA新冠疫苗进入临床以及产业化。为了更好的赋能核酸药物行业以及践行“In china,for Global”的理念,迈安纳科技拟在上海莘庄工业区投资数千万元,建设国内首家高标准的集核酸药物装备研发制造和核酸递送工艺开发一体的创新中心。整个项目I期占地面积近2000平米,项目落成后将具备GMP级递送工艺开发实验室和十万级无尘核心组件装配区,同时将引进一批高层次科技创新人员,预计该项目未来三年产值超数亿元,同时将有力提升上海在核酸药物行业的的影响力和巩固领头羊地位。关于迈安纳迈安纳(上海)仪器科技有限公司是一家专注于解决微纳米药物递送行业痛点的整体解决方案提供商,已申请多项发明专利。公司朝气蓬勃,目标远大,并且拥有强大的技术团队,包含芯片设计制造,机械自动化,软件,流体力学专家,应用专家,工程团队,以及GMP法规专家和覆盖全国的销售体系和售后团队。公司主要创始人均在制药行业拥有将近二十年的从业或服务经验。我们在上海设有总部和研发中心,并且在苏州建有小型生产基地和应用实验室。目前我们可以提供纳米载药和微球载药的整体解决方案,提供从实验室到商业化生产的整体解决方案。目前,迈安纳已服务于上百家大型生物制药公司以及学术机构,并已成功助力多个客户药物进入临床阶段。INano™平台INano™平台优势:丰富的核酸药物工艺实战经验,已为国内数百家用户提供服务(已有成功申报临床案例),涉及递送载体类型包括但不限于LNP, 聚合物,多肽,脂质体,PLGA等我们独有的CIM旋转流技术,可以在真正意义上以最小的风险和物料成本线性放大至工业级根据您独特的递送载体特性量体裁衣,高度定制化设备以及优化工艺流程与监管充分沟通,坚持中国制造和本土化快速服务(3Q,FAT,SAT,CRO....)
企业动态
2021.10.14
精彩回顾丨迈安纳×2021生物药工艺发展峰会BPD
10月9-11日,2021第五届生物药工艺发展峰会在浙江杭州顺利召开。此次会议,迈安纳携技术团队及高质量产品亮相展台,备受广大新老客户驻足关注与咨询。大会背景本届峰会由易贸医疗携手药明生物、杭州钱塘新区管委会主办,多宁生物、利穗科技联合主办,同时也获得了杭州医药港、浙江省药学会的大力支持。在短短的两天时间里大会为大家呈现了63篇主题发言、7场嘉宾访谈,吸引了来自生物药工艺领域各环节的参会人员。嘉宾们精彩的演讲掀起了浓郁的学术交流氛围,讨论和提问环节,参会嘉宾积极交流提问,现场坐无虚席。现场掠影工程师们在认真讲解设备原理及工艺↑特别活动10月9日下午,组委会安排了两条会前企业参观线路,分别为药明生物微生物和病毒产业化平台参观以、浙江药明生物医药有限公司参观、杭州医药港参观。
企业动态
2021.10.14
迈安纳邀您参加BPID 2021上海生物医药产业创新峰会
10月11-12日,BPID生物医药产业创新峰会将在上海虹桥祥源希尔顿酒店举行。迈安纳,提供一体化核酸纳米药物递送包裹设备及服务,我们将在D8展位期待您的莅临。大会主题:生物医药赋能闵行高质量发展大会规模:一个主论坛,四个分论坛,500人/论坛参会对象:生物创新药(抗体、核酸、细胞与基因治疗)与医疗(医疗器械、智慧医疗、AI技术)代表企业、临床前GLP与临床CRO机构、大分子药物CDMO代表企业、投资机构大会时间:2021年10月10日-11日大会地点:上海虹桥祥源希尔顿酒店(红松东路1116号)日 程 安 排10月12日A厅上,迈安纳创始人吴刚将坐镇第三届全球生物药CDMO高峰发展论坛,主持核酸药物生产工艺与质量分析的研讨会,敬请期待~第三届全球生物药CDMO高峰发展论坛DAY2 A厅 10月12日关 于 迈 安 纳迈安纳(上海)仪器科技有限公司是一家专注于解决微纳米药物递送行业痛点的整体解决方案提供商,已申请多项发明专利。公司朝气蓬勃,目标远大,并且拥有强大的成熟技术团队,包含芯片设计制造,机械自动化,软件,流体力学专家,应用专家,工程团队,以及GMP法规专家和覆盖全国的销售体系和售后团队。公司主要创始人均在制药行业拥有将近二十年的从业或服务经验。我们在上海设有总部和研发中心,并且在苏州建有小型生产基地和应用实验室。目前我们可以提供纳米载药和微球载药的整体解决方案,提供从实验室到商业化生产的整体解决方案。目前,迈安纳已服务于几十家知名生物制药公司以及学术机构,并已成功助力多个客户药物进入临床阶段。我们在D8展位期待您的莅临!现场还有精美礼品赠送哦~
企业动态
2021.10.09
展会预告丨9月28日-29日迈安纳诚邀您相约BIC2021
Announce In AdvanceBIC2021-第三届亚洲生物制药创新峰会将于9月28日-29日,在上海浦东嘉里酒店(花木路1388号)隆重召开。本次峰会聚焦于创新生物药物研发以及生产工艺,围绕创新生物技术开发平台、CMC策略、上下游创新工艺、生物制药4.0等等议题进行展开。届时迈安纳(展位号:B10)将携高质量产品及专业技术团队参加本次展会,展会现场更有精美礼品赠送,期待各位专家、老师及学者莅临交流。关于迈安纳 迈安纳(上海)仪器科技有限公司是一家专注于解决微纳米药物递送行业痛点的整体解决方案提供商,已申请多项发明专利。公司朝气蓬勃,目标远大,并且拥有强大的技术团队,包含芯片设计制造,机械自动化,软件,流体力学专家,应用专家,工程团队,以及GMP法规专家和覆盖全国的纯熟销售体系和售后团队。公司主要创始人均在制药行业拥有将近二十年的从业或服务经验。我们在上海设有总部和研发中心,并且在苏州建有小型生产基地和应用实验室。目前我们可以提供纳米载药和微球载药的整体解决方案,提供从实验室到商业化生产的整体解决方案。目前,迈安纳已服务于几十家知名生物制药公司以及学术机构,并已成功助力多个客户药物进入临床阶段。上海迈安纳INano系列纳米药物制备平台INano™平台优势:丰富的核酸药物工艺实战经验,已为国内数十家用户提供服务(已有成功申报临床案例),涉及递送载体类型包括但不限于LNP, 聚合物,多肽,脂质体,PLGA等我们独有的CIM旋转流技术,可以在真正意义上以最小的风险和物料成本线性放大至工业级根据您独特的递送载体特性量体裁衣,高度定制化设备以及优化工艺流程与监管充分沟通,坚持中国制造和本土化快速服务(3Q,FAT,SAT,CRO....)B10展台关于BIC 2021BIC2021-第三届亚洲生物制药创新峰会聚焦创新生物药物研发及生产工艺,以MAH、ICH等制度革新下的抗体偶联药物(ADC)、双抗、 CAR-T、AAV、基因与细胞治疗、iPSC干细胞疗法、溶瘤病毒疗法、创新疫苗、mRNA新冠疫苗等生物制品的开发及生产的技术回顾与展望。以创新的生物技术开发平台、政策法规的解读、亚太范围生物疗法研发进展、CMC策略、表征分析、上下游创新工艺、连续生产、 一次性工艺技术、生物制药智能化生产、大规模商业化生产以及生物制药4.0的实现等为主要议题。本次会议主办单位:触界生物 支持单位:南通开发区生物医药产业园、上海市生物医药行业协会日程安排·THE END·我们在B10展位等您!!
企业动态
2021.09.26