搜全站
搜展位
阴离子脂质纳米粒优先将mRNA递送至肝网状内皮系统
摘要
脂质纳米粒(LNPs)是体内递送外源RNA至靶细胞的先进非病毒载体技术。系统递送平台技术,如Onpattro,通过静脉给药靶向至肝实质细胞。然而,系统给药递送RNA至肝细胞以外的细胞组织挑战巨大。本文基于广泛的纳米粒体内分布和清除机制的理解,合理设计了一种基于LNP的mRNA递送系统,可以优先靶向至肝网状内皮系统(RES)。胚胎斑马鱼,小鼠给药实验证明该递送系统可以显著增加在肝脏,特别是肝RES细胞中mRNA的表达。该肝RES靶向递送系统仅需要改变Onpattro处方中的单一脂质,将LNP表面电荷从中性转换至负电荷。这项技术不仅为治疗RES细胞类型起关键作用的肝脏特异性和系统性疾病提供了新的机会,也证明先进的RNA疗法的合理设计必须以所涉及的主要纳米生物相互作用的充分理解为前提。
1、介绍
LNPs的肝细胞靶向是通过吸收可溶性的载脂蛋白E(apoE)在血液循环中的LNP的表面,apoE进而促进LNP与肝细胞窦状表面高表达的低密度脂蛋白受体(LDLr)结合。ApoE-LDLr的结合导致LNP内吞和进一步的RNA细胞内递送。RNA在细胞内的释放通过可电离阳离子脂质在内涵体中的质子化和后续的内涵体膜破裂而增强。
除肝细胞(大约占肝脏总体积的80%)外,肝脏由非实质肝细胞,包括Kupffer细胞(KCs)和肝窦内皮细胞(LSECs)组成。连接肝动脉、门静脉和中央静脉的肝血管或肝窦,主要由LSECs(约70%)和KCs(20%)组成。这两类细胞共同组成了肝RES,其主要作用是通过清除血液中的大分子废物和病原体来维持血液稳态。特别是LSECs,它是一种特化的清除性内皮细胞(SECs),是人体内具有最高内吞活性的细胞。
这些细胞负责清除内源性大分子,如氧化低密度脂蛋白和透明质酸,以及血液传播的病原体。
在很大程度上,LSEC对大分子废物和病原体的清除是通过一系列在LSEC管腔膜上表达的清除受体(如透明质酸和稳定素受体)介导的。
作为治疗靶点,LSECs在肝脏稳态、急性损伤后的再生以及各种肝脏疾病,如肝硬化和肝癌的发病机制中发挥着重要作用。此外,作为抗原提呈细胞,LSECs是肝脏适应性免疫和全身免疫耐受的关键调节因子,因此是很有前途的免疫治疗靶点。
本文合理设计阴离子LNPs,优先靶向和转染肝脏RES,即清道夫受体LNPs (srLNPs)。
利用胚胎斑马鱼(Danio rerio)作为一种方便、准确、经济的体内模型,定性地描述了LNP在细胞分辨率和实时水平下,在体内的生物分布、mRNA递送和外源性荧光蛋白的表达,,特别关注LNP在SECs、巨噬细胞和胚胎肝细胞中的相对摄取和mRNA表达。此外,我们证实了清道夫受体,稳定素-1和-2,介导了阴离子LNP被RES的摄取。最后,我们验证了小鼠肝脏RES中LNP优先介导的mRNA转染,并证明了stabilin-2在哺乳动物LSECs中阴离子LNP摄取和处理的关键重要性。
2、结果
2-1 阴离子srLNPs的设计和表征
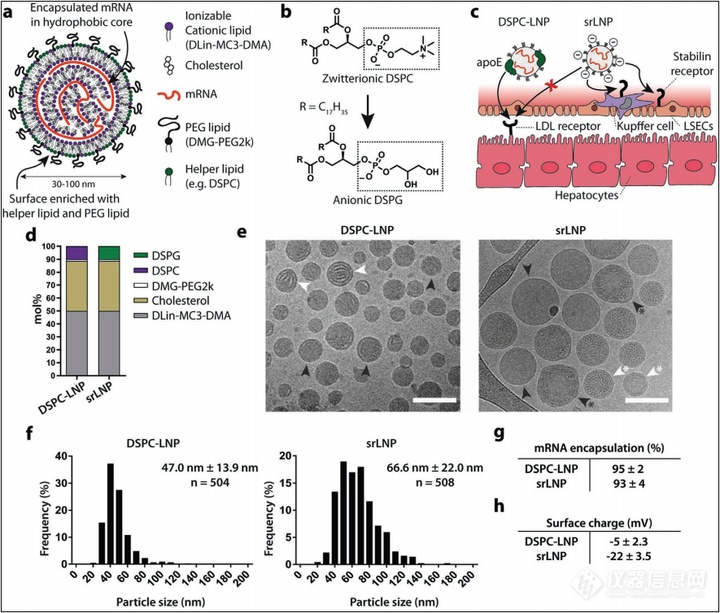
通常,LNP由5部分构成,疏水核心由可电离阳离子脂质,胆固醇和核酸药物组成,LNP表面(脂质-水界面)富含辅助性磷脂,如DSPC和脂质PEG接合物。我们将Onpattro中的两性离子DSPC换成结构最接近的阴离子类似物DSPG,使LNP表面带阴离子而最小化破坏LNP的整体结构。阴离子表面电荷反过来会在LSECs中通过稳定素途径介导LNP的和摄取,同时抑制肝细胞apoE-LDLr之间的相互作用,从而重构LNP的靶向和RNA递送。
本文中含DSPG的LNPs定义为srLNPs,基于Onpattro脂质处方的LNP定义为DSPC-LNPs。冷冻电镜显示两者均有典型的电子致密核心结构。DSPC–LNPs (47.0 ± 13.9 nm)中观察到无定形和层状的核心结构,srLNPs (66.6 ± 22.0 nm)包含无定形、单层和多层结构。两种配方的粒径均远低于大小依赖的吞噬作用的粒径阈值,及无障碍通过肝上皮细胞(无限制地通过肝细胞)的窗口值(180 ± 41 nm)。两者地包封率均>95%。然而重要的是,相比DSPC-LNPs(zeta 电位≈-5mV)srLNPs表面有明显的负电荷(zeta 电位≈-20mV),表明DSPG存在于脂质-水相地交界面。
编辑切换为居中
图1:srLNPs的设计和表征
2-2 LNPs在胚胎斑马鱼中的生物分布
之前,我们已经证明,静脉注射的阴离子纳米颗粒(大小从10到150 nm不等,涵盖各种化学成分)可以迅速和广泛地被注射给受精后(days postfertilization)两天的的胚胎斑马鱼的尾端造血组织(CHT),后主静脉(PCV)、和尾端静脉(CV)中的SECs清除。
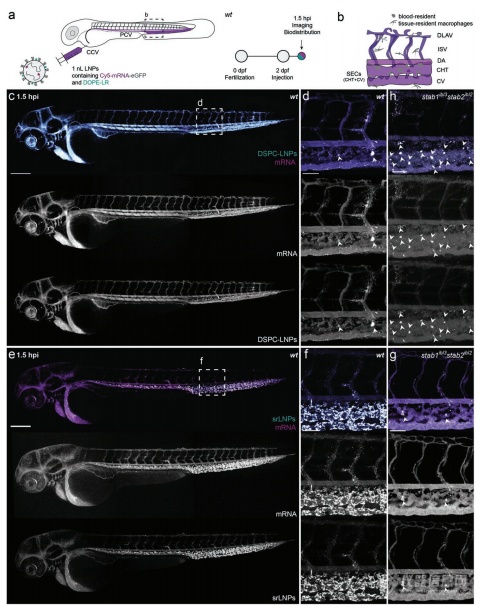
为评估LNP的体内分布,含有荧光脂质探针(DOPE-LR,0.2 mol%)和包裹了荧光标记的mRNA(Cy5标记)的两种LNP被注射给2dpf的野生型斑马鱼。共聚焦成像显示了两种LNP-mRNA在注射后1.5h(hpi)不同的生物分布模式。在DSPC-LNPs中,颗粒大多自由循环,脂质和mRNA均局限于胚胎的血管系统,且均匀分布于整个血管系统(图2c-d)。此外,一小部分DSPC-LNPs在CHT的血驻留巨噬细胞中积累,表明被RES低水平识别和摄取(白色箭头,图2d)。srLNPs大部分在1.5 hpi从血液循环中清除,在SECs和PCV, CHT和CV定居的血驻留巨噬细胞中高度选择性累积(图2e-f)。srLNPs在斑马鱼胚胎的清除血管中的选择性累积与之前报道的阴离子脂质体,聚合物囊泡,无机纳米粒的摄取类似。它们是通过稳定素清道夫受体介导被摄取的。将srLNPs注射给stab1-/-/stab2-/-双敲除斑马鱼胚胎。在这些突变胚胎中,1.5 hpi,srLNPs主要停留在循环系统。一少部分累计在CHT血液驻留巨噬细胞中(图2g),表明srLNPs被斑马鱼胚胎中SEC的非巨噬细胞摄取,主要是通过稳定素受体介导的。DSPC-LNPs的类似实验则显示生物分布没有改变,大部分的纳米粒仍然留在循环系统中(图2h)。在所有情况下,脂质和mRNA的荧光探针在1.5 hpi均完全共定位。表明在血液循环,细胞识别和早期细胞摄取阶段,mRNA均稳固地存在于DSPC和srLNPs的核心。
编辑
图2:DSPC-LNPs和srLNPs在2dpf斑马鱼胚胎给药后1.5h中的生物分布
2-3 mRNA-LNP在胚胎斑马鱼内的递送和表达
我们使用LNP包载cy5标记的EGFP mRNA,用于研究在斑马鱼体内的分布和表达。如图3b, c所示,在1.5 hpi,srLNPs主要分布在SECs和在斑马鱼PCV, CHT和CV中的血驻留巨噬细胞。而在色素细胞中观察到的微弱的绿色荧光,则是由于斑马鱼胚胎在GFP通道的自发荧光。在24 hpi,在SECs和血驻留巨噬细胞中观察到强烈的eGFP绿色荧光。这与类似的脂质系统递送eGFP-mRNA的表达时间一致。eGFP荧光的成熟和荧光发生在共孵育2-7h后,并且在24h内持续增加。在stab1-/-stab2-/-变异胚胎中,在24 hpi eGFP在血驻留巨噬细胞中有表达,但在SEC中无表达,证明巨噬细胞对阴离子纳米粒的摄取不仅依赖于稳定素受体途径。
在DSPC-LNP介导的mRNA递送中,在24 hpi,eGFP的荧光广泛分布在2天龄的斑马鱼胚胎中。结合该组在1.5 hpi,缺乏明显的mRNA细胞内聚集,表明DSPC-LNP组低水平的非特异性的细胞内摄取,相应的mRNA在包括SECs和血驻留巨噬细胞等一众细胞中表达。
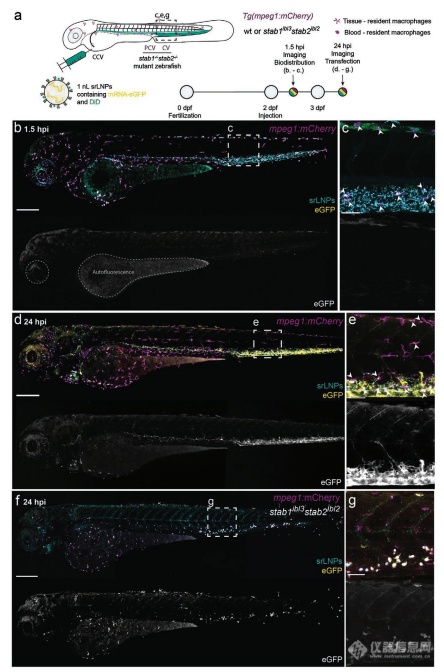
编辑
图3:在mpeg1: mCherry 转基因斑马鱼胚胎中srLNP的生物分布,eGFP-mRNA递送,和eGFP表达。
2-4 在年长斑马鱼胚胎中的肝靶向和mRNA表达
我们构建了apoE靶向的DOPC脂质体(含有5%的Chol-NH-apoE)。通过静脉注射,apoE靶向的DOPC脂质体在4天龄斑马鱼胚胎的肝脏中有明显信号(图4c, d),而非靶向性的DOPC脂质体仍自由循环(图4e, f),证明apoE介导的纳米粒识别和摄取途径在4天龄的斑马鱼中是存在的,功能化的,和可开发的。在肝脏内部,apoE靶向的纳米粒不仅可以被肝细胞摄取,并且可以描绘出肝细胞六角形的形态。
之后,我们将DSPC-LNPs和srLNPs注射入4天龄的斑马鱼胚胎中。sr-LNPs介导的eGFP表达主要是在RES细胞中,肝脏特异性的mRNA表达并未观察到,表明在斑马鱼中稳定素介导的srLNPs的识别和摄取超过任何竞争性的apoE介导的LNP处理过程。DSPC-LNPs组的eGFP表达水平很低,在肝脏中也没有优先累积(1.5 hpi),或增强的肝脏特异性的mRNA表达(24 hpi)。DSPC-LNPs和人apoE预孵育1h,确实在斑马鱼肝脏中增加了eGFP mRNA的表达,尽管在1.5 hpi没有明显增强肝靶向。表明DSPC-LNPs在肝细胞介导的mRNA表达可能可以通过apoE介导的识别和摄取途径而增强,内源性的apoE介导的LNP处理方式,在斑马鱼胚胎中是相对低效的。
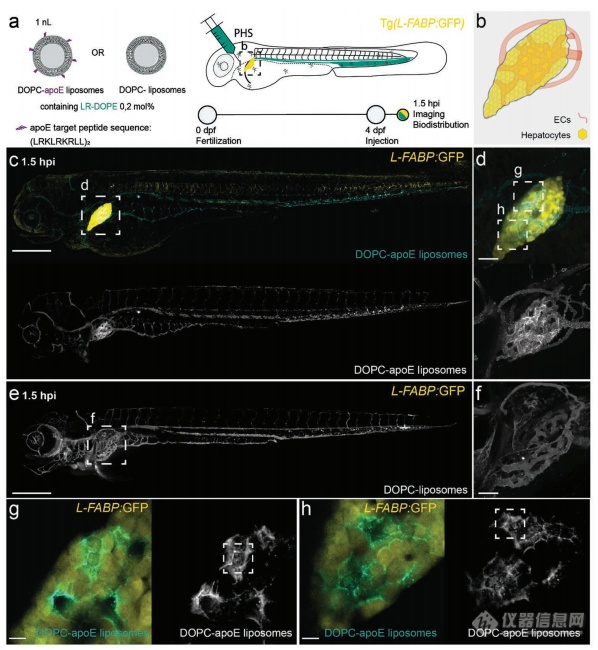
编辑
图4:apoE靶向脂质体在4天龄斑马鱼胚胎中的生物分布
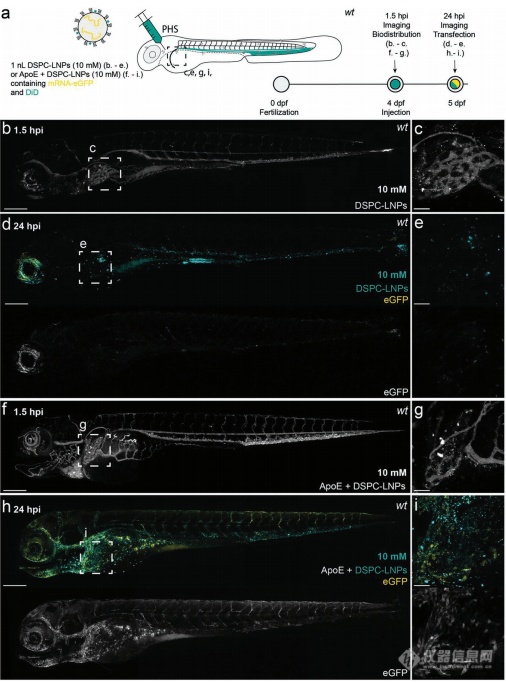
编辑
图5:DSPC-LNP在4天龄野生型胚胎斑马鱼中的生物分布和表达(与人apoE共孵育或未共孵育)
2-5 LNP介导的小鼠体内mRNA的递送和表达
接下来,我们评估了LNP在小鼠体内的生物分布和蛋白表达模式,聚焦于在肝脏,哺乳动物最大的RES器官生物分布和表达。为了评估LNP在RES细胞和组织中的生物分布,制备了含有不可交换的,荧光脂质探针DiD的LNP-mRNA,允许我们可以相对独立地评估细胞特异性的LNP靶向和相应的mRNA表达。
在2 hpi,相比骨髓和脾脏中的RES器官,DSPC-LNPs和srLNPs在小鼠肝脏均有大量的LNP聚集。然而,srLNPs在所有肝细胞类型中都有明显增强的细胞摄取(图6c)。srLNPs在小鼠LSECs和KCs中分别有大约5倍和3倍的靶向增强(图6d)。证明LNP-mRNA递送系统中加入阴离子DSPG不仅总体上增加了肝脏的趋向性,并且导致了在肝RES细胞中的优先靶向和摄取。
之后,我们使用LNP包载mCherry-mRNA,srLNPs相比DSPC-LNPs显著增强了在RES细胞中的递送。然而在肝细胞中,两种LNPs的表达均高于肝RES细胞。肝脏细胞特定的靶向和相应蛋白表达水平之间的明显不一致可能是由于肝细胞和肝RES细胞之间非常不同的生理和功能差异。LSECs和KC有非常强的内吞/吞噬能力(尽管LNP摄取率高,但mRNA仍发生显著降解)。虽然使用mRNA的表达或敲除作为LNP靶向的间接评估是很常见的,我们的实验证明,尤其是在肝脏中这种间接的读取是很差的LNP靶向性的预测指标。
最后,为了验证稳定素介导的肝脏RES靶向,srLNPs静脉注射入stab2-/-敲除小鼠,LNPs靶向LSECs有80%的减少,LSEC特定的mRNA表达有50%的减少。相比之下,敲除稳定素-2对靶向KCs(表达稳定素-2但可能涉及其他的LNP识别和摄取受体)仅有少量影响。
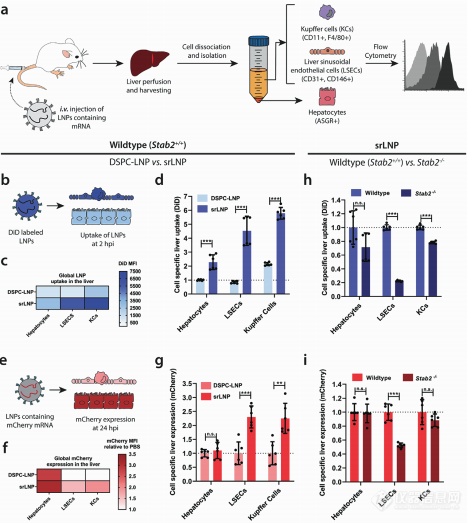
编辑
图6:静脉注射后LNP在不同肝细胞中的摄取和功能化mRNA递送
总结
本文基于对纳米-生物相互作用的广泛理解,合理设计了可以优先靶向肝RES的LNP-mRNA平台。我们发现在SECs中,稳定素介导的识别和摄取在各种阴离子纳米粒中占据主导地位。优先递送mRNA至肝脏的ECs,可以通过使用胆甾醇油酸酯或氧化的胆固醇成分而实现。这些系统可能通过电荷或稳定素介导的方式增加LSECs的摄取,在氧化LDL和乙酰化LDL系统中均可观察到。LNP介导的递送RNA至脾脏可以通过在Onpattro处方中加入阴离子磷脂18PA(40 mol%),因为其近乎中性的电荷和脾脏缺乏稳定素表达,因此这种脾脏的趋向性不大可能通过电荷或稳定素依赖的方式。
这项研究强调LNP组成,生物物理特征,LNP超结构,和LNP体内命运的复杂相互作用。对于新LNP设计,广泛理解LNP的化学和生物特性是必须的。LNP的体内评价受限于传统动物模型大规模研究的高昂花费和可实施性,本文证明胚胎斑马鱼可以成为LNP研发管线的有力补充。
参考文献:Roy et al. Anionic Lipid Nanoparticles Preferentially Deliver mRNA to the Hepatic Reticuloendothelial System. Advanced Materials. 2022, 34, 2201095.
最新动态
更多![]()
祝贺健新原力赋能RNAimmune公司创新型呼吸道合胞病毒mRNA疫苗的临床试验IND获得FDA批准
厂商
2023.12.19
喜报!祝贺迈安纳合作伙伴斯微生物编码细胞因子IL-12的mRNA注射液获得临床试验默示许可
厂商
2023.06.14
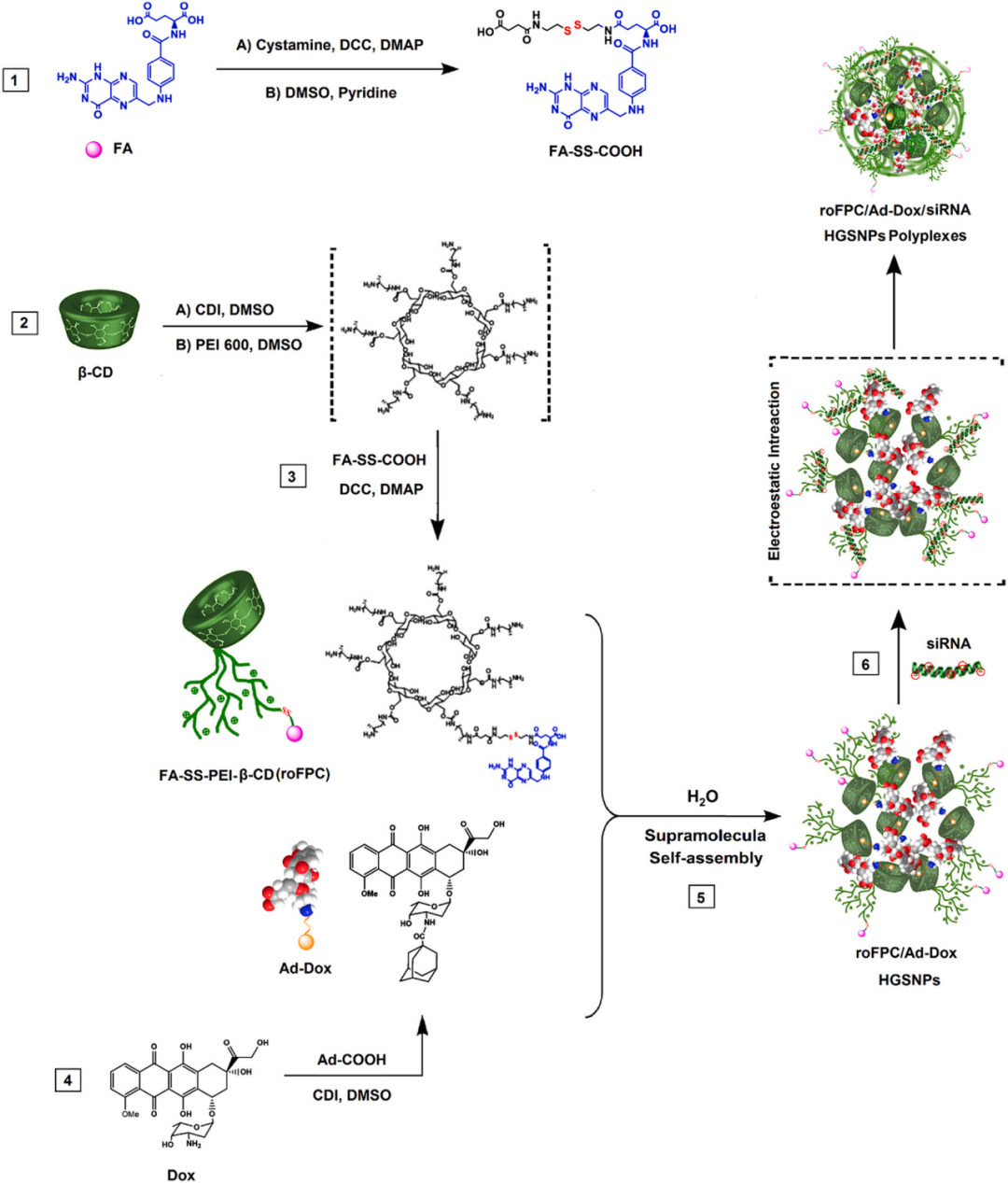
聚乙烯亚胺-环糊精纳米粒用于siRNA和DOX的共递送
厂商
2023.06.14
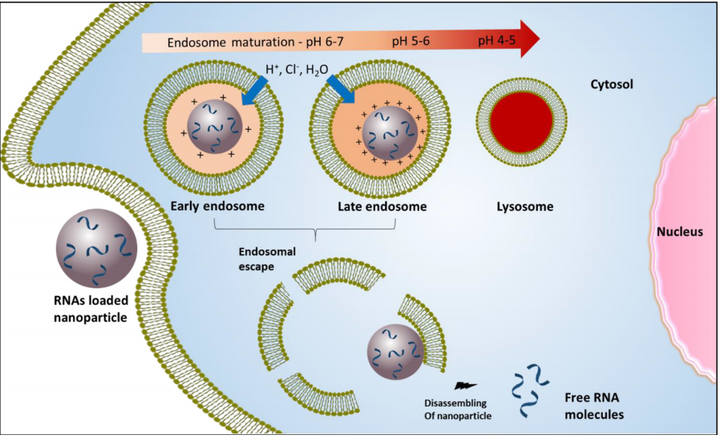
表观PKa在包裹siRNA和mRNA的纳米粒子研制中的重要性
厂商
2023.06.09
推荐产品
供应产品