自然通讯成果|非变性纳米蛋白质组学捕获内源性心肌肌钙蛋白复合物的结构和动态性信息
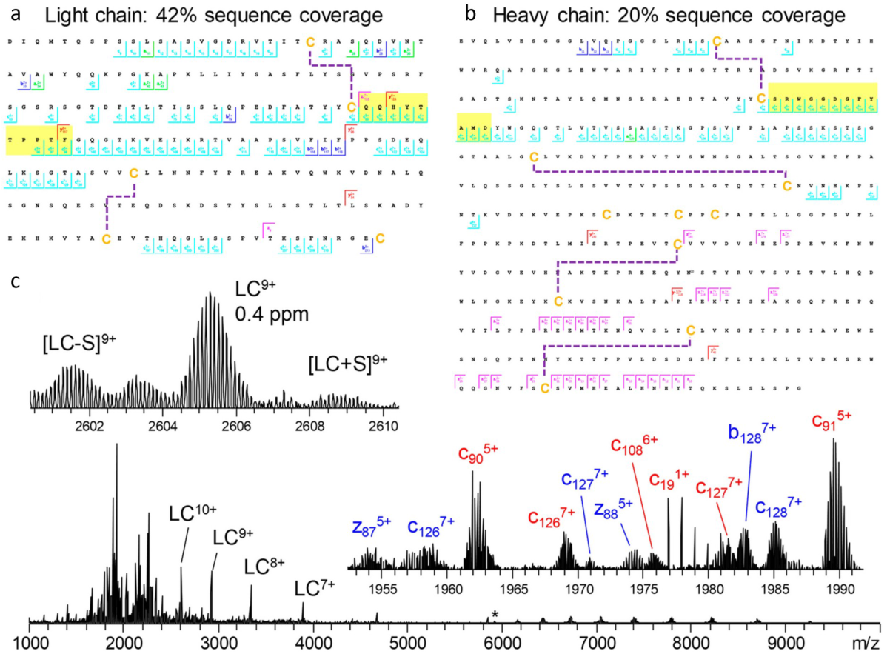
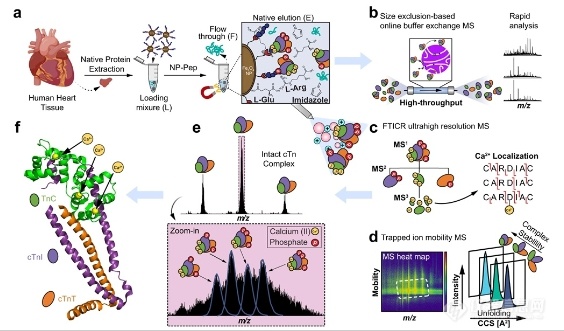
大家好,本周为大家分享一篇发表在Nat. Commun.上的文章:Structure and dynamics of endogenous cardiac troponin complex in human heart tissue captured by native nanoproteomics ,文章的通讯作者是威斯康星大学麦迪逊分校的葛瑛教授。 蛋白质大多都是通过组装成蛋白复合物来执行特定的生物功能,因而表征内源性蛋白复合物的结构和动力学将有助于生命过程的理解。蛋白复合物在其组装、翻译后修饰(Post-translational modifications,PTMs)和非共价结合等方面是高度动态的,在native状态下通常以低丰度存在,这给研究其结构和动态性的传统结构生物学技术(如X-ray和NMR)带来了巨大的挑战。非变性Top-down质谱(nTDMS)结合了非变性质谱和Top-down蛋白组学的优势,目前已发展成蛋白复合物结构表征的有力工具,可以保留蛋白质亚基-配体间的非共价作用和PTMs等重要信息。然而,由于内源性蛋白复合物自身的低丰度特性,导致对其的分离纯化和检测非常困难,所以nTDMS目前仅限用于过表达的重组或高丰度蛋白质的表征。在本研究中,作者开发了一种非变性纳米蛋白质组学(Native nanoproteomics)技术平台,通过使用表面功能化的超顺磁性纳米颗粒(Nanoparticles,NPs)直接富集组织中的蛋白复合物,然后再利用高分辨质谱表征其结构和动态性。这里选用心肌肌钙蛋白(Cardiac troponin,cTn)异源三聚体复合物(~77 kDa)作为研究对象。cTn三聚体复合物是调节横纹肌肌动蛋白收缩的Ca2+离子调节蛋白,由TnC、cTnI和cTnT这3个亚基组成。其中,TnC是Ca2+结合亚基,cTnI是抑制肌动蛋白-肌球蛋白相互作用的亚基,而cTnT细丝锚定亚基。TnC与Ca2+的结合,以及cTnI 亚基的磷酸化,会共同引起细丝上的分子级联事件,诱导心肌收缩所必需的肌动蛋白-肌球蛋白交叉桥的形成。传统结构生物学技术不能有效捕获cTn复合物高度动态的构象变化,并且先前研究用的cTn复合物是由原核细胞表达的,缺乏PTMs的信息。因此,作者开发了native纳米蛋白组学的方法,以实现对人内源性cTn复合物结构和动力学的全面表征。作者首先使用肽功能化的超顺磁性氧化铁NPs富集了人心脏的内源性cTn复合物,同时优化了非变性蛋白提取缓冲液(高离子强度LiCl溶液,生理pH)。富集到的cTn复合物中的3种亚基的含量比例为1:1:1,真实反应了肌节cTn异源三聚体复合物的组成。作者也发现含有750 mM L-Arg,750 mM咪唑和50 mM L-Glu(pH 7.5)的溶液对蛋白复合物的洗脱效果最好,并且不会破坏亚基间的相互作用。该富集方法具有很好的重现性,proteoforms信息得到很好保留,且可以直接用于化学计量分析。总的实验流程如图1所示,洗脱后的cTn复合物经体积排阻色谱(Sze-exclusion chromatography,SEC)除盐和交换至醋酸铵溶液中,随后对cTn复合物进行多种nTDMS分析:1)在线SEC监测复合物 2)超高分辨傅里叶变换离子回旋共振质谱(FTICR-MS)表征复合物的化学计量比和proteoforms 3)捕获离子淌度质谱(TIMS-MS)解析调控复合物构象变化中的非共价作用的结构动态性。 图1. 用于表征人心脏中内源性cTn复合物的native纳米蛋白组学平台。 为了全面表征内源性cTn复合物,作者使用FTICR-MS进行proteoforms测序和复合物表征。图2展示了native状态下检测丰度最高的cTn复合物的电荷态(19+),其中包含了4种独特的proteoforms,这些复合物主要带有单磷酸化的cTnT、单磷酸化和双磷酸化的cTnI,以及结合了3个Ca2+的TnC。这些结果表明人cTn复合物在肌节中以结构多样化的分子组成存在,具有高度异质的共价和非共价修饰,可产生一系列不同的完整复合物。 图2. FTICR-MS分析展示的cTn复合物状态。红色方框中是最高丰度电荷态(19+)的放大谱图,理论同位素分布(红色圆圈)可以与谱图很好叠加,说明结果具有高质量精度(质量偏差在2 ppm 以内)。 作者接着对cTn复合物进行complex-up分析,以研究复合物的化学计量比及其组成。图3a~3b分别显示的是完整cTn三聚体复合物,以及经CAD碎裂后的蛋白亚基谱图。但这里没有检测到cTnI单体,可能是因为cTnI和TnC在native状态下的亲和力很强,且cTnI单体带的电荷不多,导致其在高m/z区域出峰,所以不易被检测到.随后,作者又对解离出的亚基进行complex-down分析。图3c展示了检测到的cTnT的多种proteoforms:未磷酸化的 cTnT、单磷酸化的cTnT(p cTnT)和 C 端 Lys 截断的磷酸化cTnT(pcTnT [aa 1-286]),CAD碎裂谱图也发现cTnT的C端较N端更易暴露在外界溶剂中。图3e则是cTn(I-C)二聚体的谱图,共检测到6种具有不同数量Ca2+结合和磷酸化的proteoforms。二级谱图可将cTnI的两个磷酸化位点准确定位在Ser22和Ser23,同时发现cTnI序列两端都较内部区域更易暴露于溶剂中。但还无法通过nTDMS准确推断Ca2+结合和磷酸化是如何影响cTn复合物的稳定性。作者在此也没有优化FTICR-MS在非常高m/z范围的离子检测,所以也会遗漏带少量电荷的cTn复合物信息。 图3.nTDMS表征人心脏来源的cTn复合物。(a~b)完整cTn复合物和经CAD碎裂后的亚基谱图 (c~d)cTnT单体及其代表性的CAD碎裂谱图 (e~f)cTn(I-C)二聚体及其代表性的CAD碎裂谱图。 人TnC蛋白含有3个钙结合EF-hand基序(结构域 II~IV)。结构域 II与Ca2+结合的亲和力较低,是触发心肌收缩的调控域。结构域 III 和 IV则与Ca2+具有强的亲和力,在心肌舒张和收缩时均始终保持与Ca2+充分结合,但结构域 II只有在收缩时才被Ca2+占据。这里观察到了TnC分别与0、1、2和3个Ca2+结合的情况,通过CAD碎裂也进一步定位了TnC与Ca2+结合的具体氨基酸序列(图4)。研究发现结构域 II的骨架最容易发生碎裂,而结构域 III的骨架最难碎裂。目前结构域 II~IV的序列在UniprotKb中分别对应65DEDGSGTVDFDE76、105DKNADGYIDLDE116和141DKNNDGRIDY152。这里分别将与1、2和3个Ca2+结合的TnC隔离出来进行CAD碎裂(m/z分别为2312、2316和2321),可以更准确地将结构域 III、II和IV的序列分别定位到113DLD115、141DKNND145和73DFDE76(图4c),表明非变性纳米蛋白组学方法在定位非共价金属结合方面具有高分辨能力。 图4.nTDMS定位 TnC与Ca2+结合的结构域。(a)FTICR-MS隔离与不同数量Ca2+结合的TnC单体 (b~c)与两个Ca2+结合的TnC的CAD碎裂谱图,蓝色、红色和黄色方框分别对应结构域 II 、III和IV。 Ca2+与TnC的结合会对cTn复合物的功能和构象有着很大影响。cTn复合物的核心区维持着构象的稳定,但当Ca2+与TnC发生结合时,其柔性区会经历广泛的构象变化,复合物结构会从“closed”状态转变成“opened”状态,这会促进肌动蛋白和肌球蛋白间的相互作用,最终导致心肌收缩。然而,传统结构生物学技术很难捕获cTn复合物与Ca2+结合时的构象变化。因此,作者使用离子淌度质谱来分析cTn复合物的构象变化。TnC亚基和与Ca2+结合的cTn(I-C)二聚体的淌度分离谱图如图5所示。与0~3个Ca2+结合的TnC的碰撞截面(Collision Cross-Section,CCS)值分别为1853、1849、1829和1844 Å2(图5a~5b),TnC构象比IMPACT预测的更为紧凑,但cTn(I-C)二聚体的CCS值与预测的非常接近(图5c~5d)。作者推测TnC与两个Ca2+结合会形成更致密的构象,是因为在静息舒张时Ca2+与结构域 III 和 IV充分结合。当第三个 Ca2+与结构域II结合时,TnC转变为“opened”构象,使其N端与cTnI的C端相结合,进而引发心肌收缩(图5e)。cTn(I-C)二聚体与Ca2+结合时的构象变化也是如此(图5f)。 图5.TnC单体(a~b)和与Ca2+结合的cTn(I-C)二聚体(c~d)的离子淌度分离谱图 (e~f)TnC和cTn(I-C)二聚体与Ca2+结合时的构象变化。 最后,作者通过添加EGTA来剥离cTn复合物中的Ca2+,以进一步研究Ca2+在维持复合物结构稳定性上的作用。图6b~6c是没有EGTA孵育时的cTn复合物的TIMS-MS谱图。cTn复合物的CCS值与理论预测值非常符合。随着EGTA孵育浓度的增加(25、50和100mM),Ca2+逐渐被螯合,cTn复合物的结构也越来越舒展,体现在平均电荷态逐渐增加,以及逐渐在较低m/z范围内出峰,这表明cTn复合物构象的稳定性丢失与EGTA浓度的增加相关(图6d~6f)。虽然100mM EGTA孵育也不敢保证Ca2+的完全剥离,并且cTnI的存在又会增强TnC与Ca2+的结合,但TIMS-MS为我们研究cTn复合物与Ca2+结合时的构象变化提供了一种切实可行的分析手段。 图6.cTn复合物与EGTA孵育时的构象变化。(a)cTn复合物的构象随EGTA孵育浓度的增加发生改变 (b~c)cTn复合物的TIMS-MS谱图 (d~f)cTn复合物与不同浓度EGTA(25、50和100mM)孵育的谱图和CCS分析。 总的来说,本研究开发了一种可用于内源性蛋白复合物富集和结构表征的非变性纳米蛋白组学方法,以获取其组装、proteoforms异质性和动态非共价结合等方面的生物信息。本文采用的功能化NPs可被灵活设计成选择性结合特定的靶蛋白,在富集和洗脱过程中可以很好保持其近似生理条件下的存在状态。更为重要的是,功能化NPs与nTDMS的整合可以作为一种强有力的结构生物学工具,可以作为传统技术的补充,用于内源性蛋白复合物的表征。 撰稿:陈昌明 编辑:李惠琳文章引用:Structure and dynamics of endogenous cardiac troponin complex in human heart tissue captured by native nanoproteomics 参考文献 Chapman EA, Roberts DS, Tiambeng TN, et al. Structure and dynamics of endogenous cardiac troponin complex in human heart tissue captured by native nanoproteomics. Nat Commun. 2023 14(1):8400. Published 2023 Dec 18. doi:10.1038/s41467-023-43321-z


 400-622-8982
400-622-8982
 留言咨询
留言咨询

 400-803-1678
400-803-1678
 留言咨询
留言咨询

 400-860-5168转0230
400-860-5168转0230
 留言咨询
留言咨询