TNF-α在造血、免疫和炎症中的作用
TNF-α能够抑制造血,引起红细胞产生减少,破坏增多。输入TNF-α能够使淋巴细胞和粒细胞一过性增加,然后减少,这可能与血细胞从血液循环迁移到组织中有关,但TNF-α在体外并没有趋化作用,因此不排除其他因素的参与。尽管TNF与IL-1的结构和受体差异显著,但均可以引起发热、心动过速、低血压和诱导肝脏产生急性期蛋白,其机制尚未完全阐明。TNF-α可抑制骨髓干细胞分裂,长期应用TNF-α可以导致血液中淋巴细胞减少和免疫缺陷。与IL-1相似,TNF-α也能诱导T细胞表达 MHCⅡ类分子和高亲和力IL-2受体,TNF-α能够与IL-2协同促进T细胞产生IFN-γ和增强LAK细胞活性。TNF-α诱导的杀伤性T细胞对胰岛素β细胞的损伤作用可能与1型糖尿病有关。TNF-α能够增强巨噬细胞的活性和杀伤功能,增强巨噬细胞促进免疫应答的能力;对炎症局部的中性粒细胞的活性和聚集也有促进作用。TNF-α可抑制B细胞对EB病毒的反应,抑制B细胞增殖和分泌免疫球蛋白。
参数原理
2023.03.21
TNF-α对全身细胞的不同作用简述
在宿主生理性抗感染应答中,TNF-α对全身细胞的作用如下:TNF-α对不同的细胞有不同的作用:杀伤、抑制、促进或不影响细胞。TNF-α能够诱导敏感细胞凋亡,如内毒素可以通过TNF-α促使巨噬细胞、中性粒细胞、内皮细胞以及脏器实质细胞等发生凋亡,凋亡细胞形成凋亡小体被邻近的吞噬细胞吞噬、消化和清除,不引起炎症反应。TNF-α能够快速、强烈、不可逆地抑制红细胞系前体(CFU-E和 BFU-E)和红系,粒系肿瘤细胞(K562,HE2、HL-60)的生长,这种抑制作用不需要淋巴细胞或巨噬细胞的辅助,但细胞必须表达有TNF-α受体。表皮生长因子(EGF)和转化生长因子TGF-α并不能够抑制TNF-α受体的表达,但能够抑制TNF-α的这一作用。某些肿瘤细胞抵抗TNF-α的机制之一可能是产生了这些生长因子所致。TNF-α能促进人的成纤维细胞增殖,诱导细胞表达EGFR和转铁蛋白受体,胰岛素和EGF能增强TNF-α的这一作用。TNF-α促进小鼠肝细胞生长的作用可以被TGF-β或IL-6抑制,TNF-α与INF-Y能够协同改变某些人或小鼠正常或转化细胞株的形态、功能和生长状态,TNF-α还能够诱导人脐带静脉内皮细胞表达不同集落刺激因子的mRNA;诱导正常造血组织、人肺成纤维细胞和血管内皮细胞表达和分泌GM-CSF,并促进这些细胞产生INF-Y和IL-6。
参数原理
2023.03.21
TNF-α的生物学作用介绍
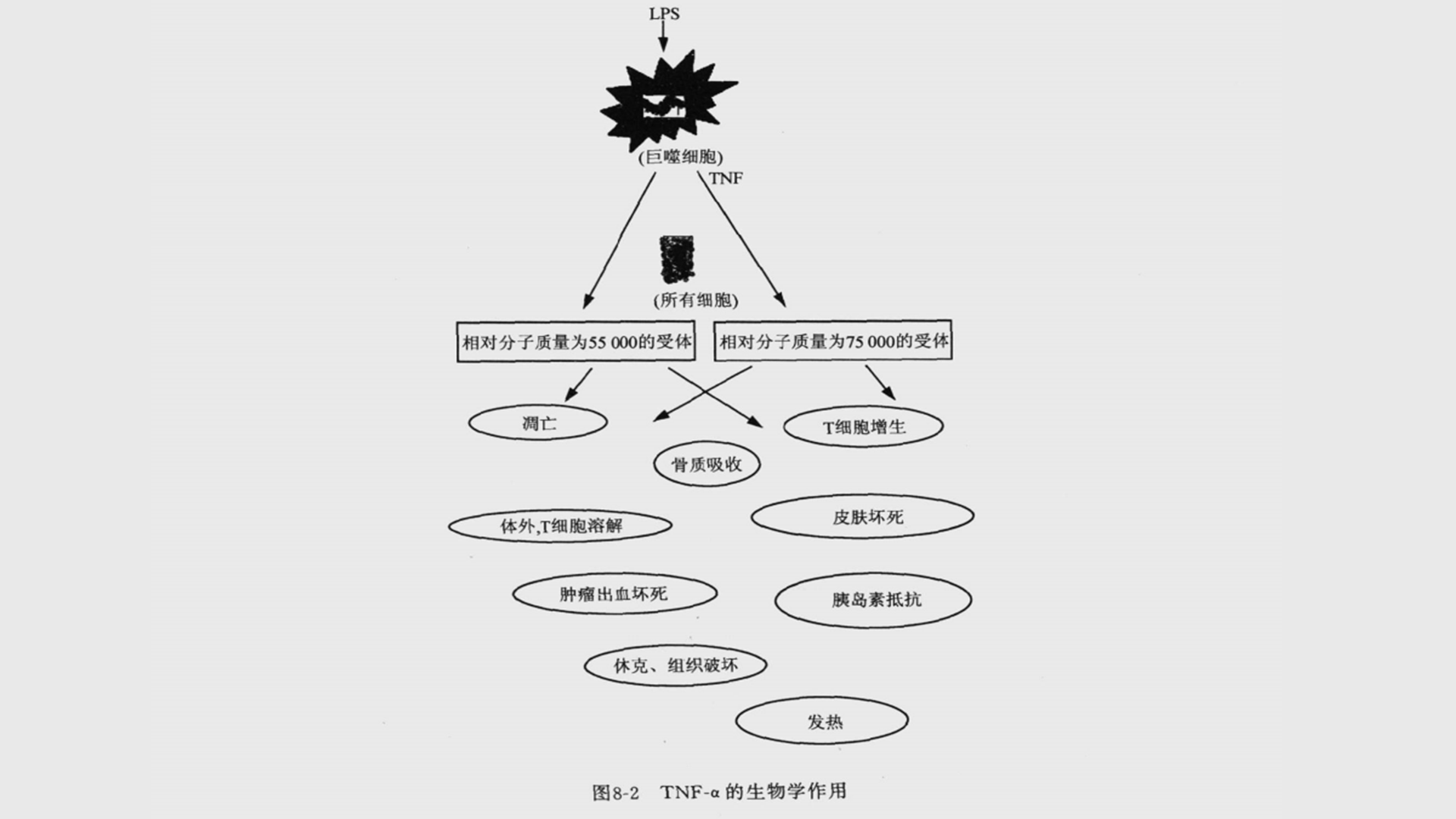
TNF-α(肿瘤坏死因子)的生物学作用(图8-2)与量有关,在低浓度即在大约10-9mol/L时,TNF-α在局部起着旁分泌和自分泌调节白细胞和内皮细胞作用,TNF-α在低浓度时的主要生物学作用如下:(1)TNF-α引起血管内皮细胞表达表面受体(黏附分子),使得内皮细胞与白细胞黏附,最初为中性粒细胞,接着是单核细胞和淋巴细胞。TNF-α可作用于中性粒细胞,以增加它们对内皮细胞的黏附,这些作用最后导致白细胞在炎症局部积聚,说明TNF-α在生理上可能有重要的局部效应。(2) TNF-α可激活白细胞杀灭微生物,TNF-α有特异性激活中性粒细胞以及增强吞噬细胞吞噬和分泌细胞因子的能力,有利于清除病原体及其成分,但也影响嗜酸粒细胞和单核-巨噬细胞,并可促使细胞凋亡。(3)TNF-α可刺激单核-巨噬细胞和其他类型的细胞产生细胞因子,包括IL-1、IL-6、TNF-α自身和趋化因子。(4)TNF-α可以产生干扰素样抗病毒的保护效应,并且使MHCⅠ类分子表达上调,增强细胞毒性T淋巴细胞(cytotoxicity T lymphocyte,CTL)介导的溶解病毒感染细胞的作用。TNF-α的这些效应对微生物的炎症反应是必需的,如果出现TNF-α的分泌量不足(如用抗TNF-α中和抗体处理过的动物),则可造成控制感染的失败。如果对TNF-α产生的刺激足够强烈,会产生大量的细胞因子,结果 TNF-α大量进入血液,在血液中起到内分泌性的作用。
参数原理
2023.03.21
关于TNF-α受体的结构及作用介绍
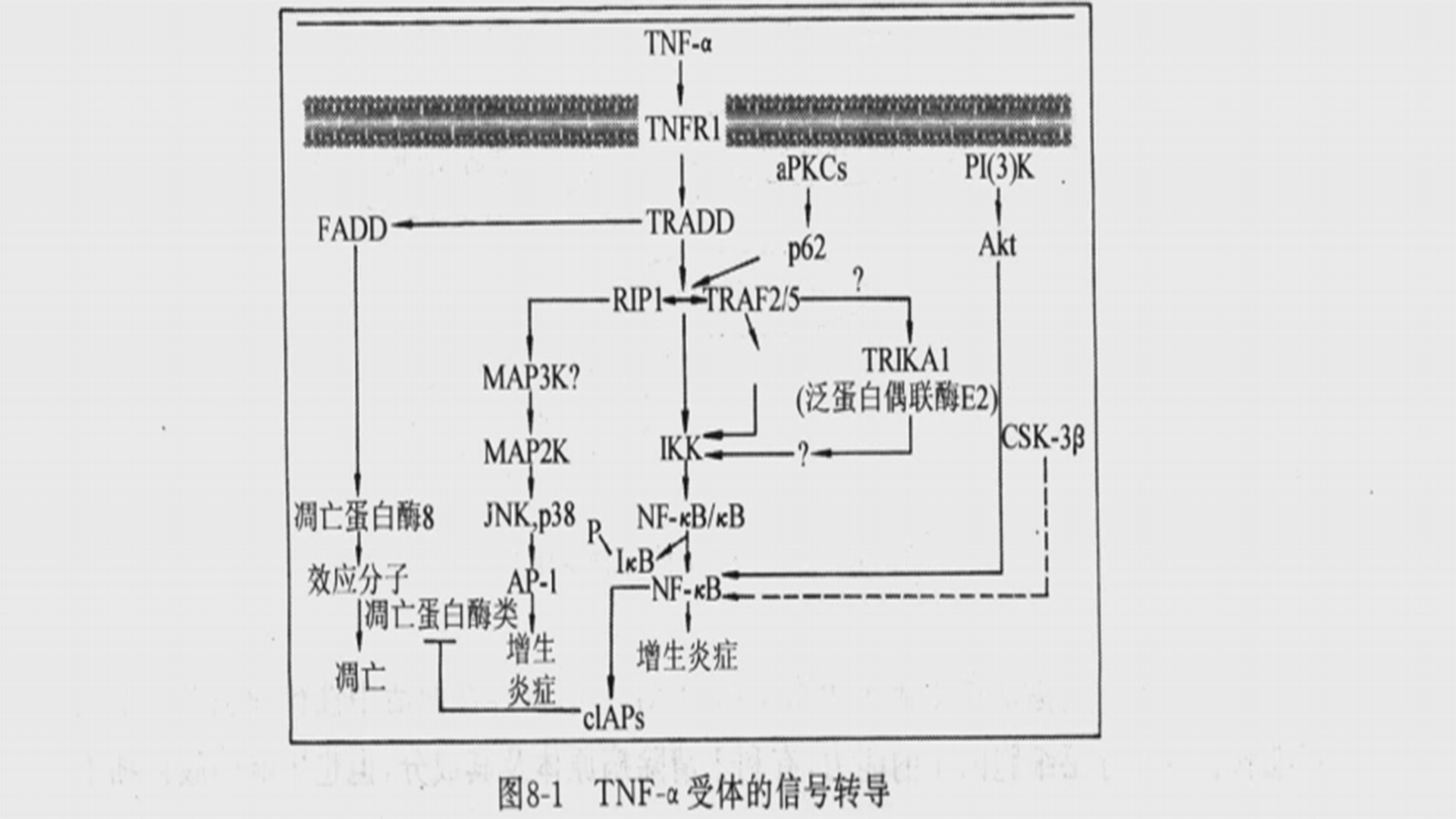
人类TNF-α的受体主要有两种,其在细胞分布、相对分子质量、结合TNF-α的亲和力和介导的生物学活性等方面都不相同。受体与TNF-α结合后发生内化,但是信号转导并不要求TNF-α内化,只要TNF三聚体与受体结合即可进行信号转导。每个细胞约有500~50000个受体。TNFR在膜上的转换半衰期约30~120min,其快速转换与胞质PEST(Pro-Glu-Ser-Thr)结构有关。TNFR被内化后很快被降解,不参与受体再循环。TNF-α受体又称为TNFRp55(TNF-αRp55、TNF-αR Ⅰ 、TNF-αR Ⅱ 、TNF-αRp60或CD120α),相对分子质量为55000~60000。TNF-α结合的平衡常数(Kd)为0.2~0.5nmol/L。TNFRp55含有426个氨基酸,细胞外部分有182个氨基酸残基,有4个由30~42个氨基酸组成的、保守的、富含Cys 的结构域,有3个糖基化的位点;跨膜区有21个氨基酸残基;细胞质内有223个氨基酸残基,其中326~413位为与诱导细胞凋亡有关的死亡结构域(D-D)。TNF的主要生物学活性包括活化NF-κB、诱导细胞凋亡、诱导IL-6、促进成纤维细胞增殖等,均与TNFRp55有关。TNFRp55基因位于人染色体12p13(小鼠6号染色体),mRNA长度约3kb。相对分子质量为75000~~80000的 TNF-α受体称为TNFRp75(TNF-αRp75、TNF-αR2、TNF-αR Ⅰ、TNF-αRp80或CD120β),TNF-α结合常数为0.03~0.07nmol/L。TNFR75的总长度为439个氨基酸,细胞外部分有235个氨基酸残基,也含有4个约由30~42个氨基酸组成的保守的、富含Cys的结构域,有2个糖基化位点,与TNFRp55的胞外区约28%同源;跨膜区有30个氨基酸残基;胞质区内部分有174个氨基酸残基,与TNFRp55胞质区完全不同,有一个富含Ser 的区域和一个 TNFR相关因子(TNF-receptor-associated factor,TRAF)的结构域。TNFRp75也与TNF的某些功能有关,例如激活T细胞、介导细胞毒性作用、抑制造血和调节内皮细胞或中性粒细胞活性等。TNFRp75基因位于人的1号染色体,小鼠4号染色体。人TNFRp75 mRNA 大约长4.5kb。可溶性TNF-α与 TNFRp55解离的半衰期为180min,与 TNFRp75解离的半衰期为10min。由于TNF-α与TNFRp75的快速解离,有人认为,TNFRp75只是将结合的可溶性TNF-α传递给TNFRp55。TNFRp55主要介导可溶性TNF-α的活性,而TNF-αRp75主要介导膜型TNF-α的活性。TNFRp55几乎存在于所有细胞的表面,没有种属的特异性,可以介导TNF-α对小鼠WEHI164细胞的杀伤作用。TNFRp75只在有限的细胞(主要是活化的淋巴细胞和抗原呈递细胞)表达,有一定的种属特异性。在单核-巨噬细胞中产生的TNF-α通过p55诱导内毒素休克和直接参与细胞毒性作用。TNFRp55和TNFRp75的N端部分可以从细胞膜上被酶解下来,成为可溶性TNF-α受体(sTNFR1和 sTNFR2)或TNF-α结合蛋白(TNF-αBP1和TNF-αBP2)。正常人血清或尿液中的sRNFR的水平约为1~3μg/L,能够抑制TNF-α的生物学活性。一些因素能够诱导sTNFR释放,包括TNF-α本身、一些细胞因子、LPS、发热和一些全身性疾病(肿瘤或HIV感染)等。STNFR 与TNF-α结合后的效应与sTNFR的量有关:低剂量sTNFR可稳定TNF-α,使之缓慢释放发挥效应;而高剂量sTNFR则可以阻断TNF-α的细胞毒性作用、免疫调节作用和对组织的毒性作用。TNF-α受体的信号转导:目前,TNF-α的信号途径中的所有分子及其功能并未完全阐明,但大致的相关分子研究已有所进展,主要表现在凋亡的信号途径上。图8-1简单概括了肿瘤坏死因子的信号转导。
参数原理
2023.03.20
内毒素可诱导TNF-α的产生和调节
TNF-α主要来源于单核细胞、巨噬细胞,也来源于T细胞,B细胞、中性粒细胞,NK细胞、星型细胞、内皮细胞和角质细胞,属于炎性细胞因子。正常人循环中的TNF-α水平在10~80ng/L浓度。1985年,Beutler等提供确凿的证据表明,TNF-α作为炎症介质参与败血症休克的病理生理变化。在小鼠体内直接输入TNF-α所诱导的组织病理学和病理生理学的变化与内毒素诱导的表现极其类似,如出现组织广泛出血坏死、白细胞浸润、低血压、低代谢率等;使用致死剂量的内毒素刺激小鼠之前,若给予TNF-α抗血清,可显著降低内毒素所致的死亡率,血清的TNF-α浓度与内毒素血症的病死率具有显著相关性。许多实验均证实,TNF-α为内毒素发病早期的重要介质,用内毒素刺激机体后,单核-巨噬细胞等组织细胞TNF-αmRNA和血液TNF-α浓度均显著上升。现已认识到,不但是革兰阴性细菌的成分如内毒素和“内毒素蛋白”,以及脂蛋白,而且革兰阳性细菌、病毒、支原体、结核杆菌等病原体的某些成分,甚至宿主体内的成分如热休克蛋白(hsp60、hsp90),药物如紫杉醇(taxol)都可通过不同的受体进行信号转导,激活NF-κB等转录因子,促使TNF-α、IL-1、L-6、NO等细胞因子释放。正因如此,可以通过降低血液的细胞因子水平来控制败血症综合征,以此降低败血症的病死率。诱导TNF-α产生的最有效物质为内毒素,巨噬细胞经内毒素处理后,基因转录增加3倍,细胞内mRNA含量增加100倍,且其mRNA稳定性也显著增加,TNF-α蛋白质增加1 000倍,说明三者并不存在一种平行关系。用内毒素刺激巨噬细胞时可引起短暂的分泌型TNF-α释放。在内毒素血症期间重复用小剂量内毒素刺激细胞,则细胞对内毒素的反应性会显著降低,表现为内毒素耐受现象。正向调节TNF-α表达的因素还包括:多种病原体及其产物,如革兰阳性菌肽聚糖﹑脂蛋白、脂阿拉伯甘露聚糖、葡聚糖、支原体和螺旋体的脂蛋白;自身病变组织或应激时的反应产物,如热休克蛋白60、热休克蛋白70;革兰阴性菌的“内毒素蛋白”、干扰素、IL-2、粒细胞-巨噬细胞集落刺激因子(GM-CSF)、集落刺激因子-1(CSF-1)、X线、IL-1、细菌DNA上的CpG岛、GM-CSF、免疫复合物、脂质A同系物、活性氧、TNF-α自身诱导、抗CD3单克隆抗体等。负向调节TNF-α表达的有:基因突变、糖皮质激素、氧化低密度脂蛋白(ox-LPL)、IL-4,高浓度的PGE2、TGF-β、IL-10、环孢霉素A、维生素D3,血小板活化因子受体拮抗剂、抗MHC Ⅱ分子抗体等都能在转录水平或转录后水平抑制TNF-α的产生。双向调节TNF-α的因素有:蛋白激酶C(protein kinase C,PKC)、PGE2和佛波酯(PMA)等。各自作用的程度有赖于诱导物的特异性和细胞被激活或抑制的程度。
参数原理
2023.03.20
TNF-α的来源和结构:可引起内毒素的毒性效应
肿瘤坏死因子(tumor necrsis factor,TNF)与内毒素密切相关。人们把来源于单核细胞和巨噬细胞的、能够使肿瘤细胞坏死的血清物质命名为 TNF-α,下面介绍TNF-α的来源和结构。一、TNF-α的来源内源性TNF(tumor necrsis factor,肿瘤坏死因子)是具有脂溶性的糖蛋白低聚物,广泛存在于内脏器官、皮肤、肌肉、白细胞、胚胎组织和神经组织。TNF-α主要由LPS(lipopolysaccharide,脂多糖)激活的单核细胞、巨噬细胞分泌产生;而TNF-β(淋巴毒素-1)主要来源于T淋巴细胞,但肥大细胞、多形核白细胞、角质化细胞、平滑肌细胞、星型胶质细胞、小神经胶质细胞、肾小球系膜细胞、肠腺的嗜酸粒细胞以及一些肿瘤细胞也可以自发或经过诱导产生TNF。在内毒素血症中,肝脏是血液TNF-α的主要来源,部分肝切除者可以耐受内毒素的毒性效应。二、TNF-α的基因位点TNF-α基因位于人染色体6p21.1~p22,在HLA基因群谱中靠近HLA-A位点,与HLA基因连锁。TNF-α和TNF-β基因沿3'→5'方向紧密连锁,相隔1.2kb。两者均由4个外显子和3个内含子所组成。TNF-αmRNA长度为1.7kb,而小鼠TNF-α基因长度约为1kb,位于17号染色体上,在主要组织相容性复合体(major histocompatibility complex,MHC)的H-2D基因上游约70kb处。三、TNF-α的转录调控TNF-α基因的TATA盒在其转录起始位点ATG上游20bp处,同时在其上游也存在其他各种调控元件,包括Y盒启动子、cAMP反应元件、c-jun/AP-1以及至少有5个NF-κB增强子等结合位点。TNF-αmRNA的3'端非翻译区还存在UUAUUUAU八个核苷酸序列结构,许多细胞因子的mRNA中均有此结构,此结构可使其mRNA稳定性降低,半衰期缩短。TNF-a mRNA的稳定性还受到3'非翻译区的其他位点调节:①对放线菌素D敏感的位点。②对放线菌素D不敏感,此位点受LPS调节后,TNF-αmRNA 的稳定性增高,显著减低TNF-αmRNA的降解率,使TNF-αmRNA在细胞内聚集100倍,增加TNF-α的蛋白质翻译,导致高TNF-α血症,易出现内毒素的毒性效应。四、TNF-α的构成成熟的TNF-α由157个氨基酸残基组成,含有1个二硫键(C69~C101位点),无糖基化位点,pI为5.6。人TNF-α前体为233肽,N端76肽不是信号肽,却能将TNF-α前体形式固定在细胞膜上,使成熟的分泌型TNF-α保留在细胞表面。TNF-α前体中疏水跨膜部分下游的Lys19和Lys20被豆蔻酸酰基化后,可以介导TNF-α前体运输到膜上的过程,膜结合型的TNF-α是Ⅱ型跨膜蛋白(typeⅡ transmembrane protein),即C端在细胞外,N端留在胞质内;胞质区有29个氨基酸,跨膜区有28个氨基酸,细胞外有176个氨基酸。膜型TNF-α有细胞毒理活性,可直接与相邻细胞表面的TNF受体(TNF-αreceptor、TNFR)结合,发挥旁分泌效应。小鼠TNF-α前体为235肽,成熟的TNF-α含有156个氨基酸残基,有1个糖化位点,糖基化后并不影响其三聚体的形成。TNF-α的二级结构主要为β折叠,结晶学分析证明,天然TNF-α为以非共价键连接的三聚体,以三重轴对称构成一个铃状结构;TNF-α单体有2个β折叠和5个反平行的β折叠串,外部的β折叠富含亲水残基,内部的β折叠为疏水性残基,单体之间相互结合形成稳定的三聚体。单体的C端卷在β折叠内,N端暴露在外。单体两两接触区是TNF结合TNFR的结构域,三聚体形成的三个结构域结合三个相邻或成簇的受体,使受体二聚化或三聚化,进而诱导其生物学活性。
参数原理
2023.03.20
C3H/HeJ品系小鼠发生内毒素耐受现象的原因
C3H/HeJ小鼠细胞Ran(或 L.ps/Ran)发生点突变可使其功能缺陷,因而可以解释C3H/HeJ品系小鼠为何发生内毒素耐受现象。依据有以下四点:①C3H/HeJ小鼠的Lpsd/Ran cDNA 的3'端非翻译区(untranslated region)发生点突变,在870位点上胸腺密啶突变为胞密啶,但编码的蛋白质相同。②Lps/Ran基因作图分析得出:Lps/Ran基因位于C3H/HeJ品系小鼠第4号染色体上,也在传统的Lps基因位点区域内。③导入Lpsn/Ran cDNA可以恢复Lpsd/Ran的B细胞对内毒素的反应,但不能恢复对巨噬细胞的效应,即内毒素耐受反应在B细胞中消失;而导入Lpsd/Ran cDNA无类似现象。④使用腺病毒载体将Lpsd/Ran cDNA转移到敏感小鼠体细胞内﹐能使敏感小鼠对内毒素反应发生耐受,表型类似于C3H/HeJ品系的小鼠;而转入Lpsn/Ran cDNA无内毒素耐受现象。由此可见,Lps/Ran在某个环节也参与了内毒素信号转导效应。使用功能性cDNA表达克隆方法和C3H/HeJ的B淋巴细胞作为检验细胞,Wong等分离出Lpsn/Ran的cDNA,并编码Ran/TC4 GTPase,其上游非翻译区的870位点处由胞嘧啶取代其胸腺嘧啶,结果引起mRNA结构出现显著改变。LpsdRan的cDNA表达在体内对内毒素敏感小鼠有抗休克保护反应,这是由于受到刺激的巨噬细胞所分泌的TNF-α,IL-1表达下调,两种Lpsn/Ran和 LpsdRan的 mRNA 的稳定性不存在差异,起初其蛋白质总量类似,但是在稳定的状态时,原代培养的巨噬细胞和B细胞中的Lpsd/Ran是Lpsn/Ran总量的5~10倍,两种蛋白质均可以从细胞质迁移到细胞核内,但Lpsn/Ran迁移的速度比Lpsd/Ran要慢。在稳定状态时,尽管两种蛋白质是完全相同的,但Lpsn/Ran的总量却下降,由于两种mRNA 的结构不同,可能mRNA在细胞内定位存在着差异。更多的Lpsd/Ran GTPase积聚在细胞核内,确信能够改变信号转导的效力,所以出现LPS介导的信号转导的下调性生物学效应。因此,Lps/Ran是LPS介导的信号转导的重要靶位,Lpsd/Ran cDNA可能在基因治疗休克方面有益。可以想像,LPS通过酶学级联反应激活多个转录因子,但这些转录因子需要转位入细胞核内,方可以与基因的调控序列结合,并发挥其效应。而这些分子均为大分子物质,需要通过核孔复合物参与,即Ran等参与,而Ran蛋白质表达的量又直接影响转录因子入核的效率和数量;同时,在基因转录成mRNA时,也需要转出到细胞质,才可以翻译蛋白质,如TNF-α、IL-1、IL-6、IL-8、NO等,如果在mRNA转出时出现障碍,势必影响细胞因子的表达,若炎症因子表达低下,则其表型对内毒素耐受,类似于TLR4突变的表型。所以,有理由认为可以通过转染突变型Ran到宿主细胞内来促使巨噬细胞对内毒素产生耐受,以减少细胞因子的分泌,并降低内毒素血症等败血症的病死率。机体的调节也包括内毒素耐受的发生和吞噬细胞对GNB和内化功能的增强。这些因素对内毒素的信号转导效应产生负性调节作用。
参数原理
2023.03.16
G蛋白等分子在内毒素信号转导效应中影响其基因的表达
在内毒素信号转导效应中,其他因素也会影响其基因的表达,如G蛋白和小G蛋白Ran-GTPase的参与,其中该LPS/Ran基因的突变能导致内毒素耐受现象。当用百日咳毒素(pertusis toxin)使巨噬细胞G蛋白Gi的近C端的Cys残基发生核糖基化时,修饰后的Gi不对受体介导的信号作出反应而处于持久失活状态,此时用内毒素进行刺激可显著降低细胞因子的合成和分泌。可见,G蛋白也参与了机体对内毒素反应的调节。lps基因位点区域也编码Ran/TC4蛋白质,Ran/TC4蛋白质是一种GTP酶,Ran/TC4的命名是因为与畸胎瘤(tetracarcinoma)中 Ras家族的第四结构域同源,该酶对细胞核进行物质转运非常重要,即具有核转运(nuclear transport)功能。Ran家族为G蛋白超家族中的一个家族,在核内外物质转运起着重要性作用。G蛋白,即鸟苷三磷酸结合蛋白,作为一个蛋白质家族,其中包含大量结构和功能极为相似的成员,在细胞信号转导过程中起着偶联膜受体和效应器的中介作用。它与GTP结合时为活化状态,与GDP结合时为失活状态。根据其分子大小和结构的不同,通常分为两大类:①异源性三聚体G蛋白(heterotrimeric GTP binding protein),由A、B、C三类亚基组成,相对分子质量约为100000,简称为G蛋白。②单链的小分子G蛋白,通常称为小G蛋白(small G-protein),相对分子质量在20000~30000之间。小G蛋白家族的分类(哺乳动物)可以分为Ras (H-Ras、K-Ras、N-Ras 等)、Rho(RhoA、RhoB、RhoC,RhoG等)、Rab(Rab1,Rab2,Rab3,Rab4等)、Alf、Ran等。Ran为 Ras样核蛋白(Ras-like nuclear protein),是一种小分子鸟嘌呤核苷三磷酸酶(GTPase),核内含量丰富。Ran是胞核和胞质进行大分子物质交换所必需的物质。Ran家族由诸多成员组成,包括Ran-GTP(GTP-bound Ran)、Ran-GDP(GDP-bound Ran)、Ran-GEF1(Ran-GTP-exchange factor 1)、Ran-BP1 (Ran-binding protein-1),Ran-BP2、Ran-GAP(Ran-GTP-activating protein)等。Ran GTPase是小G蛋白家族的成员,可水解GTP为GDP,释放出能量,参与Ran的生物学作用如核转运(nuclear transport)、微管星体形成、纺锤体装配等。小G蛋白一般只有一个亚单位,为单聚体蛋白。GTP酶的活性也需其他因子调节,其功能与信号的传递、细胞生长分化、蛋白质合成、合成后加工及物质转运等有密切关系。当细胞处于稳定状态时,Ran蛋白主要存在于细胞核内。小相对分子质量物质自由进出胞核内,可以通过核孔复合物(nuclear pore complex,NPC)自由弥散作用完成物质交换。相反,相对分子质量大于40000的大分子物质转位需通过核孔复合物进行主动运输,该过程需要消耗能量,并具有分子选择性的特点。NPC的相对分子质量大约为124×106,跨越核膜,由100余种不同多肽所组成,这些多肽统称之为核孔蛋白(nucleoporin)。核蛋白输入受体(nuclearprotein import receptor),包括输入蛋白α(importin-α)和转运蛋白(transportin);衔接蛋白包括输入蛋白β(importin $)和 snurportin、RP1-α。输入蛋白α核定位序列(nuclearlocation sequence,NLS),结合结构域(NLS-binding domain)通过其中一个核定位序列来识别和结合蛋白质,结合的蛋白质随输入蛋白α一起进入核内。带有NLS结构蛋白(NLS-bearing protein)的转位需要通过Ran的GTP酶与importin-α共同作用才能够实现。核孔复合物停泊在NLS结构上,需通过importin β与伸到胞质的其他核孔蛋白或纤维相互作用才能完成。Ran的GTP酶可由胞质内的 RanGAP(Ran GTPase activating protein)分子激活并调节其活性。Ran-GTPase中的 GTP可以被RCC1(regulator ofchromosome condensation)所置换,改变其活性,而RCC1仅存在于细胞核内。所以,RanGTPase主要在核内发挥效应。目前对核蛋白输出和RNA的核输出所知甚少,估计可能是通过上述类似途径进行的。Ran-GDP和Ran-GTP在胞质和胞核之间循环,伴随蛋白转输。除此之外还有其他功能:如最近发现,Ran GTPase在细胞有丝分裂过程起着重要作用,因为Ran-结合蛋白(Ran binding protein,Ran-BP),如 RanBPM(Ran binding protein in microtubule organ-ziting center)定位在中心体上,而中心体是有丝分裂纺锤体的生长点。体外使用非洲爪蟾属的未受精卵细胞系统检验发现,Ran 在不同形式的纺锤体形成中发挥作用。抗RCC1抗体(RCC1为 Ran GTP中GTP置换因子)能阻止微管星体和纺锤体形成,若加入大量Ran GTP可恢复上述结构组装。
参数原理
2023.03.15
Nramp 1分子影响内毒素反应敏感性
内毒素反应敏感性也涉及Nramp 1(natural resistant associated macrophage protein-1)、主要组织相容复合体Ⅱ类分子(major histocompatibility complex Ⅱ ,MHCⅡ、G蛋白、K+通道、Ran-GTPase等因素。Nramp 1为天然耐受相关巨噬细胞蛋白-1,该蛋白质突变可以降低细胞吞噬体的酸化作用,对分枝杆菌感染具有易患性,Nramp 1编码一个完整膜蛋白,在受感染的巨噬细胞中能够被募集到吞噬体的胞膜上。Hackam等运用微荧光比例成像技术进行显色,比较野生型Nramp 1和突变型Nramp 1小鼠的巨噬细胞特性,分析含有惰性颗粒和活体分枝杆菌的突变型Nramp 1巨噬细胞中的吞噬体的pH值。与突变型Nramp 1相比,含有牛分枝杆菌的野生型巨噬细胞吞噬体中的pH值更低。但不能用质子消耗,超氧化物的歧化作用、吞噬体的缓冲能力、反向离子转导,或质子“渗漏”的比例失调来解释酸化程度的不同。Nramp 1能影响细胞内分枝杆菌繁殖,主要是通过调节吞噬体 pH值高低进行的,其中Nramp 1起着关键性作用。在LPS发生效应时,可能会涉及LPS内化。TLR2识别革兰阳性菌的脂蛋白后,被内化到吞噬体内,引发信号转导效应。至于TLR4是否同样也内化吞噬体内,尚无文献报道。吞噬体的不同pH值会影响配体-受体的相互作用。由于Nramp 1能够作用于吞噬体,产生显著酸化效应,并导致LPS构象的改变,故不同酸碱度能够影响LPS 的构象,例如LPS负电荷的多少影响巨噬细胞IL-6的分泌,因而产生不同的效应。当Nramp 1突变影响吞噬体的pH时,势必也影响LPS的构象,引起宿主不同的反应,以致出现内毒素反应低下的表现。
参数原理
2023.03.15
嘌呤受体影响巨噬细胞的内毒素生物学活性
巨噬细胞表达多种P2受体亚型,细胞外核苷酸能够通过嘌呤能受体影响巨噬细胞的许多生物学活性,如影响诱导NO合成酶Ⅱ(NO synthase,NOS)表达。使用氧化ATP(oxidized ATP,oATP)可以使内毒素血症的小鼠免于死亡,另外也可调节NO和氧自由基的表达从而影响LPS信号转导效应等。巨噬细胞通过P2Z/P2X7,调节自由基介导的杀菌机制。体外应用γ干扰素或LPS活化小鼠巨噬细胞,能够杀死结核分枝杆菌和卡介苗,这主要通过NO依赖性的机制实现。Sikora等用oATP抑制INF-γ或LPS活化的J774细胞后,再观察对细胞内BCG的杀死效应,结果表明oATP作为P2受体抑制剂,用它一起培育细胞24h后,活化巨噬细胞生产NO和杀死细胞内BCG的活力下降58%。而用oATP预处理并不能改变巨噬细胞感染细菌的效率,但可降低NO和抑制杀菌能力达65%。在BCG和LPS反应体系中,P2Z能够调节一氧化氮合成酶Ⅱ(NOS Ⅱ)的表达。巨噬细胞产生大量的NO需要NOSⅡ进行催化。实验证实,oATP能够促使NOSⅡ的生成。Northern blot分析显示,BCG-感染J774细胞后,NOS Ⅱ的mRNA表达上调,而oATP能够抑制上调。这些资料证实,oATP是通过抑制NOSⅡmRNA和蛋白质的积聚来阻止NO的生成的。NOSⅡ基因的启动子中存在NF-κB、AP-1的结合位点,因而NF-κB、AP-1也参与NOSⅡ基因表达的调节,oATP能够抑制TNF-α,LPS、BCG诱导的NF-κB的活性,其抑制效率分别为82%、77%、65%。但oATP却不能抑制H2O2,诱导的NF-κB的活性,这表明oATP的抑制具有特异性,且是经受体介导的NF-κB激活的途径进行的,所以P2受体是通过干扰NF-κB、AP-1的活化来阻止NOSⅡ合成。NO、ROI由活化的巨噬细胞生成,在宿主的防御反应中起着重要作用。oATP能够抑制反应性氧中间物(reactive oxygen in-termediates,RO1)的生成,另外,P2Z基因敲除骨髓源性巨噬细胞ROI的生成,在数量上类似于PMA刺激的野生型巨噬细胞,因此P2Z受体阻止ROI 的生成可能是通过非P2X7,依赖性机制进行的。细胞外的核苷酸存在于细菌感染的位置上,实验表明结核杆菌感染能够促使巨噬细胞释放ATP,且呈现剂量依赖性,与亚硝酸盐积聚程度相一致,这反映被结核杆菌溶解的细胞可以使胞内的核苷酸释放。机体胞内核苷酸可从血小板、死亡细胞、损伤的细胞中释放出来,导致炎症和组织破坏部位出现细胞外高浓度的核苷酸。由于ROI和NO本身可促使病理炎症反应和毒性作用,通过细胞外核苷酸变化调节,促进其主要在炎症部位进行的表达,使未遭受损伤的组织免遭损害,因此使得有害的巨噬细胞效应器只在适当的生理背景中发挥作用。
参数原理
2023.03.14
嘌呤受体参与内毒素效应的调节
细胞外的核苷酸可以发挥自分泌(autocrine)和旁分泌(paracrine)的激素样作用,并调节许多细胞生理活动和参与免疫炎症及病理反应,如核苷酸(ADP、ATP及其衍生物)能使细胞膜通透性升高,允许部分小分子物质自由通过等。从细胞释放出来的核苷酸,能够同特异性细胞膜上嘌呤受体(purinergic receptor)结合并发生效应。嘌呤受体既可作为离子通道,也可偶联于磷脂酶、腺嘌呤环化酶并驱动信号转导途径(adenyl-cyclase signal transduction pathway)。嘌呤受体可分为两大家族:P1和 P2。P1由腺苷所激活;P2由ATP、ADP及其衍生物所激活,P2可再分两类:P2X和P2Y。P2X嘌呤受体家族至少含有7个不同亚型,即从P2X1到P2X7,每个均是两次跨膜离子通道蛋白质,选择性分布在易兴奋细胞上,如神经元、平滑肌细胞、横纹肌细胞、巨噬细胞。P2X嘌呤受体通道与ATP结合,导致对Ca2+具有通透性,作为非选择性的阳离子通道,一旦激活,细胞外的Ca2+中可以进入胞内,使胞内Ca2+浓度升高。P2Y嘌呤受体7次跨膜,与G蛋白偶联,参与细胞的代谢营养,其至少有6个不同的亚型,P2Y,到P2Y1到P2Y6嘌呤受体分布广泛,表达在不同起源的细胞上,如上皮细胞、内皮细胞、平滑肌细胞、横纹肌细胞,成纤维细胞、神经元细胞、单核-巨噬细胞,受体通过异源性三聚体G蛋白偶联到效应器上,发挥其刺激或抑制腺苷环化酶的作用。P2Y嘌呤受体也能够刺激磷脂酶的活性,并可增加胞内Ca2+浓度。另外,通过受体的介导和促使前列腺素释放的机制,P2Y嘌呤受体可增强cAMP的产生。P2Z受体(P2X7)几乎表达在所有炎性免疫细胞和某些转化细胞株(如某些癌细胞株)。P2Z受体的胞外ATP通道开放后所引发的反应有:①Ca2+和Na+快速内流。②K+快速外流。③细胞膜发生去极化。④磷酸化小分子代谢产物外流。⑤细胞变圆肿胀。⑥抑制巨噬细胞的胞饮和吞噬活动。⑦细胞内微管网络解聚(disaggregation of the microtubule network)。⑧胞吐颗粒内容物释放。⑨细胞死亡,包括细胞凋亡。⑩IL-1β等细胞因子成熟和释放;近来还发现其参与细胞内分枝杆菌的非NO依赖性杀伤免疫反应。P2Z可从3个方面有别于其他P2受体:①受体激活不仅形成内向的离子电流,也出现细胞的渗透性(permeabilization)增强。②苯甲酰基-苯甲酰基ATP[2',3'-(4-benzoyl)benzoyl ATP]是P2Z最有效的激动剂,但ATP效力较低。③其激活效应能被细胞外镁离子所抑制。大鼠P2X7,功能是其可形成一个对小分子阳离子具有渗透性的通道,也可形成溶解细胞的孔道。短暂使用ATP(1~2 s)刺激P2Z受体,其表现类似于其他P2X受体,并可以短暂性开放通道;重复或延长使用激动剂造成细胞渗透化;降低细胞外镁离子浓度可增强其生物学效应。渗透化的发生涉及由239个氨基酸残基所组成的胞质区C端,因为C端缺失尾部177个残基后不能出现细胞渗透化,但不影响小分子阳离子通道。P2受体参与LPS的巨噬细胞激活反应,P2X7能引起LPS诱导的ERK1(extracellularsignal-regulated kinase 1,细胞外信号调节激酶1)和ERK2的最大限度的活化,上调诱导型NO合成酶(iNOS)的表达。P2X7的C端与LBP和BPI的保守结构域同源,P2X7在内毒素信号转导和巨噬细胞的活化中起着重要作用,可能成为内毒素血症治疗的靶位。
参数原理
2023.03.14
迷走神经对内毒素反应调节的应用实例
直接刺激迷走神经传入纤维,可抑制内毒素的全身性炎症反应。将成年雄性Lewis大鼠行双侧颈部迷走神经切断术后作实验组,以分离迷走神经不切断其神经纤维作对照组。实验组的大鼠用内毒素行致死性刺激之前和之后10min,直接用电脉冲持续刺激其神经纤维末端,迷走神经传入纤维的电刺激能够显著减低血液中TNF-α的含量;而对照未行电刺激组,其血液中TNF分泌总量的峰值显著增加。内毒素血症中,肝脏是TNF-α的主要来源,电刺激迷走神经末端能够降低肝脏在内毒素刺激下TNF-α的合成,所以传入迷走神经信号发放参与体内的TNF-α产生的调节。迷走神经的电刺激能诱导抗炎症因子生成,抑制TNF-α产生。测定内毒素血症动物的抗炎因子皮质酮和IL-10水平发现,在假手术对照组中,皮质酮和IL-10总量的升高与内毒素血症生物学效应具有相关性。迷走神经切断能够显著降低皮质酮的浓度,部分原因是由于迷走神经切断后减弱了迷走神经传入纤维向大脑发放的神经冲动,因为大脑在接受外界的刺激后引发一系列下丘脑-垂体-肾上腺信号的发放。正常情况下,皮质酮能够下调TNF-α产生,所以皮质酮下降能促使TNF-α表达升高。直接电刺激外周迷走神经纤维并不能使皮质酮和IL-10水平升高,所以迷走神经刺激导致的TNF-α的表达下降不是由于皮质酮和IL-10的抗炎症介质所致。外周迷走神经刺激显著减弱可使LPS诱导的大鼠发生休克。TNF-α是内毒素休克的早期主要介质。在迷走神经切断不行电刺激的大鼠中,内毒素休克发生的时间明显缩短,这可能是因为皮质酮分泌减少,机体对TNF-α反应增高所致。ACh为扩血管物质,介导NO依赖性血管阻力的松弛反应,并造成血压下降。传出迷走神经的刺激下调了TNF-α的产生,降低了致死性内毒素血症休克的发生率。人类外周的未分化单核细胞中大量表达的ACh,能够抑制细胞因子的合成。α-金环蛇毒素敏感样的烟碱型受体的活性能够调节巨噬细胞的细胞因子的反应。神经免疫反应——“胆碱能抗炎症途径(cholinergic anti-inflammatory pathway)”,能够调节全身性炎症反应,副交感神经系统兴奋性的强弱能够影响内毒素血症者血液循环中TNF-α的量和休克反应。胆碱能抗炎症途径能够在很短时间内发挥效应,而体液抗炎症反应途径相对较慢。在全身性应激状态下,副交感神经纤维的活化,降低了致死性外周免疫反应的幅度,从而给宿主带来保护性效应。
参数原理
2023.03.13
迷走神经参与宿主对内毒素反应的调节
机体在损伤和感染时为求得内环境的稳定,需要平衡前炎症途径和抗炎症途径。中枢神经系统可以通过体液激素机制调节内毒素的全身性炎症反应。内毒素和细胞因子能促使传入迷走神经纤维向大脑发放冲动,以刺激下丘脑-垂体-肾上腺的抗炎症反应。乙酰胆碱(ACh)为迷走神经纤维的主要递质,在体外能够显著降低人巨噬细胞被内毒素激活后TNF-α、IL-1、IL-6、IL-18的释放;而对抗炎症因子IL-10分泌则无明显影响。在大鼠体内诱发致死性内毒素血症后,直接用电刺激其外周迷走神经纤维能够抑制肝脏TNF-α的合成,减低血浆TNF-α的浓度峰值,从而阻止内毒素休克的发生。迷走神经信号发放是神经冲动传入回路的关键因素,在全身性内毒素血症和细胞因子血症(cytokinaemia)中能够调节促肾上腺皮质激素的合成和发热反应。通过烟碱型乙酰胆碱受体反应使传入迷走神经信号发放并促进淋巴细胞从胸腺中释放出来。研究发现,烟碱能有效地治疗某些炎症性肠病。在炎症性肠病的吸烟患者中,结肠黏膜的前炎症因子的释放显著降低,因而推测胆碱能副交感神经系统能够调节全身性炎症反应。Borovikova等已证实,培养的巨噬细胞用内毒素刺激后,再加入乙酰胆碱能抑制巨噬细胞TNF-α的释放,并呈剂量依赖性。用化学结构不同于乙酰胆碱的胆碱受体激动剂卡巴胆碱(carba-chol),也能抑制TNF-α的释放。用测定TNF-a mRNA的方法进行TNF-α分泌抑制的机制分析,发现TNF-a mRNA与对照组无区别,认为其抑制机制是通过转录后的机制抑制TNF-α分泌的。在巨噬细胞中,ACh能显著减弱LPS(脂多糖,lipopolysaccharide)刺激后的TNF-α的免疫反应性,已证实ACh对人类巨噬细胞TNF-α合成的抑制效应是通过TNF-α基因转录后环节抑制其蛋白质合成的。外周单核细胞可表达烟碱型和蕈毒碱型ACh受体,烟碱型受体能够显著抑制TNF-α的释放,并呈剂量依赖性;而蕈毒碱也显著抑制TNF-α的释放,抑制效应的程度小于ACh和烟碱。使用特异性的蕈毒碱拮抗剂阿托品,也不能使ACh处理过的巨噬细胞恢复TNF-α的合成分泌,α-蜗牛毒素(α-conotoxin)能够恢复被ACh处理过的培养巨噬细胞的抑制效应,并呈剂量依赖性。这些实验证实,ACh在抑制LPS诱导的巨噬细胞释放TNF-α的反应中主要是通过α-金环蛇毒素(α-bungarotoxin)即敏感的烟碱型受体的机制进行的。在活体中可能由巨噬细胞烟碱型和蕈毒碱型ACh受体共同参与抑制TNF-α分泌。
参数原理
2023.03.13
内毒素信号转导的途径及产生的原理反应
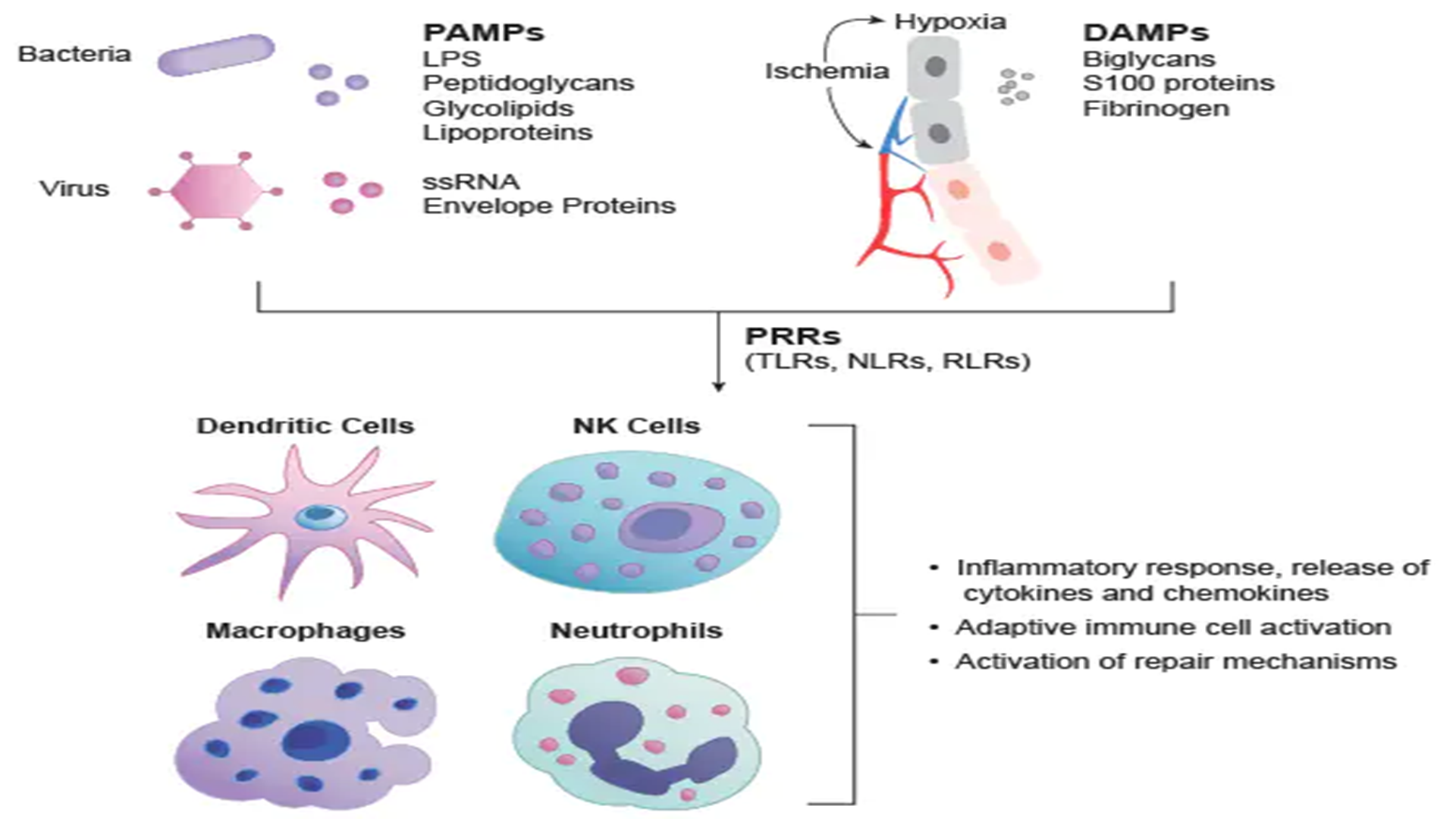
近来发现,Toll相互作用蛋白(Toll-interacting protein ,Tollip)参与IL-1的信号转导途径,并认为其也参与TLR受体的信号转导作用,因为IL-1受体的胞质结构域与TLR的结构域具有高度同源性。小鼠和人类Tollip均由274个氨基酸组成,97%的氨基酸序列相同,相对分子质量为28000。Tollip有一死亡结构域(D-D),能够与白细胞介素-1受体相关激酶(interleukin-1 receptor-associated kinase,IRAK)的D-D结合形成Tollip-IRAK复合物。在未受到外界刺激时,该复合物存在于细胞质内,未与TLR结合;一旦 TLR受到外界刺激发生构象改变后,Tollip-IRAK和衔接蛋白(adaptor)MyD88可同时被募集到IL-1受体的TIR(Toll/IL-1 receptor)结构域上,促使IRAK相互靠近引发自身磷酸化,即IRAK分子各自使对方丝氨酸/酪氨酸残基发生磷酸化,因而启动了酶学的级联反应。IRAK作用于下游两个衔接蛋白质TRAF6(tumor-necrosis factor receptor-associatedfactor 6)和ECSIT(evolutionarily conserved signaling intermediate in Toll pathway),使TRAF6发生寡聚化(oligmerization),并可以使TAK-1 (transfor- ming growth factor-β activating kinase-1)和 TAB1(TAK1-binding protein 1)所形成的复合物激活。TAK-1为MAP-3激酶(MAPKKK)家族的成员,当TAK1受到激活后,可以使其底物NIK(NF-κBinducing kinase,即 MAPKK)发生磷酸化而被激活,而后者又进一步激活IKK复合物( IκB kinase complex)。该复合物由IKK-α、IKK-β、IKK-γ所组成,IKK-γ为脚手架蛋白(scaffold),因缺乏酶学活性,也称为NEMO(NF-κB essential modulator),是 LPS、TNF及佛波酯(PMA)诱导NF-κB活化所必需的,因其氨基酸末端或羧基末端发生缺失能够阻止NF-κB的活化。IKK由多个卷曲螺旋模体(coiled coil motif)所组成,含有亮氨酸拉链(leucine zipper)结构,通过亮氨酸拉链募集上游的激活物到达IKK复合物上,激活IκB激酶。 lB激酶可使 IkB磷酸化,导致IrB被蛋白酶体(proteasome)和泛蛋白连接酶(ubi-quitin ligase)进行泛蛋白化而被降解,释放出NF-κB的p65/p50,并促使其转位入细胞核内,与相关基因的启动子序列位点结合,以诱导基因表达。在LPS信号转导的同时也激活了活化蛋白-1(activating protein-1,AP-1)的家族成员Jun和Fos 等转录因子,共同参与相关基因表达的调节。细胞因子的产生需要AP-1和 NF-κB等转录因子的参与进行调控。LPS通过膜上受体进行信号转导的模式见图7-1。
参数原理
2023.03.08
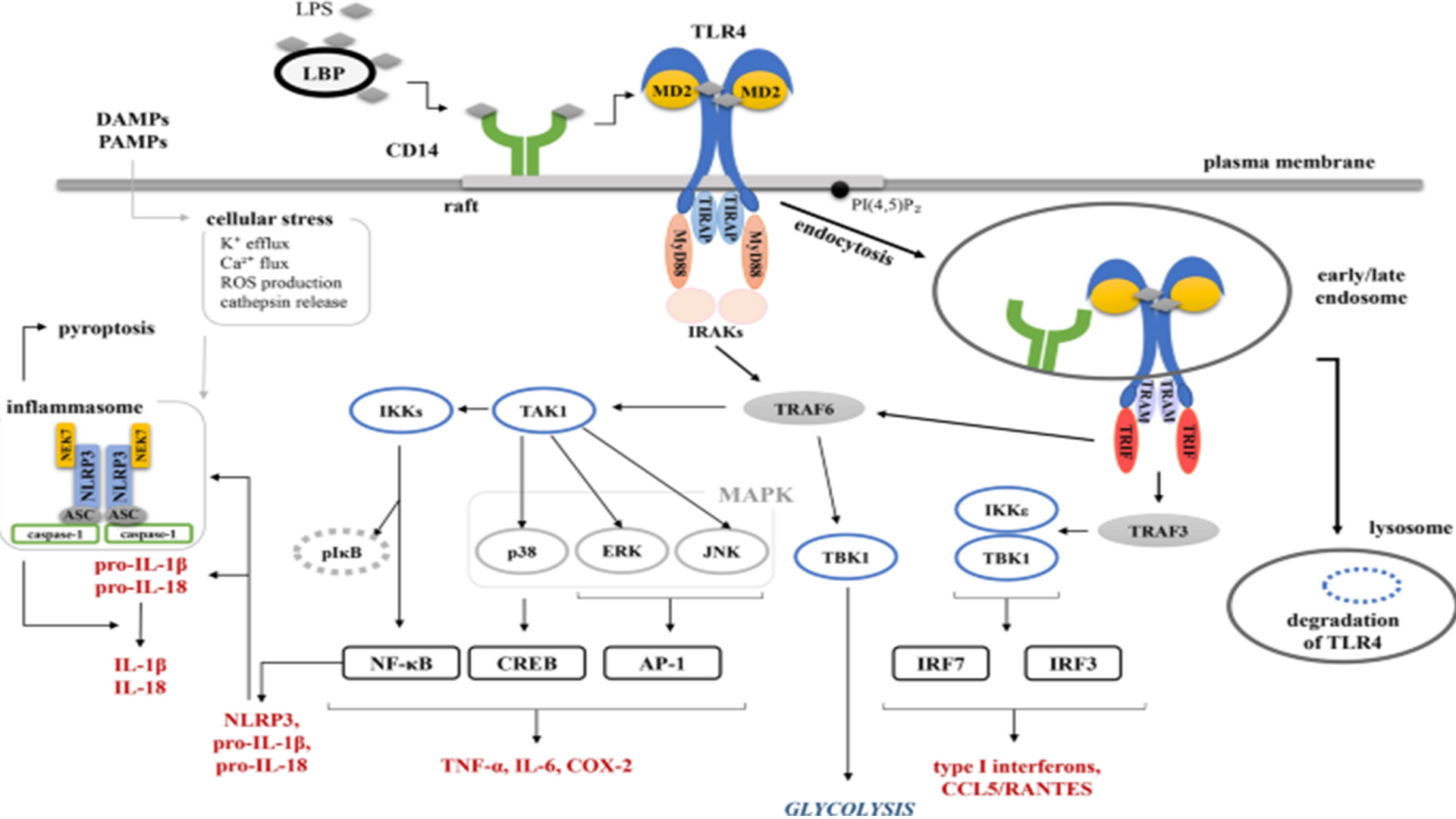
各分子在内毒素信号转导途径的作用
内毒素分子从革兰阴性菌的外膜上脱落后,可以与血液中多种成分结合,其中主要有LBP(lipopolysaccharide-binding protein,脂多糖结合蛋白)、杀菌渗透增强蛋白(bactericidal/permeation increasing protein,BPI)、可溶性CD14(soluble CD14,sCD14),以及高密度脂蛋白(HDL)和极低密度脂蛋白(very density lipoprotein,VLDL)等血浆脂蛋白。LPS(lipopolysaccharide,脂多糖)为两性物质,自身易于形成LPS聚集体或微团(micelle),LBP为急性期蛋白,在内毒素血症时表达显著升高。血液LBP会迅速与LPS结合,能促使LPS聚集体或微团解离为LPS单体,并形成LBP-LPS复合物,该复合物可以将LPS转递给血液中的sCD14,或者转递给单核细胞、巨噬细胞、中性粒细胞等免疫细胞膜上的膜结合型CD14(membrane-bound CD14,mCD14)以及脏器实质细胞如肝细胞上的mCD14受体;也可以直接以LPS-LBP-sCD14复合物的形式转递给mCD14阴性细胞,如内皮细胞、上皮细胞等。另外,sCD14本身也可将LPS传递给mCD14阳性细胞。低浓度内毒素血症时,在有LBP和CD14存在的情况下,内毒素可引发出显著生物学效应,也就是说对LBP和CD14具有依赖性;而在高浓度内毒素血症时,即使无LBP和CD14存在,也可引出显著的生物学效应,此时LBP通过其他受体,如CD11/CD18类整联蛋白(in-tegrin)、清道夫受体(scavenger receptor)、膜外突蛋白(moesin)、L-选择素(L-seletin)、CD55(即 decay accelerating factor,DAF,衰变加速因子)等,甚至直接同细胞膜上跨膜分子TLR4胞外结构域相结合,诱发信号转导效应。在内毒素发挥生物学效应的过程中,LBP的主要作用是催化LPS聚集体解离为单体并促使LPS同CD14等结合,当LPS同TLR4等受体结合后,LBP随即又从细胞表面复合物上解离出来,参与其转运功能的再循环,甚至可促使革兰阴性菌细胞膜上的LPS发生脱落。CD14分子以两种形式存在,即mCD14和sCD14。不同表达形式的CD14分子分布在不同细胞上,mCD14主要分布在单核细胞、巨噬细胞、中性粒细胞等;sCD14则分布在上皮细胞、内皮细胞上。具有一定立体化学构象(如锥体型或凹槽形,这里指在X线的横切面中LPS的疏水区大于亲水区)的LPS能够更好地与TLR4的胞外结构域发生密切的物理接触,只有形成稳定的受体配体复合物后才能诱导TLR4发生受体同源性或异源性受体二聚化或受体多聚化,发生受体聚合效应,最后导致其胞质结构域的空间构象改变,这样方可募集其信号下游分子锚定到TLR4受体的胞质结构域上。也就是说TLR的胞质结构为其他分子提供锚定的部位。另外,LPS要充分发挥生物学效应也需要MD-2的参与,MD-2的结构类似与CD14和TLR,具有亮氨酸富集域(leucine-rich region,LRR)结构,其N端仅具有一个疏水性伸展区(stretch),无法锚定到细胞膜上,属于分泌到细胞外的蛋白质,凭借其LRR与TLR的同源结构LRR发生蛋白质相互作用而共同表达在细胞膜上。当细胞表面无TLR表达时,MD-2则分泌到组织液中,而在细胞膜无法检测到MD-2分子的存在。由于该蛋白质的氨基酸序列与MD-1氨基酸序列具有显著的同源性,故命名为MD-2。对MD-2的进行性突变,如通过基因敲除或反义核苷酸技术来阻止其表达,则细胞对内毒素的反应性会显著下降,并导致内毒素耐受的发生,可见MD-2也参与LPS的生物学效应。MD-2和TLR均具有LRR的结构,能够通过LRR结构同具有类似结构的分子发生蛋白质-蛋白质相互作用,结果加速LPS与TLR4结合,稳定TLR受体聚合后的空间构象,降低LPS与TLR4结合时所需要的能量,为LPS提供更多的结合位点等。最近证实,在NF-kB活化之前,CD14已同TLR4发生紧密靠近,说明CD14可以作为LPS的中继站加速LPS同TLR4的接触,也可能为它们的结合提供能量。由于CD14在每个巨噬细胞上的表达近106,而TLR4估计为103,所以有CD14的参与更有利于LPS同TLR4发生效应,也就是说CD14具有浓集LPS的作用。
参数原理
2023.03.08
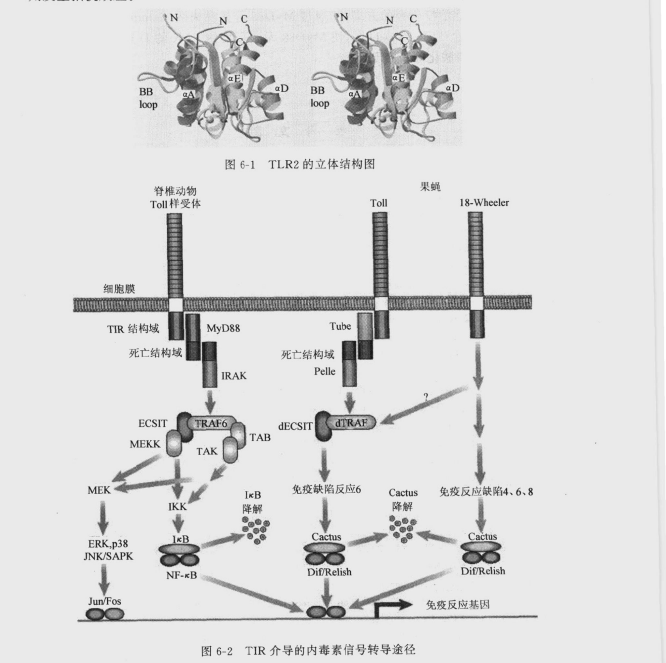
TLR在内毒素耐受中的作用及今后的研究方向
一、TLR在内毒素耐受中的作用C3H/HeJ和C57BL/ScCr小鼠品系对内毒素天然耐受,其机制是TLR4发生了突变。而在人为诱导的内毒素耐受的巨噬细胞中,表现为TLR4表达的下调,这表现了宿主的一种适应性的变化。人的TLR4突变同样也可导致内毒素耐受。二、TLR的未来研究方向TLR使机体天然免疫和获得性免疫之间架起一座桥梁,协调夭然免疫和获得性免疫,以共同抵抗病原微生物或病变坏死组织等。TLR主要参与天然免疫﹐以模式识别方式激活免疫应答。先天免疫识别由胚系编码受体所介导,这些受体不仅识别与微生物病原体结合的保守分子模式,而且与信号转导途径发生偶联,控制着许多可诱导的免疫反应基因的表达。TLR和核因子κB(nuclear factor-κB,NF-κB)信号转导途径广泛存在于哺乳类、昆虫类和植物类中,代表着最古老的宿主防御系统。哺乳类的B细胞所特有的Toll样受体蛋白RP105胞外LRR结构域与人类Toll受体LRR非常相似,被认为与进化有关。LPS激活B细胞是通过RP105和TLR4协调作用激活转录因子(在B细胞中TLR4为低量表达),RP105与TLR有高度相似性。获得性免疫是机体与抗原接触所产生的免疫力(包括主动体液免疫与主动细胞免疫),是经过基因重排后表达高度特异性受体介导免疫应答。由先天免疫分泌协同刺激分子和细胞因子调节获得性免疫。内毒素也能通过先天免疫刺激机体产生获得性免疫,如分泌抗LPS 抗体、细胞因子、黏附分子,E-选择素、组织因子等。LPSBLP、肽多糖、胞壁酸等微生物产物进入机体后﹐刺激机体免疫产生保护效应,但过多细胞因子也带来不利影响,如出现发热,DIC、休克、多器官功能衰竭等。TLR2也是机体感知病原体和抗感染必不可少的,人类TLR2可能在抗微生物感染中起着关键性作用。细菌脂蛋白、肽多糖、胞壁酸等分子通过TLR2进行信号转导,不同病原体的分子致病途径不一样,BLP通过TLR2途径使细胞激活和凋亡,而TLR4不能转导BLP信号。胞壁酸也是通过TLR2进行信号转导发挥毒性效应。这表明不同的TLR成员具有某些相同功能和不同作用。当机体自身组织或细胞出现病变时,可出现TLR内源性配体,诱导免疫反应。当机体处于应急状态时,可诱导热休克蛋白表达,并作为TLR的配体,诱发免疫反应。在发生免疫紊乱性疾病如糖尿病时,可以诱导TLR等应答。目前认为自身免疫反应也与TLR受体的识别和激活中所产生的过量的细胞因子相关。病原体之所以可逃避宿主的免疫,是由于干扰了TLR的信号转导作用,减少了细胞因子和辅助因子的分泌,如天花病毒编码的A46R和A52R蛋白可阻止TLR信号转导而致病。若使用A46R等类似物处理内毒素血症,可以减轻内毒素血症的毒性反应。随着基因工程的进一步深入,会有更多的TLR家族成员被发现。目前认为TLR不存在丰余现象,可能不同的配体有不同的TLR对其进行更精确地识别。TLR的空间结构如何识别病原体还有待阐明。在TLR信号转导中,应有MD-2类似物存在,即MD-2也应该存在家族现象,TLR下游分子也应该有更多的同源体,如IRAK,TRAF,IKK等。通过转染过量Tollip 到细胞内,可以抑制NF-κB的活化。转染Tollip质粒到机体单核细胞内,是否可减轻内毒素血症所造成的损害还有待实验证实。有报道TLR2内化到巨噬细胞的吞噬体,可诱导细胞因子产生。但目前认为,TLR2并不是LPS的受体,因此不能够确定TLR2内化与LPS的信号效应是否有关。现在尚无TLR4和LPS同时进行标记的内化报道。关于阻止TLR或LPS其中之一物质内化对细胞因子的诱导有何影响以及TLR发生内化是否可以引起受体数目减少或继续参与受体再循环,尚无文献报道。对TLR的立体化学结构需要进行X线衍射分析,所得到的空间结构图,有利于了解LPS如何同TLR发生构象结合,并阐明其效应机制(图6-1),解释不同的空间结构对生物效应的影响,如:锥体型立体结构的LPS能够有限发生效应,而圆柱性立体结构的LPS则发生拮抗效应。Beutler最近报道,抗TLR4氨基末端部分特异性多克隆抗体并不能拮抗LPS的效应,相反具有较低的拟内毒素(endotoxin-mimetic effect)活性,因此认为TLR4 不一定要求LPS同其结合才发挥效应,相反TLR4具有自身激活的特性,只要其细胞外结构的构象改变,即能诱使TLR4 发生二聚化或多聚化,并使其胞质的构象改变。一般认为TLR4是LPS反应的必需的信号转导分子,但TLR4可以独立发挥作用,不依赖于LPS;LPS 作用不需要内化,也不需要结合到细胞内的次级靶位才发挥效应。利用TLR等受体拮抗剂,或干预信号转导某个中间环节(图6-2),阻止其信号下传,是今后内毒素血症治疗研究的方向,如通过MyD88等显性失活(dominant negative),或在胞质区人为结合TLR的D-D区,使MyD88无法募集到TLR的D-D上,或通过防止IRAK发生自身磷酸化等来实现。
参数原理
2023.03.03
人类TLR的生物学作用
脂多糖(lipopolysaccharide,LPS)是一种内毒素(Endotoxin),当其作用于人类或动物等其他生物细胞时,就会表现出多种的生物活性。LPS的生理作用是通过存在于宿主细胞的细胞膜表面的Toll样受体(Toll-like Receptor、TRL)4(TRL4)而体现的。下面阐释人类TLR的生物学作用:(1)诱导细胞因子的表达,调节获得性免疫反应,使机体及时地作出免疫应答,清除病原体,在天然免疫中发挥着重要作用。TLR可以直接或间接地结合病原体,通过吞噬和内化活动,将病原体及其产物清除,同时也诱导细胞因子和共刺激分子(co-stimulatory molecule)(如B7.1、B7.2)的表达。T细胞激活需要双信号,B7.1可作为T细胞提供第二信号,诱导T细胞激活。TLR激活后能够为T细胞提供双信号,所以TLR能够调节获得性免疫反应。(2〉诱导防御素(defensin)和NO等表达,发挥天然性免疫作用。防御素是非特异性抗微生物的多肽,能够抑制微生物繁殖和杀死微生物,具有广谱的保护宿主的效应。NO能够对微生物发生杀伤作用。(3)参与细胞凋亡:BLP通过TLR2途径使细胞激活和凋亡。内毒素分子也能够诱导细胞凋亡,部分通过TNF-α,经由TNF受体进行信号转导,发生细胞凋亡,也可以与胞质内受体Nod1结合,激活凋亡蛋白酶,诱导细胞凋亡。人类的TLR4突变同样表现为内毒素耐受,易发生反复的革兰阴性杆菌感染。Ar-bour等证实,人类TLR4的胞外结构域发生突变可引起内毒素耐受,表明TLR也参与微生物的免疫反应。在内毒素耐受的巨噬细胞中,TLR4表达下调。至于人类TLR4是否参与胚胎发育有待进一步研究。
参数原理
2023.02.27
内毒素定义和标准化
杂质测试的适当标准是分析测试的重要组成部分。本文概述了美国药典(USP)规定的内毒素标准的各种要求,并详细阐述了内毒素与其他细胞成分不同的定义。内毒素或脂多糖(LPS)是革兰氏阴性菌外膜 (OM)外叶(OL)的组成部分。它是一种独特的分子,被后生动物免疫系统用作原核生物入侵的标记,并作为多种革兰氏阴性菌OM成分(包括磷脂和表面蛋白)中的单一成分出现。 LPS根据USP参考标准质量要求从其他杂质中纯化出来。 高度纯化的材料被用作标准内毒素 (RSE/CSE),它在历史上一直用于分析定义内毒素。在工业上,有些人希望为各种目的制备一种非纯化的或“天然的标准品”,并将这些制剂称为“天然内毒素”。本文概述了美国药典(USP)1规定的一些标准要求,并详细阐述了内毒素与其他细胞成分不同的定义。 一、标准化USP 40一般要求的摘录指出:“美国药典公约(USP标准物质或RS)提供的标准物质是反映特定药物和食品(原料药、生物制剂、赋形剂、膳食补充剂、食品成分、杂质、降解产物、试剂和性能验证标准品)的高度表征本。当批准适合用作USP或国家处方集 (NF) 中文件测试或化验的比较标准(即,作为专著组成部分)时,USP RS也在美国获得官方地位和法律认可。USP 的“杂质参考标准”部分指出:“杂质参考标准可以作为纯化的单一组分材料或作为多种杂质的混合物出现。” 工业界要维持当前的“内毒素”标准(BET ),而不是“革兰氏阴性细胞壁”标准,必须对其进行纯化和高度表征,否则它将成为“混合杂质”标准,并被贴上这样的标签。图1:分解成相关组成部分的内毒素定义二、内毒素的定义鉴于本文的简短性质,只能提供LPS定义的初步草图(图1)。主题将仅限于与内毒素标准化相关的项目:LPS生物合成;宿主反应的相互特异性;革兰氏阴性菌外膜的不对称性;对比成分。1. LPS 生物合成内毒素在自然界中并非随机发生;它是细菌制造过程的产物,该过程涉及九个独立的酶促事件,然后输出到革兰氏阴性细菌细胞表面。LPS中独特的糖包括核心糖、KDO(3脱氧-α-D-甘露醇辛酮酸糖)和O抗原部分中糖的独特排列,用于在表征各种革兰氏阴性细菌食源性疾病暴发(血清分型)时区分细菌菌株。 图2:LPS独特的结构定义3独特的LPS结构以及相关的糖残留物和排列如图2所示。用于“建构”LPS的酶级联,如细菌基因组中编码的那样,没有显示,但Wang和Quinn进行了广泛的详细说明,并支持LPS是一个特定的功能单元。22.宿主反应的相互特异性 后生动物系统已经通过其非常具体的反应定义了内毒素。然而,并非所有后生动物的反应都是相同的。几十年来,基于鲎的测试一直是支持药物测试的有效分析替代品。哺乳动物反应的特异性是极端的。通过脂多糖结合蛋白(LBP)从聚集体中选择(纯化)LPS的单个分子,或者可能作为单体,其中已发现血清白蛋白可代替LBP。4分离后,LPS分子被转移到位于TLR4中的MD-2,并引发跨膜信号事件。这大约是分子所能达到的“纯化”程度。TLR4不仅对分子进行测量,而且还根据亚分子部分的潜在差异发出响应信号。图3:革兰氏阴性菌的LPS激活宿主先天免疫反应。Ryu等人研究了LBP-CD14介导的LPS转移到TLR4-MD-2至单分子分辨率的动态中间体。5断言LPS本质上是“未纯化的”似乎是语义问题;它在其生物合成中以单一分子开始,在哺乳动物受体中作为单一分子结束。出于哺乳动物检测的目的,它已通过当前的分析方法尽可能地纯化。请参阅图3 中(规范的)哺乳动物检测级联的概述。63. 革兰氏阴性菌外膜的不对称性从能量上讲,革兰氏阴性菌的作用是维持与革兰氏阴性菌外膜相关的不对称性。这保持了一个有效的屏障,防止疏水性“斑块”的形成,疏水“斑块”可能允许不需要的物质(即抗生素)不加选择地通过。这是治疗革兰氏阴性菌感染困难的原因之一。如果我们看一下常见的革兰氏阴性菌表面的常见教科书图,就会清楚地看到“不对称”发生的位置(图4)。6图4:革兰氏阴性和阳性细菌的细胞壁结构6由于革兰氏阴性菌外膜外叶由LPS组成,而内叶由磷脂 (PL) 组成,因此会发生不对称性。7如果外叶中聚集了足够的磷脂,则细胞有专门的方法来重建不对称性;包括“漂浮”在新的LPS分子中。8内毒素作为单一分子实体的长期定义包括其形成这种不对称屏障的独特能力。因此,磷脂和LPS作为单独的革兰氏阴性菌外膜(图3)的比例是一个重要的属性。 4.对比成分有时,通过描述它不是什么而不是它是什么来定义某物更容易。内毒素不包括其他膜相关分子。它是六种无法通过其他方式检测到的细菌残留物的质量或分析标志物,因此是制药生产中的关键质量属性。一种与LPS共享革兰氏阴性表面的革兰氏阴性菌外膜成分类型是“孔蛋白”。孔蛋白是蛋白质结构,通常以三聚体形式存在,可调节水、溶质和营养物质进出细胞的通道。 图5:反硝化菌胞外表面的高分辨率分析。A) 膜区域密集排列着孔蛋白三聚体。B) 在高分辨率下,子结构在单个三聚体上可见。9革兰氏阴性菌外膜的概念最近发生了变化,因为对活细菌的原子力显微镜(AFM) 研究发现了主导革兰氏阴性菌表面的孔(图5)。9这些编织的蛋白质链形成空心的“管”,从表面向下延伸穿过外膜并进入细胞质(图6D和E)。LPS通过基于鲎的测试提醒制造商注意革兰氏阴性菌的存在;然而,孔蛋白目前还无法被检测到。 图6:革兰氏阴性菌外膜9中孔蛋白的天然超分子组装的原子模型使用原子力显微镜(AFM),Oestreicher等人。10研究了来自大肠杆菌和类球红细菌的两种典型革兰氏阴性细菌结构,并指出:“我们的研究清楚地表明,这两种类型的细胞都有一个外表面,该外表面覆盖着类似于分枝杆菌的纳米大小的孔网络。” 与LPS一样,孔蛋白是独立的持久结构,具有免疫反应性且难以破坏。“孔蛋白是极其坚固的蛋白质,可以在70°C的5M盐酸胍或2%SDS存在的情况下可以抵抗变性。” 11鉴于孔蛋白本质上具有免疫原性,因此应该引起人们的兴趣。12,13 虽然它不会改变LPS作为强效污染物的作用,但它清楚地表明LPS并不代表整个革兰氏阴性菌表面,其革兰氏阴性菌外膜而是由几种离散物质组成。 三、总结内毒素的详细定义支持纯化LPS作为标准化杂质(RSE/CSE)的历史和持续使用:(a)内毒素是一种具有特殊组装的独特结构(九个酶促步骤);(b)后生动物对LPS的反应(通过TLR4)的特异性与其他反应(例如激活TLR2 的孔蛋白或激活TLR5的鞭毛)是分开的;(c)它包括内毒素在产生和维持革兰氏阴性菌外膜与磷脂成比例的不对称性方面的作用(d)它作为与其他外膜结构分开和相邻的单一结构存在,在结构、功能和免疫反应(TLR激活)方面提供了对比。应努力开发新的测试方法来检测重要的非LPS膜成分。这形成了一个关键的区别。与其设计一种由未纯化的“细胞壁”成分组成且只能检测到内毒素的“天然内毒素”,不如设计一种由未纯化的“细胞壁”成分组成的“天然内毒素”,单个成分(内毒素、磷脂、孔蛋白、鞭毛蛋白等)应该有自己的检测方法和标准,作为扩大微生物污染控制能力。这将提供必要的冗余,而目前检测亚细胞革兰氏阴性细菌假象的全部权重都落在了内毒素上。杂质测试的适当标准是分析测试的重要组成部分。根据USP ,标记为“天然内毒素”的杂质混合物不是内毒素,而是可能含有内毒素、蛋白质、磷脂、核酸和孔蛋白的混合物。今天基于鲎的测试是针对内毒素的,而不是针对非内毒素的细胞壁或细胞质成分;这种特异性在鲎C因子和哺乳动物TLR4检测架构中都是固有的。内毒素的定义是一个跨学科的定义,不能随便重新定义。 参考文献1. USP40-NF35 (Official as of 1-May-2018)2. Wang X, Quinn, PJ. Lipopolysaccharide: Biosynthetic pathway and structure modification. Progress in Lipid Research 2010; 49: 97–107.3. Ranf S. Immune Sensing of Lipopolysaccharide in Plants and Animals: Same but Different, PLOS Pathogens 2016.4. Esparza et al. Endotoxin-albumin complexes transfer endotoxin monomers to MD-2 resulting in activation of TLR4, Innate Immunity, Innate Immun. 2012. 18(3): 478–491.5. Ryu et al. Reconstruction of LPS transfer cascade reveals structural determinants within LBP, CD14, and TLR4-MD2 for efficient LPS recognition and transfer. Immunity 2017. 46, 38–50.6. Berezin et al. Replacing a Century Old Technique – Modern Spectroscopy Can Supplant Gram Staining. Scientific Reports 2017. 7: 3810.7. Henderson et al. The Power of Asymmetry: Architecture and Assembly of the Gram-Negative Outer Membrane Lipid Bilayer. Annu. Rev. Microbiol. 2016. 70:255–78. 8. Ursell et al. Analysis of Surface Protein Expression Reveals the Growth Pattern of the Gram-Negative Outer Membrane. PLoS Comput Biol., v.8(9); 2012 Sept. PMC3459847`9. Jaroslawski et al. High-resolution architecture of the outer membrane of Gram-negative bacteria Roseobacter denitrificans, Molecular Microbiology 2009. 74(5), 1211–1222.10. Oestreicher, Taoka, and Fukumori. A comparison of the surface nanostructure from two different types of gram-negative cells: Escherichia coli and Rhodobacter sphaeroides, Micron 2015. 72, 8–14.11. Koebnik R, Locher KP, Van Gelder P. Structure and function of bacterial outer membrane proteins: barrels in a nutshell, Mol Microbiol. 2000 Jul;37(2):239-53.12. Liu et al. Immunogenic characterization of outer membrane porins OmpC and OmpF of porcine extraintestinal pathogenic Escherichia coli. FEMS Microbiol Lett 2012. 337: 104–111.13. Pérez-Toledo M. Salmonella Typhi Porins OmpC and OmpF Are Potent Adjuvants for T-Dependent and T-Independent Antigens. Front Immunol. 2017. 8: 230.
参数原理
2023.02.27
小鼠TLR家族对内毒素的生物学作用(二)
Lps基因的等位基因突变可引起内毒素耐受,但对免疫反应和免疫发育无影响。Lps基因突变株对其他病原体及产物反应正常。Beutler认为,只有一个独一无二的途径转导LPS跨膜信号发放,Tlr4 基因可能是哺乳动物中LPS惟一的感受器,因为假如存在替代途径,纯合子的Lps 基因突变株不应该完全阻止内毒素信号转导效应;但此时对牙龈卟啉单胞菌的LPS反应正常,故无法解释;C3H/HeJ小鼠巨噬细胞慢性感染卡介苗(BCG)后,对LPS的低反应性可以恢复,这可能是TLR2取代TLR4的结果。但这种推断仍有争议,有关细节有待进一步阐明。但关于TLR受体作为细胞膜的膜表面受体参与宿主的天然免疫应答,已经达成共识。有人认为TLR2可以介导LPS的信号转导作用,后来其他学者将商品化的内毒素再经过提纯,使其变成无蛋白质的 LPS,或用人工合成的LPS分别刺激只表达TLR2或TLR4的细胞,发现只有表达TLR4的细胞可以介导LPS的信号效应,而表达TLR2的细胞对LPS刺激不发生细胞因子表达效应。可能的原因是,商品化的LPS中含有“内毒素蛋白(endotoxin protein)”,该物质可以通过TLR2发生信号转导效应。由此可见,在机体细胞内,革兰阴性菌在崩解时或繁殖时释放出内毒素分子,由于存在LPS和“内毒素蛋白”,可以通过TLR4和TLR2共同发挥效应,促使基因表达,这是一种综合性效应。LPS 内化后,作用于TLR4,使相对应的TLR4发生同源性TLR4二聚化,通过激活一些酶,促使细胞因子表达,TLR家族其他成员也可以发挥协同作用。TLR的特异性与不同的TLR的协作可能有关。如TLR2能够识别支原体、革兰阳性菌、分枝杆菌中的成分,TLR2在识别革兰阳性菌的肽聚糖时,需要TLR6的参与:TLR2和TLR6均募集到巨噬细胞的吞噬体(phagosome)内,在物理上与肽聚糖发生联系,进行识别活动;相反在TLR2识别革兰阳性菌的另一成分脂肽(lipopeptide)时,TLR6并不参与。可见TLR受体在识别配体的特异性时,不同TLR之间是互相协作的。TLR4则以同源性受体二聚化进行特异性识别内毒素。细菌的DNA也可以刺激宿主免疫细胞,其机制是通过未甲基化的DNA进行,但哺乳动物细胞DNA的CpG未甲基化的频率很低,绝大多数都已甲基化,因此没有免疫刺激作用。CpG的 DNA能够诱导THl样炎症反应,所以许多学者运用CpG的 DNA作为免疫佐剂治疗癌症及过敏性和感染性疾病。当细胞中Tlr9(Tlr9-/-)基因敲除后,即不对CpG发生作用,包括脾细胞增生、巨噬细胞的炎性细胞因子的生成及树突状细胞的成熟等。TIr9-/-大小鼠能够抵抗CpG的致死性效应,其血清中前炎症因子无变化,体内CpG介导的THl样反应消失,可见,TLR9能识别细菌DNA中的CpG。脊椎动物免疫系统经过进化后靠产生特异性的TLR9以区别细菌CpG和自我DNA。TLR5可识别细菌鞭毛蛋白,以及参与天然免疫应答反应。
参数原理
2023.02.24
小鼠TLR家族对内毒素的生物学作用(一)
20 世纪60年代中期研究者就发现,C3H/HeJ小鼠品系对内毒素具有天然耐受性,对G-菌具有易患性。1978年,LPS反应基因被命名为Lps基因,强调了其在内毒素致病方面的重要性,并确定Lps基因在位于4号染色体上Mup-1和Ps基因座之间。1997年,Poltorak 等将Lps基因缩小到两个新的微卫星标记点B和83.3之间, DNA跨度为3.2Mb长度。1999年,Qureshi等将Lps 基因缩小到0.9厘摩尔根间隔区内,跨度为1.7Mb。随后研究已经鉴定Lps 基因编码三个转录单位,其中包括TLR4[LPS的生理作用是通过存在于宿主细胞的细胞膜表面的Toll样受体(Toll-like Receptor、TRL)4(TRL4)而体现的]。在C3H/HeJ和C57BL/ScCr小鼠,Tlr4基因均存在突变,在C3H/HeJ品系中TLR4 DNA中2342位C被A所取代,结果其编码的712位氨基酸链由脯氨酸取代组氨酸,使其胞质区结构域的拓扑结构发生改变,在内毒素刺激时突变的TLR4受体也发生受体二聚化及内化反应,但P712H的变异体已破坏其全蛋白(holoprotein)的功能,不能诱导酶学级联反应及激活细胞因子表达,表现为内毒素耐受;C3H/HeJ小鼠的Tlr4Lps-d与C3H/HeN小鼠的Tlr4Lps-d为等位基因,呈共显性(co-dominant)表达,F1代小鼠杂合子对内毒素反应表现为中度敏感,证实了TLR4参与内毒素信号转导反应。通过对C3H/HeJ和C3H/HeN同源系小鼠的研究,否认了既往认为LPS是通过插入宿主细胞膜上诱发宿主细胞膜的通透性升高的这一致病-假说。另外,C57BL/ScCr 为Tlr4基因区DNA片段发生缺失,因不表达TLR4受体,故表现为内毒素耐受。TLR4在膜上表达量较低,每个单核-巨噬细胞约有1000个TLR4分子,而每个中性粒细胞的细胞膜上有7000个CD14受体分子,每个单核-巨噬细胞中CD14超过4.0×104~4.5×104个,如受体达2.79×104个,CD14可以浓集内毒素分子作用,加速内毒素信号转导给TLR并引起内毒素内化反应。研究表明,TLR4对LPS反应非常重要。Lps基因突变能够阻止大肠菌属如鼠伤寒杆菌、大肠杆菌LPS所诱发的反应。Lps基因突变的B细胞不能对LPS发生增殖反应。Lps基因突变影响最显著的是巨噬细胞,突变的巨噬细胞被内毒素攻击时细胞因子分泌显著降低,不能吞噬经过调理的颗粒,不能产生反应性氧和NO,巨噬细胞内化反应缺损。LPS主要通过CD14依赖性巨胞饮途径(macropinocytic pathway)以聚集体发生内化(internalization)进入内体(endosome)细胞器后,再转移到溶酶体内,由酰基羧基水解酶(acyloxyacyl hydrolase)水解脂肪链,形成脱酰基脂质A,然后脂质A可以进一步在磷酸酶作用下去磷酸化,水解1位磷酸基形成单磷酸基脂质ⅣA。部分学者认为LPS单体需要内化到高尔基体才可以发生信号转导作用,引发激活效应,这种观点未得到一致认可。Tlr4 基因突变小鼠有内化功能障碍,不能及时清除内毒素分子,所以对内毒素反应减弱,但易发生反复革兰阴性杆菌感染,而对革兰阳性杆菌反应正常,后者可能由TLR2进行识别。另外,在高浓度LPS情况下,即使Tlr4基因突变也可诱发细胞因子表达;牙龈叶啉单胞菌的LPS 也能诱发正常的生物学效应,与TIr4基因突变无关,说明有其他蛋白取代了TLR4的功能。Ran也在Lps基因范围内,其在上述两种低内毒素反应的小鼠品系中均存在突变。运用基因转染技术将野生型Ran基因转染给Ran基因缺陷的小鼠巨噬细胞内,可以恢复其对内毒素的反应,转染缺陷的Ran可以使巨噬细胞对LPS产生耐受。Ran具有多种生物学功能,如参与核物质的转运、细胞分裂、纺锤体的形成等,所以 Ran可能参与内毒素信号转导反应中的某个环节。至于Ran与TLR的关系有待进一步研究。另外,LPS也可以通过膜组织性外突蛋白(简称膜外突蛋白)发生生物学作用,并可作为CD14的协同受体,介导内毒素的反应,其作用类似于TLR。用抗膜外突蛋白抗体可完全阻止内毒素的反应。膜外突蛋白和TLR4之间的关系还有待阐明。
参数原理
2023.02.24
脂多糖Toll样受体中PAMP的特点
1997年由Janeway和Medzhitov提出病原体相关分子模式(pathogen-associatedmolecular pattern,PAMP)的概念,即将在吞噬细胞上与其同族结合的配体称为模式识别受体。PAMP为病原体高度保守的结构,不易变异,有利于宿主识别。PAMP的特点为:①PAMP代表分子结构,该结构只由微生物中的病原体所产生,非宿主产生,如革兰阴性菌中的内毒素、革兰阳性菌的肽聚糖(peptidoglycan)和脂胞壁酸(lipoteichoic acid,LTA),以及支原体的甘露聚糖、甲酰化肽和细菌DNA中的CpG等。提高天然免疫系统中模式受体对PAMP的识别有助于天然免疫系统准确区别自我分子和病原体相关分子结构。②PAMP代表病原体中保守的分子模式,该结构是微生物生存所必需的,如青霉素抑制肽聚糖合成后,细菌就无法生存。和肽聚糖的结构被选择下来一样,在天然免疫的进化中,作为识别的靶位,宿主的这种策略可防止“逃避突变”的产生。③PAMP是为大多数微生物所共有的结构,所有细菌均含有肽聚糖和脂蛋白,LPS(脂多糖,lipopolysaccharide)和LTA的一般模式各自为所有革兰阴性(G-)菌和革兰阳性(G+)菌所共有,PAMP的特点是只准许非常有限的识别受体去识别多样化的微生物。④PAMP代表着病原体种类的“分子签名(molecular sig-nature)”,如LPS代表G-菌,LTA代表G+菌,脂阿拉伯甘露聚糖代表分枝杆菌,甘露聚糖代表支原体。对这些PAMP的识别,不仅显示感染的存在,而且能够提供侵入的病原体的类型,有利于宿主采取更有效的效应机制去应付病原体。具体的PAMP分子有革兰阴性菌中的内毒素、革兰阳性菌的肽聚糖(peptidoglycan)和脂胞壁酸、细菌DNA中的CpG岛以及支原体的甘露聚糖和甲酰化肽等。结核杆菌的脂阿拉伯甘露聚糖(lipoaramannan,LAM)、螺旋体的脂蛋白、支原体的甘露聚糖和脂蛋白以及自身病变或坏死组织和细胞所诱发的物质可以作为内源性配体,还有如热休克蛋白90和热休克蛋白60等。不同的配体模式识别方式缺乏病原体的特异性,针对病原体的共同保守结构,更有利于宿主发挥免疫效应,刺激特异性免疫应答。
参数原理
2023.02.24
预防癌症,从消除体内的内毒素开始
随着社会的发展,人民生活水平的提高,越来越多的人把健康放在首位,朋友们相聚,茶余饭后,谈论最多的便是健康。疾病中对健康对生命威胁最大的当属癌症,癌症已成为我国居民死亡的主要原因。毋庸置疑,在“谈癌色变”的今天,治疗癌症固然重要,防患于未然显得更为重要,那么癌症又该怎样预防呢?由于社会工业化程度的不断提高,环境污染已不容忽视,人类生活环境中的致癌因素大大增加,直接威胁着人类的健康,另外,生活中不良的生活习惯包括不合理的膳食、吸烟、长期心理压力都能造成机体的免疫功能下降,从而使癌症的发生率大大提高。人体疾病的发生是外因和内因相互作用的结果,外因是指致病物质,以及生活环境对机体的影响,内因是指机体的免疫机能。在疾病发生、发展的过程中,内因起着决定性的作用。现实生活中,越来越多的人对于头痛脑热之类的小病,自己去药房购买药品,就自行解决了。虽然药物种类多了,但是健康的人却少了。随着抗生素应用的增多,有效的药物却在减少,之所以会这样,是人们不知道服用抗生素后,细菌死亡之后会产生大量叫内毒素的物质。这种物质是法国人发现的,但一直未引起人们的注意和重视,它会随着抗生素服用次数的增多,细菌不断被消灭而不断被释放,并在体内蓄积。内毒素可能激活体内的炎性因子,导致机体炎性反应,引起机体产生慢性炎症,迁延不愈恶化而导致癌症。这就不难解释生活中老百姓常有的“现在的药不管用了,得病不爱好了,慢性病增多了,癌症增多了"等等说法。殊不知这都是内毒素作用于人体,致机体免疫力下降的结果。因此,在想预防癌症就要从根本上消除体内的内毒素,减少慢性炎症的发生,不断改善人类赖以生存的自然环境,提高机体的免疫功能,这才是预防癌症的关键。
参数原理
2023.02.22
慢性胃炎、消化性溃病的真正元凶:内毒素
慢性胃炎、消化性溃疡是全球性的多发病、常见病。人们对这两种疾病的最主要病因——幽门螺旋杆菌(HP)已不再陌生。目前,幽门螺旋杆菌感染是世界上最常见的细菌感染,我国成年人群的感染率几近60%,那么幽门螺旋杆菌是如何在人体内兴风作浪,引起上述疾病的呢?真正元凶原来是人们疏于了解的内毒素。幽门螺旋杆菌感染后释放内毒素,在机体内引起发热,白细胞反应,免疫功能受损等系列变化。并能破坏在正常情况下连接紧密的胃上皮组织,引起渗漏。同时粘膜血管扩张,间质充血水肿,逐渐形成慢性胃炎。尽管在普通人群中,胃炎已十分常见,然而在消化性溃疡患者中更为常见。大量资料表明,胃炎是消化性溃疡的一种危险因素,这一概念提示炎症和幽门螺旋杆菌感染先于溃疡。由此可见,幽门螺旋杆菌感染是慢性胃炎和消化性溃疡发病及复发的关键。那么是否针对幽门螺旋杆菌进行治疗就万事大吉了呢?事实并非如此。虽然抗幽门螺旋杆菌的药物层出不穷,可慢性胃炎和消化性溃疡患者仍不见减少,疗效仍不显著。这是怎么一回事呢?原来正是内毒素在从中作梗,因为目前针对幽门螺旋杆菌本身的抗菌药物,不但不能破坏内毒素,还可以使细菌大量崩解从而产生更多的内毒素,引发一系列病理生理反应,使慢性胃炎迁延不愈,增加消化性溃疡发病和复发的机会。因此,要想真正打败幽门螺旋杆菌,治愈慢性胃炎和消化性溃疡,就必须有对抗真正元凶内毒素的有利武器和抗幽门螺旋杆菌药物共同使用。
参数原理
2023.02.22
慢性胃炎、消化性溃病的真正元凶:内毒素
慢性胃炎、消化性溃疡是全球性的多发病、常见病。人们对这两种疾病的最主要病因——幽门螺旋杆菌(HP)已不再陌生。目前,幽门螺旋杆菌感染是世界上最常见的细菌感染,我国成年人群的感染率几近60%,那么幽门螺旋杆菌是如何在人体内兴风作浪,引起上述疾病的呢?真正元凶原来是人们疏于了解的内毒素。幽门螺旋杆菌感染后释放内毒素,在机体内引起发热,白细胞反应,免疫功能受损等系列变化。并能破坏在正常情况下连接紧密的胃上皮组织,引起渗漏。同时粘膜血管扩张,间质充血水肿,逐渐形成慢性胃炎。尽管在普通人群中,胃炎已十分常见,然而在消化性溃疡患者中更为常见。大量资料表明,胃炎是消化性溃疡的一种危险因素,这一概念提示炎症和幽门螺旋杆菌感染先于溃疡。由此可见,幽门螺旋杆菌感染是慢性胃炎和消化性溃疡发病及复发的关键。那么是否针对幽门螺旋杆菌进行治疗就万事大吉了呢?事实并非如此。虽然抗幽门螺旋杆菌的药物层出不穷,可慢性胃炎和消化性溃疡患者仍不见减少,疗效仍不显著。这是怎么一回事呢?原来正是内毒素在从中作梗,因为目前针对幽门螺旋杆菌本身的抗菌药物,不但不能破坏内毒素,还可以使细菌大量崩解从而产生更多的内毒素,引发一系列病理生理反应,使慢性胃炎迁延不愈,增加消化性溃疡发病和复发的机会。因此,要想真正打败幽门螺旋杆菌,治愈慢性胃炎和消化性溃疡,就必须有对抗真正元凶内毒素的有利武器和抗幽门螺旋杆菌药物共同使用。
参数原理
2023.02.22
内毒素:冠心病不容忽视的危险因素
冠心病与“粥”会有什么联系?你可不要小瞧这两个名词,其中的学问大着哩。懂点医学的人都知道冠心病的全名叫冠状动脉粥样硬化性心脏病。这里的“粥”是指什么呢?在回答这个问题前,先让我们看看“粥”是如何形成的。“粥”的形成要靠两个因素:第一是血管内皮的损伤;第二是血中脂类的沉积。这里的脂类主要是指甘油三酯和胆固醇,血液中的脂类不断沉积于血管内皮的破损处,便会形成淡黄的团块,其外形极似小米粥,病理学家便形象地称之为“粥样”。所以“粥”就是指沉积于血管壁的脂类。粥样物质的不断增大,这样就形成所谓粥样硬化。如果这种粥样硬化发生于心脏的供血动脉-—冠状动脉,则就是人们常说的冠心病。那么冠状动脉的“粥样硬化"与哪些因素有关呢?医学研究表明高血脂是引起冠脉硬化的危险因素,血液中的脂肪主要是甘油三酯和胆固醇,当这两种物质于血中浓度过高时,就会不断被血管内皮细胞吞噬并沉积下来。如果此时由于高血压或吸烟等因素使血管内皮损伤,则在此损伤部位就更易形成“粥样”团块,导致动脉硬化的发生。因此,只要是促进血管内皮损伤或血脂增高的因素,都可以称作冠心病的危险因素。近年来,随着人们对内毒素的认识的不断深入,医学家们发现内毒素是冠心病的又一危险因素。内毒素是由病原微生物产生的一种毒力极强的耐热物质,它可以直接导致血管内皮的损伤,并明显干扰血液中甘油三酯的代谢,从而使血脂水平迅速升高。这两种因素并存,对冠心病是极其不利的。不仅如此,内毒素还可使血液凝固性增强,抗凝性降低,这种高凝状态更易促使心血管意外的发生。由此可见,内毒素已成为冠心病不容忽视的危险因素。抗内毒素治疗,已成为医学界治疗冠心病的新方向。只有有效降低冠心病患者血液中内毒素的水平,才能防止心血管意外的发生,降低冠心病的死亡率。
参数原理
2023.02.22
慢性炎症与内毒素密切相关
“慢性炎症疾病难以治愈”这个被人们默认了许多年的观点最近由于医学科学在内毒素研究方面不断取得新进展而受到挑战。这项新发现证实,细菌不能致炎,80%左右的慢性炎症是内毒素引起的。 近几年来,随着人们对疾病病因研究的不断深入,医学家们发现慢性炎症与一种叫做内毒素的物质关系极为密切。内毒素是许多病原微生物产生的一种毒力极强的耐热的物质。大量的事实表明,许多的慢性炎症患者体内内毒素水平明显高于健康对照人群,并且这种升高与疾病的急性加重密切相关。如果这种高浓度的内毒素能被机体自身免疫力所战胜,则疾病就会暂时好转;如果机体不能打败内毒素,则就会表现为病情的持续加重,甚至会因为高内毒素血症造成死亡。 调查研究发现,慢性炎症患者体内内毒素含量明显高于健康人群,并且这种升高与疾病的加重密切相关。如有人对100例慢性肝病、47例胆管炎做过调查发现,内毒素血症分别在慢性肝病及胆管炎发展过程中起着重要作用;可加重肝细胞损伤,导致衰竭和内脏损伤。 通常与内毒素含量密切相关的慢性炎症有:各种消化性溃疡及慢性胃炎、慢性支气管炎、慢性肾炎、慢性肝炎肝硬化、慢性胆囊炎等等。 对内毒素的深入研究解决了医学上的许多迷惑和难题,为人类诸多不治之症的治愈展示了新希望。现在,人们更加翘首盼望这项研究取得更多更大的成果。
参数原理
2023.02.16
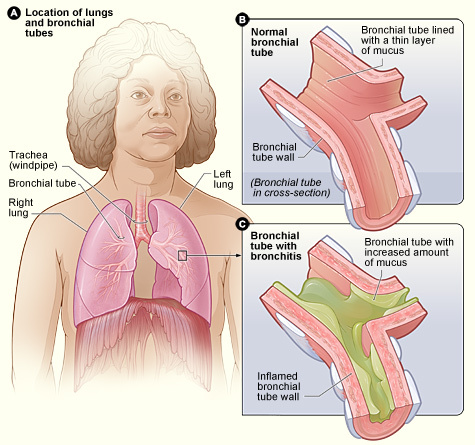
“老慢气”与内毒素
慢性支气管炎俗称“老慢气”,是一种常见多发病。尤其在北方寒冷地区其发病率更高。慢性支气管炎之所以被称为“老慢气”,就在于它迁延难愈,许多患者都是在多年老慢气的基础上,逐渐发展成为肺气肿,肺心病,最终不治而亡。 老慢气长期迁延难愈的原因究竟是什么?长期以来医学界一直没有找到对这一问题合理的解释。因此也就无法指导临床医生对患者施行最有效的治疗。不过最近有学者发现,内毒素在老慢气发病过程中起着重要作用,这一现象立即引起了医学界广泛的重视,为老慢气的治疗带来了新的希望。 内毒素是许多细菌产生的一种毒性极强的致病物质。它可以直接损害人体支气管和肺泡上皮,引起呼吸道粘膜充血水肿,加重患者咳喘等症状。不仅如此,内毒素还可以损伤肝、肾等多种器官,严重削弱机体的免疫能力,使已经弱不禁风的老慢气患者雪上加霜。 大量实验已经证实慢支患者血浆中内毒素水平比正常人高几十倍。那么内毒素是如何进入慢支患者血中的呢?目前认为主要有两种途径。其一,是通过呼吸道,老慢气患者呼吸道防御能力极低,很容易受到细菌的感染。内毒素也就会借细菌感染的机会而入血。其二,是通过消化道,众所周知正常人体肠道有大量寄生的大肠杆菌等细菌,由于老慢气患者呼吸功能下降,机体长期处于缺氧状态,肠粘膜也因为缺氧而防御能力下降,通透性增强,细菌释放的内毒素也就趁机透过肠粘膜大量入血。 血内长期存在的内毒素不断攻击呼吸系统及其他重要器官造成损害,进而又使更多的内毒素入血,从而形成恶性循环,血中过多的内毒素不但使呼吸道的症状逐渐加重,而且还引发许多其他器官的并发症。因此可以说内毒素是老慢气迁延难愈的祸根。
参数原理
2023.02.16
最新!欧洲药典家兔热原检测法将被取代
欧洲药典(Ph. Eur.) 在Pharmeuropa 35.1中公开了家兔热原试验(RPT)替代策略相关的59篇文本(1篇新通则,5.1.13. 致热性,以及58 篇修订文本)以供公众咨询,其中评论截止日期为2023 年3月31日。 这些文本涵盖了各种主题,包括人类使用的疫苗、血液制品、抗生素、放射性药物和容器,已经过修订以用体外替代方法、单核细胞活化试验 (MAT) 或其他与动物福利相容的方法取代家兔热原试验。这些文本的出版标志着欧洲科学院决定的战略迈出了重要一步。该委员会已于2021年6月启动,这些行动将最终导致欧洲药典中的家兔热原试验 (RPT)被完全取代,预计在未来三年内完成。2022 年9 月发布的热原性战略文件更全面地讨论了这一目标及其实现方式。以下是欧洲药典新通则5.1.13.草案与2020版中国药典的区别:欧洲药典新通则5.1.13.草案如下:检测项目:热原性(Pyrogenicity)使用方法:1、通则2.6.14.【细菌内毒素】、2.6.32.【使用重组C因子检测细菌内毒素】:细菌内毒素查(BET)2、通则 2.6.30.【单核细胞活化试验】: 单核细胞活化试验(MAT)方法选择:1、取消免热原检查,鼓励采用合适的体外替代方法细菌内毒素:细菌内毒素检查(BET)或单核细胞活化试验(MAT)非内毒素热原:单核细胞活化试验(MAT)2、生产工艺的开发过程中应进行单核细胞活化试验(MAT)3、选择细菌内毒素检查(BET)作为唯一的热原评估方法时,需要进行风险评估2020版中国药典如下:检测项目:热原或细菌内毒素使用方法:1、通则1142热原检查法:家免法2、通则9301注射剂安全性检查法应用指导原则:参照细菌内毒素检查法(通则1143)、热原检查法(通则1142)或单核细胞活化反应测定法,单核细胞活化反应测定法仅作为热原检查的补充方法3、通则9251细菌内毒素检查法应用指导原则:除通则1143提到的方法外,增加了重组C因子法方法选择:1、热原: 热原检查法(家兔法)、单核细胞活化反应测定法可作为热原检查的补充方法2、细菌内毒素:试剂法、重组C因子法
企业动态
2023.02.16
人体中出现的“火”“热”“毒”与内毒素的关系
何谓“火”?古语云:“火曰炎上,”炎即热也,上即向上,炎上是指具有发热、温暖、向上的特性。中医学对“火”和“热”的认识有所区别,认为“火”常自内生,多由脏腑阴阳气血失调所致,如人们常说的“上火”而出现的口疮、牙痛、小便短赤、大便秘结、腹泻腹胀、胃痛、消化不良、咳嗽痰多等等,多属于“火”;而“热”则多属于外感,如外感风热、暑热、温热之类,皆属于“热”。现代医学所言的发热是指在致热原作用下,体温调节中枢的调定点上移而引起的调节性体温升高,当体温上升超过正常值的0.5℃时,称为发热,中医病因学也将其归属于“热”的范畴。 何谓“毒”?现代毒理学认为,“毒”就是对机体生理功能状态有不良影响的物质,包括外来之毒、内生之毒及内外因素相互影响产生的毒三大部分。 外来之毒,是指外在环境的有害物质,如细菌、病毒、病原微生物、农药化肥、以及遭受污染的大气、水源等。 内生之毒,泛指机体在新陈代谢过程中产生的多种废物堆积停滞而产生的毒,以及糖、脂肪、蛋白质代谢管道不通而产生的毒。 内外因素相互影响产生的毒,如电磁波、超声波、噪音等。均可干扰人体固有频率,引起神经系统紊乱、内分泌失调、致使新陈代谢失常而产生的毒。 从以上“毒”的三种来源,不难看出,所谓的“毒”,就是“内毒素”,“毒”存留体内可导致人体各组织、脏腑﹑细胞的功能出现障碍,引起气血失和、阴阳失调、气机升降失常以及植物神经紊乱、内分泌失调等,从而出现临床的许多疾病,如炎症性疾病、消化道疾病、心脑血管疾病、内分泌疾病、传染性疾病、神经性疾病等等。 有关研究结果证明,“火”“热”“毒”的病理基础就是“内毒素血症”,主要致病途径就是通过“内毒素”引发的。 那么,“内毒素”是如何引发疾病的?健康人体只有一个内毒素池,即肠源性内毒素池,而在疾病状态下,除肠源性内毒素池外,还会出现易受细菌感染的器官形成内毒素池、炎症病灶内毒素池,即病人有三大内毒素池。正常状态下,肠源性内毒素池中的内毒素并不能透过肠粘膜屏障入血,而在精神紧张、情绪不良、睡眠不足、思想压力过重、过食辛辣、抽烟酗酒等疾病状态下,由于人体的整体防御抗病能力(免疫功能)的低下及致病因素侵袭人体。 首先造成肠粘膜屏障的通透性增加,则肠源性内毒素池中的内毒素可以透过肠粘膜屏障入血,导致体内内毒素含量骤增,最终出现“内毒素血症”。而血中内毒素的危害在于其可与机体组织、细胞结合直接导致细胞损伤,刺激巨噬细胞、粒细胞等释放介质和酶,直接影响到人体的新陈代谢;也可直接作用于机体凝血,纤维溶解系统促发弥散性血管内凝血(DIC),导致体内多脏腑、组织内的缺血、缺氧直至坏死,影响到其功能的正常发挥;作用于免疫系统,可激活补体,促进淋巴B细胞分裂,诱导干扰素等,破坏免疫系统,致使机体免疫功能下降;出现其他多种疾病如发热、低血压、败血症、休克、癌症、多系统器官衰竭等等。 “内毒素血症”的初期临床症状就是如上所述的“上火”“发热”“体毒”等一系列症状和表现。 因此可以说“火”“热”“毒”均可归为“内毒素",以“内毒素血症"作为多系统疾病的前期或早期症状,而直接危害到人类的生命和健康。
参数原理
2023.02.14
内毒素对人体健康影响的三大阶段
20世纪是医药卫生界取得伟大成就的世纪,人类的寿命持续增长、婴幼儿的死亡率大幅下降,许多曾经严重威胁人类生命的疾病如伤寒、肺炎等,都已被人类一一攻克。但是,如何摆脱不是病的“亚病”,却成为一道世纪末的难题。 现代医学正在揭去“亚病”的面纱,让我们看到真正的罪魁祸首——一个陌生的敌人“内毒素”。其实这个敌人早已潜伏在我们每一个人的体内,只是我们不了解它。 那么,什么是内毒素呢?内毒素是产生于某些微生物的一种毒性物质,这种物质的化学成分是脂多糖和类脂多糖。它广泛存在于革兰氏阴性菌及某些阴性菌样微生物如立克次体、螺旋体、衣原体及部分球菌、真菌、病毒的细胞璧外膜中,它在微生物生长期及死亡裂解后释放出来,对人体产生毒性反应。 实际上,根据人体血中内毒素的含量多少可以把内毒素对人体健康的影响大体上划分为3个阶段: 第一阶段为内毒素的含量与人体的自身抵抗力持平或人体抵抗力高于内毒素的时期。这一时期不论是从外在来看还是从内在来看,人们都是绝对意义上的健康者,因为这一时期的人们完全可以凭借自身的免疫力消灭内毒素,不让它兴风作浪,危害人们的身心健康。 第二阶段是内毒素的数量已经增加并已经出现疾病症状时期。“亚健康状态时期”,即病人有主观症状,但没有客观阳性指标。究其根源,“亚健康状态"便是人体血中内毒素增高直接导致的。在正常情况下,人体通过自身的免疫功能清除内毒素,维持机体相对平衡。当机体虚弱或受某种细菌,病毒感染,易导致连抗生素也无能为力的内毒素血症,高内毒素血症可导致多种疾病,且在疾病的发展、转化中起着加重病情的作用,如果血中内毒素含量得不到控制,就会造成全身炎性反应综合征乃至死亡。 然而由于没有疾病症状出现,所以这一时期极易被人们忽略,正因为人们没有在这一时期采取及时有效的措施来制止血中内毒素的增加,从而直接导致了下一阶段即第三阶段的出现。随着内毒素含量的继续增加,进人了疾病时期,自觉症状明显,各项检查纷纷出现阳性指标。即真正的疾病状态,如冠心病,肺心病、肾小球肾炎等。
参数原理
2023.02.13