USP美国药典中对于注射剂中的颗粒物检测规范
2022/04/14 11:35
阅读:344
分享:方案摘要:
产品配置单:
全自动显微计数法不溶性微粒分析仪
型号: YH- MIP-0205PRO
产地: 江苏
品牌: 胤煌科技
¥50万 - 80万
参考报价
联系电话
方案详情:
USP<788>美国药典中对于注射剂中的颗粒物检测规范
本总章与欧洲药典和/或日本药典的相应文本一致。这些药典已承诺不对本协调章节进行任何单方面修改。本通用章节文本中属于国家USP文本的部分,因此不属于协调文本的一部分,用符号标记(◆◆) 具体说明这一事实。
注射剂和非注射剂中的颗粒物由溶液中意外存在的外来可移动未溶解颗粒(气泡除外)组成。
◆如章节<1> Injections and Implanted Drug Products中所述,通过肌肉或皮下途径给药的注射溶液必须满足<788> Particulate Matter in Injections章节要求。这一要求已无限期推迟用于兽医的产品。包装和标记的专门用于肠外冲洗溶液不受<788>的颗粒物质要求的限制。放射性药品制剂不受<788> Particulate Matter in Injections章节的限制。凡标签规定的在用药前使用最终过滤器的非肠道产品,均可不受<788> Particulate Matter in Injections的限制,前提是有科学数据证明这一豁免是合理的。◆
对于颗粒物的测定,下文规定了两种方法,即方法1(光阻法颗粒计数试验)和方法2(显微颗粒计数试验)。当检查注射剂和肠外输液中是否存在亚可见颗粒时,最好使用方法1。然而,可能有必要通过光阻法颗粒计数试验和显微颗粒计数试验来测试某些制剂,以得出符合要求的结论。
并非所有的肠外制剂都能通过上述一种或两种方法检查亚可见颗粒。例如,如果制剂的透明度降低或粘度增加,方法1不适用时,则应根据方法2进行试验。乳剂、胶体和脂质体制剂就是例子。类似地,当被吸入传感器时产生空气或气泡的产品也可能需要进行显微颗粒计数测试。如果待测制剂的粘度足够高,以致无法通过任何一种试验方法对其进行检查,必要时需要使用适当的稀释剂进行定量稀释,以降低粘度,以便进行分析。
在检查颗粒物的单个单元或单元组时获得的结果不能确定地外推到其他未经测试的单元。因此,如果要从观测数据中得出有效的推论,以表征大量单元中颗粒物的水平,就必须制定统计上合理的采样计划。
◆就本章而言,小容量肠外注射剂是小容量注射剂的同义词,大容量肠外注射剂是大容量注射剂的同义词。◆
光阻法颗粒计数测试
根据光阻原理,使用合适的仪器,根据大小自动确定颗粒大小和颗粒数量。Reagents, Indicators, and Solutions—Reagent Specifications章节中提供了无颗粒水的定义。
使用已知尺寸在10 µm到25 µm之间的球形颗粒的分散体校准仪器。这些标准颗粒分散在无颗粒水中。分散过程中必须注意避免颗粒聚集。◆系统适用性可通过使用USP颗粒计数RS进行验证。◆
一般预防措施
试验在限制颗粒物的条件下进行,最好在层流柜中进行。
使用温热的清洁剂溶液仔细清洗所用的玻璃器皿和过滤设备(膜式过滤器除外),并用大量水冲洗,以去除所有清洁剂痕迹。使用前,用无颗粒水从上到下、从外到内冲洗设备。
注意不要将气泡引入待检查的制剂中,尤其是在将制剂的部分转移到要进行测定的容器中这个过程中。为了检查环境是否适合试验,玻璃器皿是否正确清洁,所用的水是否无颗粒,应进行以下试验。根据下述方法,测定五个无颗粒水样品中的颗粒物,每个样品5 mL。如果10 µm或更大粒径的颗粒数量超过25个,则为试验采取的预防措施是不够的。必须重复准备步骤,直到环境、玻璃器皿和水适合试验。
方法
通过连续20次缓慢翻转容器,混合样品内容物。如有必要,小心地拆下密封盖。使用无颗粒水射流清洁容器开口的外表面,并拆下封盖,避免内容物受到任何污染。通过适当的措施消除气泡,例如静置2分钟或超声波处理。
对于大容量肠外注射剂,需要测试单个单元。对于体积小于25 mL的小容量肠外注射剂,将10个或更多单位的内容物合并到一个清洁的容器中,以获得25 mL的体积;可通过混合适当数量小瓶的内容物,并用无颗粒水稀释至25 mL,或在无颗粒水不适用时,用适当的无颗粒溶剂稀释至25 mL,制备试验溶液。体积为25 mL或以上的小容量非肠道药物可单独进行试验。
非肠道使用的粉末用无颗粒水配置,或当无颗粒水不适用时,用适当的无颗粒溶剂重新配制。
◆对于标有“不用于直接输注”的散装包装的非肠道用药,当体积为25 mL或以上时,按照小容量非肠道用药的说明进行。计算与标签中给出的最大剂量相当的部分的试验结果。例如,如果散装包装的总体积为100 mL,最大剂量体积为10 mL,则每毫升的平均粒子数将乘以10,以获得基于10 mL最大剂量的测试结果。[注意,计算测试结果时,考虑这个最大剂量部分相当于一个完整容器的内容。]
应根据容器容积的不同,按照大容量或小容量肠外制剂的指示,制备和测试包装有双隔室(用于容纳药品和溶剂)的产品。按照标签对每个单元进行混合,活化和搅拌以确保单独成分和药物溶解彻底混合。◆
试样数量必须足以提供统计上合理的评估。对于大容量肠外注射或体积大于等于25 mL的小容量肠外注射,可使用适当的取样计划,测试少于10个单位的样品。
取四份样品,每份5 mL,并计算尺寸等于或大于10 µm和25 µm的颗粒数。忽略第一份的结果,并计算待检查制剂的平均颗粒数。
评估
对于在标称体积超过100 mL的容器中提供的制剂,采用试验1.A的标准。
对于在标称体积小于100 mL的容器中提供的制剂,采用试验1.B的标准。
对于在标称体积为100 mL的容器中提供的制剂,采用试验1.B的标准。
[注:日本药典中使用了试验1.A。]
如果平均颗粒数超过限值,则通过显微颗粒计数测试对制剂进行测试。
试验1.A
标称含量超过 100 mL 的容器中的肠胃外输注溶液或注射溶液:如果测试单位中存在的尺寸大于等于10 µm的粒子的平均颗粒数不超过 25个/mL,尺寸大于等于25 µm的粒子的平均颗粒数不超过 25个/mL,则该制剂符合测试要求。
试验1.B
标称含量小于 100 mL 的容器的肠胃外输注溶液或注射溶液:如果每个容器中存在的尺寸大于等于10 µm的粒子的平均颗粒数不超过 6000 个,尺寸大于等于25 µm的粒子的平均颗粒数不超过600个,则该制剂符合测试要求。
显微计数法
使用合适的双目显微镜、用于保留颗粒物的过滤器组件和用于检查的薄膜过滤器。
将显微镜调整为100±10倍,并配备一个用物镜测微计校准的目镜测微计、一个能够容纳并穿过薄膜过滤器整个过滤区域的机械工作台,以及两个合适的照明器,以提供除了倾斜照明之外的外场照明。
目镜测微计是一个直径为圆形的分划器(见图1),由一个被十字准线分成四个象限的大圆、100倍放大时直径为10 µm和25 µm的透明和黑色参考圆以及以10 µm增量刻度的线性刻度组成。使用经过国内或国际标准机构认证的测微计对其进行校准。分划的线性刻度的相对误差在±2%以内是可以接受的。大圆被指定为网格视场(GFOV)。
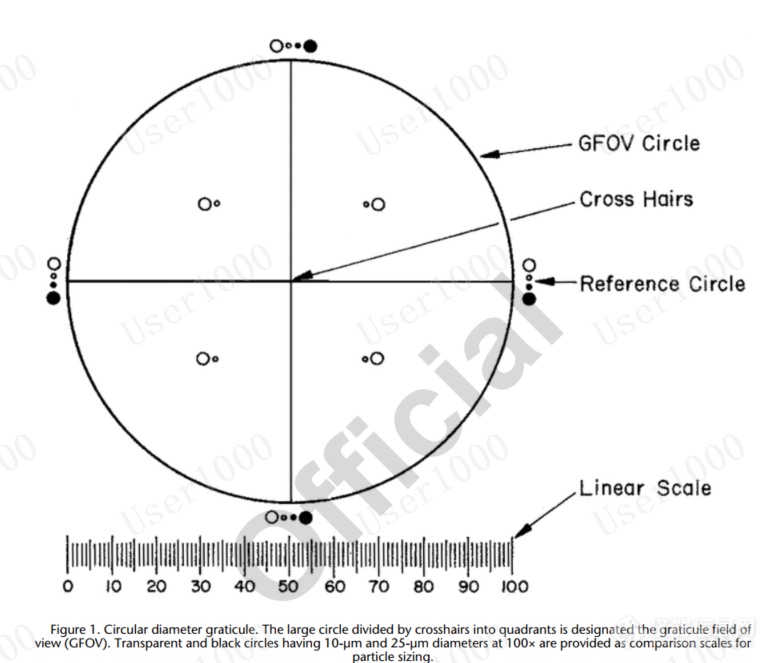
图1。圆直径分划。被十字准线分成四个象限的大圆被指定为网格视场(GFOV)。提供了直径为10µm和25µm的透明和黑色圆圈,作为粒度测定的对比标尺。
需要两个照明器。一个是显微镜内部的一个主光场照明器,另一个是一个外部的、可聚焦的辅助照明器,可以调节以提供10°–20°角度的反射斜照明。
用于保留颗粒物的过滤器组件包括由玻璃或其他合适材料制成的过滤器支架,并配备有真空源和合适的膜过滤器。
膜过滤器尺寸合适,颜色为黑色或深灰色,无网格或有网格,标称孔径为1.0 µm或更细。
一般预防措施
试验在限制颗粒物的条件下进行,最好在层流柜中进行。
使用温热的清洁剂溶液非常小心地清洗所用的玻璃器皿和过滤器组件(膜式过滤器除外),并用大量水冲洗,以去除所有清洁剂痕迹。使用前,用无颗粒水从上到下、从外到内冲洗膜过滤器和设备的两侧。
为了检查环境是否适合试验,玻璃器皿和膜过滤器是否正确清洁,所用的水是否无颗粒,应进行以下试验。根据下述方法测定50 mL无颗粒水里的颗粒物。如果过滤区域内存在20个以上粒径为10 µm或更大的颗粒,或5个以上粒径为25µm或更大的颗粒,则试验所采取的预防措施是不够的。必须重复准备步骤,直到环境、玻璃器皿、膜过滤器和水适合试验。
方法
通过将容器连续缓慢翻转20次来混合样品内容物。如有必要,小心地拆下密封盖。使用无颗粒水射流清洁容器开口的外表面,并拆下封盖,避免内容物受到任何污染。
对于大容量肠外注射剂,需要测试单个单元。对于体积小于25 mL的小容量肠外注射,将10个或更多单位的内容物组合在一个清洁的容器中;可通过混合适当数量小瓶的内容物,并用无颗粒水稀释至25 mL,或在无颗粒水不适用时,用适当的无颗粒溶剂稀释至25 mL,制备试验溶液。体积为25 mL或以上的小容量非肠道药物可单独进行试验。
非肠道使用的粉末用无颗粒水配置,或当无颗粒水不适用时,用适当的无颗粒溶剂重新配制。
试样数量必须足以提供统计上合理的评估。对于大容量肠外注射或体积大于等于25 mL的小容量肠外注射剂,可使用适当的取样计划,测试少于10个单位的样品。
用几毫升无颗粒水湿润装有薄膜过滤器的过滤器支架内部。将溶液池或单个样品的所有溶液转移到过滤漏斗中,并施加真空。如果需要,逐步添加一部分溶液,直到整个体积被过滤。最后一次添加溶液后,使用无颗粒水射流开始冲洗过滤器支架的内壁。保持真空,直到膜过滤器表面没有液体。将膜式过滤器放在有盖培养皿中,让过滤膜风干,盖子稍微半开。过滤膜干燥后,将皮氏培养皿放在显微镜台上,在照明设备的反射光下扫描过滤膜,并计算尺寸等于或大于10 µm的颗粒数量和等于或大于25 µm的颗粒数量。或者,允许通过计算部分过滤膜的计数来确定整体过滤膜的计数。计算待检查制剂的平均颗粒数。
采用圆形直径网格进行粒径测定的过程是通过估算颗粒的等效直径,并与网格上的10 µm和25 µm参考圆进行比较。因此,粒子不会从网格视场内的初始位置移动,也不会叠加在参考圆上进行比较。透明分划参考圆的内径用于确定白色和透明粒子的大小,而黑色粒子的大小则使用黑色不透明分划参考圆的外径。
在进行微观颗粒计数试验时,不要试图测量或列举无定形、半液体或其他形态不明显的材料,这些材料在过滤膜上会出现污渍或变色。这些材料表面很少或没有起伏,呈现胶状或薄膜状外观。在这种情况下,可通过光阻法计数方法测试溶液样品来帮助解释计数。
评估
对于在标称体积大于100 mL的容器中提供的制剂,应采用试验2.A的标准。对于在标称体积小于100 mL的容器中提供的制剂,采用试验2.B的标准。对于标称体积为100 mL的容器中提供的制剂,采用试验2.B的标准。
[注:日本药典中使用了试验2.A]
试验2.A
标称含量超过 100 mL 的容器中的肠胃外输注溶液或注射溶液:如果测试单位中存在的尺寸大于等于10 µm的粒子的平均颗粒数不超过 12个/mL,尺寸大于等于25 µm的粒子的平均颗粒数不超过2个/mL,则该制剂符合测试要求。
试验2.B
标称含量超过 100 mL 的容器中的肠胃外输注溶液或注射溶液:如果测试单位中存在的尺寸大于等于10 µm的粒子的平均颗粒数不超过 3000个,尺寸大于等于25 µm的粒子的平均颗粒数不超过300个,则该制剂符合测试要求。
解决方案:
上海胤煌科技为注射剂中的不溶性微粒检测提出了以下产品:
1、 YH-LEIP-0201光阻法不溶性微粒分析仪

LEIP系列不溶性微粒检测仪满足各国药典中光阻法检测不溶性微粒的仪器要求,可直接检测注射液、无菌粉、输液器具及药包材的不溶性微粒含量及大小。仪器采用高性能进口激光光源及补偿电路,保证各种无色、有色样品的测试精确度。进样狭缝及管路采用进口316L及进口PTFE材料,可直接检测有机溶剂、油基质等特殊溶液。
2、YH-MIP-0103显微计数法不溶性微粒分析仪

技术优势:
√全自动的测试系统,自动扫描、计数、出具报告,减少人为操作的误差
√全自动检测系统,减少在使用过程中对测试人员眼睛的伤害
√可以区分颗粒性质,鉴别不溶性微粒的来源,是金属还是纤维
√符合中国药典、美国药典、欧洲药典、日本药典等各国药典对于不溶性微粒检查的要求。
3、YH-MIP-0205 Pro全自动显微计数法不溶性微粒分析仪

YH-MIP-0205 Pro全自动显微计数法不溶性微粒分析仪是全新一代的不溶性微粒分析仪,能够以全自动的方式实现样品中的不溶性微粒检测,可以完成自动过滤、干燥、测试、出具报告等多项流程;超分辨算法、AI智能算法等多种图像处理方式的引入,能有效确保测试数据的准确性。符合中国药典、美国药典、欧洲药典及日本药典等各国药典不溶性微粒检查的仪器要求。
下载本篇解决方案:
更多![]()
药用辅料不溶性微粒检测-关注辅料蔗糖不溶性微粒超标的危害
药用辅料蔗糖在生物技术药物的冻干工艺中常用作保护剂,它既能在冷冻过程中充当低温保护剂,又能在干燥脱水过程中起到脱水保护剂的作用,并且不含还原基不会使得生物制品发生蛋白质褐变反应从而变质失活。在生物技术药物的冷冻干燥配方中,蔗糖是最常用、用量最大的保护剂,因此在其质量控制过程中安全性应予以足够的重视。 王珏等学者在《基于小鼠腘窝淋巴结模型对疫苗用辅料蔗糖中不溶性微粒激发免疫应答风险的评估》中对比了部分不同厂家蔗糖产品中不溶性微粒在大小和数量上的差异,实验结果表明不同厂家的蔗糖产品显示出对小鼠脾淋巴细胞增殖不同程度的影响,作用程度与产品中的不溶性微粒数目有关。
制药/生物制药
2022/08/22
不溶性微粒检查专题介绍9-不溶性微粒检查的QA
不溶性微粒检查需要多少样品测试? 不溶性微粒检查样品前处理的方法有哪些? 不溶性微粒检查怎么消除气泡? 不溶性微粒检查样品能不能稀释?
制药/生物制药
2023/11/12
不溶性微粒检查专题介绍8-不溶性微粒定性分析介绍
不溶性微粒的定性分析,这个是接下来很多用户关注的重要领域,在USP1788上面有介绍到在我们之前专题不溶性微粒发展趋势里面也有讲到,对于不溶性微粒的研究,不只是大小,还需要知道微粒是什么,然后去溯源和改进。当然不知道是不溶性微粒,可见异物的溯源和定性分析也是关注的热点。
制药/生物制药
2023/11/05
不溶性微粒检查专题介绍6-不溶性微粒检查的应用领域
我们介绍了不溶性微粒的定义、检查原理和发展趋势等,结合前面的介绍,不溶性微粒的检查在生物医药领域目前应用的三个主要领域是:制剂的不溶性微粒检查、 药用包材的不溶性检查、医疗器械的不溶性微粒检查。
制药/生物制药
2023/10/17













