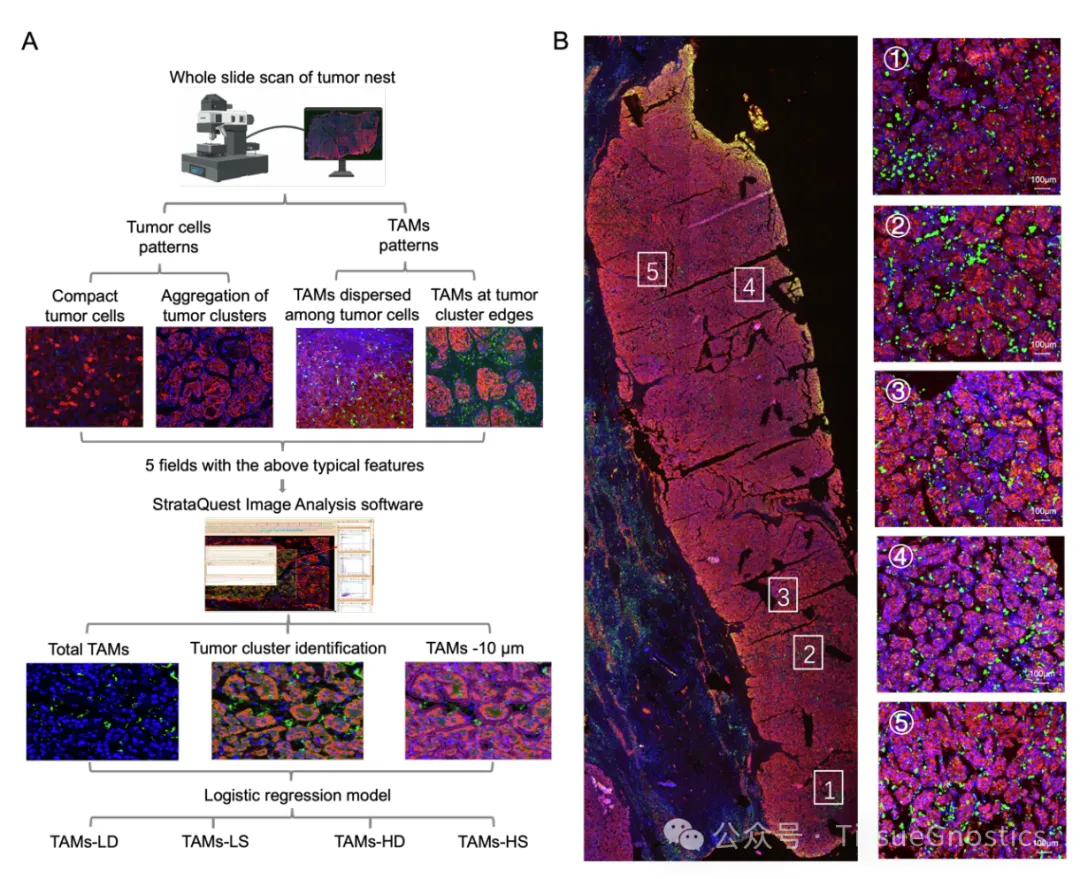
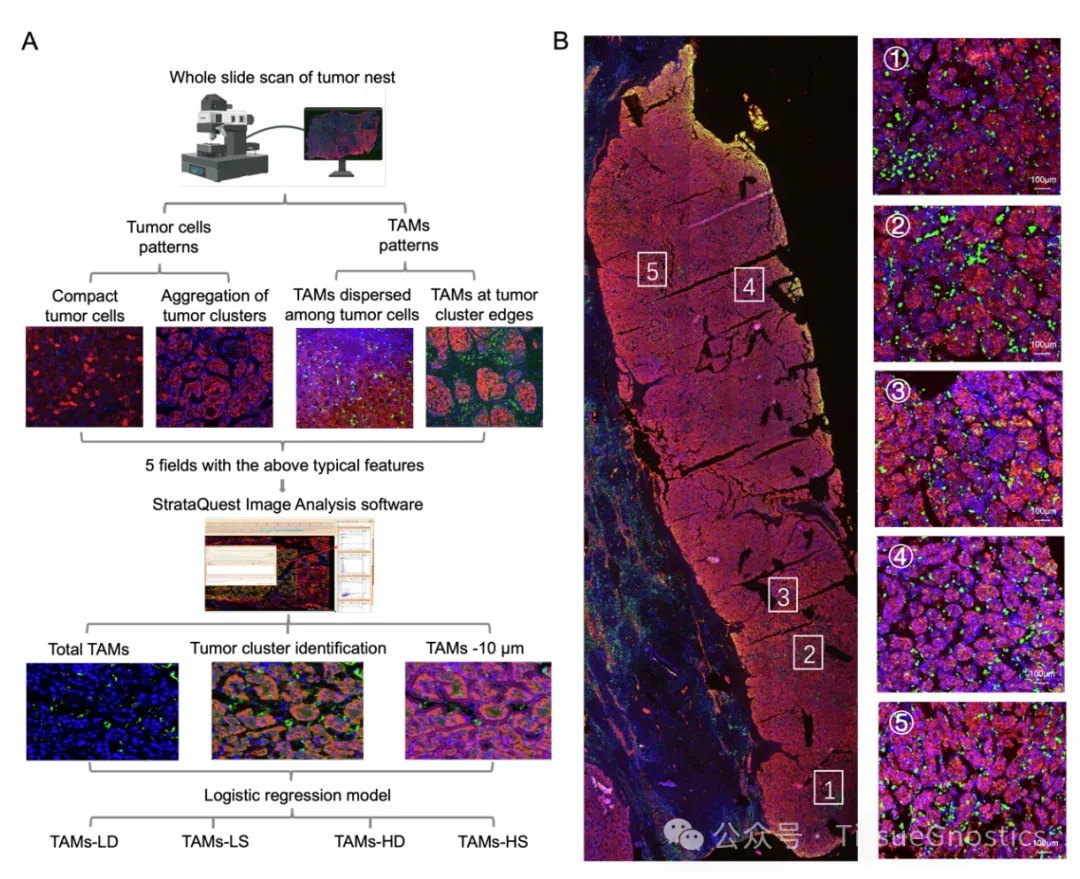
山东大学马春红教授等发现Siglec-9/Siglec-9L可作为潜在干预靶点
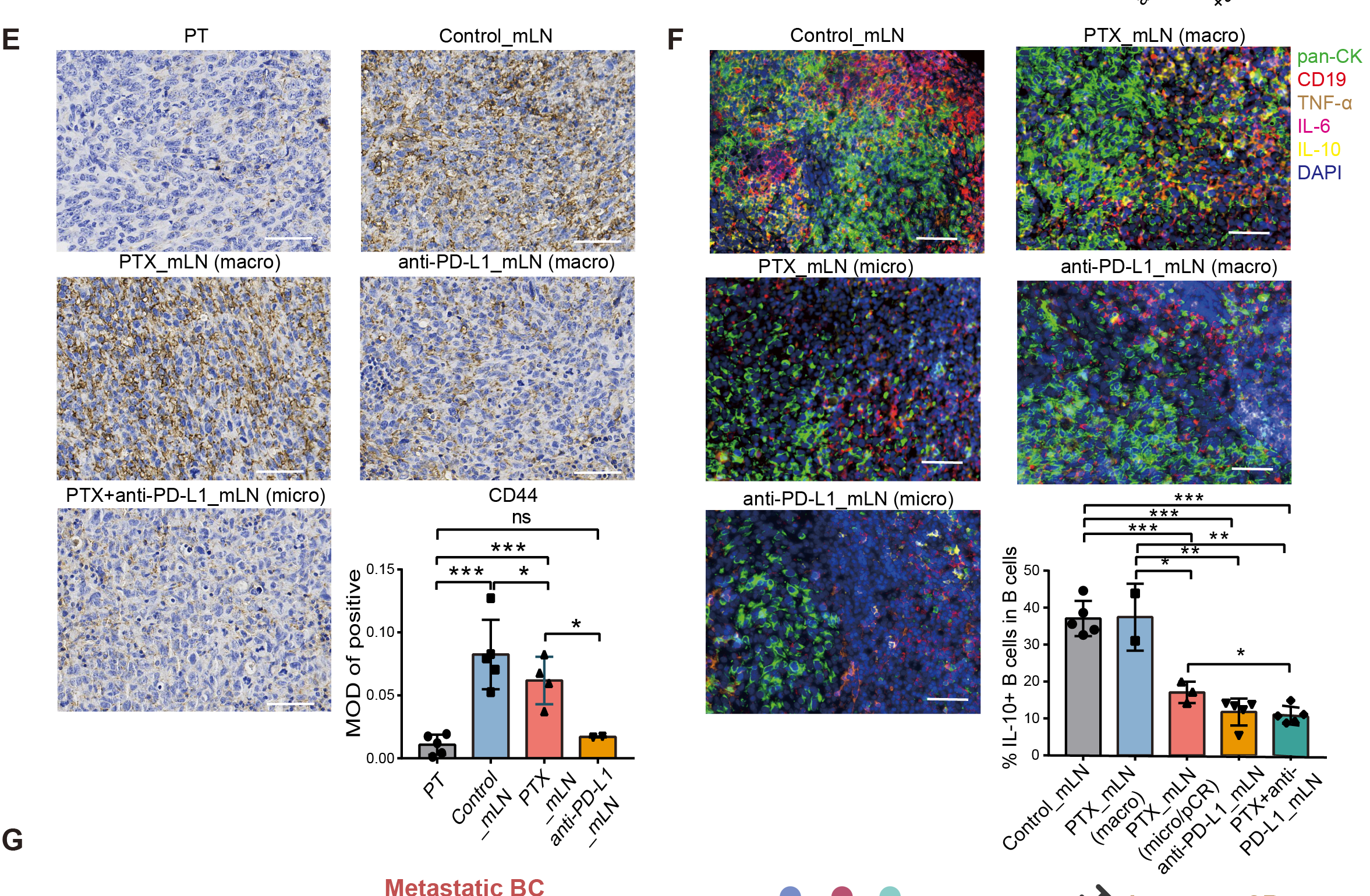
肝细胞癌(HCC)是世界上发病率和死亡率最高的肿瘤之一,其发病率和死亡率分别位列第六位和第四位。自然杀伤(NK)细胞是监测肿瘤的重要效应淋巴细胞,尤其富集于肝脏。然而,在大多数HCC患者中,肿瘤微环境(TME)中的NK细胞数量减少,功能受损,其影响与肿瘤分期和患者生存期相关。Siglec-9是一种与其配体Siglec-9L相互作用并限制NK细胞功能的蛋白质,因此被认为是一种潜在的治疗靶点。然而,Siglec-9/Siglec-9L 在 HCC 中的原位相互作用尚未见报道,也缺乏相关的干预策略。在此,本研究为了表明 Siglec-9/Siglec-9L 介导的细胞社会学,并确定靶向 Siglec-9 的小分子抑制剂,以提高基于 NK 细胞的 肝癌免疫疗法的疗效。山东大学马春红教授、梁晓红教授、刘新泳教授以及山东大学齐鲁医院韩博教授作为共同通讯作者在Journal of Hepatolog发表题为“Increased Siglec-9/Siglec-9L interaction in NK cells predicts poor HCC prognosis and can be a targetable checkpoint for immunotherapy”的研究论文。研究发现了一种针对 Siglec-9 的小分子抑制剂,可以增强 NK 细胞功能,揭示了一种新的肝癌免疫治疗策略,值得进一步的临床研究。本研究采用多重免疫荧光染色分析Siglec-7、-9及其配体在HCC组织中的表达模式。分析发现,Siglec-9及其配体的表达呈明显正相关,在肿瘤组织中,与Siglec-9+ NK细胞邻近的配体阳性细胞比例显著提高,并且以NK细胞为主,提示肿瘤微环境内Siglec-9与其配体有更强的相互作用,且该相互作用主要发生在NK细胞之间,表明Siglec-9/Siglec-9L可作为NK细胞上肝癌免疫治疗的潜在干预靶点。然后,研究团队基于虚拟对接、生物膜干涉技术(BLI)和表面等离子共振技术(SPR),来鉴定有效的小分子 Siglec-9 抑制剂。在体外和 NCG 小鼠中进一步评估了治疗潜力。结果表明MTX-3937可以作为先导化合物,具有HCC免疫治疗的临床应用前景,为肝癌免疫治疗提供了新的靶点和策略。实验部分本文使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统对小鼠肝癌组织TMA样本进行扫多色荧光图像采集。通过Tissue Cytometry技术获得了精准的单细胞定量结果、空间定量数据及蛋白表达水平的量化。Panel 1:DAPI、CD68、CD56、CD3、Siglec-9Panel 2:DAPI、CD68、CD56、CD3、Siglec-9L、HepPar-1Tissue Cytometry是一种先进的多色免疫荧光分析技术,它结合了组织学、细胞生物学和流式细胞术的特点,允许研究人员在细胞和组织层面上进行高分辨率、高通量的定量分析。本文作者利用Tissue Cytometry技术,对肝癌组织进行多色标记后,通过其精确定量、空间分辨率能力,整合蛋白结构研究数据和生物信息学数据,对肝癌临床组织芯片中Siglec-7和Siglec-9与其配体的空间分布特征进行详细分析。文中利用Tissue Cytometry技术,通过单细胞及亚细胞结构的准确识别,构建了Siglec-9和Siglec-9L在肿瘤浸润的NK细胞(TINK)中的表达模式,结合临床数据验证其与肿瘤预后之间的关系。研究发现,Siglec-9及Siglec-9L在TINK中的表达显著高于正常组织,并且与患者的不良预后呈负相关,揭示了Siglec-9/Siglec-9L相互作用在肝癌发展中的潜在作用,并指出了它们作为免疫治疗靶点的可能性;通过可视化并量化Siglec-9和Siglec-9L在肿瘤微环境中的表达和相互作用,对NK细胞在肝癌免疫监视中的作用,以及如何通过靶向Siglec-9/Siglec-9L相互作用来增强NK细胞的抗肿瘤活性也进行了定量研究。此外,研究者使用Tissue Cytometry技术对筛选出的小分子化合物MTX-3937验证发现其抑制Siglec-9信号通路来提高NK细胞的抗肿瘤能力,为后续的实验设计和治疗策略提供了重要信息。值得一提的是,Tissue Cytometry技术提供了从亚细胞结构到组织水平的多层级单细胞空间分辨率,为原位数据的探索和验证提供了重要途径。Figure 1. NK 细胞中 Siglec-9 表达上调与 HCC 患者生存率低有关(B)HCC 组织中多重免疫荧光染色(Siglec-9,绿色;CD56,黄色;CD3,青色;CD68,红色;细胞核,蓝色)的代表性图像。(C) 癌组织和癌旁组织中 Siglec-9 在指定细胞上的 MFI 和频率。CD3-CD56+ 表示 NK 细胞;CD3+CD56- 表示 T 细胞;CD68+ 表示巨噬细胞。(D) 癌旁组织和癌组织中 Siglec-9+ 和 Siglec-9- NK 细胞分布的模型图像。Figure 2. 在与 Siglec-9+ NK 细胞相邻的 Siglec-9L+ 细胞中,CD3-CD56+ 细胞占主导地位。(A)HCC 组织中多重免疫荧光染色的代表性图像(Siglec-9L,绿色;CD56,红色;CD68,黄色;CD3,青色;HepPar-1,白色;细胞核,蓝色)。(B)癌组织和癌旁组织中 Siglec-9L 在指定细胞上的 MFI 和频率。(C) Siglec-9L 在肝细胞(左)和 NK 细胞(右)上的代表性图像。(D) 16 名复发性和 8 名非复发性 HCC 患者癌组织中 NK 细胞和肝细胞上 Siglec-9L 的 MFI。(E)癌组织中 Siglec-9 和 Siglec-9L 表达水平的相关性。(F)癌组织中 Siglec-9L+/- 肝细胞周围 HepPar-1- 细胞的比例。(G)Siglec-9+CD3-CD56+ NK 细胞(橙色)与 Siglec-9L- (红色l轮廓)或 Siglec-9L+ (黄色轮廓)邻居的细胞社会学。图中显示了代表性图像和x相邻频率。(H)HCC 组织中与 Siglec-9+CD3-CD56+ NK 细胞相邻的 Siglec-9L+ 细胞中指定细胞群的比例。每个点代表一个样本的数据。
应用实例
2024.07.29
苏州大学章良教授发现USP2a 在EGFR驱动突变的肺癌中的作用,提供肿瘤治疗靶点
肺癌是最常见的癌症类型,肺癌病例的85%为非小细胞肺癌(NSCLC)。非小细胞肺癌中一个极其重要的驱动突变基因是表皮生长因子受体(EGFR),大约三分之一的肺腺癌中都发现了其突变。EGFR突变可以赋予肿瘤细胞更强的CD8+T细胞的抑制功能,EGFR突变的肺腺癌亚型(EGFR MT)在TME中的B7-H4表达增强,CD8+ TILs功能降低,这与抗PD-1疗法的不良反应有关。最近,越来越多的临床研究将 B7-H4 作为肿瘤免疫治疗策略的靶点。近日,苏州大学药学院章良课题组在Cancer Letters发表题为“The deubiquitinase USP2a promotes tumor immunosuppression by stabilizing immune checkpoint B7–H4 in lung adenocarcinoma harboring EGFR-activating mutants”的文章,研究了去泛素化酶 USP2a 在肺腺癌中的作用,特别是其如何通过稳定免疫检查点 B7-H4 来促进肿瘤免疫抑制,提供了一个潜在的肿瘤治疗靶点。这项研究发现,B7–H4 是一个关键的免疫检查点,能够抑制 CD8+ T 细胞的活性。目前正在进行一项临床试验,研究 B7–H4 作为潜在免疫治疗剂的作用。然而,B7–H4 通过泛素-蛋白酶体途径(UPP)降解的调控机制仍然不清楚。在这项研究中,我们发现蛋白酶体抑制剂有效地增加了 B7–H4 的表达,而 EGFR 激活突变体通过 UPP 促进了 B7–H4 的表达。通过进一步研究 USP2a 在体内肿瘤生长中的作用。发现在免疫健全的 C57BL/6 小鼠肿瘤模型中,USP2a 的缺失促进了 CD95+CD8+ 效应 T 细胞的浸润,并通过破坏 B7–H4 的稳定性阻碍了 Tim-3+CD8+ 和 LAG-3+CD8+ 耗竭 T 细胞的浸润。临床肺腺癌样本显示,B7–H4 的丰度与 USP2a 的表达显著相关,表明 EGFR/USP2a/B7–H4 轴对肿瘤免疫抑制的贡献。实验部分文章使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统获取图像。通过Tissue Cytometry技术获得了精准的单细胞定量结果、空间定量数据及蛋白表达水平的量化。Panel 1:EGFR、Cyclin D1、PCNA、Ki67、DAPIPanel 2:EGFR、CD8、PD-1、TIM-3、LAG-3、DAPIPanel 3::EGFR、CD8、CD137、CD95、CD69、DAPITissue Cytometry技术,也称为组织细胞定量分析技术,是一种先进的组织成像和分析方法,不仅能帮助临床医师更深入地理解肿瘤的生物学特性,还能提升科研能力和效率,克服科研过程中的挑战。01肿瘤微环境中的作用文章中提到USP2a通过去泛素化作用稳定B7-H4,从而促进肿瘤免疫抑制。利用Tissue Cytometry技术,作者可以定量分析肿瘤组织中B7-H4的表达和分布,深入理解其在肿瘤微环境中的作用;为研究B7-H4与其他免疫细胞(如CD8+ T细胞)的关系,Tissue Cytometry技术在一张病理切片中同时检测多个标记物,提供多参数分析,帮助揭示这些复杂相互作用;研究USP2a的敲除影响了肿瘤细胞与免疫细胞的相互作用时,作者借助Tissue Cytometry技术的空间分析功能,揭示了免疫细胞在肿瘤微环境中的空间分布,这对于理解免疫细胞如何参与肿瘤免疫调节至关重要。02高通量自动化的分析Tissue Cytometry技术拥有国际领先的组织切片原位定量分析思路、算法与验证工作流,参与使用Tissue Cytometry技术的项目,临床医师可以通过实际操作提升其科研技能,特别是关于组织成像和定量分析的技能。使用该技术能够处理来自大量患者的样本,使得研究更具代表性和统计学意义,对于研究如肺腺癌这样具有高度异质性的疾病尤为重要。利用TissueFAXS Cytometry技术的自动化和高通量分析能力,临床医师可以更高效地处理大量样本,从而在繁重的临床工作之余,还能有效进行科研工作。尽管资金是科研的一大挑战,但以Tissue Cytometry技术作为数据深入分析的基础,提供的高通量和高精度分析可以在有限的预算内产生更多的研究成果,在科研项目中提高资金的使用效率。03提升多学科交叉合作,帮助临床拓宽科研领域,打开合作思路文章中的研究表明,USP2a的作用涉及多个生物学领域,如分子生物学、免疫学和肿瘤学等,这些也同样是Tissue Cytometry技术的应用范畴。利用Tissue Cytometry技术,临床医师可以更容易地与其他领域的专家合作,共同解决复杂的医学问题。相比之下,Tissue Cytometry技术发表文章的影响因子普遍较高,研究结果具有国际影响力,利用该技术,临床医师可以与国际同行分享和讨论研究数据,提升研究的国际认可度。Figrure1. USP2a 可促进免疫缺陷裸鼠的肿瘤增殖(F) 具有代表性的裸鼠肿瘤多色染色图在裸鼠体内形成的肿瘤的代表性多色染色:表皮生长因子受体(绿色)、细胞周期蛋白 D1(红色)、PCNA(灰色)、Ki67(紫色)、SN470(蓝色)。(G) EGFR+ 肿瘤细胞中 Cyclin D1+ EGFR+、Ki67+ EGFR+、PCNA+ EGFR+ 的百分比统计。Figure2. USP2a在免疫健全的C57BL/6小鼠中促进肿瘤免疫抑制,B7-H4参与这一过程。(B) 代表性多色染色显示耗竭的CD8+ T细胞标志物:EGFR(绿色)、CD8(红色)、PD-1(灰色)、Tim-3(黄色)、LAG-3(紫色)、SN470(蓝色)。(C) 统计了EGFR+肿瘤细胞和CD8+ T细胞在所有细胞中的百分比。(D) 类流式散点图显示了肿瘤浸润的Tim-3+CD8+、PD-1+CD8+和LAG-3+CD8+ T细胞的百分比。统计分析显示三组之间浸润的Tim-3+CD8+ T细胞百分比存在显著差异。(E) Tim-3+CD8+和LAG-3+CD8+ T细胞在EGFR+肿瘤细胞距离梯度(0–5 μm、5–10 μm、10–20 μm和20–100 μm)内的空间分布。(F) 代表性多色染色显示效应CD8+ T细胞标志物:EGFR(绿色)、CD8(红色)、CD69(灰色)、CD137(黄色)、CD95(紫色)、SN470(蓝色)。(G) 类流式散点图显示了肿瘤浸润的CD69+CD8+、CD137+CD8+和CD95+CD8+ T细胞的百分比。统计分析显示三组之间浸润的CD95+CD8+ T细胞百分比存在显著差异。(H) CD95+CD8+ T细胞在EGFR+肿瘤细胞距离梯度(0–5 μm、5–10 μm、10–20 μm和20–100 μm)内的空间分布。
应用实例
2024.07.29
浙大医学院徐骁教授团队利用10色mIHC标记技术,挖掘肝细胞癌免疫治疗新思路
在全球范围内,肝细胞癌(HCC)以其高发病率和死亡率成为一大健康难题。中国作为HCC负担最重的国家之一,对有效治疗方法的需求尤为迫切。近年来,尽管免疫治疗为癌症治疗带来了突破性的进展,但HCC的免疫治疗响应率仍然不尽人意。在这样的背景下,一项针对HCC免疫微环境和RNA修饰作用的创新研究,为肝病治疗开辟了新的道路。HCC的治疗面临着多方面的挑战,包括肿瘤的快速进展、治疗抵抗性以及复杂的肿瘤微环境。在众多治疗方法中,免疫治疗因其激活患者自身免疫系统攻击肿瘤的机制而备受关注。然而,HCC患者对免疫治疗的反应不一,部分患者甚至在治疗后病情加剧。因此,深入研究HCC的分子机制,探索新的治疗靶点,对于提高治疗效果、改善患者预后具有重要意义。浙江大学徐骁教授、浙大一附院卫强副教授等团队在Cellular and Molecular Biology发表题为“Downregulation of N4-acetylcytidine modification in myeloid cells attenuates immunotherapy and exacerbates hepatocellular carcinoma progression”的文章。通过检测 HCC 免疫治疗期间各种免疫细胞亚群中 ac4C 水平的变化,验证了ac4C修饰在HCC免疫治疗中的重要作用。作者通过构建原位移植小鼠肝癌模型并分离肿瘤浸润的免疫细胞,使用流式细胞术评估ac4C修饰强度。通过单细胞RNA-seq全面评估肿瘤浸润免疫细胞的变化并识别靶细胞簇。进行 RNA-seq 和 RIP-seq 分析以阐明潜在的分子机制。然后本文研究者利用Tissue Cytometry技术,深入探究了RNA修饰ac4C在HCC免疫治疗中的作用。研究发现,ac4C修饰能够促进M1型巨噬细胞的浸润,减少骨髓源抑制细胞(MDSCs)的浸润,从而增强CTL介导的肿瘤细胞杀伤能力。更重要的是,高浸润的ac4C+CD11b+细胞与HCC患者的更好预后正相关,这为HCC治疗提供了新的生物标志物和治疗靶点。实验部分本文使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统对小鼠肝癌组织TMA样本进行扫多色荧光图像采集。通过Tissue Cytometry技术获得了精准的单细胞定量结果、空间定量数据及蛋白表达水平的量化。Panel:DAPI,TCF1,CD3,CD11B,PD1,CD25,TIM3,CD4,CD8,ac4cTissue Cytometry技术通过先进的图像分析和数据处理能力,解决了传统方法在肿瘤微环境研究中的多个难题,在本文原位数据的获取及分析方面发挥了关键作用。作者借助TissueCytometry技术,精确量化细胞密度和蛋白表达水平,为研究者提供了关于肿瘤微环境中细胞分布和状态的详细信息。通过对肝细胞癌中ac4C+CD11b+细胞分布密度的定量,分析了ac4C+CD11b+细胞比例与HCC患者预后之间的关系,发现高浸润的ac4C+CD11b+细胞与更好的预后正相关。在空间多组学数据分析方面,作者借助TSA技术标记多色标记技术,在一张样本上实现了10种蛋白标记物的免疫荧光染色:TCF1 (C63D9, CST, USA), CD11b (ab52478, Abcam, UK), PD1 (D4W2J, CST, USA), CD25 (ab231441, Abcam, USA), TIM3 (D5D5R, CST, USA), CD3 (ab16669, Abcam, USA), CD4 (ab133626, Abcam, USA), CD8 (ab237709, Abcam, USA), 以及 ac4C (ab252215, Abcam, UK)。此外,结合单细胞RNA测序(scRNA-seq)数据,作者评估了使用ac4C修饰抑制剂Remodelin hydrobromide(REM)对免疫细胞表型的影响,包括对CD8 T细胞、髓系细胞(CD11b+)、B细胞(CD20+)等的影响;分析了REM处理对髓系细胞中PDL1表达的影响,发现抑制ac4C修饰诱导了PDL1的表达;文章中对CTL(细胞毒性T淋巴细胞)的功能状态也进行了客观评估。Figure 1. Ac4C+CD11b+浸润与HCC患者更好的预后相关。(A)基于 TSA IHC 技术在 HCC 微阵列上观察多种标记物(DAPI、TCF1、CD11b、PD1、CD25、TIM3、CD3、CD4、CD8 和 ac4C)的图像。(B) I02患者组织中显示了ac4C+CD11b+细胞和CD3+CD8+PD1+细胞的图像。(C)计算肿瘤和邻近组织中的相对 ac4c+CD11b+ 细胞比率。(D)计算ac4C+CD11b+细胞与T亚群之间的相关性分析。通过对肿瘤的精准分型来推动癌症精准医疗,是国家关注及重大投入的重点项目之一。对不同肿瘤的常见靶点进行IHC标记技术,已经应用于临床肿瘤的辅助诊断。通过免疫荧光IF在一张样本中进行多色标记,不但可以获得以往结合多张IHC样本才能获得的多种标记标志物的阳性细胞含量,更可以通过空间距离分析其相互作用关系,这也正是肿瘤空间精准分型的意义。
应用实例
2024.07.29
山东大学基础医学院马春红教授团队发现胰岛β细胞新干预靶点
糖尿病是由于胰岛素分泌异常和/或功能受损引起的以高血糖为特征的代谢性疾病,长期代谢紊乱可引起多种严重并发症,是导致患者死亡的重要原因。β细胞质量和胰岛素分泌不足是2型糖尿病(T2D)发展的关键因素。Tipe1作为肿瘤坏死因子α诱导蛋白,在多种生物过程中发挥重要作用。传统认为其在肿瘤相关巨噬细胞(TAMs)中高度表达,支持肿瘤生长转移,并与患者的生存率降低有关;除此之外作为脂质转运蛋白也能参与脂质代谢和细胞膜稳定性过程,以及在炎症调节中发挥重要作用。但在糖尿病代谢相关研究领域发表的科研成果较少,缺乏对比数据使其文章数据的发表对实验结果可靠性与可信性要求更高。山东大学基础医学院马春红教授团队在Advanced Science发表题为“Beta-cell Tipe1 orchestrates insulin secretion and cell proliferation by promoting Gαs/cAMP signaling via USP5”的文章。研究结果表明,Tipe1通过Gαs/cAMP途径调节β细胞功能,提示Tipe1可能成为T2D干预的新靶点。Tipe1被确定为T2D的关键调节因子,有助于维持β细胞的稳态。结果显示,β细胞特异性敲除Tipe1(称为Ins2-Tipe1BKO)加重了db/db小鼠或高脂饮食诱导糖尿病小鼠的糖尿病表型。值得注意的是,Tipe1通过依赖Gαs(G刺激蛋白的α亚基)的过程改善了β细胞质量和功能。在机制上,Tipe1通过招募去泛素化酶USP5抑制了Gαs的K48连接泛素化降解。因此,Gαs或cAMP激动剂几乎完全恢复了Ins2-Tipe1BKO小鼠中观察到的β细胞功能障碍。实验部分本文使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统对人胰腺癌样本进行多色荧光图像采集。通过Tissue Cytometry技术获得了精准的单细胞定量结果、空间定量数据及蛋白表达水平的量化。多重免疫荧光标记技术(mIHC)的意义是通过一张组织切片样本进行成像分析,不仅在于可以从原位真正“看”到某个细化分型的关键细胞,更可以明确其分布的真实规律。在本文中,作者使用了Tissue Cytometry技术不但获得了多色切片中胰岛的准确轮廓,通过细胞核识别算法与细胞质形态学识别,在亚细胞水平上实现了单细胞蛋白表达的原位精准定量分析,更通过正反向回溯技术对关键蛋白Tip1表达情况及位置分布的重要性进行了双重确认,保证了数据的准确性及可靠性。在通过Tissue Cytometry技术建立标准分析流程的基础上,对比胰腺癌组织芯片上获得的大量数据,肯定了Tipe1通过促进 G𝜶s/cAMP 信号传导作用,调节了胰岛 β 细胞的质量和功能,以及在机制上Tipe1 通过招募去泛素化酶 USP5,抑制 G𝜶s 的 K48 连接泛素化降解,从而提高 G𝜶s 的稳定性。Figure 1 在db/db小鼠中,β细胞中Tipe1敲低导致严重的糖尿病表型(N-P) Ins2-Cre-db/db和Ins2-Tipe1BKO-db/db小鼠胰腺组织的H&E染色图像,测量胰岛面积/胰腺面积比,胰岛面积。(Q,R)免疫组化染色图像检测胰腺切片中胰岛素的蛋白水平,评估β细胞质量。Figure 2 人胰岛β细胞中Tipe1和Gαs表达与血糖水平呈负相关。A:来自患有和不患有T2D的胰腺癌症患者的胰腺癌旁组织的多重免疫荧光染色图像(TIPE1,绿色;胰岛素,橙色;USP5,红色;Gαs,紫色)。Figure S1 Tipe1在胰岛β细胞中高表达(A)采用人胰腺癌组织芯片,用抗TIPE1抗体进行免疫组化染色,并对癌旁组织进行分析。(B)胰腺癌患者癌旁组织多重免疫荧光染色图像(TIPE1,绿色;胰岛素,红色;胰高血糖素,橙色;生长抑素,粉红色)。(C,D)胰腺癌患者癌旁组织中β,α和δ细胞中Tipe1表达的中位荧光强度和频率。(E)取12周龄WT小鼠胰腺组织切片,进行抗TIPE1抗体免疫组织化学染色。细胞核苏木精染色(蓝色)。(G)3月龄雄性WT小鼠胰岛β细胞(胰岛素,红色)、α细胞(高血糖素,红色)和δ细胞(生长抑素,红色)染色。细胞核用DAPI(蓝色)染色,TIPE1阳性细胞用绿色染色。Figure S2 禁食状态下胰岛Tipe1的表达降低,重新摄食后表达恢复(E) 用抗TIPE1和抗胰岛素抗体对禁食和再喂养小鼠的胰腺切片进行IF染色。
应用实例
2024.07.05
国自然热点——可变剪接分析中的Tissue Cytometry技术应用
可变剪接的概念可变剪接(Alternative Splicing)是指从一个前体mRNA(pre-mRNA)通过不同的剪接方式(选择不同的剪接位点组合)产生不同的mRNA剪接异构体的过程。这一机制在真核生物中广泛存在,是调节基因表达和产生蛋白质组多样性的重要方式。基因序列中包含内含子和外显子,通过剪接体(spliceosome)的作用,内含子被移除,外显子被拼接在一起。然而,在可变剪接过程中,不同的外显子组合可以被选择性地保留或排除,从而产生多种不同的mRNA转录本和相应的蛋白质异构体。不同的剪接异构体可能具有不同的功能或活性,这种功能多样性使得可变剪接在调控复杂生理过程(如细胞凋亡、信号传导、免疫反应等)中具有重要意义。可变剪接与蛋白质多样性可变剪接是从相对简单的基因组提高蛋白质组多样性的重要机制。人类基因组中大约95%的多外显子基因存在可变剪接现象,一个基因通过可变剪接可以产生多种剪接异构体。例如,果蝇的Dscam基因通过可变剪接可以产生多达38,016种不同的蛋白质异构体[1]。这种多样性使得蛋白质组的复杂性远远超过基因组的复杂性,赋予生物体在不同环境和生理条件下更强的适应能力。除此之外,可变剪接还通过调控mRNA的稳定性、翻译效率和定位来影响蛋白质的表达水平;不同的剪接异构体可能具有不同的修饰位点,从而改变蛋白质的功能、活性、定位和稳定性。在基础研究中,转录组数据主要反映基因的转录水平,而蛋白质组数据则反映蛋白质的实际表达水平和功能状态。由于可变剪接的存在,蛋白质组数据和转录组数据之间可能存在显著差异。可变剪接可以导致同一个基因产生多种不同的mRNA和蛋白质异构体,这些异构体在不同的组织、细胞类型或生理条件下可能具有不同的表达模式和功能。因此,在研究中,转录组数据和蛋白质组数据可能会显示出不同的表达谱和功能特征。蛋白质组数据研究的重要性与挑战蛋白质组研究直接反映了细胞的功能状态和生理过程,是理解生命活动本质的核心。相比之下虽然转录组研究提供了有价值的信息,但蛋白质组研究更能揭示细胞功能的执行机制和调控网络。因此,蛋白质组研究在生命科学研究中具有不可替代的核心地位。蛋白质组研究可以直接揭示细胞的功能状态、代谢活动和信号传导过程,而这些在转录组水平可能无法准确反映;翻译后修饰(如磷酸化、糖基化、泛素化等)对蛋白质功能至关重要。这些修饰只能通过蛋白质组学方法检测,是理解蛋白质活性调节和信号传导的关键。空间转录组技术可以精准分析不同细胞基因表达的差异,但mRNA水平并不总是与蛋白质表达水平相关,结合蛋白质组学直接测量蛋白质的实际表达水平,更准确地反映基因表达的最终结果。蛋白质组学的复杂性为技术开发带来了巨大挑战。由于翻译后修饰产生了大量异构体,且这些异构体通常以复合物形式存在并发挥生物学功能,因此需要特殊技术来追踪多标记蛋白和进行超多蛋白表达的定量分析。蛋白质组学分析需要更高的灵敏度和更广的检测范围,以覆盖蛋白质表达水平的广泛动态范围。Tissue Cytometry在蛋白质组研究中的应用优势Tissue Cytometry技术作为一种先进的生物医学研究工具被广泛用于空间蛋白质组学研究,其多标记分析能力在单细胞水平上提供了前所未有的细胞分析精度,并通过多色免疫荧光定量分析则进一步增强了其在精准医疗领域的应用潜力。这项技术不仅能够检测多个抗原,还能保留细胞的空间位置信息,这对于研究细胞如何在组织中相互作用以及它们在微环境中的行为至关重要。结合AI技术,Tissue Cytometry能够实现精准的形态学分割和空间定位,这在多组学整合分析中尤为重要。该技术在高水平学术期刊上发表的2700+研究成果,证明了其在科学研究中的重要价值和可靠性,在癌症治疗、免疫学研究等领域正在积极推动个体化医疗和靶向治疗的发展。这些优势共同塑造了Tissue Cytometry技术作为空间蛋白组学研究的强大工具的地位,有助于科学家们更深入地理解细胞在组织微环境中的复杂交互和功能状态。Tissue Cytometry技术拥有独特的动态可视化流式散点图分析方法,正反向回溯追踪校验目标组织结构、单细胞甚至单个核酸荧光分子的表达强度及位置,这种追踪甚至可以直至目镜,通过肉眼直接判断数据分析策略方法的合理性及准确性。大量应用TC技术发表的高水平研究文章证明研究者已经把TC技术作为衡量其他研究技术的可信程度,提取组织原位数据进行验证的可靠工具之一。TC技术发表文章及案例1. 癌症转移相关分子机制研究中国科技大学张华凤教授课团队与南方医科大学高平教授课题组联合发表文章《缺氧诱导的 MBD2 剪接抑制通过激活 FZD1 促进乳腺癌转移》[2],阐明了低氧条件下MBD2可变剪接的调控机制,以及不同MBD2异构体在乳腺癌转移中的相反作用,为理解乳腺癌转移机制提供了新的视角。文章使用TissueGnostics公司的HistoQuest软件进行定量分析,研究MBD2a在正常乳腺组织、原位导管癌(DCIS)、侵袭性癌症和乳腺癌相关的肺转移中的表达情况。2. 构建具有特殊用途的动物模型中山大学眼科中心郑颖丰教授团队在Cell子刊发表题为《研究视网膜和血管相关疾病的 RBPMSCreERT2-tdTomato 小鼠品系》[3] 的文章。作者开发了一种新的RBPMSCreERT2-tdTomato报告小鼠系,用于跨各种组织追踪RBPMS+细胞的谱系,特别是在视网膜神经节细胞(RGCs)和平滑肌细胞中。利用这种小鼠系模拟视网膜退行性疾病,并在体内无创地检查脉络膜新生血管形成。RBPMSCreERT2-tdTomato小鼠系可用于疾病建模、药物筛选以及分离特定靶细胞,为相关研究提供了宝贵工具。本文讨论的视网膜成像和分析,采用了TissueGnostics公司的2D/3D多维全景组织细胞定量分析系统。该系统不仅利用共聚焦原理清晰成像厚视网膜,而且其多通道免疫荧光成像速度是传统共聚焦的5到10倍,显著提高了高清成像的通量。3. 肺癌中不同亚型蛋白的功能研究随着对参与表型可塑性的RNA异构体的困惑增加,异常的CpG甲基化介导的选择性剪接中断越来越被认为是肿瘤内异质性(ITH)的驱动因素。蛋白酶3(PRSS3)具有4种亚型,即PRSS3-V1到V4,是一种不可或缺的胰蛋白酶,对肺癌的发展有不同的影响。在肺癌中,作者发现PRSS3基因的转录本及其剪接变体在肺癌中表达不同,具有相反的功能和临床结果,即具有致癌性的PRSS3-V1和PRSS3-V2与具有抑癌性的PRSS3-V3。2023年5月,首都医科大学附属北京胸科医院肿瘤研究中心黄家强教授团队在Acta Pharma Sin B上发表了题为 《UHRF1/DNMT1eMZF1 axis-modulated intragenic site-specific CpGI methylation confers divergent expression and opposing functions of PRSS3 isoforms in lung cancer》[4]的研究论文,探讨了UHRF1/DNMT1–MZF1轴通过调节基因内CpG岛甲基化(Intragenic CpG Methylation, iCpGIm)来调控PRSS3剪接变体的表达差异,从而导致非遗传功能的肿瘤内异质性。[1]Schmucker, Dietmar, et al. "Drosophila Dscam is an axon guidance receptor exhibiting extraordinary molecular diversity." Cell 101.6 (2000): 671-684.[2]Liu, Zhaoji, et al. "Hypoxia-induced suppression of alternative splicing of MBD2 promotes breast cancer metastasis via activation of FZD1." Cancer research 81.5 (2021): 1265-1278.[3]Li, Guilan, et al. "The RBPMSCreERT2-tdTomato mouse line for studying retinal and vascular relevant diseases." Iscience 26.11 (2023).[4]Lin, Shuye, et al. "UHRF1/DNMT1–MZF1 axis-modulated intragenic site-specific CpGI methylation confers divergent expression and opposing functions of PRSS3 isoforms in lung cancer." Acta Pharmaceutica Sinica B 13.5 (2023): 2086-2106.
应用实例
2024.07.02
Tissue Cytometry技术为胆管癌相关IL-6信号通路的多组学可视化研究提供策略
胆管癌 (CCA) 是第二常见的肝原发性恶性肿瘤,其金标准治疗是手术。不幸的是,由于晚期诊断和频繁的主要血管浸润,CCA 很少适合根治性切除。大血管浸润历来被认为是切除术的禁忌证,但在对胆管癌的非手术治疗方案研究中,少有涉及针对胆管癌血管侵袭靶点的机制性研究。其难点在于胆管癌具有高度的生物学异质性,肿瘤微环境复杂,缺乏有效可靠的评估手段。胆管癌是一种典型的炎症诱导性恶性肿瘤,升高的白细胞介素-6(IL-6)水平与CCA的发病和进展有关。本研究旨在探讨IL-6通路在CCA中的潜在预后价值。陆军军医大学西南医院李大江教授团队在Frontiers in Immunology发表题为“Expression and clinical significance of interleukin-6 pathway in cholangiocarcinoma”的文章。本研究的发现表明IL-6信号通路可能对CCA具有潜在的预后价值。需要进一步研究以了解CCA中IL-6通路的潜在分子机制。本文使用多重免疫荧光技术检测了CCA的TMA样本中IL-6、IL-6R、糖蛋白(gp130)、C-反应蛋白(CRP)、Janus激酶2(JAK2)和转录激活因子3(STAT3)的表达。此外,文章还评估了临床相关性和预后价值。最后,进行了单细胞转录组分析,以评估CCA中IL-6通路基因的表达水平。研究结果显示,与正常组织相比,肿瘤组织中IL-6的表达较低,而STAT3的表达较高。尤其在肿瘤微环境中的研究中,IL-6通路基因的表达普遍下调。重要的是,gp130在肿瘤组织中与JAK2强相关,而在正常组织中与JAK2的相关性较弱。虽然没有基因表达与总生存率和无病生存率直接相关,但我们的研究发现,IL-6、IL-6R、CRP、gp130和JAK2与血管侵袭呈负相关,这是CCA患者预后不良的风险因素。实验部分本文作者利用Tissue Cytometry技术,针对胆管癌TMA组织芯片进行多重免疫荧光标记,在获得TMA芯片中单细胞染色信号的强度和分布的基础上,通过大量的Spearman回归算法分析,确定了IL-6通路IL-6、IL-6R、gp130、CRP、JAK2和STAT3基因表达之间的相关性。值得一提的是,Tissue Cytometry为IL-6信号通路的研究提供了一个强大的工具,并使得这一复杂的生物过程得以可视化。通过Tissue Cytometry技术,研究人员能够在单细胞水平上观察并定量IL-6及其受体与细胞内信号分子的相互作用,结合mIHC多重免疫荧光染色与Tissue Cytometry技术中流式散点图圈门的分析思路以及正反向回溯的追踪验证模式,极大提升了数据的可靠性与可信度,这对于深入理解IL-6在疾病中的作用至关重要。文章最后借助单细胞测序技术,从转录水平层面进行了交叉验证,让数据更加准确真实,也拓展了空间多组学研究思路在胆管癌中的应用。使用TissueGnostics公司TissueFAXS Plus全景组织扫描定量分析系统获取图像。获取到图像利用StrataQuest软件进行定量分析,首先, 作者 使用了光谱库来获得单通道荧光信号,然后使用DAPI通道来识别有效的细胞核。以细胞核为核心,我们根据每种 marker 的染色的情况设置了阈值,将 marker 表达阳性的细胞群分开,并计算了阳性细胞的数量。 本文 还计算了双阳性细胞的数量和强度。最后,使用平均强度乘以阳性细胞的百分比来表示 marker 的表达水平 。Figure 1 多重免疫荧光检测胆管癌组织中IL-6、IL-6R、gp130、JAK2、STAT3和CRP的表达。(A)IL-6(黄色)、gp130(绿色)和JAK2(红色)的多重免疫荧光图像。(B)IL-6R(绿色)、STAT3(黄色)和CRP(红色)的多重免疫荧光图像。(C)IL-6(黄色)、gp130(绿色)和JAK2(红色)平均强度的分布。(D)IL-6R(绿色)、STAT3(黄色)和CRP(红色)平均强度的分布。Figure 2 应用StrataQuest软件对MIF样本中肿瘤组织(蓝色)和正常组织(红色)中IL6(A)、IL6R(B)、gp130(C)、JAK2(D)、STAT3(E)和CRP(F)的表达差异进行评估。Figure 3应用StrataQuest软件对IL-6、IL-6R、gp130、JAK2、STAT3、CRP在双阳性和三阳性细胞中的表达差异进行评估。(A)IL-6R+CRP+细胞中IL-6R和CRP的表达。(2)IL-6R+STAT3+细胞中IL-6R和STAT3的表达。(C)IL-6R+CRP+STAT3+细胞中IL-6R、CRP、STAT3的表达。(D)IL-6+gp130+细胞中IL-6和gp130的表达。(E)IL-6+JAK2+细胞中IL-6和JAK2的表达。(F)IL-6+gp130+JAK2+细胞中IL-6、gp130和JAK2的表达。Figure 4 应用StrataQuest软件对IL-6、IL-6R、gp130、CRP、JAK2、STAT3的相关性分析。Figure 5应用StrataQuest软件对IL-6和IL-6R在有血管侵犯和无血管侵犯患者中的表达差异。(A)IL-6+gp130+细胞中IL-6的表达。(B)IL-6+JAK2+细胞中IL-6的表达。(C)IL-6+gp130+JAK2+细胞中IL-6的表达。(D)IL-6R+CRP+细胞中IL-6R的表达。(E)IL-6R+STAT3+细胞IL-6R的表达。(F)IL-6R+CRP+STAT3+细胞IL-6R的表达。
应用实例
2024.07.02
北京协和医院赵玉沛院士团队利用Tissue Cytometry多组学验证技术构建胰腺癌的NETs异质
胰腺导管腺癌(PDAC)是导致与癌症相关的死亡的主要因素,仅有10%的患者在诊断后的五年内存活。在不到20%的患者中,原发性手术切除是可行的,而大多数患者表现为晚期、不可切除的疾病。PDAC肿瘤微环境呈现出复杂的异质性,其中中性粒细胞成为先天免疫细胞群体中的主要成分。在现代肿瘤学研究中,精准分型的重要性日益凸显,它为个体化治疗提供了科学依据。多组学技术的应用,如基因组学、转录组学、蛋白质组学和代谢组学的综合分析,已成为揭示肿瘤异质性和指导精准治疗的关键手段。这些技术能够在分子水平上揭示肿瘤的复杂性,从而帮助医生更好地理解肿瘤的生物行为,预测治疗反应,并为患者制定更加个性化的治疗方案。北京协和医院赵玉沛院士团队在Precision oncology发表题为“Multiomics integration reveals NETosis heterogeneity and TLR2 as a prognostic biomarker in pancreatic cancer”的文章。通过单细胞测序、空间转录组和多组学方法,我们包括了已发表的数据和我们的临床患者队列,阐明了中性粒细胞外陷阱(NETs)形成的内在异质性,并揭示了NETs与免疫抑制之间的相关性。同时,本文构建了一个多组学预后模型,表明表达下调的NETs可能导致患者不良预后。本文还确认了TLR2作为一个强有力的预后因子,低TLR2表达的患者具有更有效的T细胞和总体生存延长6个月。靶向TLR2可能是逆转免疫抑制、控制肿瘤进展以改善预后的有希望的策略。实验部分本文作者通过多组学技术,构建了一个针对胰腺导管腺癌患者的预后模型,发现NET表达下调的患者可能会有不利的预后。这种发现对于临床决策具有重要意义,因为它可能帮助医生识别出需要更积极治疗的高风险患者群体。在作者使用的多组学技术中,Tissue Cytometry多色免疫荧光定量分析技术作为一种强大的多层级原位空间分析工具,能够在单细胞水平上对组织样本进行深入分析。这项技术利用多色标记,可以同时检测多个抗原,从而提供关于细胞类型、状态和细胞间相互作用的详细信息。作者通过计算巨噬细胞与NET阴性及阳性中性粒细胞的距离关系,发现巨噬细胞与NET阴性的中性粒细胞之间的相互作用显著活跃,表明这些细胞在肿瘤微环境中扮演着重要的角色。此外,转录组学的证据进一步验证了这些观察结果,增加了发现的可信度。转录组学分析可以揭示细胞在基因表达层面的变化,这些变化可能与细胞功能和细胞间相互作用的变化相对应。因此,结合Tissue Cytometry和转录组学的数据,研究人员可以获得关于肿瘤生物学的更全面的理解。鉴于免疫抑制部分是由肿瘤微环境(TME)的重塑引起的,我们进一步研究了中性粒细胞外囊泡(NET)亚型与巨噬细胞之间的相互作用的异质性。与NET阳性亚型相比,巨噬细胞与NET阴性中性粒细胞之间的相互作用明显活跃。 为了提供更多中性粒细胞与巨噬细胞之间相互作用的证据,本文在胰腺导管腺癌(PDAC)组织中应用了免疫荧光染色,并确定了NET阳性中性粒细胞/NET阴性中性粒细胞与巨噬细胞之间的距离(Figure 1a、b)。该距离被标示并计算,以统计距离CD68+巨噬细胞20um和40um内的中性粒细胞(Figure 1b、c)。结果证实,巨噬细胞周围的NET阴性中性粒细胞数量大于NET阳性中性粒细胞(Figure1d)与转录组数据的结果一致。Figure 1 TME的异质性,包括中性粒细胞与巨噬细胞的相互作用和中性粒细胞诱导的T细胞耗竭。a : PDAC肿瘤组织中的CD66b(红色,中性粒细胞标记)、CD68(紫色,巨噬细胞标记)、LC3b(淡蓝色,自噬标记)、MPO(绿色,网状增殖标记)和DAPI(蓝色,细胞核标记)多色荧光图像。b : StrataQuest软件通过CD68染色识别肿瘤组织中的巨噬细胞。量化距巨噬细胞不同距离的中性粒细胞数:0~20μm(深绿色区域),20~40μm(棕色区)。c :StrataQuest软件量化中性粒细胞与巨噬细胞的位置关系。d: 巨噬细胞在20μm和20~40μm区域的中性粒细胞。
应用实例
2024.06.14
Tissue Cytometry助力中大附一林颖教授团队发现炎症性乳腺癌发展新机制
炎症性乳腺癌(IBC)是一种罕见且高度恶性的乳腺癌亚型,其特征是迅速出现弥漫性红斑和水肿。IBC转移发生率高达30%~40%,5年生存率仅为25%~48%。目前引起炎症和促进转移的潜在机制尚未阐明。尽管IBC和非IBC的组织病理相似,且具有相同的分子亚型,但前还没有针对IBC的治疗策略。因此,迫切需要探索导致IBC发展的发病机制和分子机制,以确定新的靶点来指导治疗。中山大学附属第一医院林颖教授团队近期在AACR发表题为“A subpopulation of luminal progenitors secretes pleiotrophin to promote angiogenesis and metastasis in inflammatory breast cancer”的文章。研究人发现IBC肿瘤中含有高表达神经营养性细胞因子胸腺素(PTN)的一组腺突前体(LP)细胞的富集。LP细胞分泌的PTN通过与位于IBC肿瘤和受影响皮肤中的内皮尖端细胞上的NRP1受体直接相互作用,促进了血管生成。NRP1在尖端细胞中的激活导致在IBC受影响的皮肤中招募不成熟的周血管细胞,这与增加的血管生成和IBC转移相关。总的来说,这些发现揭示了LP细胞、内皮尖端细胞和不成熟的周血管细胞之间通过PTN-NRP1轴的相互作用在IBC发病机制中的作用,为改善IBC的治疗策略提供了实验部分本文使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统对样本进行多色荧光图像采集。通过Tissue Cytometry技术获得了精准的单细胞定量结果、空间定量数据及蛋白表达水平的量化。文章作者借助Tissue Cytometry多色荧光单细胞定量分析技术,首先验证其在肿瘤中的富集情况,更通过原位空间位置距离证明了PTN+ LP细胞(krt1 /18+ ITGA6+ PTN+)分泌的PTN与尖端细胞(CD31+ CXCR4+ NRP1+)的NRP1相互作用。在这种研究方法中,无论是PTN+细胞还是尖端细胞所需的精细化表型研究依赖的多标记技术,还是从组织切片原位精准分析细胞真实轮廓的距离关系,都需要达到较高水平的组织染色技术、成像技术以及单细胞原位分析技术要求以及数据的可靠性验证要求更值得注意的是,本文作者表示,这部分工作的发表,也是第一次在单细胞水平上描述IBC肿瘤和受影响皮肤微环境的研究报告。通过这种方法,确定了 PTN + LP 亚群是 IBC 独特临床表现和侵袭性的关键贡献,为LPs、内皮尖端细胞和未成熟血管周围细胞之间在IBC发病机制中的作用探索了一条新的研究手段何思路,未来可以帮助改进IBC的治疗策略。PTN+ 28lp亚群在IBC肿瘤中的富集。(I)ibc邻近25个正常组织(ibc_nearby)中PTN+ 23个LP细胞(KRT8/18+ ITGA6+ PTN+ 24,用红色箭头标记)多重免疫荧光染色(mIF)的代表性图像。标尺,20 μm。(K)邻近正常组织、IBC肿瘤(左图)和非IBC组织(右图)PTN免疫组化(IHC)染色的代表性图像。标尺,20 μm.PTN+ 11 LP细胞通过PTN- nrp1轴与ECs相互作用。(E)代表性的mIF染色图像显示邻近的正常IBC组织。白色箭头表示PTN+ LP细胞(krt1 /18+ ITGA6+ PTN+,用红色箭头标记)分泌的PTN与尖端细胞(CD31+ CXCR4+ NRP1+,用黄色箭头标记)的NRP1相互作用。标尺,20 μm。(F) IBC患者受累皮肤的代表性mIF染色图像。白色箭头表示PTN+ LP细胞分泌的PTN与尖端细胞上的NRP1 (CD31+CXCR4+NRP1+,黄色箭头表示)相互作用。标尺,20 μm。(G) ibc_nearby组和非ibc_nearby组、IBC_Skin组和非IBC_Skin组中尖端细胞(CD31+ CXCR4+)的百分比和密度。Wilcoxon秩和检验。**p(H) PTN+ LP细胞与NRP1+尖端细胞之间的距离(距离PVL细胞亚型及其功能特征。(G)用于验证28例IBC患者皮肤中ECs (CD31+ 25)、未成熟PVL细胞(MCAM+ CD36+ 26,用白色箭头标记)和分化PVL细胞(α-SMA+ NG2+ MCAM+ 27,用红色箭头标记)位置的代表性mIF图像。标尺,20 μm。(H)用于验证2例IBC_Tumors中ECs (CD31+ 29)和PVL分化细胞(α-SMA+ NG2+ MCAM+ 1,用红色箭头标记)位置的代表性mIF图像。标尺,20 μm(G)多重免疫荧光染色(mIF)的代表性图像(左图) 中的 PTN+ LP 细胞(EPCAM+ KRT8/18+ ITGA6+ PTN+,红色箭头标记)。IBC 邻近正常组织(IBC_Adjacent)中的 PTN+ LP 细胞(EPCAM+ KRT8/18+ ITGA6+ PTN+,红色箭头标记)。尺度条,20μm。上皮细胞中 上皮细胞(EPCAM+)中 PTN+ LP 细胞的百分比(右图)。正常组织(右图)。点数表示患者人数。Wilcoxon 秩和检验。****p (H)具有代表性的 mIF 染色图像,用于验证 IBC 受损皮肤中 EC(CD31+)和未成熟 PVL 细胞(MCAM+CD36+,白色箭头标记)之间的位置。比例尺,20μm。 (I) 用于验证非 IBC 皮肤中 EC(CD31+)和 PVL 细胞(α-SMA+ NG2+ CD146+,红色箭头标记)之间位置的代表性 mIF 染色图像。
应用实例
2024.06.11
Tissue Cytometry单细胞空间多组学技术探索乳腺癌新辅助化疗的微环境表型差异
激素受体阳性乳腺癌(HR+ BC)被认为对化疗相对不敏感,由于化疗一直是HR+ BC的主要新辅助治疗方法,化疗耐药的未知机制以及化疗如何重塑免疫微环境需要通过高通量技术来探索。2024年1月,浙江大学医学院附属第二医院倪超教授团队在Cancer Letters 发表文章“Neoadjuvant chemotherapy-induced remodeling of human hormonal receptor-positive breast cancer revealed by single-cell RNA sequencing”。通过使用单细胞RNA测序和多重免疫荧光染色分析HR+ BC样本(新辅助化疗前后配对),发现先前未被认识的免疫细胞亚群水平增加,包括表达T细胞发育(LMNA)和细胞毒性(FGFBP2)标记的CD8+ T细胞,以及表达增殖标记(ATP1B3)的CD4+ T细胞和表达CD52的巨噬细胞,这些都在新辅助化疗后增加,预示着化疗敏感性,并且它们的抗肿瘤功能也通过体外实验得到了验证。在CD8+ T细胞的免疫检查点表达方面,本文发现它们在新辅助化疗后的变化不一致,LAG3和VSIR减少,而PDCD1、HAVCR2、CTLA4、KLRC1和BTLA增加。此外,对化疗耐药癌细胞的新型基因组和转录模式的鉴定以及通过TCGA队列验证其预后价值,突显了预测化疗敏感性和克服化疗耐药性的潜在生物标志物。这类研究至关重要,因为它不仅有助于理解癌症对化疗的复杂动态,还为个体化治疗开辟了新途径,可以根据个体独特的肿瘤特征和免疫反应来制定治疗方案。实验部分本文使用TissueGnostics公司TissueFAXS全景多光谱组织扫描定量分析系统对NAC前后样本进行多色荧光图像采集。通过多重免疫荧光技术,结合Tissue Cytometry技术获得了精准的单细胞定量结果以及丰富的组织结构空间定量信息和表达水平。实验中对特定表型的单细胞进行识别和定量分析,并参考建立了相对于阳性信号对照的空间梯度。在空间表型分析数据的获取策略上,CK+细胞被确定为空间梯度的核心,然后建立5个微环境空间梯度(0-25, 25-50, 50-100, 100-150, 150-200um),并对空间梯度内的多种免疫细胞亚型数量进行统计分析。另外,实验通过使用多重免疫荧光染色和Tissue Cytometry技术评估了癌细胞和免疫细胞之间的空间相关性。NAC后,我们观察到癌细胞周围0-25um范围内CD4-Tcm-ATP1B3的比例显著减少,这突出了其间接的免疫调节功能,而不是与癌细胞的直接接触。随着组织原位数据变得越来越重要,空间组学技术能够在单个切片上标记大量的核酸分子和蛋白,并提供这些标记物在组织切片中的精确位置信息。这不仅克服了传统单细胞技术的限制,而且显著增强了所获得的单细胞数据的空间解析度。Tissue Cytometry技术采用流式散点图,又称组织流式的数据解析策略,通过层层设门圈选+数据实时正反向回溯验证,最终确定筛选阈值和目标亚群的特征一一对应。这种方案具有更强的逻辑性和可操作性,实现了组织/细胞数据、图像以及显微镜下的实时可视化验证。本文作者联合单细胞测序技术和大量生信分析算法模型,以单细胞分辨率揭示了化疗对肿瘤生态系统的影响,从而揭示了HR + BC中NAC敏感性和耐药性的决定因素;并联合应用了Tissue Cytometry空间多蛋白标记解析技术,不但获得了转录组表达差异的蛋白水平验证结果,更在组织细胞分布的空间关系方面校验了生信聚类分析的预测模型。Figure 1 化疗后的CD4+阳性细胞。(E)敏感组HR+BC患者的MIF染色图像(K)加或不加CD4+T细胞亚群培养4天后B细胞表面CD38的表达比例Figure 1 S:(F) 多重免疫荧光(mIF)空间分析的示意图。绿色区域代表距离癌细胞0-25um。所有被绿色区域包围的细胞都是癌细胞。 (G) 每组中距离癌细胞200um内CD4-Tcm-ATP1B3的比例(左图)。距离癌细胞200um内CD4-Tcm-ATP1B3的分布(右图)。Figure 2 化疗后的巨噬细胞。
应用实例
2024.06.06
组织空间原位助力首都医科大学肇玉明教授团队发现DDAH1在神经再生生态位的作用
急性缺血性脑卒中(AIS)是导致人类死亡和伤残的重要因素,解析其内源性的修复机制是近年AIS治疗的热点课题之一。先期研究表明,二甲基精氨酸二甲胺水解酶1(DDAH1)在多种疾病中,如心血管事件、非脂肪性肝病变中可作为应激性因子产生保护作用。但其对AIS作用的报道较少。仅在动物实验模型上验证了DDAH1通过调节不对称性二甲基精氨酸(ADMA)含量减轻大鼠卒中后急性损伤;以及在细胞层面上检验出不依赖ADMA的方式调控神经生长因子(NGF)诱导的大鼠肾上腺嗜铬瘤PC12细胞的分化作用。而对卒中后患者血液内DDAH1的临床检验结果以及DDAH1对卒中的脑损伤修复作用均未见报道。首都医科大学基础医学院肇玉明副教授、宣武医院脑血管病研究所罗玉敏教授和中国科学院大学生命科学院陆忠兵教授合作在“Acta Pharmaceutica Sinica B”发表题为“DDAH1 promotes neurogenesis and neural repair in cerebral ischemia”的文章。作者对脑卒中患者血液内DDAH1变化与患者脑损伤程度相关性及其可能参与的卒中脑损伤的内在保护作用进行了分子机制探讨。临床研究发现,作为应激性保护因子,DDAH1在缺血性脑卒中患者血清中表达量与损伤程度呈现正相关;动物研究进一步表明: 缺血性脑卒中发生后DDAH1可能通过低氧诱导因子-1α/乙酰胆碱转移酶(HIF-1α/ChAT)信号通路对受损的胆碱能神经进行再生性修复。显然,这一新发现有望为缺血性卒中治疗提供新分子靶点及新思路。实验部分本文使用TissueGnostics公司TissueFAXS Plus全景组织扫描定量分析系统对小鼠脑组织进行多色免疫荧光图像采集。借助Tissue Cytometry技术,对小鼠脑组织不同分区的目标阳性细胞的表达进行了精准定量分析。本文中,作者建立了一种关于DDAH1的潜在治疗及评估手段,发现DDAH1调节脑卒中损伤后,海马中负责ACh合成的基因(Chat、Slc5a7、Slc18a3)和ACh浓度。本文作者在关键环节,数据校验均采用多色免疫荧光(mIHC)技术,这种方案通过三级信号放大的原理,不但可以提升数据检测的灵敏度,还在满足数据校验通量的前提下,极大提高了数据的可靠度与可信度。 作者表示,文章最核心的意义在于,发现ACh介导下,DDAH1在成人神经再生的生态位中起重要作用,实现了原位空间特征信息的锚定。这种作用可能直接诱导NSCs增殖,间接促进NSCs分化为胆碱能神经元,进一步刺激周围NSCs的增殖。 增强的神经源性活性有助于突触形成和功能恢复,以对抗中风损害,成为未来缓解及治疗中风的潜在分子靶点。Figure 3. DDAH1促进缺血损伤下神经干细胞(NSCs)的增殖。(B)同侧SVZ和SGZ中DDAH1和Nestin免疫荧光染色的代表性图像。(C)同侧SVZ和SGZ中BrdU和DCX免疫荧光染色的代表性图像。(D, E)同侧SVZ和SGZ的BrdU和DCX细胞统计分析(每组n=4)。Figure 4. DDAH1促进缺血损伤下神经干细胞(NSCs)的神经分化。(B)同侧SVZ、纹状体和DG中BrdU和NeuN免疫荧光染色的代表性图像。(C, D)同侧纹状体(C)和DG (D) BrdU和NeuN细胞的统计分析。(E)同侧SVZ、纹状体和DG中BrdU和GFAP免疫荧光染色的代表性图像。(F, G)同侧纹状体和DG BrdU和GFAP细胞的统计分析。(H, I)纹状体和DG中BrdU、NeuN和GFAP的表达情况。Figure 6. DDAH1增强脑卒中后神经发生有助于I1h/ R28d后认知功能恢复,但对运动功能恢复没有作用。(J)同侧SVZ、纹状体和DG BrdU和Neu免疫荧光染色的代表性图像。Figure 7.神经干细胞(NSCs)中DDAH1的条件敲除可消除脑卒中后神经发生活动并加重认知功能障碍。(F)同侧SVZ、纹状体和DG中BrdU和NeuN/GFAP免疫荧光染色的代表性图像Figrure 9. DDAH1在损伤后23小时调节SVZ和SGZ 神经干细胞(NSCs)中ChAT的表达。(A) SVZ和SGZ中ChAT和SOX2免疫荧光染色的代表性图像。(B) (B, C) SVZ和SGZ中ChAT、SOX2细胞的统计分析(每组n=3)。
应用实例
2024.05.30
Tissue Cytometry技术助力天津医科大学于津浦/李祥春团队探索HCC内部巨
肝细胞癌(HCC)是一种侵袭性很强的肿瘤,术后复发率高。免疫检查点抑制剂(ICIs)由于其丰富的淋巴细胞浸润能力而成为治疗肝细胞癌(HCC)的一种很有潜力的治疗方法。然而,由于肿瘤微环境中存在多种免疫抑制因子,一些HCC患者对ICI治疗反应不佳。因此,迫切需要揭示HCC免疫治疗耐药的分子机制,并开发新的策略来提高ICI治疗的疗效。2024年4月12日,天津医科大学于津浦/李祥春共同通讯在《Cell Reports Medicine》发表题为“Macrophage-coated tumor cluster aggravates hepatoma invasion and immunotherapy resistance via generating local immune deprivation”的研究论文。该研究证明,巨噬细胞包被肿瘤簇(MCTC)通过产生局部免疫剥夺加重肝癌侵袭和免疫治疗抵抗。通过572例HCC样本,研究人员发现了HCC中的一种独特空间结构组织——MCTC,这种组织与患者的无复发生存率和总生存率的降低相关。从机理上讲,肿瘤源性巨噬细胞相关凝集素Mac-2结合蛋白(M2BP)会诱导MCTC形成,并并在MCTC的边缘捕获免疫活性细胞,从而诱导瘤内细胞毒性T细胞排斥和局部免疫剥夺。用Mac-2拮抗剂阻断M2BP可能是防止MCTC形成、增强T细胞浸润从而提高ICI治疗HCC疗效的有效方法。实验部分本文使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统对HCC样本进行多色荧光图像采集。通过多重免疫荧光技术,结合Tissue Cytometry技术获得了精准的单细胞定量结果以及丰富的组织结构空间定量数据。Panel 1: CD8,CD68,HepPar-1Panel 2: CD8,CD163,CD68,HepPar-1Panel 3: Foxp3,CD163,CD68,HepPar-1Panel 4:CD68,HepPar-1,Trem2Panel 5:CD8,F4/80,Pan-CK作者通过多种细胞的组织原位信息,构建了HCC分类评估系统,发现了MCTC与侵袭性病理特征的关系。为了探索HCC肿瘤微环境中,与肿瘤作用最强的细胞作用关系情况,文章作者利用StrataQuest软件,对肿瘤簇进行空间定量分析,以10μm为范围,定义了肿瘤最强浸润区间,并研究巨噬细胞与肿瘤细胞直接相互作用,进一步证实了MCTC的预后价值。Figure 1.HCC组织中发现的MCTC是一个有价值的复发预测因子(A)HCC组织中四种不同的TAMs空间模式的代表性图像(左)与RFS和OS Kaplan-Meier曲线(右)(高倍比例尺:50 μm;低放大比例尺:100μm)。(B) TJMUCH队列I中距离肿瘤群0 - 10 μm范围内的TAMs的代表性图像(左)与RFS和OS Kaplan-Meier曲线(右)(比例尺:50 μm)。用于识别肿瘤簇和用于定量分析与代表性图像相同区域的tam的方法详见图S1A。(D) TJMUCH III队列中MCTC+与MCTC HCC患者的代表性图像(左)与OS KaplanMeier曲线(右)(比例线:100 μm)。Figure 2.MCTC预测HCC患者对ICI治疗的不良反应中MCTC对照组之间免疫调节基因特征的比较。(C) 免疫荧光成像显示CD8+ T细胞在MCTC+和MCTC- HCC组织中的分布(比例尺:50 μm)。作者通过多重免疫荧光染色,使用Strata Quest定量分析软件,证明了在MCTC+ HCC中,细胞毒性T细胞被TAMs战略性地转移到肿瘤周围,有效地阻碍了它们的直接抗肿瘤活性的假设。发现在MCTC+组织中,CD8+ T细胞和Foxp3+ T细胞与MCTC- 组织中的CD68+巨噬细胞和CD68+ CD163+ M2极化巨噬细胞相比,明显更接近CD68+巨噬细胞和CD163+ M2极化巨噬细胞。Figure 3.MCTC+ HCC的特征是免疫热肿瘤被癌细胞外的大量活性免疫活性细胞浸润(E) TJMUCH队列IV中MCTC+和MCTC- HCC组织中HepPar-1、CD68、CD163和CD8的代表性免疫荧光图像(比例尺:50 μm)。(F) TJMUCH队列IV中MCTC+和MCTC- HCC组织中HepPar-1、CD68、CD163和Foxp3的代表性免疫荧光图像(比例尺:20 μm)。(G) TJMUCH队列IV中MCTC+和MCTC- HCC组织中CD8+ T细胞和CD68+巨噬细胞(左)以及CD68+ CD163+ M2极化巨噬细胞(右)的平均距离分析。Figure 4.MCTC+ HCC中的巨噬细胞表现出明显的免疫抑制和促肿瘤表型(H) 免疫荧光图像显示Trem2蛋白在MCTC+和MCTC- HCC组织中的表达分布(左,比例尺:20 μm),并分析了TJMUCH队列IV中MCTC+和MCTC- HCC组织中Trem2+巨噬细胞的数量和比例(右)。Figure 5.肿瘤来源的M2BP增强了趋化性和细胞间粘附,诱导MCTC形成(C) TJMUCH队列III HCC组织中M2BP表达的代表性免疫组织化学(IHC)图像和MCTC状态的相应免疫荧光图像(左)以及M2BP表达与MCTC的相关性分析(右)(高倍刻度条:50 μm;小放大比例尺:100μm)Figure 6.肿瘤来源的M2BP增强了趋化性和细胞间粘附,诱导体内MCTC的形成(A) mIF成像描绘了CD8+ T细胞的MCTC结构和分布(左),以及MCTC计数的统计分析(右),在皮下植入Hepa1-6NC和Hepa1-6M2BPhi肿瘤的C57小鼠中,无论是否接受GB1107治疗(尺度条:50 μm)。每组N = 5只。通过对肿瘤组织的多重免疫荧光染色扫描成像发现,CD8+ T细胞主要定位于MCTC的周围,而不在对照小鼠的肿瘤核心,抗PD -1抗体与GB1107联合治疗不仅明显阻碍了MCTC的形成,而且恢复了肿瘤内T细胞的浸润,克服了局部免疫剥夺。Figure 7.抗PD -1抗体和GB1107联合治疗可通过恢复T细胞瘤内浸润(A),在体内显著抑制MCTC+ HCC的生长和转移。在皮下肿瘤植入后的第7、14和21天处死C57小鼠,以评估MCTC形成的时间。提出了两种抗PD -1治疗模型:MCTC形成后和MCTC形成前。在MCTC后形成模型中,肿瘤植入后第14天开始抗PD -1治疗。对于MCTC前形成模型,在植入后第7天开始抗PPD -1治疗,无论是单独治疗还是与GB1107联合治疗。(B)两种模型皮下肿瘤的肿瘤体积和肿瘤生长曲线的综合概述。每组N = 5只。(C)两种模型小鼠肺转移结节的代表性H&E染色图像(左,比例尺:100 μm)以及转移结节的定量(右)。每组N = 5只。(D)两种模型小鼠的MCTC结构和CD8+ T细胞分布的mIF成像(左,比例尺:50 μm)以及肿瘤巢内CD8+ T细胞的定量(右)。每组N = 5只。Figure 8.肝细胞癌组织中tam的空间异质性(A) TAM空间格局分类示意图。(B) MCTC结构在整个组织全景图像中的分布。
应用实例
2024.05.20
Cancer Cell|陆军军医大学卞修武院士团队利用Tissue Cytometry揭示胶质瘤血管
扩散性胶质瘤,包括异柠檬酸脱氢酶(IDH)-野生型(wt)胶质母细胞瘤(GBM)和IDH突变型星形细胞瘤和少突胶质细胞瘤,是成人中最常见的恶性脑肿瘤。肿瘤相关巨噬细胞(TAMs)是扩散性胶质瘤中占主导地位的免疫浸润细胞。TAMs直接与恶性细胞互动,促进肿瘤进展,并作为免疫抑制微环境的建筑师。因此,TAMs已成为一个有吸引力的治疗靶点。作为实体瘤的标志,缺氧与肿瘤坏死、新生血管形成以及各种炎症和趋化因子的产生有关。缺氧肿瘤线索在空间上受到限制,并可能引导肿瘤和生态位细胞的基因组不稳定性、转录适应和代谢重编程。此外,缺氧生态位中增强的 TAM 募集和免疫抑制肿瘤-髓样细胞相互作用增强了神经胶质瘤对化疗和免疫治疗的耐药性。这促使研究者确定缺氧生态位线索如何扭曲缺氧-TAM特征,以及缺氧TAM如何与其他细胞相互作用以促进肿瘤进展。2024年4月18日,陆军军医大学第一附属医院(重庆西南医院)全军临床病理学研究所卞修武院士、时雨副教授、平轶芳教授团队联合陆军军医大学第一附属医院脑胶质瘤医学研究中心、神经外科李飞副教授、华中科技大学武汉光电国家研究中心张智红教授团队的祁淑红副研究员在Cancer Cell(IF=50.3) 发表文章“Identification of hypoxic macrophages in glioblastoma with therapeutic potential for vasculature normalization”。揭示了胶质母细胞瘤中缺氧巨噬细胞的存在和它们在肿瘤血管正常化治疗中的潜在作用。在扩散性胶质母细胞瘤中,单核细胞来源的肿瘤相关巨噬细胞(Mo-TAMs)以显著的异质性密集浸润。通过单细胞转录组学,作者绘制了51名携带异柠檬酸脱氢酶(IDH)野生型胶质母细胞瘤或IDH突变型胶质瘤的患者的Mo-TAMs的空间分辨率转录景观。通过生物体内原位效能验证技术表征了一个定位于坏死周边区域的Mo-TAM亚群,受缺氧生态位线索的影响,获得了缺氧反应特征。缺氧-TAM通过激活肾上腺髓质素旁分泌信号,破坏内皮细胞黏附连接,从而刺激了一个高通透性的新生血管,阻碍了胶质母细胞瘤异种移植物中药物的传递。因此,通过遗传消除或药物阻断缺氧-TAM产生的肾上腺髓质素,可以恢复血管完整性,提高抗肿瘤药物达布拉非尼的肿瘤内浓度,并实现联合治疗效果。缺氧-TAM的比例增加或肾上腺髓质素表达预示着肿瘤血管高通透性和胶质母细胞瘤的不良预后。文章发现突显了Mo-TAM的多样性和空间生态位引导的Mo-TAM重编程,暗示了针对缺氧-TAM以正常化肿瘤血管的潜在治疗方法。实验部分原位转录组技术不但可以通过测序技术对差异化表达的基因进行深度鉴定,还提供了组织原位的空间定位数据,从距离特征上对关键基因的作用关系进行了探索。但与此同时,现有的原位转录测序技术精度尚达不到亚细胞分辨率,同时在细胞功能承载的蛋白层面,仍然缺乏可靠的数据一致性比对方案。本文作者大量应用了Tissue Cytometry技术,利用抗体对样本中超多靶标蛋白进行荧光标记后,从血管形态,肿瘤及其坏死区域识别,缺氧空间微环境范围构建并探索微环境中细胞和血管的作用关系。这种原位数据校验的思路,不但填补了原位转录组技术的空白,同时进一步提升了数据的可靠性,对文章观点进行了强有力的支撑。Figure 1 在hGBM组织上揭示空间梯度下的相关细胞特征(E) hGBM 坏死周围区域 ADM、半乳糖凝集素-3 和 CD31 的 H&E 染色和免疫染色。虚线表示距坏死核心的距离(600 微米/线)。用正方形表示的区域被放大,并以每种颜色或底部不同颜色的组合显示。比例尺,200 微米。文章作者对hGBM组织进行H&E染色和免疫染色,借助Tissue Cytometry技术,利用StrataQuest软件对缺氧-TAM的空间特征进行定量分析,发现在hGBM的坏死区域周围,存在丰富的缺氧-TAM伴随着丰富的微血管,确定了缺氧-TAM在缺氧生态位中的功能意义。对ADM和Galectin-3(Mo-TAM标记物)的共表达进行空间定量分析,确认了缺氧-TAM靠近hGBM组织中的伪栅栏状坏死区域。这些数据证实了缺氧-TAM在hGBM组织的缺氧生态位中的富集。Figure 2 ADM敲除可以恢复mGBM异种移植物的血管完整性(D 和 E)右旋糖酐标记的肿瘤脉管系统 (D) 的活体成像和 WT 和 Adm cKO 异种移植物中血管结构的定量 (E)(n = 15 张图像/组)。比例尺,100 微米。(G) 异种移植物中 VE-钙粘蛋白、claudin-5、层粘连蛋白、PDGFRb、尸体碱和 CD31 的免疫染色(n = 15 图像/组)。比例尺,25 微米。借助TissueFAXS Spectra全景多光谱组织扫描定量分析系统,作者利用多重免疫荧光技术对Adm cKO异种移植物组织样本进行VE-cadherin, claudin-5, laminin, PDGFRb, cadaverine和 CD31的多重免疫染色,并获取多色荧光图像。使用StrataQuest软件,对多色荧光图像首先去除非特异背景,优化血管和其它标志物染色,进而利用AI classifier对血管进行特异性识别,同时定量分析各种标志物的蛋白表达。结果显示,在ADM cKO异种移植物中,内皮粘附连接标志物血管内皮(VE)-钙粘蛋白的表达基本恢复,而紧密连接标记物claudin-5、周细胞标记物血小板衍生生长因子受体和血管基底膜标记物层粘连蛋白的表达不受ADM敲除的影响。使用cadaverine评估肿瘤血管通透性显示,与野生型异种移植物相比,ADM cKO异种移植物的cadaverine渗出面积显著减少。这些数据表明,敲除ADM选择性地恢复了肿瘤血管的完整性,并减少了mGBM异种移植物中的血管渗漏。Figure 3 ADM通过激活CRLR信号通路破坏内皮细胞粘附连接(B) 用 rhADM 或载体处理的 HBMEC 中 VE-钙粘蛋白的免疫染色。比例尺,10 微米。(C 和 D)用缺氧-TAM-CM 和/或 AMA 处理的 HBMEC 中 VE-钙粘蛋白和荧光素-链霉亲和素 (Strep) (C) 的免疫染色以及 VE-钙粘蛋白区和链球菌区 (D) 的定量(n = 5 个样本/组)。比例尺,20 微米。作者利用多重免疫荧光技术对hGBM组织进行ADM,CRLR和CD31的多重免疫染色并获取图像,使用Tissue Cytometry技术定量分析免疫染色的共定位表达,结果证实CRLR和内皮细胞标记物CD31的共定位在hGBM坏死区域周围伴随ADM信号上调。ADM通过激活内皮细胞中的CRLR信号破坏其粘附连接。Figure 4 AMA治疗可使hGBM异种移植物中的肿瘤血管系统正常化(A) hGBM 组织中 ADM、VE-钙粘蛋白和 CD31 的免疫染色。hGBM(n = 41 例)根据 ADM 细胞的比例进行分层。比例尺,50 微米。(B) hGBM 组织中 VE-钙粘蛋白信号的定量(n = 41 例,5 张图像/例)。(D 和 E)VE-钙粘蛋白、尸体和层粘连蛋白 (D) 的免疫染色,以及 hGBM-3 异种移植物和小鼠正常大脑中尸体渗出区域和 VE-钙粘蛋白血管 (E) 的百分比(n = 15 张图像/组)。比例尺,10 微米。(F 和 G)Pimo 的免疫染色 (F) 和异种移植物中 Pimo 肿瘤面积 (G) 的百分比(n = 15 图像/组)。比例尺,50 微米。(H 和 I)异种移植物中 Dox (H) 和 Dox 肿瘤区域 (I) 的百分比的免疫染色(n = 15 张图像/组)。比例尺,50 微米。作者利用多重免疫荧光技术对hGBM组织进行ADM, VE-cadherin 和CD31 免疫染色,利用StrataQuest软件,对hGBM组织中 VE-cadherin信号定量分析,并根据ADM+细胞比例对hGBM组织进行分层。通过VE-cadherin, cadaverine 和 laminin的多重免疫染色,使用StrataQuest软件,分别定量出hGBM-3异种移植物和小鼠正常大脑中的cadaverine积液区面积和VE-cadherin+血管的百分比。验证了AMA在肿瘤移植物中恢复了VE-钙粘蛋白的表达,保留了内皮连接,减少了cadaverine积液,但对小鼠正常脑血管系统的影响可以忽略不计。通过Pimo和Dox的免疫染色,使用StrataQuest软件,定量异种移植物中Pimo+和Dox +肿瘤区域的百分比。结果显示AMA治疗减少了肿瘤缺氧并增强了药物传递,在接受AMA的异种移植物中,吡唑标记的缺氧区域显著减少,阿霉素灌注区域增加。Figure 5 AMA治疗提高了dabrafenib的给药效果和治疗效果(A 和 B)BRAF 突变体 hGBM 中 VE-钙粘蛋白、CD31 和 ADM (B) 的 H&E 染色 (A) 和免疫染色。坏死区域和坏死周围区域的血管分别用虚线和箭头突出显示。比例尺,100 微米 (A) 或 25 微米 (B)。通过对BRAFV600e突变体hGBMs组织进行 VE-cadherin 、CD31和ADM 的多重免疫染色和多重荧光图像获取,观察到该组织表现出明显的坏死,缺乏VE-钙粘蛋白,并且有丰富的血管和大量产生ADM的TAMs。
应用实例
2024.05.06
免费试用 | 高能TSA多重免疫组化检测试剂盒限时免费体验
企业动态
2024.04.15
nature communications | 中山大学附属第三医院与东方肝胆医院联合研究发现肝癌治
肝细胞癌(简称“肝癌”)是世界上最常见的恶性肿瘤之一,在我国尤为高发,每年新发病和死亡均占全球近一半。手术切除是目前肝癌治疗的首选方式,但70-80%的肝癌病人确诊时已发生肿瘤播散转失去了手术机会;即使手术切除,肝癌术后5年转移复发率高达60-70%。阿替利珠单抗(anti-PD-L1)联合贝伐珠单抗(anti-VEGFA)(“T+A”方案)在不可切除肝癌的治疗中显示出良好的疗效,但受益于该方案的患者数量仍然有限。因此,研究人员寻求新的治疗策略,以提高肝癌患者的生存率和生活质量。nature communications中山大学附属第三医院肝脏外科暨肝脏移植中心杨扬教授团队与东方肝胆外科医院程树群教授在Nature Communications发表“Low-dose Radiotherapy Combined with Dual PD-L1 and VEGFA Blockade Elicits Antitumor Response in Hepatocellular Carcinoma Mediated by Activated Intratumoral CD8+ exhausted-like T cells”文章。文章研究了低剂量放疗(LDRT)与PD-L1和VEGFA双重阻断(DPVB)联合治疗在肝细胞中的抗肿瘤反应。研究发现,LDRT能够使肿瘤对DPVB介导的CD8+ T细胞激活更加敏感,并提高了肝癌患者的抗肿瘤反应。本研究在多种临床前肝癌模型中发现低剂量放疗(Low-dose Radiotherapy, LDRT)可以明显增强双重程序性细胞死亡配体-1 (Programmed cell death 1 ligand 1,PD-L1) 和血管内皮生长因子A (Vascular endothelial growth factor A, VEGFA) 阻断 (Dual PD-L1 and VEGFA Blockade, DPVB) 的抗肿瘤作用。该联合治疗显示出显著的CD8+ T细胞介导的抗肿瘤治疗疗效。高通量单细胞RNA测序和多种实验结果显示,LDRT联合DPVB增强了肿瘤排斥的耗竭样CD8+ Tex的效应功能和细胞毒性。此外,利用多个肝癌临床前模型和体外肿瘤片段平台(Patient-derived tumor fragments, PDTFs) 进行疗效机制深入研究,结果表明LDRT通过CXCL10/CXCR3轴促进干细胞样祖耗竭性CD8+ Tpex从引流淋巴结向瘤内募集进而增敏DPVB的机制。该研究对于提高不可切除肝细胞癌的联合治疗疗效提供了可靠的临床前证据。实验部分本文使用TissueGnostics公司TissueFAXS Spectra SL高通量全景多光谱组织扫描定量分析系统获取多色免疫组化肝癌样本图像。Panel:TCF1,PD-1,CD8,DAPITissue Cytometry技术作为一种基于全景组织细胞定量分析系统的图像处理的病理定量分析技术,其应用广泛,以本文为例,还可以实现以下精准定量分析数据结果的呈现。01细胞形态、组织形态与蛋白空间表达水平,对病变程度及影响精准分析Tissue Cytometry技术可以实现单细胞精准形态学识别以及组织的形态学识别,通过细胞形态、蛋白表型分布以及组织形态,可以轻松实现在同一张病理切片中,细划出具有不同研究意义的研究位置,例如肿瘤内部/微环境/肿瘤间质/浸润区等,进而研究不同氧环境下细胞的功能与形态学变化的关系,以及最可能的关键位置作用点上的细胞表型分布情况。02使用mIHC免疫多标记技术带来更深入的信号通路作用分析Tissue Cytometry所使用的mIHC多色标记技术,可以实现在一张组织样本中,进行10种荧光标记物的染色及成像。通过这种方法,不但可以研究在目标信号通路中,关键节点蛋白/细胞的变化情况,还可以研究与其他空间临近细胞的互相作用关系。这种单细胞多标记互相作用的定量分析技术,也已经成为了当前肿瘤研究的热门工具之一。Figure 1 T+A治疗后肝细胞癌患者干细胞样CD8+TPex表达与Treg/Tef比值与T+A治疗后肝细胞癌及全部肝细胞癌患者预后的关系(a)T+A反应和无反应肝细胞癌中CD8+TPex的MIHC图像。(e)肝细胞癌Treg/Tef图像。借助于TissueFAXS Cytometry技术,结合多色免疫荧光染色,不但可以对肿瘤组织进行精准识别 ,还可以实现肿瘤微环境中免疫细胞在组织中的空间分布、形态特征、与其他细胞类型的相互作用等方面进行高通量、高精度的原位定量分析。
应用实例
2024.04.02
Cancer Research | 中山大学彭穗/邝栋明教授团队发现骨髓细胞和B细胞之间的相互作用是
肿瘤微环境(TME)在肿瘤的所有阶段中都起着关键作用,从早期发起到转移性疾病。由于对TME的广泛研究,越来越多的免疫疗法,特别是免疫检查点阻断(ICB),已经显著改变了抗癌治疗的格局。然而,由于肝脏是一个高度免疫耐受的器官,肝癌的免疫治疗受到阻碍。2023年6月26日,中山大学附属第一医院彭穗/邝栋明教授团队在Cancer Research上在线发表题为“Crosstalk between myeloid and B cells shapes the distinct microenvironments of primary and secondary liver cancer ”的研究论文。该研究首次从单细胞角度对原发性和继发性肝癌中的免疫微环境进行了深入探讨,揭示了不同类型的浆细胞与髓系细胞相互作用介导免疫抑制微环境的相关机制。证明了B细胞是肝细胞癌( HCC )和结直肠癌肝转移( CRLM )微环境中的重要调节因子。这篇文章详细探讨了骨髓细胞和B细胞之间的相互作用如何塑造原发性和继发性肝癌的不同微环境。研究发现,在肝细胞癌(HCC)和结直肠癌肝转移(CRLM)中,B细胞表现出不同的发育轨迹。单细胞分析揭示,IgG+浆细胞在HCC中优先积累,而IgA+浆细胞则在CRLM中更为丰富。实验部分本文使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统g肝脏组织样本进行多色荧光图像采集。并且使用多重免疫荧光技术,通过AI Classifier技术获得大量组织形态学信息,还结合了Tissue Cytometry技术中精准的单细胞识别技术。通过多种细胞的组织原位信息,证实了cxcr3 + B细胞和TAMs通过CXCR3-CXCL10轴的相互作用,并通过进一步实验,发现在体内阻断CXCR3可以显著地减弱B细胞向肿瘤的迁移,证明了TAMs在HCC中募集CXCR3 + IgG浆细胞的重要作用。Figure 1 TAMs 通过 CXCR3-CXCL10 轴招募肝细胞癌中的 IgG 浆细胞D mIHC染色验证CXCR3þ B细胞和巨噬细胞在HCC中的相互作用。E mIHC 染色三级淋巴结构以确定 HCC 中 CXCR3þ B 细胞的位置I,J 对照组和抗 CXCR3 小鼠肝脏病变中 CD19 IHC 染色的图像和定量分析(使用StrataQuest软件对抗CXCR3小鼠肝脏病变中 CD19进行定量分析)Figure 2 CRLM 中的 IgA 浆细胞通过 CCR10-CCL28 轴被肿瘤细胞招募F mIHC 染色验证 CRLM 中 CCL28 和 CCR10 的相互作用H,I 对照组和抗CCL28小鼠肝脏病变中IgA的IHC染色图像和定量分析(使用StrataQuest软件对抗CCL28小鼠肝脏病变中IgA进行定量分析)这项研究的重要性在于,它揭示了肿瘤浸润B细胞的免疫调节模式在原发性和继发性肝癌中是不同的,浆细胞介导的重要生理过程推动了癌症的进展。这为理解肝癌的免疫微环境提供了新的见解,并可能对肝癌的免疫治疗策略产生影响。借助于TissueFAXS Cytometry技术,结合多色免疫荧光染色,不但可以对肿瘤组织进行精准识别 ,还可以实现肿瘤微环境中免疫细胞在组织中的空间分布、形态特征、与其他细胞类型的相互作用等方面进行高通量、高精度的原位定量分析。
应用实例
2024.03.29
中国科学技术大学高平、张华凤团队发现肌肽对细胞的调节促进溶酶体依赖的肿瘤免疫逃避
肝癌是全球最常见的恶性肿瘤中癌症相关死亡的第二大原因,其由具有不同组织特征和不良预后的异质性恶性肿瘤组组成。肝细胞癌(HCC)是最主要的肝细胞肿瘤。据估计,原发性肝癌的发病率每年在60万至80万之间,占所有人类癌症的5.6%,其中HCC约占所有原发性肝癌的80%-90%。HCC的发病率很高,并且在全球范围内趋于增加。原发性肝癌的发生,发展和转移的基本机制仍然很大程度上未知。肝脏内肿瘤细胞和周围的免疫细胞进行代谢重编程,导致酸性肿瘤微环境。然而,目前尚不清楚肿瘤细胞在肿瘤进展过程中如何适应这种酸性应激。2024年1月4日,中国科学技术大学高平及张华凤共同通讯在Nature Immunology 在线发表题为“Carnosine regulation of intracellular pH homeostasis promotes lysosome-dependent tumor immunoevasion”的研究论文。该研究发现肌肽,一种在肿瘤细胞缺氧下积累的移动缓冲代谢物,调节细胞内pH稳态并驱动溶酶体依赖的肿瘤免疫逃逸。一种以前未被识别的肌肽合成酶异构体,CARNS2,在缺氧条件下促进肌肽合成。肌肽作为一种可移动的质子载体,通过加速胞浆内H+的迁移和释放来维持细胞内pH (pHi)的稳态,从而控制溶酶体亚细胞分布、酸化和活性。此外,通过维持溶酶体活性,肌肽促进核转录因子X-box结合1 (NFX1)降解,触发半乳糖凝集素-9和T细胞介导的免疫逃逸和肿瘤发生。这些发现表明了癌细胞中pHi调节的一种非常规机制,并证明了溶酶体如何促进免疫逃避,从而为开发利用免疫检查点阻断破坏pHi稳态的肝癌联合治疗策略提供了基础。实验部分本文作者为了进一步探讨CARNS2在肿瘤免疫中的病理意义,检测了10对人肝细胞癌组织和癌旁非癌组织中CARNS2、NFX1和Galectin-9的表达水平。通过免疫组化技术,利用Tissue Cytometry 技术对CARNS2蛋白和NFX1蛋白进行荧光强度定量分析结果表明CARNS2蛋白在正常肝组织中普遍呈阴性表达,但随着肝癌进展到更高的临床分期,CARNS2蛋白的表达逐渐增加,而NFX1的表达则呈现相反的趋势。继而对相同组织做连续切片,利用TissueFAXS获取免疫组化化学图像,利用HistoQuest软件分析HIF-2α、CARNS2、NFX1和Galectin-9蛋白在肝细胞癌肿瘤区和癌旁区域的荧光强度对比,并证实了四种蛋白的相关性。以上部分是该研究的必要基础,为了客观明确的阐述实验的前提,文章作者采用了经典的科研思路,直观的通过Tissue Cytometry技术进行组织原位切片成像及量化分析,结合流式细胞术与测序技术等间接手段,获得了全面的数据结果。该研究证明肌肽可以作为缓冲剂来减缓短暂的pH湍流,并作为一个移动的质子载体来加速细胞内H+的迁移和释放,以维持pHi的稳态和溶酶体的功能。还发现,肌肽的合成是由一种以前未知的肌肽合成酶的异构体CARNS2催化的,CARNS2通过激活转录抑制因子NFX1的溶酶体降解来促进免疫检查点蛋白galectin-9的表达。体内同种移植物和原位肝细胞癌(HCC)实验表明,这条CARNS2/NFX1/galectin-9调节轴通过抑制CD8+T细胞的丰富度和功能促进免疫逃避,与肝癌进展高度相关。该研究强调了肿瘤细胞中肌肽代谢的重新连接是周围T细胞衰竭的关键调节因子,以及肿瘤中靶向pHi促进抗肿瘤免疫的潜在治疗价值。
应用实例
2024.03.13
中国科学院上海营养健康所尹慧勇教授团队发现ALDOB调控TGFB1基因表达,为肝癌免疫治疗提供新策略
肝细胞癌(HCC)是世界上发病率和死亡率最高的肿瘤之一,其发病率和死亡率分别位列第六位和第四位。转化生长因子-β(TGF-β)作为肿瘤免疫微环境中重要的免疫信号分子,可以和细胞表面的TGF-β受体相结合,激活信号通路,影响肿瘤微环境中肿瘤细胞和免疫细胞功能,在肿瘤的发生发展过程中扮演着重要的角色。在HCC的发生发展过程中,肿瘤微环境中肿瘤细胞与免疫细胞的互作影响肝癌免疫应答的分子机制仍不清楚。果糖-1,6-二磷酸醛缩酶B(ALDOB)作为糖酵解过程中的重要代谢酶,其表达随着肝癌的发生发展而逐渐降低,ALDOB表达下调可能引起肿瘤细胞代谢重构并促进肝癌。同时也有研究发现,GLUTI/ALDOB/G6PD轴也影响胰腺癌的化疗效果,然而,肝癌肿瘤细胞ALDOB的表达如何影响肿瘤免疫微环境及具体机制仍需进一步研究。中国科学院上海营养与健康研究所尹慧勇教授研究组在国际学术期刊Hepatology在线发表了题为“ALDOB/KAT2A Interactions Epigenetically Modulate TGF-β Expression And T Cell Functions in Hepatocellular Carcinogenesis”的合作研究成果,揭示了肝癌组织中肿瘤细胞果糖-1,6-二磷酸醛缩酶B(ALDOB)的缺失通过表观遗传调控促进TGF-β的转录表达,进而引起肝癌微环境中效应T细胞的耗竭,促进肝细胞癌的新机制。本研究从临床样本出发,对肝癌病人的肿瘤组织进行流式细胞分析和Western Blot检测,发现ALDOB的表达和CD8+ T细胞的浸润呈显著负相关,即肿瘤组织ALDOB的下调表达反而增加CD8+ T 细胞浸润;进一步对肝癌组织内CD8+ T细胞中的PD1、CTLA-4免疫抑制分子进行流式检测,发现这些CD8+ T细胞处于免疫耗竭的状态,提示肿瘤细胞ALDOB的表达影响肝癌免疫微环境。通过研究发现肝癌细胞内ALDOB可以入核与KAT2A相互结合,抑制TGFB1启动子区域H3K9的乙酰化,降低TGFB1转录表达,从而降低肿瘤组织内Treg细胞的数量和维持肝癌的免疫微环境中CD8+ T细胞的功能;相反,肿瘤细胞ALDOB的丢失不仅可以通过代谢重构上调糖酵解、PPP以及TCA,生成大量的乙酰辅酶A,促进肿瘤细胞糖脂代谢,还可以解除对KAT2A活性的抑制,增加H3K9的乙酰化并上调TGF- 表达,影响CD8+ T细胞和Treg细胞的数量和功能,促进肝癌。本研究发现了糖酵解内的重要代谢酶ALDOB通过进入细胞核表观调控TGFB1基因的表达,从而影响肝癌免疫微环境免疫应答的全新分子机制,为肝癌的免疫治疗提供潜在新策略。实验部分本文使用TissueGnostics公司TissueFAXS Plus全景组织扫描定量分析系统获取图像。Panel 1 : ALDOB,FOXP3,DAPIPanel 2 : CD3,CD4,DAPI本文大量使用了流式细胞技术对细胞表型及细胞表达水平进行了量化分析,但是在关键数据上,可以进一步使用Tissue Cytometry技术作为原位校验方法的验证标准。相比传统的研究思路,这样获得的数据不但更加全面,并且从单细胞蛋白表达层面对空间分布关系进行研究,是最能反映生物体真实情况的研究水平。ALDOB通过KAT2A调控TGF-β转录表达进而影响HCC免疫微环境的机制图TissueFAXS Plus全景组织扫描定量分析系统获取图像部分内容转载自:营养与健康所尹慧勇研究组合作发现肝癌肿瘤细胞代谢影响肿瘤免疫新机制----中国科学院上海营养与健康研究所 (sinh.ac.cn)
应用实例
2024.03.13
JEM(IF=15.3)|Tissue Cytometry技术助力雷根斯堡大学免疫学研究所类器官研究
CD8 T 淋巴细胞通常被视为细胞毒性 T 细胞。人类CD8 T细胞是否可以同时诱导组织再生程序尚不清楚。雷根斯堡大学免疫学研究所Markus Feuerer教授发表了题为“The effector of human CD8 T cells supports tissue remodeling”的文章,表明CD8 T细胞可以通过重新编程受损的周围细胞(如成纤维细胞、上皮细胞和组织干细胞)来诱导组织再生,可增强肿瘤球体和干细胞介导的类器官生长。类器官是一种干细胞或器官细胞培养而来的,能够模拟人体器官结构和功能的三维细胞聚集体。与传统的二维细胞培养相比,类器官能够反映人体器官的复杂性和异质性,提供了一种更具生理相关性的模型,使研究人员能够研究复杂的细胞相互作用和组织特异性功能,不但可以用于建立疾病模型、进行药物筛选和毒理测试、实现精准医疗和再生医学等研究,还对疾病的诊断和治疗提供新的转化方法。虽然类器官研究具有诸多益处,但是现在仍存在一些研究困难与挑战。在当前研究前沿,缺乏类器官生成、维护和表征的标准化协议,也缺乏对应的标准化数据评估手段,因此很难比较不同研究的结果;类器官可以表现出细胞异质性,结构中存在不同的细胞类型。这种异质性可能使研究特定的细胞群或准确解释实验结果变得困难。实验部分本文作者使用Tissue Cytometry技术,参考其在组织原位肿瘤复杂微环境中的定量分析方案,提出了较为领先的类器官”End Point“终点分析评估理念,不但测量类器官的大小,结构和整体形态,提供有关其生长和发育的定量数据,更进一步量化类器官大小、数量和细胞组成等参数,终点分析可提供有关组织再生潜力的客观数据。重要的是,这些定量分析数据的获取标准、算法标准和评价指标同样可以用于其他类器官研究领域的研究。图1, 人CD8 T效应细胞可以促进类器官的组织再生。(A) 将 20 个 ECO 类器官解离并单独培养或与来自不同供体 (D1-D3) 的 10,000 个 CD8 T 细胞共培养,并观察到类器官随时间生长。左图,代表图像。除了本文之外,文章作者还同时发表了题为"Analysis of organoid and immune cell co-cultures by machine learning-empowered image cytometry"的方法学文章,详细描述了包括Tissue Cytometyry技术定量分析策略方法,以及应用其发现的类器官形态学变化、类器官的发育和功能调节以及类器官和免疫细胞之间存在动态的相互作用和信号传导等内容。Tissue Gnostics公众号也有转载。欢迎大家参考阅读。
应用实例
2024.03.13
雷根斯堡大学免疫学研究所使用StrataQuest开发类器官研究新工具
类器官是一种能够模拟特定组织结构和功能的三维细胞培养系统,具有广泛的生物医学应用价值。然而,传统的类器官培养缺乏与邻近组织的微环境相互作用,特别是免疫细胞的影响,这可能限制了类器官在机制研究方面的潜力。因此,将类器官与免疫细胞共培养是一种有效的方法,可以模拟类器官在体内的复杂情境,探索免疫细胞对类器官发育和功能的调节作用。今日,雷根斯堡大学免疫学研究所 Uwe Ritter教授团队,在Frontiers in Medicine上发表了题为“Analysis of organoid and immune cell co-cultures by machine learning-empowered image cytometry”的文章,以胆管上皮类器官(ECO)和极化的人类效应T细胞为实验模型,建立了类器官和免疫细胞的共培养系统,并用所开发的成像分析平台进行了类器官的检测和定量。作者发现,T细胞对ECO的生长和形态有显著的影响,而生长因子EGF也可以调节ECO的发育。这些结果表明,类器官和免疫细胞共培养可以用于研究类器官和免疫细胞之间的相互作用和信号传导,为疾病机制和药物筛选等领域提供了一个有价值的平台。类器官和免疫细胞共培养的一个主要技术难题是如何准确地检测和定量类器官的数量、大小和形态等参数,因为共培养中的免疫细胞会干扰类器官的成像和分析。目前已有的一些软件工具或算法主要针对单纯的类器官培养,不能有效地区分类器官和免疫细胞的边界和内部区域。实验部分鉴于多年沉浸于此项研究,文章作者为了读者获得更好的科研技术体验,比较了不同的软件工具或算法(如Incucyte®和OrganoSeg)在不同复杂度的类器官-免疫细胞共培养图像中的表现,发现它们都存在假阳性或假阴性的问题,不能准确地识别类器官结构。在这部分研究中,作者通过优化图像处理和分类器训练的步骤,提高了类器官检测的精度和召回率,但仍然无法满足需求。Figrure 1.免疫细胞培养物种类器官定量。A.不同科学家进行手动计数B-D.不同复杂程度的自动分析比较了Incucyte®和OrganoSeg两种软件,数据表明在共培养条件下正确识别器官的能力有限为了解决这一问题,作者借助于 StrataQuest 基match于机器学习的match图像分析平台,成功构建了一个专门用于类器官与免疫细胞精准定量分析的应用:Organoid App。这个App通过自动成像技术和先进的图像处理工具,基于机器学习算法,能够在密集的免疫细胞共培养中准确地识别类器官,并提取相关的参数,如数量、大小和形状,并实现灰度转换、对比度增强、膜检测和结构分离等辅助方法,更精准对类器官样本进行识别,可以用于高通量的检测和分析类器官和免疫细胞的共培养系统。Figure 2.使用StrataQuest构建类器官分析平台StrataQuest软件是TissueGnostics公司顶级的组织原位单细胞定量分析工具,也是Tissue Cytometry技术的重要组成部分。文中用到的所有算法,包含机器学习、深度神经识别网络算法、结构辅助分离等,也可方便快捷的用于其他研究领域的应用。Figure 3. 使用StrataQuest Organoid App进行类器官识别并进行质控。验证了类器官检测计数与面积测定等数据,与手动人工测量结果表现出了高度相关性。Figure 4. 对比不同分析软件, StrataQuest Organoid App能够更好的识别类器官轮廓文中借助Tissue Cytometry技术主要研究的内容包括:T细胞的极化状态对类器官的生长和形态有显著的影响:作者发现,与未极化的T细胞相比,Th1和Th17细胞能够显著地抑制类器官的生长,而Treg细胞则能够促进类器官的生长。此外,Th1和Th17细胞还能够改变类器官的形态,使其变得更加扁平和不规则,而Treg细胞则能够维持类器官的球形和光滑。EGF对类器官的发育和功能有重要的调节作用:作者发现,EGF能够显著地促进类器官的生长和分化,增加类器官的大小和密度,以及表达特异性的标记物。EGF还能够抵消T细胞对器官样体的抑制作用,恢复类器官的形态和功能。类器官和免疫细胞之间存在动态的相互作用和信号传导:作者发现,器官样体和免疫细胞之间不仅有物理上的接触和迁移,还有化学上的分泌和受体。例如,器官样体能够分泌IL-6和IL-8等细胞因子,诱导T细胞的极化和活化;而T细胞能够表达EGFR等受体,响应器官样体的EGF信号。这些相互作用和信号传导在不同的时间点和条件下有不同的强度和模式,反映了器官样体和免疫细胞之间的复杂的互惠关系。
应用实例
2024.03.13
Tissue Cytometry助力中山大学附属第一医院揭示ILC3s在LN中的致病作用
狼疮性肾炎是系统性红斑狼疮(通常称为狼疮)的常见并发症。狼疮是一种自身免疫病,会导致免疫系统产生自身抗体蛋白质,这些蛋白质会攻击自身的组织和器官,包括肾脏。当狼疮自身抗体影响肾脏滤除废物的结构时,就会出现狼疮性肾炎。早期的一项研究发现了ILC2s在狼疮性肾炎(LN)中可能具有保护作用,但到目前为止,关于这个领域的研究进展还相对较少。为了针对性开发新的治疗策略,探索其作为新治疗靶点的潜力,中山大学附属第一医院作者在Advanced Science杂志上发表了文章《Group 3 innate lymphoid cells exacerbate lupus nephritis by promoting B cell activation in kidney ectopic lymphoid structures》,揭示了ILC3s在LN中的致病作用,为LN的治疗提供了新的靶点。实验部分文章作者首先发现,ILC3s 在狼疮肾炎患者和小鼠的外周血和肾脏中显著增加,并与疾病活动度和肾脏损伤程度呈正相关。继而通过流式细胞术与TissueCytometry技术对ILC3s的来源进行探索发现, 肠道来源 ILC3s 的是肾脏中出现的 ILC3s 的重要来源,并加速自身免疫病和肾炎发展的全身表现。以上部分是该研究的必要基础,为了客观明确阐述实验的前提,文章作者采用经典的科研思路,直观的通过Tissue Cytometry技术进行组织原位切片成像及量化分析,结合流式细胞术、与测序技术等间接手段,获得了全面坚实的数据结果。Figure1:比较各组每mm2肾组织内ILC3s的数量(n=7~10)。为了研究ILC3 对 MRL/lpr 小鼠肾脏中 B 细胞的增殖和分化以及 ELS 的形成的作用,及其对B细胞的作用途径,作者更进一步大量使用了Tissue Cytometry多重免疫荧光定量分析技术。Panel如下:DAPI(灰色)、RORγt(红色)、CD127(黄色)、CD3(蓝色)和 CD20(绿色)。Figure 5:ILC3s促进MRL/lpr小鼠肾脏B细胞增殖、分化和ELS形成。(A)肾脏ELS和非ELS区域的ILC3s定量(CD3−CD127+ROR𝛾t +)(每组n=10)(B) T细胞和B细胞到ILC3s的空间距离分布(每组n=35)。由于免疫荧光染色技术中抗体的种属特异性限制,多色免疫荧光标记技术存在一定的技术门槛,虽然其对切片样本中组织细胞的数据提取极为重要,但在设计实验的环节往往只有某些顶尖的实验技术人员或某些成熟的染色公司才会考虑使用。Tissue Cytometry技术采用了最新的TSA染色试剂方法,可以实现在一张切片样本中最多进行10色的免疫荧光标记,而且通过连续光谱成像-光谱拆分的原理,解决通道之间的串色问题和背景自发荧光的干扰问题。正缘于此,多重免疫荧光染色技术对科研及临床工作者的难度被大大降低,开始考虑借助拥有更多蛋白生物标志物的切片样本,不但要对其蛋白表达进行定性,还要更进一步定量分析,甚至实现其空间关系分布的量化。这些需求也正是Tissue Cytometry技术的优势所在。值得关注的是,常规使用免疫荧光对目标细胞采用评估结果,仅能得到简单的定性数据,但是本文作者对ILC3s的分布分析采用了单细胞原位的空间距离梯度分析标准。在细节上,作者以20um为梯度,对其在与B细胞丛的相互作用关系方面进行了精准的量化研究。虽然在Tissue Cytometry技术中这种分析操作十分简单,但其带来的单细胞分布分析思路和以微米为单位的定量标准,对于客观精准的科研文章发表具有极其重要的参考价值。
应用实例
2024.03.13
Cell Reports|山东大学齐鲁医院发现CD8+ T细胞耗竭和与ICB在肿瘤治疗中协同作用新靶
子宫内膜癌(EC)是发达国家中最常见的妇科癌症,每年全球有417,000例新诊断。2013年,美国TCGA项目提出了关于子宫内膜癌的TCGA分型,分为了4个亚型。其中,MMRd也被称为微卫星不稳定(MSI)EC,被认为是一个“免疫热”的肿瘤亚型,具有高突变负荷和活跃的免疫微环境。免疫检查点阻断(ICB)疗法在微卫星不稳定性(MSI)子宫内膜癌(EC)治疗中显示出临床疗效,其关键机制是逆转T细胞耗竭和恢复抗肿瘤免疫。但部分患者仍表现出原发性耐药。因此,迫切需要找到可靠的生物标志物来选择适合抗PD-1疗法的患者,并寻找联合疗法的治疗靶点。2023年8月10日,山东大学齐鲁医院孔北华教授团队在Cell Reports上发表题为“Targeting TCF19 sensitizes MSI endometrial cancer to anti-PD-1 therapy by alleviating CD8+ T cell exhaustion via TRIM14-IFN-b axis”的文章。文章证明了转录因子19(TCF19)是癌症基因组图谱(TCGA)-EC队列中MSI和微卫星稳定(MSS)患者之间最具有显著差异表达的基因之一,与不良预后和免疫衰竭特征有关。TCF19在MSI EC中显著升高,进而促进三重基序14(TRIM14)转录,并与TANK结合激酶1(TBK1)-干扰素调节因子3(IRF3)-干扰素b(IFN-b)途径的过度激活信号有关。TCF19-TRIM14轴在非免疫学背景下促进肿瘤的发生,而干扰素-b的下游分泌增加通过细胞分化重编程促进CD8+T细胞的耗竭。最后,使用人源化模型展示,TCF19抑制和ICB疗法的组合显示出更有效的抗肿瘤反应。总的来说,本文研究表明,靶向TCF19是缓解CD8+ T细胞耗竭和与ICB在肿瘤治疗中协同作用的有效策略。实验部分本文使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统MSI EC患者子宫内膜癌的TMA样本进行多色免疫荧光图像采集。文章作者选择多重免疫荧光(mIHC)对TMA芯片进行染色后,借助Tissue Cytometry技术,对每个TMA芯片点中,每个细胞的核面积、每个细胞面积、每个细胞的表达强度以及细胞在不同微环境中密度分布进行了精准定量分析。首先,根据DAPI染色信号、核大小和形状对细胞核进行了设门圈选,然后在有核细胞中筛选出CD8阳性细胞,这些细胞的CD8染色信号强度超过阈值(根据阴性对照和数据分布设置)。之后,根据强度阈值确定了每个表位阳性细胞在CD8阳性细胞中的比例。确认每个算法都能成功识别阳性细胞,就将其用于生成所有TMA点的目标标记/CD8+ T细胞的阳性百分比,以保持一致性。对于从体内模型中切除的肿瘤的浸润PD-1+ CD8+ T细胞耗竭的定量,进行mIHC染色,在每个肿瘤切片中随机选择了三个高倍视野,统计了PD-1+ CD8+细胞中Ki-67+、TOX+、GranzymeB+ (GZMB+)、IFN-g+和TNF-a+细胞的百分比进行分析。 Panel : DAPI、PanCK、CD8、PD-1、TTM-3、LAG-3Figure 1 TCF19在MSI EC患者中的高表达与CD8+T细胞的高耗竭水平相关(K) MSI EC在的多色免疫荧光染色TMA样本:DAPI(蓝色)、PanCK(青色)、CD8(白色)、PD-1(黄色)、TTM-3(绿色)和LAG-3(红色)。(L) MIHC染色后,扫描25个MSI EC TMA斑点,定量分析CD8+细胞中PD-1+、TIM-3+和LAG-3+细胞的百分比,并比较低TCF19组(n=17)和高TCF19组(n=8)之间的差异。Figure 2 TCF19促进体内肿瘤形成和肿瘤浸润性CD8+T细胞的耗竭(N) (O)MIHC分析Ki-67+/PD-1+CD8+TIL比例。Figure 3 在人源化CDX和PDX模型中,TCF19抑制和PD-1阻断有效地逆转CD8+T细胞耗竭和阻止肿瘤发展(E)-(G) MIHC检测人源化CDX模型切除肿瘤中PD-1+CD8+T细胞功能。(E)TOX+或GZMB+细胞/PD-1+CD8+T细胞的定量分析。本文核心是围绕TCF19与CD8 +T细胞的关系,通过临床样本及人源化实验动物为对象开展了研究。作者为了评估CD8+T细胞的耗竭状态,以及对TCF19影响下PD-1和CD8+T细胞的表达情况,在文章关键数据的验证上使用了Tissue Cytometry技术。在肿瘤免疫相关研究中,由于肿瘤微环境的存在,评估CD8耗竭不但有数量关系的变化,更重要的是所处的微环境位置。单纯通过流式细胞技术、单细胞测序技术虽然可以获得目标细胞群体表达量的变化,但是无法准确判断其在特定部位的富集程度,以及无法有力验证是否目标细胞群体与肿瘤存在空间上的相互作用。TG公司的Tissue Cytometry技术不但可以通过多重免疫荧光染色mIHC,对组织切片中单个细胞进行精准量化分析(包括单细胞标记蛋白形态),还可以通过精准的单细胞空间距离分析来校验目标细胞的微环境分布水平及其与肿瘤的空间作用关系。作为mIHC单细胞定量分析技术的优势还在于,在单张切片上的细胞关系是可视化的明确指标,可以作为终极验证手段之一;而常规使用传统的连续切片进行免疫组化染色,以及利用不同算法在生物信息学领域进行数据分析中提取细胞互作水平,更多的是通过“推断“来进行数据产出,尚需借助其他技术进行印证。Tissue Cytometry技术拥有包括多重免疫荧光染色试剂盒在内的肿瘤微环境整体解决方案,可以在一张切片样本中最多标记10色荧光,并结合精准的光谱拆分技术、单细胞分割技术以及空间微环境可视化分析技术,在mIHC定量分析领域实现了业内领先水平,对于数据精准校验的应用需求,给出了一份完美的答卷。Nat Immunol| 中国科学技术大学高平、张华凤团队发现肌肽对细胞的调节促进溶酶体依赖的肿瘤免疫逃避 不喜内容低质不看此公众号
应用实例
2024.03.13
同一张冰冻切片中借助Tissue Cytometry单细胞原位空间蛋白分析技术同步验证解析空间转录组
免疫疗法为晚期或转移性癌症患者提供替代治疗。尽管免疫疗法延长了总生存期和无进展生存期,但在头颈部鳞状细胞癌(HNSCC)中的反应率仍然较低。浸润到肿瘤区域,包括肿瘤床和肿瘤巢,是与细胞毒性CD8+T细胞功能相关的主要步骤,也是免疫治疗的限制因素之一,特别是对于实体瘤中嵌合抗原受体T细胞免疫疗法(CAR-T)的疗效。然而限制CD8+T细胞浸润的机制知之甚少。2023年11月,上海市交通大学医学院附属第九人民医院张建军团队在Cancer Research上发表题为“Spatial and single-cell transcriptomics reveal a cancer-associated fibroblast subset in HNSCC that restricts infiltration and anti-tumor activity of CD8+ T cells”的文章。本文研究确定干扰素诱导的MHC-IhiGal-9+CAF形成CD8+T细胞的陷阱,为调节T细胞渗透和功能的肿瘤微环境中的复杂网络提供了洞察力。文中对具有不同免疫浸润的HNSCC标本进行了空间转录组分析,并对五对肿瘤和邻近组织进行了单细胞RNA测序,揭示了与CD8+T细胞浸润限制和功能障碍相关的特定肿瘤相关成纤维细胞(CAF)亚群。这些CAFs表现出高表达的CXCLs(CXCL9、CXCL10、CXCL12)和主要组织相容性复合物I类(MHC-I)以及半乳凝素-9(Gal-9)的富集。MHC-IhiGal-9+CAFs的比例与CD8+T细胞中TCF1+GZMK+亚群的丰度呈负相关。CAFs上的Gal-9诱导CD8+T细胞功能障碍,并降低了肿瘤浸润TCF1+CD8+T细胞的比例。总之,MHC-IhiGal-9+CAFs的鉴定促进了对CAFs在癌症免疫逃避中的确切作用的理解,并为更有效的HNSCC免疫疗法铺平了道路。实验部分为了明确CAFs对头颈部癌的具体影响,文章作者选择采用原位空间转录组技术,对肿瘤微环境及肿瘤内部相关的转录组表达情况进行了分析。这种技术的优势是可以通过空间位置的限定,结合转录测序的方法间接体现大量细胞标志物的表达情况,但同时受限于检测精度和转录组水平的研究,尚无法实现单细胞分辨率下真正蛋白标志物的检测分析。所以,在空间转录组技术的基础上,研究者需借助组织切片多重免疫荧光技术,通过精准的单细胞识别算法、组织识别算法以及空间分布的关系算法,真正对原位转录组水平的数据进行验证。作者在应用单细胞分辨率下多重免疫荧光定量分析的技术时,最值得关注亮点,是在最后数据验证的阶段,使用Tissue Cytometry技术,不但实现了肿瘤微环境中Gal-9+ CAFs诱导TCF1+GZMK+CD8+ T细胞功能变化的研究,更开创性的使用了与原位空间转录组分析使用相同的冰冻组织切片,甚至是前后相邻的连续冰冻切片。相比福尔马林固定-石蜡包埋的组织切片,冰冻切片可以保留更多的组织核酸/蛋白成分,但其组织结构更为脆弱,与载玻片的结合能力较差。所以在传统TSA技术中,每轮染色之间需要微波加热沸腾漂白十几分钟,这样就无法使用冰冻切片作为染色样本。Tissue Cytometry技术使用TG配套多重免疫荧光染色试剂盒,采取的漂白时间缩短到了十几秒,同时配备有专业的冰冻切片修复-洗脱试剂,洗脱更加温和,这样就解决了冰冻切片上多重免疫荧光的染色问题。在此基础上,Tissue Cytometry技术拥有的包括单细胞的精准识别与定量,组织结构AI识别,以及通过真实原位像素水平获得的细胞-组织-细胞距离关系(非空间向量坐标)分析能力,都是蛋白水平数据精准定量验证的必要条件。作为Tissue Cytometry技术的提供方,我们也很高兴可以在作者数据补充阶段,以极其高效的方式完成了相应7色冰冻切片的染色、连续全光谱扫描、光谱拆分及数据分析。Figure 1 三种免疫型HNSCC细胞空间分布和基因表达谱的异质性B:排除型免疫表型的PANK(绿色)、CD8α(黄色)、α-SMA(紫色)的多重免疫荧光图像及其区域放大图。Figure 2 Galectin-9与TCF1+CD8+T细胞分化功能障碍有关。B、三种免疫表型类型HNSCC的多重免疫荧光染色(CD3、CD8、α、PANCK、COL1A1、GAL-9、α-SMA),相同的标本进行空间转录组测序。D,三种免疫表型类型HNSCC中Gal-9+成纤维细胞和CD8+T细胞中TCF1+CD8+T细胞的比例,以及CD8+T细胞与Gal-9+成纤维细胞的比例。在这些细胞与恶性细胞(Panck+细胞)之间的不同距离范围内,Gal-9+CAF(Gal9+COL1A1+细胞)的比例。
应用实例
2023.12.01
Tissue Cytometry技术为转移性淋巴结中的CD24hiCD27+Bregs促进癌症的耐药
腋窝淋巴结(LNs)是乳腺癌(BC)的主要转移部位。然而,转移性淋巴结(mLNs)内肿瘤细胞和免疫细胞之间的相互作用仍然不清楚。在本文的研究中,我们探讨了mLNs内CD24hiCD27+调节性B细胞(Bregs)对BC细胞耐药性的影响。2023年10月11日,浙江大学医学院附属第二医院乳腺外科在Clinical Cancer Research杂志上发表了题为CD24hiCD27+Bregs within metastatic lymph nodes promote multi-drug resistance in breast cancer的研究论文。研究揭示了CD24hiCD27+Bregs通过与mLNs内BC细胞相互作用促进耐药性的关键作用,为BC患者使用化疗-免疫治疗联合策略提供了新的证据。实验收集了接受标准新辅助治疗(NAT)的BC患者的mLN样本,并通过多色免疫荧光染色分析了CD24hiCD27+Bregs的空间分布特征。通过体外实验评价了CD24hiCD27+ Bregs对BC细胞耐药性的影响。使用带有mLNs的小鼠模型评价了阻断Bregs和BC之间相互作用以改善mLNs内肿瘤消退的策略。在接受NAT的BC患者中,活化的CD24hiCD27+Bregs与mLN内残留的肿瘤细胞之间存在密切的空间相关性。机制上,CD24hiCD27+ Bregs通过分泌IL-6和TNF-a显著增强了BC细胞多药耐药性和类干细胞特征。更重要的是,BC细胞通过CD40L-和PD-L1依赖的近端信号进一步促进了CD24hiCD27+Bregs的激活,形成了一个正反馈模式。PD-L1阻断显著减弱了由CD24hiCD27+ Bregs诱导的BC细胞耐药性,并且在化疗中加入抗PD-L1抗体可以改善mLNs内肿瘤细胞消退。实验部分本文使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统对来自7个不同患者的BC肿瘤和对照LN的组织切片进行多色免疫荧光图像采集。Panel 1 : pan-CK,CD19,IL-10,DAPIPanel 2: pan-CK,CD19, CD24, CD27,IL-10,DAPIPanel 3 :pan-CK, CD19, TNF-α, IL-6, IL-10, DAPI为了研究数据的可靠性,本文作者首先通过Tissue Cytometry技术对B细胞分泌IL-10的单细胞表达水平进行了精准定量分析,明确了mLN 中存活的标准 NAT 的残留肿瘤细胞密切相关。为了实现这一目的,免疫荧光染色使用了Panel1:Panel 1 : pan-CK,CD19,IL-10,DAPI。接下来,为了探讨免疫细胞的活化状态,研究者以在乳腺癌 mLN中的CD24hiCD27+ Bregs作为研究目标,不但对其单细胞表达水平进行了量化,还对其在肿瘤微环境中的分布进行了空间作用关系分析。研究发现,在富含B细胞的淋巴滤泡被破坏, B细胞更多地分布在转移性肿瘤巢周围。在这部分同样借助Tissue Cytometry技术,并使用了Panel2:Panel 2: pan-CK,CD19, CD24, CD27,IL-10,DAPI在下一步中,研究者对表达IL-10 的B细胞进行研究的基础上,结合表达IL-6和/或TNF-a的细胞亚型,对其与残留肿瘤负荷的关系进行了研究,发现结果呈正相关,从而证明CD24hiCD27+ Breg衍生细胞因子的效应,即TNF-和IL-6,而不是IL-10,是BC细胞干性和多药耐药性的原因。在这部分研究中使用了Tissue Cytometry技术进行分析,使用Panel组合3:pan-CK, CD19, TNF-α, IL-6, IL-10, DAPI虽然本文大量使用了流式细胞技术与转录组技术对细胞表型及细胞表达水平进行了量化分析,但是在关键数据上,都建立了使用Tissue Cytometry技术作为原位校验方法的验证标准。相比传统的研究思路,这样获得的数据不但更加全面,并且从单细胞蛋白表达层面对空间分布关系进行研究,是最能反映生物体真实情况的研究水平。在空间距离分析方面,考虑到肿瘤微环境中作用细胞的分布特性,距离肿瘤边界越近相对作用越显著,所以文章作者在考虑微环境作用关系分析方面,在不同测试方案后,采用了距离梯度0-25μm,25-50μm,50-100μm这三个范围,既细化了肿瘤微环境研究的精准性,同时也兼顾远端细胞的数据分析考量。Figure 1 CD24hiCD27+Bregs是LNS中最主要的B细胞亚群,位于MLN中非常接近肿瘤细胞处。A: 部分应答(PR,n=17)和进展的转移性淋巴结(MLN)患者的多色免疫荧光图像IL-10(黄色),CD19(红色),pan-CK(绿色)和DAPI(紫色)。根据IL-10和CD19表达的多色免疫荧光图像分析,定量不同药物反应的mLN中IL-10+CD 19+的细胞占比。F: 在BC患者的非MLN和MLN中的IL-10(黄色)、CD19(红色)、CD24(天蓝色)、CD27(紫红色)、pan-CK(绿色)和DAPI(紫色)染色的多色免疫荧光图像。定量分析IL-10+B细胞中IL-10+CD24hiCD27+B细胞中IL-10+CD24hiCD27+B细胞的百分比。G: BC患者外周血中IL-10+CD24hiCD27+ B细胞中pan-CK+周围的IL-10+CD24hiCD27+ B细胞占比。Figure 6 F: 不同处理组小鼠骨髓单个核细胞pan-CK、CD19、IL-10、肿瘤坏死因子-α、IL-6的多色免疫荧光图像。不同处理组小鼠骨髓单个核细胞中IL-10+B细胞占B细胞百分比的统计分析。
应用实例
2023.11.24
Theranostics| 天津医科大学肿瘤医院通过组织原位真实完整单细胞形态评估Tim-3调节2型
肿瘤微环境的免疫抑制是肿瘤免疫治疗的主要障碍。干扰素刺激因子(STING)激动剂可以触发炎症性的先天免疫反应,有可能克服肿瘤的免疫抑制。虽然STING激动剂可能有望成为潜在的癌症治疗药物,但是肿瘤对STING单一疗法的耐药性已经在临床试验中出现,其机制尚不清楚。2023年9月4日,天津医科大学肿瘤医院任秀宝教授团队在Theranostics(IF=12.4)上发表题为“Blocking Tim-3 enhances the anti-tumor immunity of STING agonist ADU-S100 by unleashing CD4+ T cells through regulating type 2 conventional dendritic cells”的文章。本实验使用小鼠肿瘤模型,测量了STING激动剂ADU-S100(S100)和抗T细胞免疫球蛋白和粘蛋白结构域-3抗体(αTim-3)的体内抗肿瘤免疫效果。利用流式细胞术检测了肿瘤特异性T细胞的激活和肿瘤微环境的改变。同时测量了树突状细胞(DC)的成熟和功能,以及CD4+ T细胞在联合治疗中的重要性。此外,还通过体外实验验证了S100对CD4+ T细胞的影响。最后,进一步评估了在人类肿瘤样本中高表达Tim-3的常规树突状细胞(cDC)2对生存或治疗效果的影响。S100通过激活cDC1增强了CD8+ T细胞的反应,但未能启动cDC2。在机制上,S100的给药导致了小鼠和人类cDC2(Tim-3+cDC2)中Tim-3的上调,这具有免疫抑制作用。Tim-3+cDC2抑制了CD4+ T细胞,并减弱了CD4+ T细胞驱动的抗肿瘤反应。S100与αTim-3的联合治疗有效地促进了cDC2的成熟和抗原呈递,释放了CD4+ T细胞,从而降低了肿瘤负担,延长了生存。此外,人类肿瘤微环境中Tim-3+cDC2的高百分比预示着不良的预后,而Tim-3+cDC2的丰度可能作为CD4+ T细胞质量的生物标志物和免疫治疗反应性的贡献指标。这项研究证明了阻断Tim-3可以通过调节cDC2来增强STING激动剂ADU-S100的抗肿瘤免疫效果,释放CD4+ T细胞。它还揭示了ADU-S100单一疗法的内在障碍,同时提供了一种克服肿瘤免疫抑制的联合策略。实验部分本实验收集了58例接受新辅助化疗(NAC)或新辅助培溴利珠单抗联合化疗(NAPC)治疗的肺癌患者的肿瘤标本。使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统获取图像。获取到图像利用StrataQuest软件进行定量分析,评价肿瘤浸润性TIM-3+CDC2或CD4+T细胞与疗效的关系。Panel : CD11c、CD1C、Tim-3、CD4、Foxp3和DAPI为了验证在DC上表达的Tim-3对CD4+ T细胞的负向调控作用,文章作者对Tim-3+ cDC2 和 CD4+ T的作用关系进行了分析,并参考主要病理反应(MPR)作为临床特征指标进行作用关系评估。考虑到在免疫作用中CD4+T细胞处于cDC2的下游,其存在的相互作用在传统意义上只能通过整体水平进行粗略评估,但是无法精准量化,故此次本文作者借助于Tissue Cytometry技术对Tim-3-cDC2/Tim-3+cDC2 和 CD4+ T/Treg细胞的分布进行了空间定量分析。研究者根据文献记载,采用泊松分布原理,将Tim-3-cDC2/Tim-3+cDC2半径(r = 30 μm)内的CD4+T细胞的分布密度进行比较,发现在 NAC 和 NAPC 患者中,与 Tim-3-cDC2 相比,Tim-3+cDC2 周围的 CD4+ T 细胞显着减少,代表CD4+ T 和 Tim-3+cDC2 之间细胞接触的可能性降低。这个分析结果启发性的为Tim-3+cDC2肿瘤患者预后不良的关系提供了初步的证据,“急需相关临床试验证实“——作者在文中写道。大部分现有的技术是利用空间坐标方法,对细胞空间生物学信息进行研究,但是当细胞呈梭形或不规则形态时,细胞中心点就无法代表其真实的组织形态轮廓,导致分析结果出现偏差。Tissue Cytometry技术与其他技术不同,采用组织原位真实的细胞形态、轮廓,通过原始成像结果中真实像素距离运算作为距离分析基础,这样不但可以获得真实细胞的距离关系,更可以通过组织-细胞形态计算其微环境分布水平,让分析结果更加精准可靠。Figure 1 高比例TIM-3+cDC2预示肿瘤患者预后不良(A)治疗后肺癌样本的多重免疫荧光图像(B)接受NAC或NAPC治疗的患者的MPR百分比的比较。接受NAC或NAPC治疗的MPR或非MPR患者的(C)Tim-3+cDC2或(D)CD4+T细胞的比较。(G-I) 采用空间分析方法,计算参考细胞周围30μm半径范围内感兴趣细胞的密度,并进行图示。与NAC和NAPC患者中Tim-3+cDC2细胞相比,Tim-3-cDC2细胞周围30μm范围内的 (H) CD4+ T细胞和 (I) Treg细胞密度如下。
应用实例
2023.11.17
Cell Death& Disease| 北京大学基础医学院张宏权/战军教授团队验证乳腺腔祖细胞的分
母乳喂养是婴儿的规范喂养方式,是一个公共卫生问题,因为它可以提高婴儿的存活率和母亲的健康。但是,全世界有5-15%的妇女患有乳腺发育异常和泌乳功能障碍。Notch信号通路被广泛报道参与乳腺干细胞的维持、细胞命运的决定和乳腺发育和成熟过程中的分化。Notch1在乳腺干细胞中的激活对于促进乳腺细胞的分化和推动单能性雌激素受体阴性乳腺细胞的渐进转化是必需的。Kindlin-2是由FERMT2基因编码的一种重要的整合素结合蛋白,它在中胚层来源的器官中高度表达,包括平滑肌、心脏、血管和骨骼。肌上皮细胞在乳腺发育中起着重要的作用,但关于肌上皮细胞如何控制妊娠期间腺泡细胞分化的分子机制还不太清楚。2023年10月,北京大学基础医学院、北京大学国际癌症研究院张宏权/战军研究团队在Cell Death& Disease杂志上发表题为 Kindlin-2 in myoepithelium controls luminal progenitorcommitment to alveoli in mouse mammary gland的研究论文。本文发现在肌上皮细胞中缺失Kindlin-2会损害乳腺形态发生、腺泡细胞形成和泌乳。利用五种基因修饰的小鼠模型结合单细胞RNA测序,我们发现在肌上皮细胞中存在一个Kindlin-2–Stat3–Dll1信号级联,它能够使管腔细胞中的Notch信号通路失活,从而促进管腔祖细胞向腺泡细胞的分化。单细胞谱分析显示,Kindlin-2缺失显著降低了成熟肺泡细胞的比例。在分子机制方面,Kindlin-2在肌上皮细胞中的缺失促进了Stat3的激活和Dll1的上调,这些因素激活了管腔细胞中的Notch信号通路,并抑制了妊娠期间管腔祖细胞的分化和成熟。用橘皮素抑制Notch1,使Kindlin-2在肌上皮细胞中缺失的妊娠小鼠的管腔祖细胞恢复了分化能力。总之,文章证明了Kindlin-2是肌上皮细胞控制妊娠期间管腔祖细胞向腺泡细胞转化的必需因素。实验部分由于肌上皮是一种特殊肌肉样分化的上皮细胞,在大多数情况下薄薄附着在管腔上皮细胞上,这样导致其存在比例较低,并且在传统分析过程中和管腔上皮存在串扰,无法精确进行量化分析,故研究者通过大量前期研究认为使用传统测序方法研究的分辨率无法满足需求,转而关注单细胞多组学定量分析技术,实现了在不破坏原始组织结构形态的基础上对其表达及分布情况进行了深入分析。为了保证单细胞多组学定量分析数据的精准可靠,本文中全部免疫荧光图像及定量分析结果,都使用了TissueGnostics公司的Tissue Cytometry技术进行分析及验证。Panel 1: CK5,CK8,Kindlin-2在实验细节上,研究者首先关注了Kindlin-2在乳腺中的生理分布,发现Kindlin-2在CK5标记的肌上皮细胞中高表达,而且证实在基因敲除小鼠中其表达有显著降低,为后续的实验建立了研究基础。(Panel1)Panel 2: CK5,DII1,CK8,Notch1 接下来,为了检测肌上皮中的Dll1和腔上皮中的Notch1,进一步在组织原位证实肌上皮缺失Kindlin-2会激活了肌上皮与腔上皮之间的Notch信号通路,与单细胞拟时序分析结果相呼应,研究者使用了多重免疫荧光定量分析技术,从单细胞识别层面通过位置分析,判断肌上皮和管腔上皮之间的信号通路是否通过接触来实现。(Panel2)Panel 3: CK5,STAT3,STAT3 pY705,DII1最后,为了证实Kindlin-2和Stat3在乳腺微环境中的原位调节相互作用,研究者利用荧光多色免疫标记技术在E18.5肌上皮缺失Kindlin-2小鼠(K14-Cre+; Kindlin-2flox/flox)乳腺检测肌上皮中的Dll1和Stat3 Y705和S727位点的磷酸化水平,在组织原位证实了Kindlin-2–Stat3–Dll1信号级联的存在。(Panel3)Figure 1 哺乳动物上皮特异性敲除Kindlin-2抑制雌性小鼠的泌乳B:K14-Cre + ; Kindlin-2flox/flox 或者 K14-Cre-; Kindlin-2flox/flox对照组4月龄小鼠乳腺的CK5(绿色)、Kindlin-2(红色)、CK8(紫色)和DAPI(蓝色)的多色免疫荧光图像。Figure 2 Kindlin-2的肌上皮细胞特异性敲除通过上调P18.5乳腺中的Dll1激活Notch信号通路管腔上皮中的肌上皮和Notch1D:K14-Cre+中P18.5乳腺的CK5(绿色)、Dll1(红色)、CK8(紫色)、Notch1(黄色)和DAPI(蓝色);Kindlin-2flox/flox或K14-Cre-;Kindlin-2 flox/flox同窝对照小鼠的多色免疫荧光图像。G:统计分析显示在K14-Cre+中P18.5处CK5+细胞中Dll1+细胞和CK8+细胞中Notch1+细胞的百分比;Kindlin-2flox/flox组与K14-Cre-组比较。Figure 3 Kindlin-2的缺失激活了肌上皮中的STAT3并上调了Dll1。A:K14-Cre+;Kindlin-2 Flox或K14-Cre-;Kindlin-2 Flox/Flox雌性P18.5乳腺的CK5(绿色)、STAT3(橙色)、STAT3 pY705(青色)、DL11(红色)和DAPI(蓝色)的多色免疫荧光图像B:统计分析显示在K14-Cre+中的P18.5处,CK5+细胞中的STAT3+细胞、CK5+中的STAT3-pY705+细胞和CK5+单元中的Dll1+细胞的百分比;Kindlin-2flox/flox组与K14-Cre-组比较;Kindlin-2 flox/flox组。***值得关注的是,在文章讨论部分,研究者提出未来需要进一步研究来确定 Kindlin-2 和 Jak2-Stat3-Dll1 轴之间的调节相互作用,以及Kindlin-2、Jak-Stat信号通路(与炎症相关)和Notch信号通路(与细胞干性和命运分化相关)之间的复杂调控过程,是否与乳腺炎和乳腺癌等乳腺相关疾病有关。这些更深入的探索内容依然可以通过Tissue Cytometry技术中,细胞组织空间作用网络研究模块来实现。
应用实例
2023.11.09
Cancer Cell(IF=50.3)| 上海交通大学医学院证实肿瘤内微生物群落可通过骨髓源性抑制
肺癌是全球癌症相关死亡的主要原因,每年导致约180万人死亡,其中肺腺癌(LUAD)是主要的病理类型。肿瘤内微生物组是肿瘤微环境的重要组成部分,其与宿主的相互作用对癌症的发生、发展至关重要,因此肿瘤内微生物研究为癌症的诊断、筛查和治疗提供了崭新的视角。虽然“多形态微生物组”已经成为癌症的标志之一,但关于肿瘤内真菌群(mycobiome)作为活体微生物在癌症进展中的作用还知之甚少。2023年9月21日,上海交通大学医学院王慧/刘宁宁、同济大学张鹏以及中科院巴斯德所陈昌斌课题组共同通讯在国际顶尖肿瘤学期刊Cancer Cell(IF=50.3)上发表题为“The intratumor mycobiome promotes lung cancer progression via myeloid-derived suppressor cells”的文章。本文使用富含真菌的DNA提取和深度宏基因组测序,发现了肺腺癌(LUAD)患者中富集的肿瘤驻留的聚多曲霉A. sydowii。通过三种不同的同系肺癌小鼠模型,我们发现聚多曲霉通过IL-1b介导的骨髓抑制细胞(MDSCs)的扩增和激活,抑制细胞毒性T淋巴细胞的活性,并促进PD-1+ CD8+ T细胞的积累,从而形成免疫抑制的肿瘤微环境促进肺肿瘤的进展。这是通过b-葡聚糖/凝集素-1/CARD9途径介导的IL-1b分泌实现的。人体样本的分析证实,富集的A. sydowii与免疫抑制和患者预后不良相关。研究结果表明,肿瘤内的真菌生物群,尽管生物量较低,但会促进肺癌的进展,并且可以作为改善LUAD患者预后的潜在靶点。实验部分相比针对癌症的一般研究,本文作者关注于真菌菌群失调对癌症的影响及作用机制,并借助FISH染色技术对目标菌群进行了标记。根据研究的需要,迫切需要解决的问题,一是从宏观角度理解菌群与肿瘤之间的关系,二是从微观角度解析真菌与细胞的作用机制。为了对以上两个问题进行深度探索,作者采用了StrataQuest定量分析软件建立了精准量化的分析标准。由于技术原理导致FISH染色成像结果经常会呈现的高背景、低信号状态。StrataQuest定量分析软件作为Tissue Cytometry技术数据分析层面的强大工具,对于FISH染色标记的点状荧光信号也有其独到的分析策略:首先在识别精度上,可以精准识别到高背景下的每个信号点,对核酸片段进行计数分子;其次在识别并计数的基础上,结合细胞核的定位,以及某蛋白染色的细胞质轮廓定位,在微观水平实现了核酸表达的空间定位,并可同时获得真菌及其相关细胞的作用情况数据。这种方法也可以用于对某些特定基因复制、转录及翻译过程的一致性定位分析,对中心法则传递性的验证是极其具有价值的。在宏观层面,Tissue Cytometry技术也可以通过肿瘤识别,并在肿瘤周边对微环境空间位置进行自由定义,以此来分析肿瘤微环境内不同表型的单细胞的空间分布关系,通过简单的数据统计,即可获得以往需要生信分析算法才能获得的作用关系数据,例如菌群与肿瘤见的互相作用,或者肿瘤微环境中不同炎性细胞的相互作用情况等。Figure 1 A.sydowii的高丰度与免疫抑制和患者预后不良有关A)LUAD患者临床样本的多色免疫荧光显示瘤内的A.sydowii与A.sydowii特异的FISH图像。红色,A.Sydowii;蓝色,DAPI。(B)LUAD患者的临床样本的肿瘤内MDSCs的多色免疫荧光图像(CD11b+CD33+HLADR-)。粉色,CD11b;绿色,CD33;红色,HLADR;蓝色,DAPI。(C)LUAD患者临床样本中的肿瘤内Tregs(FOXP3+)的多色免疫荧光图像。绿色,FOXP3;蓝色,DAPI。(D)LUAD患者临床标本中肿瘤内PD-1+CD8+T细胞(PD-1+CD8+)的多色免疫荧光图像。绿色,CD8;红色,PD-1;蓝色,DAPI。(E-G)LUAD患者肿瘤组织样本中A.sydowii丰度与MDSCs(E)、Tregs(F)和PD-1+CD8+T细胞(G)的相关性。Figure 2 A.Sydowii没能够促M2巨噬细胞的免疫抑制活性。(C)通过在皮下LLC小鼠模型中用D223 28S rRNA探针对真菌进行FISH染色,比较感染A.111 sydowii、烟曲霉、白色念珠菌或载体的小鼠中肿瘤内真菌的丰度。红色真菌FISH探针;蓝色,DAPI。
应用实例
2023.11.08
全新一代10+1肿瘤免疫微环境多色解决方案
TissueGnostics公司推出的10+1肿瘤免疫微环境多色解决方案,在类流式分析方法的基础上,构建了整套肿瘤免疫微环境大数据深度挖掘体系,拥有1.成熟的多标记染色试剂盒体系 2.大尺寸高倍率全自动连续光谱全景成像 3.可原位追溯的大数据AI深度空间量化分析功能。一体化解决方案优势在于简化了数据的流转环节,允许应用定制APP,全自动的无人值守大大提高了组织原位数据分析操作的效率。a) 基于全新一代TSA染色技术同时标记10种生物标志物后,使用TissueFAXS Spectra系统进行连续全光谱高倍率成像,构建全景(多光谱)虚拟切片。b) Tissue Cytometry技术,能够获取10色独立的真实染色标志物数据,还可以去除背景自发荧光或血细胞/胶原等自发荧光,实现10+1色的独立通道采集。c) 免疫微环境信号量化分析,可提供多种自动化解决方案APP,实现AI大数据深度空间量化分析功能。(APP包括但不限于:核酸分子/亚细胞结构/细胞/组织等目标中的形态学识别、 强度量化统计分析、结构/空间分布关系分析),以及正反向回溯数据(双向)校验机制,对大数据分析结果进行校验。d) 针对创新研发型的肿瘤微环境量化分析需求,可选配量化分析软件StrataQuest,不但可以同时实现所有APP功能,还可以针对稀有样本进行数据获取,其可追溯校验的数据分析模式也获得NCS等期刊的一致认可。
应用实例
2023.10.23
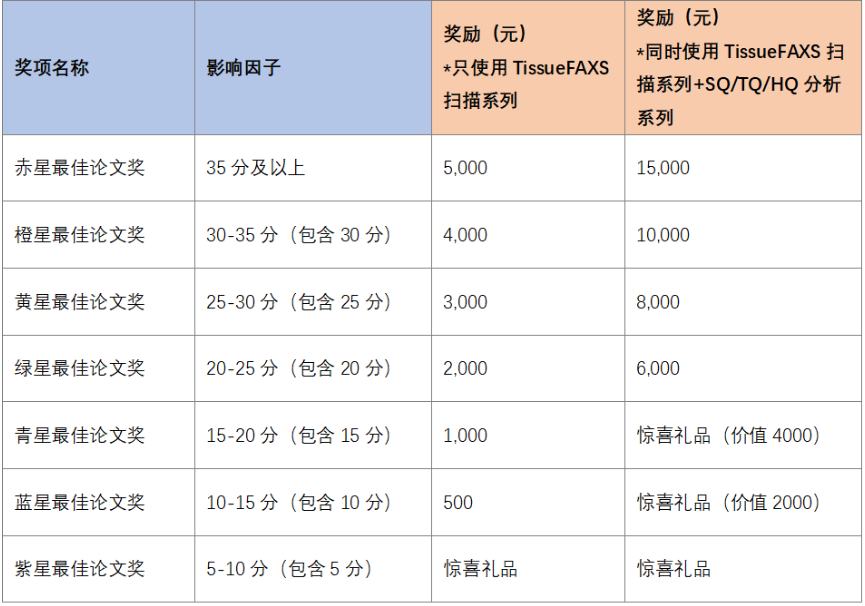
2023年度TissueGnostics论文发表激励计划
TissueGnostics论文激励计划自2022年正式启动,期间得到了众多科学家们的大力支持,Tissue Cytometry技术在数篇高水平论文中被使用,其中不乏NCS级期刊。截至2023年7月31日共发放数十万元奖励。为了鼓励科学家们在生命科学领域的不断开拓创新、对前沿技术及高精度产品的的追求。2023年我们将持续推出【论文发表激励计划】,希望大家使用Tissue Cytometry技术发表更多、更优秀的文章。2023年度论文发表激励计划具体方案如下活动时间:2023-08-01至2024-07-31(2023-08-01前发表的文章送精美礼品一份)活动内容:使用TissueGnostics公司设备在国际刊物上发表文章(需SCI收录), 并在Methods明确体现TissueGnostics公司及所使用的具体设备型号科研人员有权申领。SQ=StrataQuest,TQ=TissueQuest,HQ=HistoQuest申领规则:1.文章发表及见刊时间为2023-08-01至2024-07-31;2.申请人需为论文第一作者或通讯作者,共同一作只可领一份奖励(同一篇文章只可申领一次奖励);3.若同一作者使用相同产品发表多篇文章,则只可领取一次奖励(按IF值最高的领取);4.文中需明确体现TissueGnostics公司及所使用的具体设备型号,包括:TissueGnostics,TissueFAXS,HistoQuest,TissueQuest,StrataQuest,TissueFAXS Spectra,TissueFAXS Q+等;5.发表文章中与TissueGnostics相关图像及分析数据,需提供给TissueGnostics公司用于市场宣传;6.期刊SCI- IF 值以2023年公布为准;7. 此活动仅面向中国大陆地区。(更多申领规则详见申请表)
企业动态
2023.10.23
临床介导的 CD8+ T 细胞和 NK 细胞焦亡的发现揭示了黑色素瘤异质性
黑色素瘤组织中,与细胞焦亡相关的基因(PRGs)GZMA、GSDMB、NLRP1、IL18和CHMP4A的阳性细胞比例低于正常皮肤。细胞焦亡是一种影响肿瘤微环境和肿瘤免疫治疗的新领域。然而,细胞焦亡的作用仍有争议,部分原因是由于黑色素瘤的细胞组成异质性。2023年8月,上海中医药研究院皮肤病研究所李斌教授团队在Cell Death& Disease杂志上发表题为 Clinical-mediated discovery of pyroptosis in CD8+ T cell and NK cell reveals melanoma heterogeneity by single-cell and bulk sequence 的研究论文。本文对黑色素瘤标本的单细胞转录组进行了全面分析。我们发现PRGs的表达在免疫细胞中,如CD8+细胞(代表CD8+ T细胞)和CD57+细胞(代表NK细胞)中失调。此外,免疫组化和多重免疫荧光染色实验结果进一步证实了GZMA+细胞和GSDMB+细胞主要在免疫细胞中表达,特别是在CD8+ T细胞和NK细胞中。黑色素瘤标本中,GZMA+合并CD8+ T细胞(0.11%)和GSDMB+合并CD57+细胞(0.08%)的存在量很少,而对照组分别为4.02%和0.62%。这些发现表明,肿瘤中免疫细胞的减少可能降低了细胞焦亡的能力,从而对抗黑色素瘤的特性构成了潜在的风险。我们根据单细胞和整体RNA-seq分析,构建了一个预后风险模型和个体化的预测模型(C指数=0.58,P = 0.002),提示PRGs在恶性黑色素瘤的预防中可能发挥作用。总之,通过实验验证鉴定了免疫细胞群和免疫基因模块,有助于我们更好地理解黑色素瘤中的细胞焦亡。实验部分本文中,研究者使用TissueGnostics公司TissueFAXS Spectra全景多光谱组织扫描定量分析系统获取图像。获取到图像利用StrataQuest软件进行定量分析。Panel 1 :DAPI,CD8,GZMA,GSDMBPanel 2:DAPI,CD57,GZMA,GSDMB虽然细胞焦亡对癌症的影响尚为有定论,但是也正因为如此,针对细胞焦亡的研究仍然有广泛的未知等待探索。考虑到细胞焦亡的研究和炎症反应过程密切相关,借助于TissueFAXS Cytometry技术,结合多色免疫荧光染色,不但可以精准识别焦亡相关特异性蛋白表达的细胞,还可以实现对细胞焦亡水平在组织中的空间分布、形态特征、与其他细胞类型的相互作用等方面的高通量、高精度、高信息量的定量分析。在单细胞定量水平上,先通过识别细胞核标记对细胞进行计数,继而借助于Tissue Cytometry的核扩张算法精准对细胞质/膜染色的形态进行识别。在获得单细胞真实染色的轮廓区域后,对每个细胞蛋白标记的所有像素强度进行统计分析,最终获得单个细胞蛋白表达的真实强度水平。这种方法用于阳性阈值的精准筛选划分,甚至更进一步鉴定了阳性细胞与相邻的阴性细胞的作用关系。在本文中作者还利用了多组学研究的思路,对黑色素瘤发病机制有关的细胞 - 细胞相互作用网络提出了新的见解思路,以CD8阳性T细胞作为研究线索观察到CD8细胞边缘浸润的失调,进一步为肿瘤免疫的相关机制研究拓展了研究领域的广度。除此之外,针对NK细胞、GZMA 细胞和 GSDMB 细胞也均进行了原位精准空间定量分析,为后续的深入研究奠定了扎实的基础。在这些研究中,在切片原位的多重免疫组化标记,针对不同表型细胞的蛋白表达及细胞分布分析,也都是利用TissueFAXS Cytometry技术来进行的个体化精准定量分析。Figure 1 GZMA+细胞和GSDMB+细胞由CD8+T细胞分泌。A:对照组和黑色素瘤组织的多色免疫荧光染色图像。DAPI(蓝色)、CD8(粉色)、GZMA(绿色)和GSDMB(红色)。B:CD8+GZMA+共定位和CD8+GSDMB+共定位散点图。Figure 2 NK T细胞分泌GZMA+细胞和GSDMB+细胞A:对照组和黑色素瘤组织的多色免疫荧光染色图像。DAPI(蓝色)、CD57(粉色)、GZMA(绿色)和GSDMB(红色)。B:CD8+GZMA+共定位,CD8+GSDMB+共定位,CD57+GZMA+和CD57+GSDMB+散点图。
应用实例
2023.10.19
STTT(IF=39)| 暨南大学闫森/涂著池团队成功创建了一种新型的免疫缺陷猴模型
严重联合免疫缺陷(SCID)是一种能够导致免疫系统严重恶化的遗传性疾病。在与SCID相关的关键基因中,RAG1和IL2RG起着关键作用。IL2RG对T、B和NK细胞的发育、分化和功能是必不可少的,而RAG1则通过促进淋巴细胞成熟过程中的V(D)J重组对适应性免疫有着关键的贡献。携带这些基因突变的动物模型表现出明显的免疫系统缺陷。非人灵长类动物(NHPs) 由于与人类在遗传和生理上的相似性,是生物医学研究的理想模型。碱基编辑技术(CBE)是精确和有效地修改基因组中单碱基突变的强大工具。它们的成功实施已经在人类细胞、小鼠和作物物种中得到证明。2023年9月4日,暨南大学港澳中枢神经再生研究院闫森/涂著池团队在Signal Transduction and Targeted Therapy(IF=39) 发表题为“Generation of inactivated IL2RG and RAG1 monkeys with severe combined immunodeficiency using base editing”的研究论文。本文研究概述了使用CBE4max系统通过使IL2RG和RAG1基因失活来建立免疫缺陷猴子模型。经过碱基编辑的猴子表现出严重的免疫系统受损,其特征是淋巴细胞减少,淋巴器官萎缩,成熟T细胞缺乏。此外,这些碱基编辑的猴子能够承载和支持人类乳腺癌细胞的生长,从而导致肿瘤的形成。综上所述,我们成功地利用CBE4max系统开发了一种具有促进肿瘤生长能力的免疫缺陷猴子模型。这些免疫缺陷猴子作为有价值的工具,显示出推进生物医学和转化医学的巨大潜力。实验部分本文使用TissueGnostics公司TissueFAXS plus全景组织细胞定量分析系统对碱基编辑猴的胸腺和脾组织切片进行图像采集及组织原位单细胞数据分析。为了评估使用碱基编辑猴作为研究人类肿瘤学的体内模型的可行性,研究者使用Tissue Cytometry技术对野生/突变猴的胸腺、脾脏中关键表型细胞进行了精准的量化分析,并且利用其技术的精准定量特性,和WB、流式技术互相印证,进一步提升了数据的可靠性。与传统免疫组化、免疫荧光基于染色强度来评估蛋白表达水平的技术相比,Tissue Cytomery技术先对细胞核进行识别,并通过组织流式散点图的方式筛选去掉黏连细胞与细胞碎片,继而以组织原位真实单细胞为核心,圈定目标蛋白染色的完整轮廓,最后通过计算单细胞完整染色的强度与轮廓,实现了对单细胞的精准定量目标。正是由于这种方法的精准可靠,近期越来越多的学者结合多组学分析技术,最后选择Tissue Cytometry技术作为单细胞数据的验证手段,并借助Tissue Cytometry技术的空间作用分析方法,更进一步,把组织原位切片分析,不但作为了最终的验证手段,更拓展成为了原位空间组学的分析解决方案。Figure 1 碱基编辑猴子的表型分析和组织病理学变化e:碱基编辑猴的胸腺和脾的发育的HE图像h-j: RAG1和IL2RG在突变猴和WT猴胸腺和脾中的免疫组化图像和定量分析Figure 2 碱基编辑猴子的T、B淋巴细胞的研究a-d:胸腺(a,b)和脾(c,d)中IgM+和CD3+的免疫组化图像和定量分析Figure 3 肿瘤组织原位验证Ki67和CD133标记肿瘤组织免疫荧光图像及定量分析
应用实例
2023.09.22