









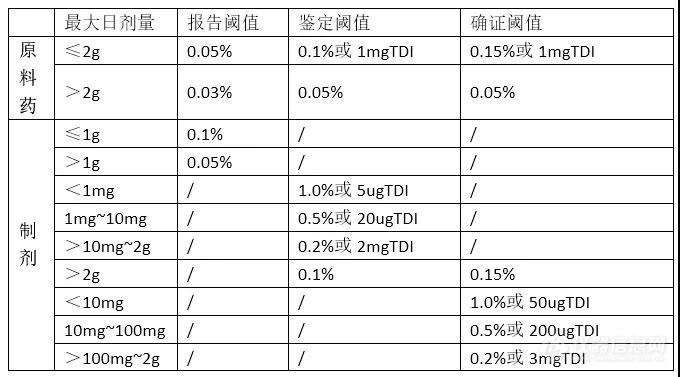
报告限度:超出此限度的杂质均应在检测报告中报告,并应报告具体的检测数据;
鉴定限度:超出此限度的杂质均应进行定性分析,确定其化学结构;
质控限度:质量标准中一般允许的杂质限度,如制定的限度高于此限度,则应有充分的依据;
TDI:药品杂质的每日总摄入量。
对于药品中的杂质检查,有薄层色谱法、高效液相色谱、气相色谱法,最常用的就是高效液相色谱方法和薄层色谱法,现介绍如下:
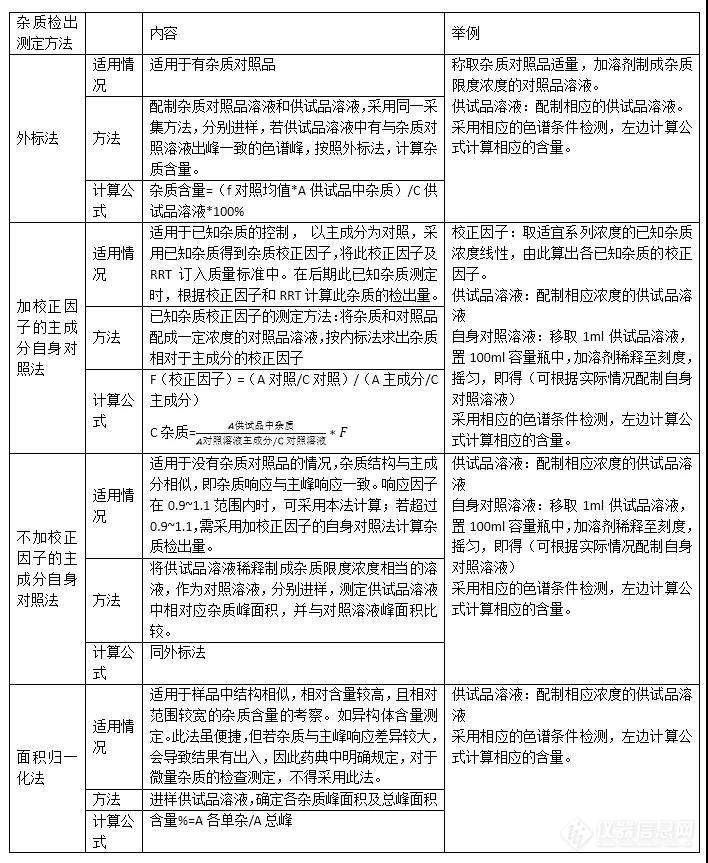
对于采用高效液相色谱法测定杂质检出量,有以下几种办法:
外标法(也称杂质对照品法)
加校正因子的主成分自身对照法
不加校正因子的主成分自身对照法
面积归一化法
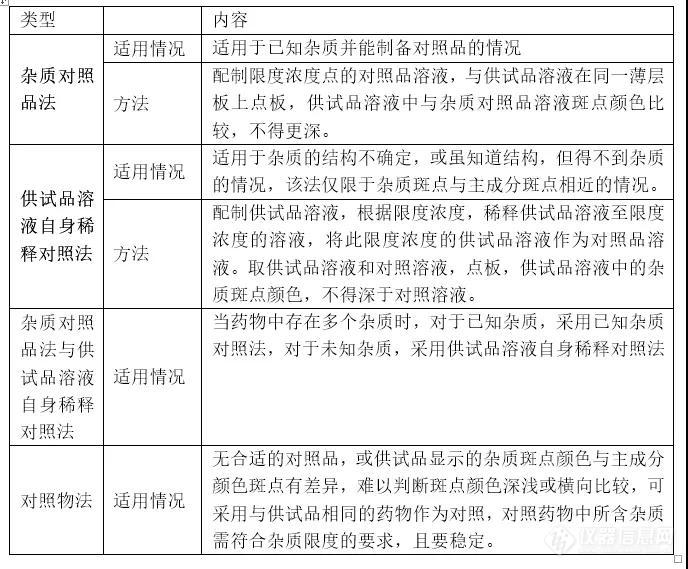
杂质对照品法;
供试品溶液自身稀释对照法;
杂质对照品法与供试品溶液自身稀释对照法;
对照物法。
[来源:药通社]
 18家认证机构检查结果公示
18家认证机构检查结果公示
2020.06.23

2021.08.11

2024.07.17

1835万!岳麓山实验室集聚区农科院片区A5栋实验室设施采购项目
2024.07.12

国家标准化管理委员会组织开展2024年强制性国家标准实施情况统计分析工作
2024.07.09

2024.07.07
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~