细菌内毒素检查法中凝胶法在药品中的正确使用方法
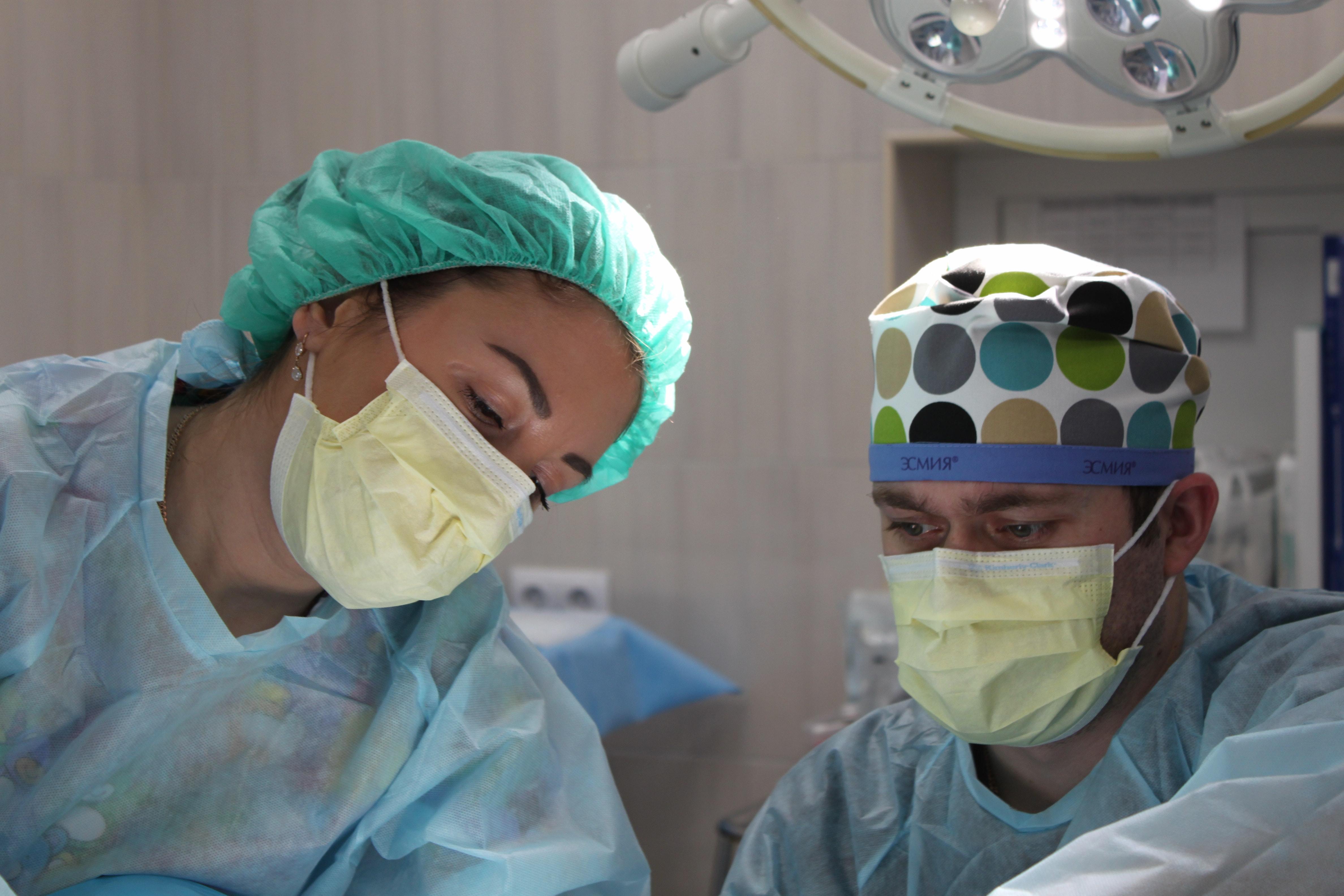
细菌内毒素作为外源性致热原的内毒素能激活中性粒细胞等,是革兰阴性菌细胞壁个层上的特有结构,会使中性粒细胞释放一种叫内源性热原质的物质,其在体温调节的中枢会引起发热反应。当内毒素经消化道进入人体不会产生危害,但内毒素经注射液等方式进入血液时则引起症状不同的疾病。因此,药品安全性检验一个重要项目就是药品注射剂中细菌内毒素检查。美国科学家Levin和Bang1968年建立鲎试验法来检查细菌内毒素,美国FDA于1973年制定的规则指出“鲎试剂是一种检测细菌内毒素的灵敏指示剂。” 1.鲎试剂的特性及与内毒素产生反应的作用机理 鲎试剂是细菌内毒素检查法中最重要的试剂。它是鲎科血细胞(变形细胞)裂解液的冻干产物。鲎的血液中只有一种类型的血细胞参与循环就是被称为变形细胞。目前制备细胞鲎试剂一种是东方鲎,另一种是美洲鲎。研究鲎试剂作用机理表明,细菌内毒素激活鲎试剂中鲎血细胞溶解物,产生一系列的凝集酶反应,形成凝固蛋白凝胶。判断供试品中细菌内毒素的限量能否在规定范围,可通过用鲎试剂检测,或者是量化革兰阴性菌所产生细菌内毒素。 2.细菌内毒素检查法 2.1内毒素标准品 细菌内毒素国家标准菌株由大肠杆菌提炼精制而成,是用来检查,校准,仲裁鲎试剂灵敏度、细菌内毒素浓度测定,干扰测试和测试方案中供试品阳性对照和阳性对照溶液的制备和光度测定方法的可靠性测试、凝胶检查鲎试剂试验敏感性。国家标准是细菌内毒素校准的参照标准,单位为内毒素(EU),1EU等于1国际单位内毒素(IU)。 2.2实验准备 玻璃器皿在酪酸洗液、其他热源性灭活剂、或清洗剂将充分浸泡,控干洗液后用蒸馏水3遍以上的冲洗,放入干燥箱,在250℃干烤30min以上,用以除掉可能性存在外源性内毒素干扰。如果用塑料的器具,如微孔板和与微量加样器配套的吸头等,应选用标明无内毒素并且对试验无干扰的器具。 无热原酶标板 2.3鲎试剂灵敏度复核 将细菌内毒素采样标准品与专门的检查水在涡流搅拌器中混合溶解15min,稀释后测定鲎试剂的灵敏度值(λc)。每一批新批次鲎试剂全部需严格采用灵敏度试验。 2.4实验方法 将8支鲎试剂分别加入细菌内毒素检查用0.1mL水溶解。按最大稀释倍数稀释的供试品溶液0.1mL加入2支,作为供试品溶液管,2支加入含内毒素浓度为2λ对照溶液为供试品阳性对照管,2支加入2λ内毒素工作标准品溶液0.1mL作为阳性对照管,2支加入细菌内毒素检查用水0.1mL作为阴性对照管。试管混匀封口置于37C±1℃恒温器中保温60分钟±2分钟,从恒温器中慢慢取出,极缓的倒转180°,若未形成凝胶,或者形成凝胶不坚实、变形体从管壁下滑脱落为阴性;管内出现凝胶并且凝胶不变形、如果不从管壁下滑脱落即为阳性。拿取或者保温试管时要避免振动,以免出现假阴性检测结果。 细菌内毒素工作标准品 2.5实验注意事项 准备工作:肥皂洗手,用75%乙醇棉球消毒。应在清洁环境中进行操作,取样时防止混入气体,并防止微生物污染移液管。
参数原理
2022.09.16
影响输液剂热原含量因素的探讨
输液剂在现代医学中是抢救病人和战备不可缺少的常用制剂。现在多数医院都是自制输液剂,由于条件不同,在配制过程中容易带入热原,使临床应用时出现热原反应,给患者带来痛苦。近年来由于净化和空调技术在医药方面的应用,输液剂中的热原反应有了一定程度的控制。但输液剂带入热原的因素复杂,而且在配制过程中不易检出。本文以预防为主的精神,从葡萄糖输液剂的配制到灭菌前的室温、时间限度和输液剂pH对热原含量的影响进行探索,以便找到在配制输液中可以防止带入热原的可行办法。 配制输液剂的室温、时间对热原量的影响,我们以葡萄糖为例做了如下试验:分别在室温18℃、28℃、38℃条件下,按常规配制三批10%葡萄糖液。在各配制的室温下分别放4、16小时,每批各取一组置115℃经30分钟灭菌。分别用家兔法按药典规定做热原试验,其结果如表1。 输液剂的pH对热原量的影响,我们以葡萄糖为例做了如下试验:常规下配制10%葡萄糖二批,其中一批用盐酸调节pH至3.8,另一批不加盐酸调节,pH为5.5。同样室温下放置4、8、6小时,经115℃30分钟灭菌。采用鲎试剂法做热原试验,结果如表2。 实验证明配制葡萄糖输液时,室温的升高、灭菌前配制时间的延长均会使热原量增加,但降低溶液的pH又可使热原量减少。我们认为配制输液剂的室温最好控制在18~20℃。配制时间最好在4小时内完成。至于输液的pH则要根据输液剂的性质和要求进行控制。在质量标准允许的pH范围内,尽量偏酸或偏碱一点为宜。但同时也要考虑到大量输液对体液酸碱平衡的影响和对血管的刺激。
参数原理
2022.09.15
医院输液制剂配制工艺中的热原控制
影响医院输液制剂批量生产的最大因素之一是输液制剂的热原控制。 热原是微生物的代谢产物,是微生物的一种内毒素。它是由蛋白质﹑磷脂、脂多糖所组成的复合物,其中脂多糖是内毒素的主要成分,具有很强的热原活性。大多数细菌都能产生热原,致热能力最强的是革兰阴性杆菌所产生的热原。霉菌甚至病毒也能产生热原。通常1ng内毒素足以引起健康成人产生发热反应[1]。含有热原的输液制剂输入人体,大约30min以后,会使人体发冷、寒战、体温升高、恶心呕吐等不良反应,有时体温可升高至40℃,严重的可出现昏迷、虚脱,甚至有生命危险。虽然已发现某些热原具有热不稳定性,但在通常注射剂灭菌的条件下,往往不足以破坏热原。 热原本身具有不挥发性,但在蒸馏时可随水蒸汽雾滴带入蒸馏水。因此在用多效蒸馏水器制备注射用水时,应严格控制蒸馏塔水位。热原体积微小,约在1~ 5nm之间,因此即使目前常用的微米级的微孔滤膜,也不能有效地机械截留。热原过滤[2]的模式有两种:吸附和机械模式。聚合态的热原常可以通过0.2μm 的细菌过滤器,只有少部分被过滤膜机械截留,一般我们把吸附模式的过滤器作为热原过滤的终端过滤。超滤也可用来去除溶液中的内毒素[2]。超滤膜是以截留物质的分子量的大小来划等级的,如果溶质分子的分子量与内毒素聚合体或其亚单元的分子量相近,那么就很难去除热原。如溶质分子量远小于热原的分子量,那么超滤的去热原的效果是很显著的。 活性炭为最常用的吸附剂。它对热原有较强的吸附能力,同时又有脱色助滤作用,因此在注射剂、输液的配制中广泛地使用注射用活性炭粉配合砂滤棒脱炭来去除热原。注射用活性炭粉具有吸附表面大,吸附能力强的优点。常用量为配制量的0.01%~ 0.5%。这种过滤属热原过滤的吸附模式。 吸附模式热原过滤的机制[4]可分为两种:①过滤膜带上正电荷(位)与带负电荷(位)的热原(内毒素)之间电动力学型的吸附,如荷电微孔滤膜法[5]。但一旦过滤膜上电荷(位)耗尽,吸附作用就终止,影响这种吸附作用的因素有溶液的pH值。②过滤介质表面上的化学基团和热原(内毒素)上的内脂体A这个化学部位起疏水性反应型的吸附。但过滤介质表面上的吸附基团一旦耗尽,吸附作用也将终止。物料pH值对吸附作用的影响并不显著,但物料中带负离子的组分会与热原(内毒素)争夺束缚基团。活性炭吸附热原的机制[4]属于疏水性反应型的吸附,热原能被强酸、强碱所破坏,也能被强氧化剂(高锰酸钾、过氧化氢)所钝化,但只适用于输液瓶、胶塞等包装容器、敷料的热原去除,超声波[5]也能破坏热原。 利用注射用活性炭吸附热原配合加压通过砂滤棒脱炭预滤30min,使活性炭在砂滤棒四周形成一层活性炭助滤层,使溶液完全通过活性炭助滤层过滤,从而使活性炭由混悬在溶液中的被动吸附热原转为活性炭助滤层的主动吸附热原。然后经0. 65μm微孔滤膜二级过滤后,灌封,115℃、30min热压灭菌。这种除热原的方法,操作简便,条件要求不高,费用低,效果确切。能满足医院输液制剂除热原的要求,提高输液制剂的质量和产量,适合医院输液制剂的批量生产。 参考文献:[1]焦炳华.分子内毒素学[ M].上海:上海科学技术文献出版社,1995:151.[2]夏正明.特殊过滤工艺的验证.上海医药,1997,(7):20.[3]苏建勇,龚承元,朱孟府等.荷电微孔滤膜去除细菌内毒素的试验研究.军事医学科学院院刊,1995,19(4):289.[4]孔祥文.活性炭吸附蛋白质溶液中的热原物质的研究.中国药学杂志,1999,34(6):407.[5]奚念朱.药剂学[M](第3版).上海:人民卫生出版社,1996:166.
新品
2022.09.14
细菌内毒素(脂多糖)的的纯化
脂多糖(Lipopoly saccharide,LPS)是革兰氏阴性细菌细胞壁中的一种成分,脂多糖对宿主是有毒性的。脂多糖只有当细菌死亡溶解或用人工方法破坏菌细胞后才释放出来,所以叫做内毒素。 三氯醋酸法(Trichloroacetic Acid,TCA)、酚水法、苯酚╱氯仿╱石油醚法(PCP)、DMSO法、高压超声处理法所提取的LPS或多或少受到蛋白质、核酸及多糖的污染,故需作一定的纯化。LPS的纯化方法目前最常用的为超速离心(4万转×4小时,共三次),在这一条件下,LPS可沉淀下去,而蛋白质、核酸及多糖则保留在上清液中,去除上清液即可得到较为纯化的LPS。 但是这一方法需时较长,且质量过关的超速离心机目前在国内亦不十分普及,故而难以推广应用。我们在实际工作中体会到,用任何方法提取的LPS,可再以PCP纯化一次(140ml/g LPS),然后只需一次超离,即可取得高度纯化的LPS。 提取的LPS除可被蛋白质、核酸及多糖污染外,还可被一些小分子物质,如多胺、阳离子(Ca++、Mg++、K+等)的污染。通过电透析可将这类小分子物质除去。此时形成的LPS为酸性LPS(由LPS中类脂A上的磷酸基团形成的)。应用碱中和LPS,可变成LPS的盐。如用NaOH中和则可变成LPS钠盐,而应用三乙基乙胺则可变成LPS三乙胺盐、后者极易溶解于水,已广泛地应用于生物学研究。 综上所述,LPS提取方法较多,应当根据菌种和实验条件而选用合适方法。PCP法对R型菌尤显长处,高压超声法虽可用于S或R菌,但方法步骤繁杂;DMSO法与TCA法已很少用到;而酚水法无论产量,纯度及物理性质均较满意的,不失为一个实用的方法。LPS纯化目前一般采用PCP法及一次超速离心,应用该法可使LPS污染物包括蛋白质、核酸及多糖除去,而应用片透析方法,则可除去LPS中的小分子物质如多胺、二价阳离子,从而可得LPS转化成实验需要的盐类。
参数原理
2022.09.13
细菌内毒素(脂多糖)的提取之PCP法、高压超声处理法及DMSO法的介绍
一、苯酚╱氯仿╱石油醚法(PCP) LPS分子镶嵌于胞壁的外膜中,用某些化学试剂将胞壁裂解(如酚)后,LPS分子从破溃的胞壁中游离出来。由于LPS是一种两性分子,故它们在不同溶剂中的溶解度,完全取决于该分子上的亲水/疏水性基团的多少。S-LPS有完整的亲水性О特异性侧链,所以S型LPS属亲水性分子。而R型LPS,缺乏O特异性侧链,含有完整或不完整的核心多糖和完整的类脂A,亲水度不大,而易溶于有机溶剂中,故而R-LPS用酚水法提取时所得的产量极低。 PCP法是以90%苯酚、氯仿及石油醚(40~60℃)以2:5:8所组成的单相混合提取液,这一提取方法只能将LPS及与之紧密结合的透道蛋白(Porin)提取出来,而其它成分则排除在提取液外。PCP法的水沉淀步骤仅能使LPS发生沉淀,而透道蛋白仍溶于苯酚中,故而PCP法所提取的LPS是一种较为纯化的制剂。 PCP法对制取R型细胞的LPS产量十分满意,且无核酸污染,蛋白质含量也仅在0.1~1 %间,该法温和,在室温5~20℃即可完成,制取周期较短,适用于从Ra至Re的细菌,可成功地提取R-LPS,产量也相当高。故PCP法是研究R-LPS的有用方法。应必须注意的是在PCP法中,每一步操作均不应使用盐类,如MgCl2、CaCl2,否则会严重影响产量。 二、高压超声处理法 以某些物理方法(如超声波)处理菌体细胞,使其完全破裂,可增加继后提取方法的完全性,从而可使LPS的产率增加。Richard1983研制了一种既可提取光滑型又可提取粗糙型LPS的新方法。该方法采用了高压处理(15000Ib/in2)细菌的方法,粉碎菌细胞,继又用超声波处理,促进碎片完全裂解,再以DNa s e,RNa s e处理,消化核酸。再加入蛋白酶去消化蛋白质,离心12000xg,浓缩干燥。如此制得的LPS,产量为菌体的51~81%(按测脂肪酸、庚糖和KDO值),蛋白质为0.1%、核酸1 %、脂类2~5%,纯度较高,产量比酚水法高7倍,比PCP法高2倍。 所得LPS经各种免疫化学分析,均提示用此方法提取的LPS其抗原结构完整。其不足之处是碱性条件上的加热,以前认为这一处理在于除掉蛋白质,特别是对于有些细菌(如绿脓杆菌)有用,但对别的细菌恐属多余。应当指出的一点是,碱性加热条件使类脂体A上的脂肪酸酯降解。另外一个不足之处是,此方法较为复杂,不易被一般实验室采用。 三、DMSO法 Adams介绍了一种较为简单的LPS提取方法。该法应用二甲亚砜(Dimethyl Sulfoxide,DMSO)作为主要提取试剂。以胞壁原料提制LPS。主要步骤为将预先制取的干燥胞壁以60℃DMSO提取水洗,酸化丙酮处理,冷冻干燥。DMSO法提取的LPS产量是酚水法的10倍,但蛋白质含量很高(45%) 。
参数原理
2022.09.09
细菌内毒素(脂多糖)提取法之三氯醋酸法及酚水法的介绍
内毒素系革兰氏阴性菌细胞壁外膜中的脂多糖(Lipopoly saccharide,LPS)成分。在维持外膜的结构、通透性以及临床阴性菌感染中均起着重要的作用。以化学方法提取的LPS注射动物能重复革兰氏阴性菌感染期间所出现的多种病理反应,故实验动物应用提取的LPS可更好地了解LPS的致病作用并寻找可能的防治对策。 一、三氯醋酸法(Trichloroacetic Acid,TCA) TCA法是Boivin等(1933)首先应用的,借助0.25N TCA,在4℃可将LPS从湿菌或经丙酮干燥的细菌中提取出来,加入2倍体积的冷乙醇即可取得LPS的沉淀物。用这种方法提取的产物,严格地讲是一种LPS-蛋自质复合物,这种复合物即方早期所称的Boivin抗原。TCA法提取的LPS产量较高,具有很好的抗原性,对O特异性侧链抗体有血清学特异反应,可结合补体和致敏红细胞,分子量达几百万,但蛋白质含量很高,故纯度较差。目前这一方法已较少使用。 二、酚水法 这一方法是Westphal等于1952年提出的,该法是目前应用最广泛的方法。酚水法主要用于S型细菌LPS的提取,亦可用于R突变型细菌LPS的提取,但产量稍低。酚水法提取液所含的苯酚与水的比例是45 : 55。当提取液加热至68℃并维持5分钟时,苯酚和水形成了一个单一的相,冷却至4℃后,形成了两个相,分别为苯酚相(被水饱和)和水相(被苯酚饱和)。核酸、多糖及LPS大部分溶解于水相中,而大部分蛋白质溶解于苯酚相中,不溶性物质沉淀在两相交界处。 含LPS的水相经吸取、透析〈去除苯酚)并干燥后即为LPS的粗制品。LPS粗制品经超离心1000000×g,可得到精制的LPS。精制后的LPS,尚含有多糖成分及与其共价结合的类脂体A成分、小量的肽(1~3 %)。这种提取物对人、兔的抗原较弱,但能展示O特异性侧链抗原反应。内毒素毒性较强,致敏红细胞不明显,能结合补体,分子量有几百万。产量仅1~4 %(占干菌重)。
参数原理
2022.09.08
鲎血淋巴参与的免疫应答
与其它无脊椎动物相类似,鲎也缺乏获得性免疫系统,但具有多种属于先天性免疫的防御系统。该防御系统一般也分为细胞免疫和体液免疫,主要包括血淋巴凝聚﹑酚氧化酶原激活、细胞凝集﹑释放抗菌物质产生抗菌反应、活性氧形成以及吞噬反应,共同构成鲎的先天性免疫系统。该系统可对潜在病原表面的抗原作出免疫应答。因此需要有对各种病原上结构稍有不同的多种类型的抗原表位具有足够特异性识别能力的生物传感器,同时该传感器也必须能够区别“自己”和“异己”的抗原表位。 在长期的生物演化历程中,鲎血细胞发展出了以丝氨酸蛋白酶原c因子和G因子为生物传感器的凝血系统。它们分别在革兰氏阴性细菌细胞壁主要成分LPS或真菌细胞壁主要组分(1→3) -β-D-葡聚糖的作用下发生自催化活化。即当细菌或真菌侵入血淋巴时,血细胞探测到其表面的LPS或(1→3) -β- D-葡聚糖,血细胞迅速进行胞吐作用,释放大、小颗粒内含物。C因子或G因子这两个生物传感器被相应激活物激活﹐启动凝血级联反应,最终使凝固蛋白原形成凝固蛋白凝胶。 这种受病原激发的凝血反应不仅对止血非常重要,对宿主防御也非常关键。同时,鲎血细胞也可通过释放主要储存在大颗粒中的各种凝集素来识别病原上的不同的糖链,引发血细胞凝集,将入侵病原固定下来。另外鲎血细胞可从各个方向伸出伪足,将入侵病原吞噬。这些被免疫化的外源入侵者最终均被由血细胞释放的tachyplesins、 tachycitin、tachystatins和 big defensin等抗菌物质以及血浆中的类似哺乳动物补体系统的CRPs和α2-巨球蛋白所杀灭,从而有效地防御外来病原的入侵。 无脊椎动物血淋巴研究虽已有一百多年的历史,但对其参与的免疫应答机制了解很少,也很不系统。唯一例外的是人们对鲎凝血系统及其先天性免疫系统的基础理论研究较为深入,而且以鲎凝血系统为基础建立的鲎试验法在细菌内毒素检测上应用非常广泛。另外从鲎血淋巴中分离的大量抗菌肽也是目前开发新型抗菌、抗病毒、抗肿瘤药物的研究热点。因此有关鲎血淋巴中的先天性免疫系统研究对当代免疫学研究及其应用具有重要意义。
参数原理
2022.09.07
鲎血淋巴的免疫应答因子之抗菌肽及其它防御分子的介绍
一、抗菌肽 抗菌肽是动植物体内组成性表达或诱导产生的天然免疫物质,是机体先天性免疫的重要组成部分。抗菌肽对病原微生物具有选择性毒性,杀菌快速,广谱抗菌且微生物不易产生抗性[2]。目前人们已从鲎血淋巴中分离得到多种抗菌肽。 1.tachyplesins 与 polyphemus tachyplesins与polyphemus(统称为鲎素)是存在于鲎血淋巴颗粒细胞的小颗粒中的一族小分子多肽,由17~18个氨基酸组成,相对分子质量约2.3ku。tachyplesinⅠ是Nakamura等于1988年从东方鲎血细胞酸性抽提物中分离得到的,随后的研究中又相继发现了tachyplesinⅡ、Ⅲ以及存在于美洲鲎中的 tachyplesins类似物polyphemus Ⅰ、Ⅱ。它们都是含C末端α-精氨酰胺的阳离子肽,具两亲性,有3个串联的四肽重复,并在相同的位置,以2个分子内二硫键形成独特的刚性稳固结构。tachyplesinⅠ、Ⅱ、Ⅲ及polyphemusⅠ、Ⅱ之间有很高的同源性和相似的抗菌、抗病毒作用,可强烈抑制革兰氏阴性菌、阳性菌和真菌的生长,对囊泡口炎病毒、流感病毒A、人艾滋病病毒HIV-1等病毒也有强烈的抑制作用。其抗菌特性与其它一些抗菌肽如蝎毒(magainins)相类似,可能与其引发膜通透泄漏有关[2,3]。因此,基于鲎素独特的抗菌、抗病毒特性,目前国内外正着手以鲎素为先导化合物开发新的抗菌、抗病毒、抗肿瘤药物[2,4]。 2.tachycitin tachycitin是 Kawabata等于1996年从鲎血细胞小颗粒中分离到的抗菌肽,对革兰氏阴性及阳性细菌的生长都有抑制作用。该抗菌肽由73个氨基酸组成,具几丁质结合活性,相对分子质量约为8.5ku,有5个分子内二硫键。tachycitin自身的抗菌作用并不强,但可协同增强 big defensin 的抗菌活性[1,5]。 3.tachystatins tachystatins是一族分离自鲎血细胞小颗粒中的抗菌肽,相对分子质量约6.5 ku,可分为A、B、C ,3种类型,均具有几丁质结合能力,对革兰氏阴性菌、阳性菌以及真菌的生长均有抑制作用,其中以tachystatin C的抗菌活性最强[1,6,7]。 4.抗LPS因子 抗LPS因子存在于大颗粒中,是1982年分离到的抗菌性蛋白,由128个氨基酸组成,分子质量约15ku,可通过结合LPS,特异性抑制LPS介导的C因子的激活,从而抑制凝血反应的激活,对革兰氏阴性细菌生长有抑制作用。 5.big defensin big defensin是Saito等于1995年从鲎血细胞大、小颗粒中分离到的抗菌肽,广泛存在于鲎的各种组织中,具有抗革兰氏阴性菌、阳性菌以及真菌的活性。big defensin由79个氨基酸组成,其C末端的37个氨基酸序列与哺乳动物嗜中性粒白细胞的防御素相似,N末端则有一个由35个氨基酸组成的疏水序列。这2个末端序列的抗菌活性有很大差异,前者具有更强的抗革兰氏阳性菌的活性,而后者则抗革兰氏阴性菌更为有效。研究表明,big defensin很可能是在微生物入侵的情况下,作为防御分子与抗LPS因子、tachyplesins一起被分泌到细胞外体液中起协同抗菌作用[1,8,9]。 二、其它防御分子 除以上免疫活性因子以外,还有许多其它防御分子参与了鲎先天性免疫应答反应和凝血反应,如α2-巨球蛋白、C反应蛋白(CRPs)、D因子、PAP、hemocyanin等[1]。 参考文献:Iwanaga S. The molecular basis of innate immunity in the horseshoe crab[J] . Curr Opin Immunol, 2002, 14(1):87 - 95.Matsuzaki K. Why and how are peptide - lipid interactions utilized for self - defense? Magainins and tachyplesins as archetypes[J] . Biochim Biophys Acta, 1999, 1 462(1 - 2):1 - 10.Matsuzaki K, Yoneyama S, Fujii N, et al . Membrane permeabilization mechanisms of a cyclic antimicrobial peptide tachyplesin I, and its linear analog[J] . Biochemistry , 1997, 36(32):9 799 - 9 806.Chen Y X, Xu X M, Hong S G, et al . RGD - tachyplesin inhibits tumor growth[J] . Cancer Res, 2001, 61(6):2 434 - 2 438.Suetake T, Tsuda S, Kawabata S, et al . Chitin - binding proteins in invertebrates and plants comprise a common chitin - binding structural motif[J] . J Biol Chem, 2000, 275(24):17 929 - 17 932.Osaki T, Omotezako M, Nagayama R, et al . Horseshoe crab hemoyte - derived antimicrobial polypeptides, tachystatins, with sequence similarity to spider neurotoxins [J] . J Biol Chem, 1999, 274(37):26 172 - 2 6178.Fujitani N, Kawabata S , Osaki T, et al . Structure of the antimicrobial peptide tachystatin A[J] . J Biol Chem, 2002, 277(26):23 651 - 23 657.Kawabata S, Saito T, Saeki K, et al . cDNA cloning , tissue distribution, and subcellular localization of horseshoe crab big defensin[J] . Biol Chem, 1997, 378( 3 - 4):289 - 292.Iwanaga S, Kawabata S, Muta T. New types of clotting factors and defense molecules found in horseshoe crab hemolymph:their structure and functions[J] . J Biochem, 1998, 123(1):1 - 15.
参数原理
2022.09.06
鲎血淋巴中的免疫应答因子之蛋白酶抑制剂和凝集素的介绍
鲎先天性免疫系统完全依赖于一套独特且非常有效的宿主防御系统和凝血系统。目前人们已从鲎血淋巴的血细胞和血浆中分离纯化了多种参与鲎凝血反应和宿主防御的免疫应答因子。今天主要讲解的是蛋白酶抑制剂和凝集素。 一、蛋白酶抑制剂(protease inhibitors) 鲎血细胞大颗粒中含抑制蛋白酶活性的物质,包括丝氨酸蛋白酶抑制因子(serpins)和半胱氨酸蛋白酶抑制因子(cystatin)。 1.丝氨酸蛋白酶抑制因子 目前已从东方鲎的血细胞中分离得到3种丝氨酸蛋白酶抑制因子:LICI1、LICI2和 LICI3,三者的同源性较高,与哺乳动物血浆的丝氨酸蛋白酶家族的结构、功能相近。LICI家族通过与丝氨酸蛋白酶形成1:1的复合物来抑制其活性。其中 LICI1特异抑制C因子,LICI2及LICI3则抑制C因子、G因子及凝固酶的活性,但LICI2对凝固酶的抑制作用较强,而 LICI3对G因子的抑制作用较强。由于凝血级联反应中活化的C、G因子以及凝固酶都是丝氨酸蛋白酶,因此LICI可能是作为凝血过程的调节因子,防止不必要的凝血。 2.半胱氨酸蛋白酶抑制因子 鲎半胱氨酸蛋白酶抑制因子是一由114个氨基酸组成的单链蛋白,相对分子量约为12.6 ku,可通过与半胱氨酸蛋白酶形成1:1非共价复合物而抑制其酶活性。cystatin可能通过影响胞内外的蛋白质及多肽的分解代谢,调节酶原、激素原的水解,抵御微生物侵入正常组织,对革兰氏阴性菌有强烈抑制作用。 二、凝集素(lectins) 除通过凝固因子C、G等来识别外来入侵病原外,鲎也可通过凝集素特异性地结合病原外露的糖链来识别入侵病原,从而引发相应的凝血反应或免疫反应。 目前人们已从鲎血淋巴中分离到大量的凝集素,如tachylectins、limunectin、limulin、 polyphemin、LCRP等,其中对tachylectins 的结构与功能研究的较为清楚。tachylectins是一种从鲎血细胞或血浆中分离到的凝集素,具有结合LPS及凝集细菌的特性。目前发现的tachylectins可分5种类型,分别简称为TL-1、TL-2、TL-3、TL-4、TL-5,前四种分布于血细胞内,TL-5分布于血浆中。除TL-1无凝血活性外,其它4种tachylectins均对人A型红细胞具有凝血作用,尤其是TL-5(又分为A和B两种亚型)可凝集人所有类型的红细胞,同时也是5种 tachylectins中细菌凝集活性最强的一种[1,2~4]。 参考文献:[1] Iwanaga S. The molecular basis of innate immunity in the horseshoe crab[J] . Curr Opin Immunol, 2002, 14( 1):87 - 95.[2] Gokudan S, Muta T, Tsuda R, et al . Horseshoe crabacetyl group - recognizing lectins involved in innate immunity are structurally related to fibrinogen[J] . Proc Natl Acad Sci USA, 1999, 96(18) :10 086 - 10 091.[3] Kawabata S, Iwanaga S. Role of lectins in the innateimmunity of horseshoe crab[J] . Develop Compara Immuno , 1999, 23( 4 - 5):391 - 400.[4] Kawabata S, Tsuda R. Molecular basis of non - self recognition by the horseshoe crab tachylectins[J] . Biochim Biophys Acta , 2002, 1 572:414 - 421.
参数原理
2022.09.05
鲎血淋巴中的免疫应答因子之凝固因子的介绍
鲎先天性免疫系统完全依赖于一套独特且非常有效的宿主防御系统和凝血系统。目前人们已从鲎血淋巴的血细胞和血浆中分离纯化了多种参与鲎凝血反应和宿主防御的免疫应答因子。今天主要讲解是的凝固因子。 一、凝固因子(coagulation factors) 鲎血淋巴进行快速凝血对宿主防御和止血均非常重要[1,2]。该凝血级联反应由4种凝固因子和1种凝固蛋白原(cogaulogen)组成。其中凝固因子包括C因子、G因子、B因子及前凝固酶(proclotting enzyme),这些因子都属于丝氨酸蛋白酶原家族。 1.C因子 C因子为糖蛋白,是鲎凝血反应中由细菌内毒素(LPS)激活的凝血级联反应的起始点。分子质量为123 ku,由轻、重二链通过二硫键组成,其重链N端可以与LPS特异结合,而轻链C端有催化活性。在 LPS作用下C因子被活化,活化的c因子有酰氨化酶活性,可激活B因子。B因子进一步将前凝固酶活化为凝固酶。这一丝氨酸蛋白酶的级联活化最后使凝固蛋白原转化为凝固蛋白凝胶。 基于该原理利用鲎血细胞崩解物制成的鲎试剂,已被广泛应用于LPS检测。这种细菌内毒素检测方法即“鲎试验法”,自1968年提出后,已被陆续纳入各国药典[3]。 2.B因子 B因子是C因子的靶因子,分子质量约64 ku,在活化的C因子的激活下﹐B因子可将前凝固酶活化为凝固酶。 3.G因子 G因子是鲎凝血反应的另一起始点,是一种特殊的丝氨酸蛋白酶原,为异二聚体,可被真菌细胞壁组分(1→3)-β- D-葡聚糖特异性激活[4]。 4.前凝固酶 前凝固酶分子质量约38 ku,由346个氨基酸组成。可被活化的B因子或C因子激活为凝固酶,凝固酶可进一步活化凝固蛋白原,形成不可溶的凝固蛋白凝胶。 5.凝固蛋白原(coagulogens) 目前已从美洲鲎、中国鲎及2种东南亚鲎体内获得4种凝固蛋白原。凝固蛋白原是鲎凝血系统的核心,是凝血级联反应的的靶蛋白,与脊椎动物的纤维蛋白原功能相似,但不同的是凝固蛋白原是在血细胞的大颗粒内而不存在于血浆中。凝固蛋白原是碱性多肽链,由3个片段(A、B、C)组成。在凝胶化过程中,C肽被释放出来,最终形成的凝固蛋白凝胶分子由A、B二条链以二硫键连接而成。 参考文献:1.Muta T, Iwanaga S . The role of hemolymph coagulation in innate immunity[J].Curr Opin Immuno, 1996, 8:41-47.2.Muta T, Iwanaga S. Clotting and immune defense in Limulidae[J] . Prog Mol Subcell Biol, 1996, 15:154-189.3.Ding J L, Ho B. A new era in pyrogen testing[J] . Trends Biotech, 2001, 19(8):277-281.4.Takaki Y, Seki N, Kawabata S S, et al . Duplicated binding sites for ( 1→3)-beta-D-glucan in the hor-seshoe crab coagulation factor G implications for a molecular basis of the pattern recognition in innate immunity[J] . J Biol Chem, 2002, 277(16):14 281-14 287.
企业动态
2022.09.02
鲎血淋巴中免疫应答细胞的介绍
鲎(horseshoe crab)是一种生活在海洋中的大型底栖节肢动物,从早古生代的奥陶纪出现至今已有4亿多年的历史,是动物界具有独特进化地位的“活化石”之一。鲎隶属于节肢动物门(Arthropoda)、有螯肢亚门(Chelicerata)、肢口纲(Merostomata)、剑尾目(Xiphosurida)、鲎科(Limuroidea)。现存的鲎种类很少,仅存2亚科3属4种,这4种鲎分别为美洲鲎(Limulus polyphemus)、东方鲎(Tachypleus tridentatus ,又称中国鲎或日本鲎)、南方鲎(Tachypleus gigas)和圆尾鲎(Carcinoscorpius rotundicauda),其地理分布也较为狭隘,仅限于北美与东亚及东南亚一带。除具有动物“活化石”称号外,鲎又冠有“无脊椎动物献血冠军”的美誉,其体内拥有大量的血淋巴。一只成年鲎可制备100 ~ 300 mL血,血淋巴采集也较为便利,而且鲎的凝血系统与哺乳动物的非常相似,因此鲎是无脊椎动物血液学研究的绝好材料,也是目前鲎资源开发利用和鲎试剂研制的主要原材料,一直受到日、美等国学者的高度重视[1]。 近年来,随着对鲎血淋巴的免疫功能研究及其与其它无脊椎动物血淋巴的免疫学比较研究,尤其是从鲎血淋巴中分离出许多具有抗菌、抗病毒的活性物质,鲎血淋巴研究已成为当前无脊椎动物免疫学研究的重要热点领域。 鲎血淋巴中的免疫应答细胞 鲎血淋巴内含免疫应答细胞和许多免疫活性物质,是鲎抵御入侵病原的先天性免疫系统。鲎血淋巴呈蓝色,由血浆和血细胞组成。血浆内含有以可溶形式存在的起呼吸作用的血蓝蛋白,该蛋白占整个血浆蛋白总量的90% ~95%。 鲎血细胞一般可分为无颗粒细胞和颗粒细胞。无颗粒细胞又称蓝细胞,仅占血细胞总数的1%左右,可合成并分泌血蓝蛋白;颗粒细胞又称变形细胞或阿米巴样细胞,呈卵圆形板层状结构,最大直径可达 15~20 μm,占血细胞总数的99%以上,内含大、小两种分泌性颗粒,大颗粒直径约1.5μm,小颗粒直径约0.6μm。鲎血细胞大小颗粒内含有许多免疫活性物质。 目前人们已从大、小颗粒内分离到40多种蛋白组分,其中大颗粒含有与凝血有关的凝固因子、凝固蛋白原、蛋白酶抑制剂、凝集素以及少量抗菌性组分如 tachplectins 等;小颗粒则含有大量的抗菌活性物质以及一些具有凝集细菌作用的组分,这些组分是一类富含半胱氨酸的碱性蛋白,即抗菌肽,如tachyplesins、tachycitin、tachystatins等;big defensin则为大、小颗粒所共有。颗粒细胞既无粘附性,也不具备运动能力,但当鲎在外渗作用或外伤情况下,颗粒细胞被激活,从而导致细胞获得粘附性,并通过胞吐作用释放颗粒,同时伸出伪足从而具有运动能力。 因此当外来病原侵入鲎血液时,血细胞通过胞吐作用将大、小颗粒释放出来,在大、小颗粒及血浆中的各种抗菌活性物质的协同作用下,杀死外来病原,构成一个有效的防御系统[1-2]。 参考文献:[1] Sekiguchi K, Yamamichi Y, Seshimo H, et al . Biology of Horseshoe Crabs[M] . Tokyo Science House , 1988.[2] Iwanaga S, Kawabata S. Evolution and phylogeny of defense molecules associated with innate immunity in horseshoe crab [J] . Front Biosci, 1998, 3:973-984.
企业动态
2022.09.01
鲎试验法中鲎试剂及内毒素的标化问题
一、鲎试剂的标化问题鲎试剂为鲎变形细胞的细胞溶解物,制备时可采用裂解法和机械方法使细胞破裂。鲎试剂的敏感性可受到动物个体差异、季节差异及生产工艺过程中不稳定因素的影响。因此各批次间,其敏感性差异很大。即使是同一批试剂,由于操作、保存方法、环境因素等影响,其敏感性亦不一样。鲎试剂在液态时极不稳定,往往很难保存。贮存于4 ℃冰箱,其活性一般于4~5月开始下降,8个月左右完全失活。冷冻保存的稳定性稍高于液态保存。`真空冻干粉剂保存为目前最好的方法,- 30℃保存其有效期可达2年。改善生产工艺,控制制剂中的参数,可使试剂的敏感性和稳定性增高。国内丁友玲等报道,鲎试剂含水量控制在5%以下,总蛋白量控制在5mg/ml以上,Ca++、Mg++控制在0.01~0.1M,可使鲎试验的稳定性提高,重演性增强。试验前,应以WHO标准内毒素作标定,如试剂敏感性为1ng/ml或小于1ng /ml,则认为是敏感的,可以应用。美国制备了参考鲎试剂,各种鲎试剂在应用前与其比较,可获得相对效力。除应解决好鲎试剂的标化问题外,对鲎试剂的操作程序亦应标化,因为操作上微小的差异即可使试剂的敏感性改变。二、内毒素的标化问题从各种细菌制备的内毒素,或以同一种细菌制备的内毒素,或内毒素批次间、批次内,其活性均可不一致。所以应用LT法(鲎试验法,Limulus test)检测内毒素时,需要一个标准的内毒素作为对照参比。大肠杆菌内毒素在各种细菌内毒素的LT反应上处于中值的位置(图4),且其稳定、可溶,因此将大肠杆菌内毒素作为参考标准内毒素(Reference Standar d En-dotoxin,RSE)是较为适宜的。根据以上理由及原则,美国FDA下属的生物制品管理局(BOB)组织了大规模的研究。制备了一系列标准参考内毒素(表4)。分别命名为16、EC、EC-1,EC-2………,EC-5。其中EC-2是以大肠杆菌O111B4。(Braude株)提取的,各项指标均为满意。日本从大肠杆菌UKTB中提取了内毒素,作为日本的标准参考内毒素,采用酚水抽提法,然后再用乙醇沉淀。化学分析、热原性及鲎试剂激活性完全符合RSE的标准。且其在干燥状态下稳定性极好,可长期应用,但如溶于水,则稳定性可下降。最近美国药品部门已向WHO提供了一批新的RSE,供国际上检测时作为参比用,这使世界上LT试验结果容易统一。实际上WHO对此早就组织了合作研究,包括多种鲎试剂及内毒素。从理论上讲,一种RSE需满足下述条件:①干燥制剂;②在性质是可用的;③在室温下稳定;④吸湿性少;⑤易溶于水;⑥在水及生理盐水中清澈;⑦可致家兔及人反应;⑧须从常见的菌株提取。但目前所有RSE均不完全符合上述条件,因此,有关内毒素的标化问题仍须进行深入的研究。具体检测时,各实验室可采用对照标准内毒素(Control Standard Endotoxin,CSE),但其效能必须先以RSE进行标定。CSE效能的计算公式为:CSE效能=GM比值×E Eu/μg其中GM比值为算术平均值,E为RSE的效能,常为6000Eu/管,CSE与 RSE作平行的LT试验,试管数N应大于16,然后算出CSE与RSE相应的比值R1,R2,……RN,将这些比值换算成以10为底的对数值,然后计算平均和标准的SD,平均SD的反对数即为GM比值。1981年9月美国、日本、英国、西德、瑞典、意大利六国学者及监定部门的代表在美国Woods Hole 海洋学院召开了用于注射用品的鲎试剂和内毒素标准的国际会议,会上Difco实验室的Fleishman报告了“自多种革兰氏阴性菌内毒素的LT法检测热原的比较”一文,提出了被检内毒素相对活力的概念,即与参考标准内毒素(EC-2)比较后的相对活力,计算公式如下图:其中5 Eu/ng是FDA标准内毒素EC-2的指定活力。
应用实例
2022.08.31
鲎试验法中药物与医疗器械的热原允许含量问题
尽管鲎试验应用于许多领域的内毒素检测,确实取得了许多成绩,解决了不少实际问题。但仍存在不少问题,本文主要讲解药物与医疗器械的热原允许含量问题。 由于很小剂量的内毒素即能引起机体产生一系列生物效应及病理效应,而许多药物(包括大输液、静脉注射剂、口服药物、放射性同位素、各类生物制剂),在其原料、制备过程及制备后的各个环节,或多或少地受到内毒素污染。各类医疗器械由于消毒不严格(内毒素需120℃4小时才能完全破坏)亦可受到内毒素的污染。所以检测药物及医疗器械内毒素的含量,以便有效地采取控制内毒素的含量的措施,使显得具有重要的实际意义。对此问题尽管国内外组织了许多人力物力进行研究,并提出了许多有参考价值的意见,但国内外许多专家、厂家对此仍有甚多不同的意见。 1.药物方面 药物内毒素的允许含量是多少?其根据是什么?目前对此问题仍未有一个满意的回答。以人类内毒素允许接受限量作为药物内毒素允许含量的参考较为适宜。而发热为机体对内毒素反应最为敏感的现象之一,且发热亦最易判断,因此可将药物发热的阈值剂量作为内毒素允许含量的上限。 早在1961年Keene等即观察到30ng /kg从衰败沙雷氏菌提纯的内毒素为引起人发热的阚值点,所以对此种内毒素,阈值剂量即为30ng/kg,人类应用30ng/kg以下是安全的。 1980年1月18日美国食品药物管理局起草了“鲎试验法定作为人、兽用药及医疗器械终产品试验准则”,并规定对于大多数药物(不包括大输液及鞘内注射剂),以重量/公斤(人体重)计算,如产品内毒素含量≤0.5ng/kg,则此产品可以允许出厂,但是没有明确的数据支持此规定。为此Pearson等应用流产沙门氏菌、福氏痢疾杆菌、衰败沙雷氏菌、绿脓菌、克氏杆菌等的内毒素测定了其对于家兔的阈值剂量值。事实上,家兔与人体内毒素的反应较为一致,家兔比人对内毒素更为敏感,因此试验结果是确实,而可应用于人。这些细菌对内毒素的阈值剂量值分别为:流产沙门氏菌内毒素:稍大于1.0ng/kg;福氏痢疾杆菌内毒素:2.0ng/kg;衰败沙雷氏菌内毒素:15ng/kg;绿脓杆菌内毒素:370ng/kg;参考标准内毒为1.43ng/kg。从这些结果来看,细菌内毒素的阈值剂量均为1.0ng/kg以上。 在1977~1979年间,上述作者检查了530371份制备过程中的半成品及终产品的内毒素含量,内毒素为0.05~0.2ng/ml的有489份,>0.2ng/ ml有70份。在内毒素含量为0.05~0.2ng/ml的489份标本中,仅有13例家兔热原试验法为(+),占3 %,内毒素含量>0.2ng/ml的70份标本中,仅8份家兔热原试验法为(+),占11%。因此,对于大多数药物(不包括大输液和鞘内注射液),1ng/ml为人可接受的内毒素上限值,以0.1ng/ml作为这些药物内毒素的允许含量有较高的保险系数〈安全系数为10)。 1980年对17家国际药厂生产的药品应用家兔热原试验及鲎试验法进行了研究,以考察大输液内毒某的允许含量。67份内毒素含量为50~200pg/ml的检品鲎试验法均为(-),家兔热原试验法(-)的有66份,占98.5%;家兔热原试验法(+)者1份,仅占1.5 %;18份内毒素含量>200pg/ml的检品,17份家兔热原试验法(-),占94%;家兔热原试验法(+)者仅1份,占69%。因此内毒素含量、鲎试验法及家兔热原试验法三者间在内毒素<200pg/ml时有平行的关系,因而将100pg/ml(相当于1.0ng/kg)作为静脉大输液内毒素的允许含量是安全的。 2.医疗器械内毒素的允许含量 BMD于1977年11月4日明确指出,鲎试验法应作为医疗器械内毒素检测的试定方法。此后,HIMA (Health Industry minufactures Association,保健工业工厂联合会)组织了一个合作研究,由生物制品管理局(BOB)下属的生物测试分局及几个工厂的试验室参加。研究结果推荐0.1ng/ml(10ml/k g)作为医疗器械内毒素的允许含量。对于接触脑脊液的医疗器械,内毒素的允许含量为0.04ng/ml,因内毒素进入脑脊液中容易引起毒性反应。
企业动态
2022.08.29
脑脊液中内毒素的检测
细菌性脑膜炎为一种十分凶险的疾病,其发展迅速,死亡率高,目前尚缺乏快速、敏感、可靠的诊断方法。 Siegel等综合了7位作者的研究结果,发现在培养到阴性菌的237例阴性菌脑膜炎中,有225例经过鲎试验法检测为阳性,阳性率为95%,两者基本一致,故鲎试验法可用于阴性菌脑膜炎的快速诊断。脑脊液中不存在鲎试验法反应的抑制物质,故标本不必经处理。脑脊液中的内毒素相对不稳定,不被网状内皮系统迅速清除,而循环中的内毒素亦不能通过血脑屏障而入脑脊液。另外,脑脊液经鲎试验法检测的阳性率一般不受事先应用抗生素治疗的影响。 试验时常以无菌方法采集脑脊液0.5ml,立即测定。一般不需处理,如脑脊液有血液污染,白细胞过高或蛋白成分过多,则可先离心沉淀取其上清进行测定。 总之,测定血液、尿液、脑脊液中的内毒素有利于有关革兰氏阴性菌感染性疾病的诊断及予后判断。但其亦有下列缺点: ①不能协助诊断阳性菌感染性疾病,且有些霉菌亦可使鲎试验法检测(+)﹔ ②不能确定感染性疾病由何种阴性菌引起; ③不能识别混合感染。 免责声明:本文节选自:《内毒素的检测与鲎实验(三)》,文章作者:余庆。如有侵权,请联系删除,谢谢!
企业动态
2022.08.26
应用鲎试验法对尿液进行内毒素检测
尿定量细菌培养为常规的尿路感染检测方法,一般细菌数≥105/ml尿则可确定尿路感染的诊断。此法较为可靠,并可直接移种细菌进行药敏的测定,以指导临床正确应用抗生素。但此法费时,常需24~48小时才能出结果。尿液鲎试验法检测内毒素快速、方便,有利于尿路感染的快速诊出。 在临床实践中观察到,尿液鲎试验法(+)与尿液革兰氏阴性菌培养阳性是基本一致的,尿培养到阴性菌。测尿液的鲎试验法99%呈(+),两者显示高度的相关性。故证明鲎试验法用于尿路阴性菌感染更具价值,一般认为尿标本经1:100稀释与敏感度为1ng/ ml的鲎试剂呈阳性反应者,可代表每ml尿中含有的细菌数为105。 尿液内毒素测定时,一般取清洁中段尿或经导尿取得尿标本,并在试验前以无菌无热原生理盐水作适当的稀释。一般尿液中不存在内毒素抑制物质。
企业动态
2022.08.25
应用鲎试验法对尿液进行内毒素检测
尿定量细菌培养为常规的尿路感染检测方法,一般细菌数≥105/ml尿则可确定尿路感染的诊断。此法较为可靠,并可直接移种细菌进行药敏的测定,以指导临床正确应用抗生素。但此法费时,常需24~48小时才能出结果。尿液鲎试验法检测内毒素快速、方便,有利于尿路感染的快速诊出。 在临床实践中观察到,尿液鲎试验法(+)与尿液革兰氏阴性菌培养阳性是基本一致的,尿培养到阴性菌。测尿液的鲎试验法99%呈(+),两者显示高度的相关性。故证明鲎试验法用于尿路阴性菌感染更具价值,一般认为尿标本经1:100稀释与敏感度为1ng/ ml的鲎试剂呈阳性反应者,可代表每ml尿中含有的细菌数为105。 尿液内毒素测定时,一般取清洁中段尿或经导尿取得尿标本,并在试验前以无菌无热原生理盐水作适当的稀释。一般尿液中不存在内毒素抑制物质。
企业动态
2022.08.25
血液中内毒素的检测
检测血液中的内毒素,有助于临床上细菌感染性疾病(如革兰氏阴性菌菌血症、败血症、内毒素休克、革兰氏阴性菌尿路感染及革兰氏阴性菌脑膜炎等)的诊断。 正常健康人血液中是不含内毒素的,但亦偶具有些无菌性内毒素血症病人,其血液中可有少量的内毒素存在。此种情况如网状内皮细胞系统功能障碍、肠道粘膜屏障损伤、局部阴性菌感染、污染大量内毒素的注射用品、输液及输血等均可引起。 测定血液中的内毒素,为快速诊断阴性菌菌血症、败血症、脓毒症及内毒素休克的有用辅助方法。通常的血液细菌培养法,大多需24~48小时才能出结果,所以达不到快速的要求,而应用鲎试验法检测内毒素,则一般只需1~2小时即可。大多数革兰氏阴性菌感染病人,尤其是菌血症、败血症、脓毒症、内毒素休克的病人,鲎试验法多为(+),且此反应的阳性率与血液内细菌数有密切关系。一般血液内细菌数>1000个/ml即可使鲎试验法呈(+)。因此鲎试验法诊断此类疾病有较大的价值,特别是对于内毒素休克病人。 一般来讲,革兰氏阴性菌菌血症及败血症约有40%可并发内毒素休克。内毒素休克是一种特殊类型的休克,其致死性极高,死亡率可达25~50%,有的作者报告还要高。此种类型的休克,从休克过程中的可逆阶段到不可逆阶段的转变时间极短,一般仅数秒到数分钟,因此往往来不及进行及时正确的诊断及有效而确实的治疗。鲎试验法测定血液中的内毒素,则可预示内毒素休克的发生,在临床上有重要的实际意义。 在进行血液内毒素检测时,往往由于血浆内存在内毒素抑制物质而致鲎试验法敏感性降低。因此常要在测定前除去这些抑制物质。
企业动态
2022.08.24
医疗器械和设备的内毒素检测
FDA于1975年已批准用鲎试验法代替美国药典的家兔热原试验法用于医疗器械及设备的内毒素检测。FDA下属的医疗器械管理局于1977年11月4日发表的《联邦文件档》(Federal Register)的注释中明确规定厂方只有应用鲎试验法检测医疗器械的内毒素,其产品才能出厂。并且这种LT法必须被BMD所承认。 具体检测方法为:每10个注射器、输液导管、塑料管及其它外科用手术器械以20~40ml无热原生理盐水充分灌洗和浸泡,总量200~400ml。取此液进行内毒素的测定。规定医疗器械的内毒素含量不得超过0.1ng/ml,接触脑脊液的器械的内毒素含量不得超过0.04ng/ml,并应作抑制/增强试验。 BMD于1981年5月规定对168种器械须作内毒素检测,包括胃肠道、尿道及普外手术器械73种、心血管手术器械61种、神经手术器械23种、妇产科及放射科器械6种、整形器械4种、眼、耳鼻喉及口腔器械1种。 医疗器械内毒素的测定,可减少医疗过程中外源内毒素的污染。
企业动态
2022.08.23
喜讯丨科德角国际实验室荣获中检院&国实院检验检测机构资质认定及实验室认可内审员证书
为了进一步加强科德角国际实验室质量控制管理能力,保障细菌内毒素检测工作的有效性,2022年7月18日—31日,科德角国际生物医学科技(北京)有限公司技术团队代表参加由中国食品药品检定研究院和北京国实检测技术研究院联合举办检验检测机构资质认定/实验室认可内审员能力提升网络培训,并一次性通过考试获得证书。 内审员资格证书 中国食品药品检定研究院培训证书 此次培训旨在指导检验检测机构/实验室有效策划与实施内部审核和管理评审,完善和改进管理体系。培训内容围绕《检验检测机构资质认定管理办法》和《检验检测机构监督管理办法》,从内审员职责、内部审核方法、编写规范等多方面内容展开。 经过13天的网络培训,科德角国际对实验室认可的核心要求有了更深刻的理解和把握。此次培训不仅有效提升了科德角国际实验室的内部审核能力和整体水平,也为我司实验室在细菌内毒素检测领域的发展打下了坚实的基础。 策划丨科德角国际·市场部编辑丨Carrie·Tse校对丨Zoe,Feng·He
企业动态
2022.08.22
鲎试验法应用于食品卫生的监测
1.肉类制品 肉类制品的腐败菌主要为革兰氏阴性菌,尤以假单胞菌为多。在潮湿高气温中,变形杆菌在肉品表面繁殖迅速而使肉品变质。其它的革兰氏阴性菌如大肠杆菌、副溶血弧菌亦能在肉制品中生长。因此这些食品中均含有一定量的内毒素。应用鲎试验法不仅能检出食品中内毒素的含量,亦能间接地反映肉制品被细菌污染的程度。 测定时取一定数量的肉类制品,去脂肪,打碎离心沉淀,然后上清液作内毒素测定。用此种方法,可检出0.1ng的内毒素,鲎试验法可作为食品卫生质量的一个指标。Jay提议鲜牛肉经1000倍稀释后而鲎试验法为(-)者,则说明食品的细菌学质量优秀。 2.蛋、蛋制品 蛋的败坏变质亦主要由革兰氏阴性菌引起,故变质的蛋及蛋制品中含有较高的内毒素,曾有报道说变质的咸鸭蛋及皮蛋中常含有大量的内毒素。应用鲎试验法可选择出这些含量高的蛋。 3.牛奶、饮料 1976年Hartman首先报道鲎试验法可测出革兰氏阴性菌引起的牛乳腺炎的乳汁中的内毒素。以后 Diluzio在奥尔良市牛奶标本中亦发现有内毒素,含量约为30~130μg/ml。牛奶放置室温24小时,随着细菌的增殖内毒素含量亦相应地增高,一般可升高16倍。 一般市售的啤酒、饮料及酒,鲎试验法均为(-)。但有些饮料是经细菌发酵后制得的,因此这些饮料应常规地应用鲎试验法进行内毒素的检测。
企业动态
2022.08.19
应用鲎试验法检测水环境中的内毒素含量
目前水质卫生的细菌学指标均以大肠菌数指数、大肠菌数值作为主要标准,这些方法虽然所用原料简单,操作方便,但每份标本的检查需24小时或48小时才能得出结果,而采用鲎试验法检查水中细菌的污染情况,采样后只需2小时即能出结果。 据国外资料报道,水中总内毒素浓度(尤其是结合内毒素浓度)与细菌菌落数之间存在明显的正比关系。如以细菌菌落对总内毒素或结合内毒素的对数转换值作一回归曲线,则可显示出两者的高度相关性,因此检测水中的内毒素量可了解水中细菌污染的情况。 鲎试验法可检出每ml低达100个革兰氏阴性菌,因而是极为敏感的方法。此外,鲎试验法尚能检出管道水中的另一些细菌,如嗜铁细菌、硫酸盐还原菌以及许多鞘膜细菌(Sheathed bacteria)等。这些细菌虽属非病原菌,但能引起腐败及令人讨厌的怪味,因而亦有一定的公共卫生意义。 Diluzio曾从8个城市采集的18个饮水标本中测得16个标本含有内毒素,其中个别自来水水中内毒素可达800μg/ml。还发现从密西西比湖中作为自来水源采取的标本中,内毒素含量约为400μg/ml,而经过处理后的门来水含内毒素约为1μg/ml,这说明在饮用水的纯化过程的内毒素的含量亦相应减少,但目前尚不知纯化过程中哪一阶段能起到这一作用。从两口井所采集的水样,其中一口为阴性,另一口为阳性,可能与井的深度有关。推测深井水土壤的过滤有去除内毒素的作用。 一般水源不需稀释即可进行鲎试验,污染严重的水源,可先离心沉淀后取其上清液进行测定。
企业动态
2022.08.18
利用鲎试验法检测生物制剂的内毒素含量
生物制剂:包括菌苗、疫苗、各种血液制品以及其他生物制剂如干扰素、转移因子、胸腺素等。 1.菌苗 在菌苗的制备过程中,特别是革兰氏阴性菌菌苗,或多或少地受到内毒素的污染。因此采用敏感、特异并可定量的LT法(鲎试验法,Limulus test),对生产技术加以改进,可使菌苗提纯到满意的水平,反应率亦大大降低,说明LT法是检定菌苗毒性的适宜方法。 Kreeftenberg曾对不同方法制备的伤寒菌苗的内毒素含量和接种反应的大小进行了比较。结果发现丙酮菌苗引起的反应一般比苯酚菌苗小些,其内毒素含量少些。荷兰卫生部门用LT法检查多糖体菌苗的内毒素含量,发现在内毒素含量最高的菌苗(14000ng内毒素/100μg)其发热反应率亦最高,肛温超过38.5℃者可达1.8~1.9%;但含内毒素最低(600ng/100μg)的菌苗,其反应较低(0.5%);另有一批菌苗内毒素含量<3ng/100μg,其反应率仅0.3%。 2.疫苗 LT法亦已成功地应用于流感疫苗的质量控制,以估计流感疫苗中内毒素的含量。Cooper从美国6家厂生产的26批流感疫苗检测结果,发现批间的内毒素含量差异极大,一般达μg/ml 水平。故FDA特制一批标准疫苗供安全试验参比用。要求凡新生产供人群免疫用的A/swine株流感疫苗内毒素的含量不得超过6ng/ ml,从而提高了该疫苗的质量。 3.血液制剂 由于血浆或血清制品有内毒素抑制蛋白,故用LT法检测血浆制品前需将标本事先进行处理。LT法应用于血液制品的质量控制,可有效地杜绝制品中可能的内毒性污染,以保证其安全性。 4.其他生物制剂如干扰素(IFN)等 常用的IFN制剂系由淋巴细胞在体外经诱导剂刺激后产生的一种醣蛋白。近年来的研究发现,IFN在许多方面有内毒素一样的作用,如引起发热,中性粒细胞数量和功能的变化,刺激单核巨噬细胞的活性,增强细胞毒性及溶细胞活性,刺激B淋巴细胞,抑制T淋巴细胞等等。因此有人认为此是由于在IFN的制备中受到了内毒素的污染所致。故应用LT法检测IFN中的内毒素,控制其含量,可能具有一定的降低IFN副反应的作用。
新品
2022.08.17
应用鲎试验法检测药物的内毒素含量
药物作为终产物进行内毒素LT法检测是极为适宜的。 美国FDA已将LT法作为法定的药物内毒素的检测方法。检测时,应用的鲎试剂其敏感性不得低于0.2EU/mL。并应考虑药物中内毒素的耐受限量(Tolerance limit,其值等于每mg或每ml产物中内毒素的允许量)。 如果一种药品未曾通过LT法(鲎试验法,Limulus test),但却通过了RT法(家兔热原试验,Rabbit pyrogen test),则这种药物亦不能出厂,除非此种RT法由官方进行。有一些药物,特别是已知有抑制或增强LT反应的药物必须作抑制/增强试验。 应用LT法检测抗生素中内毒素的含量是很适宜的。大多数常用的抗生素如林可霉素、氯霉素、庆大霉素、双氢链霉素、乳酸盐红霉素等并不抑制LT反应,故可直接进行测定。但亦有一些抗生素溶液能抑制LT反应,故必须进行抑制试验。可用足量的无热原水进行稀释,直至用该抗生素不能抑制LT凝胶作用的最高浓度进行试验,所以采用的鲎试剂的敏感度必须等于或超过药典规定的热原试验的敏感度。 这些能抑制LT反应的药物中最典型的是青霉素类药物,其抑制机理目前尚不清楚。有人认为青霉素的抑制作用是因其对细菌细胞壁所含的酶起作用之故;另有人认为青霉素对LT凝胶形成的抑制作用与它们的血清蛋白结合率有显著的相关、(p)。如BRL1071青霉素的血清蛋白结合率最高,它对LT反应的抑制作用亦最强,1.5mmol即能起抑制作用。盐酸四环素对LT反应亦有抑制作用,其抑制机理是由于抗生素溶液pH过低(≈4)的缘故。 用LT法测定抗生素中内毒素含量比RT法敏感10~100倍。 肿瘤化学疗剂的副反应较多,有些与应用内毒素后相似。因此其不良反应可能是由于内毒素的污染所致。左旋门冬酰胺酶是由大肠杆菌或欧氏(Erwinia)植病杆菌制备的,由大肠杆菌制备的门冬酰胺酶每1000单位含内毒素超过1ng,由欧氏杆菌制备的酶中亦发现有微量的内毒素。另外,博莱霉素,柔红霉素、长春新碱等药品,亦有少量的内毒素存在,--般为0.1~5ng/ m1。因此,必须对抗肿瘤半成品、成品及加工过程进行内毒素的检测,使药物中的内毒素含量控制在安全水平以下,以减少不良反应。 有些抗肿瘤药有细胞毒性,不宜采用RT法,因此LT法用于抗肿瘤药物中内毒素的检测是可行和适宜的。试管法仍为最实用的方法。
企业动态
2022.08.16
输液制剂的热原检查
静脉点滴用的各种浓度葡萄糖液,生理盐水、林格氏液、甘露醇等,以往常采用RT法(鲎试验法,Limulus test)检测热原。近年来,国内外许多研究者应用LT法和RT法(家兔热原试验,Rabbit pyrogen test)作了大量的比较研究,结果表明,两者的结果是基本相符的,但LT法较RT法敏感10~100倍。 1977年Travenol实验室对他们国内各厂生产的输液及其它产品进行检查,RT法进行28410次,不合格4次,LT法进行143196次,呈阳性者37次。并表明LT法操作简便、快速、敏感,故LT法应用于此类产品的热原检查是非常合适的。将LT法用于制剂流程中热原监测,原料、半成品及终产品的热原检查,可以杜绝污染,提高质量,保证了临床使用的安全性。 对于Ca++浓度较高的制剂,如30%葡萄糖酸钙、浓度>5%的CaC12·2H2O可出现假阴性反应,故每次试验时,尤其是第一次测试的未知药品一定要做抑制对照试验。
参数原理
2022.08.15
鲎试验法——用荧光测定检测细菌内毒素含量的方法
将荧光母素(fluorescamine)加入鲎试剂中,可使参与凝胶反应的蛋白分子被荧光素标记上。在形成凝胶的过程中,由于蛋白分子产生聚合结构变化,结合于蛋白的荧光素因部分蛋白随水分子运动而同时发生旋转,导致荧光偏光度发生变化。令荧光偏光度为P,垂直荧光强度为I1,水平荧光强度为I2,则可见Р值由于凝胶化而增加,其值可按下式求得如下图: Р值与标本中内毒素的含量呈线性关系。 实验时所用的荧光母素浓度常为0.02%。因为荧光母素浓度在0.05%以上时,聚合反应有明显的抑制,0.025%有轻微的抑制作用。鲎试剂凝胶化,可以使P值增大,其反应潜伏期的长短与P值增大的程度取决于内毒素的浓度。当内毒素在10-2μg/ml时,5分钟内P值开始增大,而10-3μg /ml时,则在30分钟仍看不出P值的增大,当内毒素-3μg /ml时,浓度越小潜伏期越长。从而形成了P值上升的图像,据此可求出回归直线方程。 设倾斜度为b,潜伏期为t ,计算b/t值。如按不同浓度的标准内毒素计算结果绘成曲线,可见内毒素在10-8~10-3μg /ml范围内呈上升型直线,其相关系数为0.9804,方程式为: Y = 0.0207 + 0.0797x (R = 0.9804) 根据标准曲线,即可求出被检标本中内毒素的含量。 本试验的操作均在0℃进行,测定时则在25℃进行。应观察60分钟内反应的全过程,每隔5分钟测定一次。
新品
2022.08.12
鲎试验方法——用产色基质法检测细菌内毒素含量的方法
日本学者对内毒素的产色基质测定法(Chromogenic subs-trate method)进行了大量的研究。从鲎试验的反应机理可知,鲎试剂中含有一种特异的前凝固酶,其受内毒素激活后变成有活性的凝固酶,后者具有α-凝血酶的活性及Xa因子及XⅡa因子的一些功能。这种酶可水解凝固蛋白原成三个片段,即A链、B链及C肽。A、B链和C肽再通过共价相联而成为凝胶。此酶作用的部位,分别为A链羧基端的-Val-Leu-Gly-Arg(Gly,Arg 分别为第17、18位)及C肽的-Val- Ser-G1y-Arg(G1y,Arg分别为第45、46位)上,提示羧基末端Gly-Arg的结构可受到鲎血凝固酶的作用。鉴于此,利用人工合成的肽-硝基苯胺.(肽一PNA)或肽-4甲基香豆素酰胺(肽-MCA)基质中肽段氨基酸排列顺序与凝固蛋白质切断部位的氨基酸排列顺序相同的特性,就可以由于这种酶的水解作用,使产色基质游离出来,即可用分光光度计于适当的波长处测得吸光度。 如用肽-PNA基质,则释出的为PNA,可在405nm处测定吸光值。如用肽-MCA基质,即释出7-氨基-4-甲基香豆素(AMC)经380nm波长紫外线激发后,在460nm处可测得荧光,如用370nm波长亦可测知AMC的游离量。 目前应用的产色基质有许多种,主要有:Bz - lle - Glu - Gly -Arg - PNABz - Val - Gly - Arg - PNABoc - Lue - Gly - Arg -PNABoc - Lue - Gly - Arg - PNABoc - Ser - Gly - Arg - PNABoc - Leu - Gly -Arg - MCABoc - Ser - Gly - Arg- MCA等。 这些基质对鲎凝固酶的酰胺酶感性随内毒素浓度的提高和作用时间的延长而增强,显示其高度的专一性。测出内毒素的范围为5Pg-50ng/ml。反应时间延长测得更低的内毒素值。反应需要的最适pH为8.0~8.5。 在试验时必须作阳性标准管,即以一定浓度(如0.100,0.025,0.075ng/ml)的标准内毒素与肽-PNA或肽-MCA反应,然后作出线性标准曲线。作出的标准曲线,其相关系数应>0.98,变异系数<5 %。被检样品的吸光值只要与标准曲线比较,即得知标本中所含的内毒素量。亦可采用下列公式求得如下图: 如果要测定血浆或血清中的内毒素,则由于其中含有内毒素抑制蛋白,可事先加热37℃30分钟,以破坏这些抑制物质,或通过稀释的方法消去这些抑制物质。亦可在血清中加入标准内毒素作出标准曲线。
新品
2022.08.11
鲎试验的方法——比浊法
比浊法又称浊度测定法。浊度法系利用检测鲎试剂与内毒素反应过程中的浊度变化而测定内毒素含量的方法。 Teller等首先报导将鲎试剂与内毒素作用后,可产生凝胶从而使液体呈混浊,其浊度与内毒素在一定条件下(内毒素浓度20~100pg/ ml)呈线性关系。此法有如下优点①减少了鲎试剂的用量,②快速,③操作简便,④半自动化。 本试验的方法是:将已适当稀释后的鲎试剂与处理后的被检标本各0.1ml加入微孔中,振颤器振动60秒钟,使两者充分混匀。放置37℃60分钟,然后取出在分光光度计360~380nm处读取光密度值(OD)。另以系列稀释的标准内毒素作阳性对照,并将其OD值与内毒素量间的关系描成标准曲线。比较试验管与对照管的OD值,即可知道标本中内毒素的含量。 在操作中,孵育的时间是至关重要的,因为随着时间的延长,浊度亦将增加,一般孵育1小时即可终止其反应。即使在室温中,如时间过长浊度亦会增加,因此孵育后应立即读取OD值。读取OD值时,应每隔1分钟进行一次,共四次,取其平均值,变异系数应不超过1%。 另外,某些注射药品及放射性药物本身带有颜色或浊度时,必须减去标本本身的OD值。
新品
2022.08.10
三种凝胶法常用方法:试管法、玻片法及毛细吸管法的介绍
凝胶法常用的方法有三种,即试管法、玻片法及毛细吸管法。 试管法将等量的被检样品与鲎试剂加入试管,混匀,放入水浴中让其充分反应,然后取出观察凝胶形成的情况。实验时共需作四种试管,即试验管、阳性对照管、阴性对照管及阴性抑制对照管。 试验管:取标本0.1ml+鲎试剂0.1ml。一般的标本如水、注射液等,实验前不须加以处理,但血液及腹腔渗出液等实验前必须加以处理,因为在这些标本中可能会有LT(Limulus test,鲎试剂法)反应的抑制物质。应用的鲎试剂应事前以标准内毒素进行标定,并认为是可用的。 阳性对照管:标准内毒素0.1ml+鲎试剂0.1ml。标准内毒素用前应以WHO标准品标定。所用的内毒素浓度按鲎试剂的敏感性而定,一般为1~5 ng/ ml。 阴性对照管:无热原水0.1ml+鲎试剂0.1ml。 抑制对照管:标本0.1ml+标准内毒素0.1ml+鲎试剂0.2ml。 上述四管均放入37℃孵育1~2小时观察结果。如形成凝胶坚固,试管倒转180度不变形,则记为(++);如混浊度和粘滞性明显增加,呈胶体状,但倾斜试管时变形,则记为(+);如液体流动自如,透明无变化或稍混浊,有少量颗粒细絮片状物,则记为(-)。 如被检样品中有抑制物存在,则可将检品作适当的稀释或经各种处理以除去抑制物,再次测试。如这些方法无效,亦可采用其它内毒素检测法,如RT(Rabbit pyrogen test,家兔热原实验)法。 玻片法鉴于试管法耗费鲎试剂量多,结果判定不易标准化,需用时间较长等缺点,Frauch于1974年首先创用了玻片法。将10μl鲎试剂与已处理过的被检样品10μl滴于无菌无热原的玻片上,充分混匀,水平放置37℃30分钟,取出观察结果。如标本中含有内毒素,则混合物形成凝胶,倒转玻片时混合物不流动,触之较结实。反之则说明样本中不含内毒素或内毒素含量过低。 Goto等于1977年对此法进行了两点改进。①增加鲎试剂及样品的量,所用量各为20μl。由于Frauch法仅用10μl的鲎试剂及10μl的被检标本,量太少,且形成凝胶后其体积更小,不易判断结果。故各增加鲎试剂及被检标本量1倍,这样结果判定更正确、容易些。②使用不含硅的玻片。由于硅玻璃组成的玻片,滴加在其上的液体可向四周扩散,而显得不规则。不含硅的玻片可使滴加在其上的液体保持稳定,不向四周扩散,这样,为结果的判断提取了方便。 毛细吸管法此法由瑞典学者Gardi于1980年首先创用。将10μl被检标与10μl鲎试剂滴于无菌无热原的载玻片上,充分混匀,然后以毛细吸管吸入其内(一般为2/3的高度),水平37℃孵育45-60分钟,取出毛细吸管,再浸入溴酚染料中2~3秒钟,取出即可判断结果。如染料能进入毛细吸管,则说明样品中无内毒素或所含的内毒素量低于鲎试剂检测的敏感度记为(-);如有坚固凝胶形成以致染色不能浸入,即说明样本含有内毒素,记为(+)。此法敏感性高、操作简便、所需试剂量少、孵育时间短,结果判断较客观。我们实验室于1982-1983年间应用毛细吸管微量测定法对临床的多种标本进行了内毒素检测,结果较为满意,认为此法值得在临床上广泛推广。 目前,日本已有专门的内毒素微量检测管出售,这种毛细吸管内已装有微量的冻干鲎试剂,只需将此管插入液相标本,取出孵育一定的时间后即能判断结果。
参数原理
2022.08.09
各国法定检测内毒素的方法
美国首先将LT法(鲎变形细胞溶解物试验)作为检测内毒素的法定方法。在美国药典第20版(1980)的细菌内每素一项中对LT法亦进行了详细的介绍。继美国以后,许多国家(特别是欧洲国家)纷纷仿效,亦已将LT法作为检测内毒素的法定方法。现以美国为例,来说明这种法定的LT法。 美国食品药品管理局(FDA)对厂家提出了一条准则。FDA认为对于应用于人类的药物、生物制剂、兽用药物及医疗器械必须将LT法作为法定的终产品(end product)内毒素检测方法,厂家只有遵循这个原则并按介绍的方法操作后,其产品才能得到FDA的承认。 LT法作为法定的内毒素检测方法,在进行测定时必需作①测定鲎试剂的敏感性;②抑制与增强试验。1.鲎试剂的敏感性在鲎试验的操作过程中,各个实验室之间必定有差异。检测人员必须应用同一批鲎试剂及同一批内毒素作4~8个稀释度的试验,以2倍倍比稀释以便取得适宜的终点范围作LT。终点内毒素量应以ng/ m1表示,然后换算成log值,计算标准差(SD)。如果4个稀释度的SD值小于或等于SD值的99%限值,则此方法是可用的。如SD超过比值,则应采用8个稀释度的试验,计算新的SD值。此时,如SD值仍超过8个稀释度SD的99%上限值,则此方法由于变异太大不能采用。在重新试验前应找出原因并进行纠正。 如实验室通过了上述变异试验,则应以一系列浓度的参考标准内毒素(RSE)或对照标准内毒素(CSE)检查鲎试剂的敏感性,如果鲎试剂的敏感性差异不超过标定值的2倍稀释,则认为是满意的。2.抑制与增强试验一种药物含不同浓度的标准内毒素(敏感性以鲎试剂标定》,然后与水中的一系列同种内毒素浓度进行比较。标准系列的内毒素检测结果与药物中的内毒素检测含量进行比较,其差异不应超过两倍稀释浓度。原则说明此种药物有抑制或增强现象。 由不同浓度不同活性要素组成,而其它成分相对恒定的药物,只需测最高和最低浓度即可,如果每种浓度均表明有抑制或增强,则每种浓度均需进行抑制/增强试验。 所有法定的药物检测均需在未稀释或在适当稀释后测定。稀释倍数不能超过最大有效稀释(Maxium Valid Dilution,MVD),否则其中的内毒素经稀释后浓度过低而不被LT法检出。 如果药物表明有抑制或增强现象,则应服从RT法。此时,RT法仍将是检测药物内毒素含量的适宜方法。至少应检测3个生产批次终产品的抑制及增强试验。如果药物的加工制造过程改变,或药物的配方或药物中某种特殊要素的来源改变,则每种药物至少要对3种单位重复测定抑制/增强试验。如鲎试剂的生产或鲎试剂批号更变时,至少每种药品要对1种单位进行重复测定。
新品
2022.08.08
细菌内毒素检测仪:细菌内毒素检查法的注意事项
细菌内毒素检测仪制造商介绍细菌内毒素检查法是利用鲎试剂来检测或量化由革兰阴性菌产生的细菌内毒素,以判断供试品中细菌内毒素的限量是否符合规定的一种方法。 1.医疗器械细菌内毒素检验标准 (1)GB/T 14233.2-2005 医用输液、输血、注射器具检验方法第2部分:生物学试验方法; (2)2015年版《中国药典》1143 细菌内毒素检查法。 2.医疗器械细菌内毒素所需主要设备 (1)电热干燥箱,温度达到 250 ℃,用于除外源性内毒素。 (2)旋涡混合器。 (3)试管恒温仪、恒温水浴箱或适宜的恒温器,可设定温度为(37±1)℃。 (4)天平,精度为 0.1 mg 以下。 (5)鲎试剂,应具有国家主管部门的批准文号。 (6)细菌内毒素检测仪制造商表示细菌内毒素国家标准品或细菌内毒素工作标准品,应具有国家主管部门的批准文号。 (7)细菌内毒素检查用水应符合灭菌注射用水标准,其内毒素含量小于0.015EU/ml(用于凝胶法)或0.005 EU/ml(用于光度测定法),且对内毒素试验无干扰作用。 (8)实验用具:剪刀、砂轮、试管、三角瓶、试管架、洗耳球、封口膜、75% 乙醇棉、时钟、移液管(或刻度吸管)、凝集管(10 mm×75 mm)、微量加样器及无热原吸头。耐热器皿须经250℃干烤至少30min。若使用与微量加样器配套的吸头等塑料器具时,应选用标明无内毒素并且对试验无干扰的器械。 3.细菌内毒素检测仪制造商介绍检测的注意事项: (1)试验前,须用肥皂洗手,用75%乙醇棉球消毒,试验操作应在清洁环境中进行,过程中应防止内毒素的污染。 (2)在使用洗耳球、移液管取样时,应注意不要将洗耳球中的气体吹入溶液中,以防止气体中的内毒素进入供试液。 (3)试验所用器具经250℃干烤30min以上,要待烤箱温度升至250℃后开始计时。在不打开金属容器的情况下,可在2d内使用;如果玻璃器皿用锡箔纸包装,嘉峪检测网建议在不打开包装的情况下可在两周内使用,否则须再次干烤。 (4)细菌内毒素检测仪制造商表示开启细菌内毒素国家标准品或工作标准品、鲎试剂时,先轻弹瓶壁,使粉末落入瓶底,然后用砂轮在瓶颈上部轻轻划痕,75%乙醇棉球擦拭后启开,启开过程中应防止玻璃碎片落入瓶内。 (5)无菌医疗器械生产企业在生产过程中须严格控制产品初始污染菌,以免导致灭菌后产品细菌内毒素指标超过限值。 (6)对于非液态产品企业制定产品技术要求时,如按EU/ml规定细菌内毒素限值在试验方法中则需明确产品的浸提液体积。 (7)按GB/T14233.2-2005医用输液、输血、注射器具检验方法:生物学试验方法进行供试品细菌内毒素检验时,供试液应在(37±1)℃恒温箱中浸提不小于1h,供试液贮存应不超过2h。 (8)溶解鲎试剂及混匀供试品和鲎试剂时,不要剧烈振荡避免产生气泡;试验过程中应注意更换吸头,以避免检查用水的污染及溶液的交叉污染。 (9)由于凝集反应是不可逆的,所以在反应过程中及观察结果时应注意不要使试管受到振动,以免使凝胶破碎产生假阴性结果。 (10)细菌内毒素检测仪制造商表示进行干扰试验时,标准对照系列和含内毒素的供试品溶液系列应同时进行;如经检验证实供试品对细菌内毒素试验有不能排除的干扰作用则不适宜采用凝胶限度法。 (11)在进行鲎试剂灵敏度复核、干扰试验和供试品细菌内毒素检查时,各个试验中要求的对照应同时进行,并在试验有效的情况才能进行计算和判断。 (12)细菌内毒素检测仪制造商表示对于一个初包装内有多组件的成套器械,如规定的内毒素限值是针对成套器械的,可以用一份浸提液对所有组件浸提,也可将各组件分别浸提后混合,各组件所用的浸提液总体积应不超过MVD,当组合后样品出现结果不确定时,则需分别检验各组件,以研究各组件的污染源。 (13)如一个初包装产品为多个医疗产品的集合,在临床应用中每种医疗器械独立使用,则应有各自的产品内毒素限值,且应分别进行试验和评价。 (14)2015年版《中国药典》1143细菌内毒素检查法包括凝胶法和光度测定法,后者包括浊度法和显色基质法。供试品检测时,可使用其中任何一种方法进行试验。当测定结果有争议时,除另有规定外,以凝胶限度试验结果为准。
企业动态
2022.08.05