两性霉素 B 脂质体制剂的分析方法建立及比较研究
2023/11/01 18:34
阅读:58
分享:方案摘要:
产品配置单:
华溶活塞泵流池法溶出系统DS-7CP
型号: DS-7CP
产地: 广东
品牌: 华溶仪器
¥100万 - 150万
参考报价
联系电话
方案详情:

翻译:华溶应用中心
审核:工业药剂发烧友
摘要
两性霉素B脂质体(AmBisome®),是一种救命的抗真菌产品,2019年销售额为4.07亿美元。AmBisome®具有相当复杂的物理结构,其中两性霉素B(AmpB)与脂质双层形成稳定的离子复合物,以保持AmBisome®在体循环中的低毒性和高稳定性。重现AmBisome®精确结构的失败尝试导致体外和体内的快速药物释放和高毒性。在这项研究中,我们建立了几种分析方法来量化脂质体AmpB组分,表征脂质体的热力学特性,并确定粒径分布、AmpB聚集状态和药物释放动力学。我们应用这些方法,结合体外溶血潜能和抗真菌活性测试,对多个批次的AmBisome®和印度批准的两种仿制产品Phosome®和Amphonex®进行了表征。我们还使用了Fungizone®,一种胶束AmpB制剂,以及”泄漏”AmpB脂质体作为阴性对照。结果表明,Phosome®和Amphonex®都与AmBisome®相似,而Fungizone®和”泄漏”脂质体则在热力学特性和AmpB聚集状态方面均表现出差异,导致药物释放更快和毒性更高。由于制药行业对制造仿制AmBisome®的兴趣增加,并且缺乏表征脂质体AmpB产品的标准分析方法,因此,这里描述的方法对开发AmpB脂质体仿制药是有价值的。

一、简介
两性霉素B(AmpB)是一种大环内酯类多烯广谱抗真菌药,对大多数临床相关的真菌种类有效。AmpB的主要作用机制是结合敏感真菌细胞膜上的固醇,损伤细胞膜的通透性,导致细胞内的一些重要物质外漏,从而破坏细胞的正常代谢,抑制真菌生长。然而,AmpB还与哺乳动物细胞膜中的胆固醇结合,导致慢性肾毒性和几种输液相关毒性。为了减轻这些副作用,NeXstar制药公司开发了AmpB脂质体制剂( AmBisome®),并于1997年获得美国食品药品监督管理局批准。与传统的AmpB注射剂相比,AmBisome®的药效时间更长,临床毒性特征也更低,是一种更安全、更有效的真菌感染治疗方法。2019年,AmBisome®全球销售额达到4.07亿美元。2016年该产品美国专利有效期使AmBisome®成为仿制药生产的主要目标。然而,迄今为止,尚未获得美国食品药品监督管理局批准的AmpB脂质体仿制药。
研发AmBisome®仿制药的困难源于该产品复杂的物理结构。AmBisome®中的脂质成分由氢化大豆磷脂酰胆碱(HSPC)、二硬脂酰磷脂酰甘油(DSPG)、胆固醇和α-生育酚(一种防止脂质降解的抗氧化剂)组成。在AmBisome®中,AmpB带正电的胺基与带负电的DSPG相互作用形成稳定的离子络合物。同时,与AmpB结合的胆固醇有助于将药物保留在脂质双分子层内,从而稳定制剂。这种独特的超分子结构使AmBisome®具有低毒性和在体循环中的高稳定性,直到脂质体到达目标真菌细胞。AmBisome®的制备过程决定了脂质体的物理结构,如果不能复制AmBisome®的精确结构,将导致药物在体内和体外释放更快,毒性更高。一些AmBisome®仿制药已在美国境外获批,但一些仿制药已被撤出市场,因为尽管具有相同的化学成分,但毒性远远超过AmBisome®,即Anfogen®(基因制药,阿根廷)和Lambin®(太阳医药工业有限公司,印度)。AmBisome®及其仿制药Anfogen®和Lambin®的毒性特征存在巨大差异,这表明确保不同产品和批次内的质量均匀性至关重要。
证明仿制药的治疗等效性始终是一个巨大的挑战,尤其是脂质体制剂。由于AmBisome®独特的超分子结构特征,仅展现定性(Q1)/定量(Q2)的相似性不足以确保仿制药与原研药的生物等效性。2016年,FDA起草了仿制药AmpB脂质体开发指南,建议仿制药和参比药具有相同的药物组成和相同的脂质体特征,包括脂质体组成、脂质体粒径分布、层数、表面电荷、脂质双层相变和体外释放率。因此,有必要建立系统的分析方法,它不仅可以用于比较AmBisome®与其仿制药之间的相似性,还可以为仿制药开发过程中的处方和工艺优化提供建议。
在本文,我们选择了AmBisome®的在印度上市的两种现有仿制药Phosome®和Amphonex®,对粒径分布、组分定量、吸热行为和体外药物释放行为进行了一系列表征实验。我们还研究了不同制剂中的AmpB聚集状态,因为聚集被认为是AmpB毒性的原因。基于这些发现,我们进一步研究了AmpB制剂对白色念珠菌的体外毒性和抗真菌活性。 我们在研究中纳入了另外两种AmpB产品,即FDA批准的Fungizone®和由ZoneOne制药(批号35:48-7)制备的“泄漏”AmpB脂质体,这些产品与AmBisome ®有根本差异,以显示我们方法的鉴别能力。Fungizone®是一种基于胶束的两性霉素B制剂,缺乏脂质和胆固醇,但含有大量脱氧胆酸钠作为增溶剂。AmpB脂质体(35:48-7)含有与AmBisome®相同的化学成分,但使用不同的生产工艺。我们试将这两种产品的聚集状态和药物释放行为与AmBisome®进行比较,以强调建立一套标准分析方法来评估AmpB产品均匀性的重要性。
二、材料与方法
2.1材料
四批AmBisome®(Astellas Pharma US, Inc.)和一批ApmB注射液Fungizone®(X-GEN Pharmaceuticals, Inc.)购自密歇根大学医院药房。四个批次的Phoso®(Cipla Ltd.)和三个批次的Amphonex®(Bharat Serums and Vaccines Ltd.)由BSV生物科学公司提供。泄漏的两性霉素B脂质体(批号35:48-7)由ZoneOne Pharma Inc.制备。AmpB标准品购自美国药典。氢化大豆磷脂酰胆碱(HSPC,纯度99.8%)和1,2-二硬脂酰- Sn-甘油- 3 -磷酸甘油,钠盐(DSPG-Na,纯度99.3%)购自NOF America Corporation。胆固醇(纯度99%)和α -生育酚(纯度96%)购自西格玛。Floort-A-Lyzer ®透析管(截留分子量300 kDa)购自Spectrum Laboratories。Wistar大鼠全血购自创新研究公司。白色念珠菌(ATCC 10231)来自ATCC®。其他试剂来自商业来源。
2.2 粒径分布和zeta电位
所有冻干AmpB制剂按照AmBisome®包装说明书中的描述进行复溶,方法是在每个小瓶中加入12 mL去离子水,用力摇动小瓶30秒以完全分散脂质体,然后让小瓶静置得到含有4 mg/mL AmpB的混悬液。
粒径检测:将0.1 mL AmpB脂质体加入0.9 mL去离子水中,并使用Malvern ZetaSizer NanoZSP(Malvern Panalytical Ltd.)通过动态光散射检测AmpB脂质体的粒径分布。还使用Malvern ZetaSizer NanoZSP和DTS1070一次性折叠毛细管细胞(施加的场强为24.4V/cm)检测了脂质体的Zeta电位。为测定颗粒浓度,用去离子水将AmpB脂质体稀释100000倍注入Nanosight NS300(Malvern Panalytical Ltd.)。使用纳米颗粒跟踪分析(NTA)软件对脂质体进行单独跟踪和记录,并测量其颗粒粒径和浓度。
2.3 AmpB和脂质定量
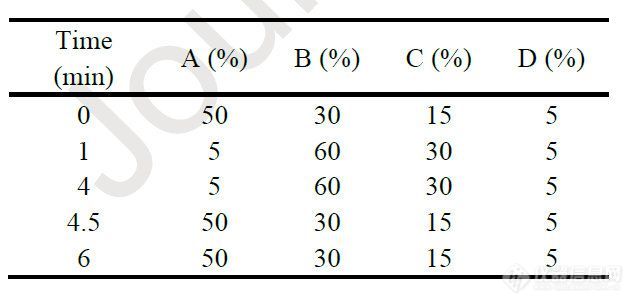
使用高效液相色谱法(HPLC,Waters 2695系统)在390 nm下进行紫外检测(Waters 2996光电二极管阵列检测器)对AmpB进行定量。将0.1 mL AmpB制剂溶于1 mL二甲基亚砜(DMSO)中,然后用甲醇稀释至5 mL。将AmpB标准品溶于 DMSO配制成4mg/ml,然后用甲醇稀释生成标准曲线。流动相包括(A)甲醇和(B)去离子水(均含0.1%三氟乙酸)。流速为1ml/min,梯度洗脱程序从60%(A)至84%(A)(9min),回到60%(A)(1min)。使用希金斯PROTO 300 C18色谱柱(5μm,250 ×4.6mm,柱温为室温)分析样品,每次进样的运行时间为13min。
使用超高效液相色谱-质谱法(UPLC-MS,Waters Acquity系统)检测HSPC、DSPG和β -生育酚的含量。脂质体制剂在甲醇中分别稀释100倍和2000倍。100倍稀释样品用于α -生育酚定量,2000 倍稀释样品用于HSPC和DSPG定量。流动相包括(A)含0.1%甲酸的去离子水、(B)含0.1%甲酸的乙腈、(C)含0.1%甲酸的甲醇和(D)100 mM甲酸铵水溶液。流速为0.3 mL/min,按照表1列出的梯度洗脱程序进行洗脱。色谱柱为Waters ACQUITY UPLC BEH 300 C4 (1.7 μm, 2.1 × 150 mm,柱温为室温),HSPC、DSPG - Na和α-生育酚的QDa质量检测分别为784.69(+)、801.48(+)和431.64 (+)。
表1.使用UPLC-MS进行脂质定量的流动相组成
通过游离胆固醇检测试剂盒(Wako Diagnostics)测定胆固醇浓度。用1% TritonX-100将AmpB脂质体稀释50倍。用1% TritonX-100稀释胆固醇标准品,生成标准曲线。将40 μL标准品或50 倍稀释样品在96孔板中与200 μL游离胆固醇颜色试剂混合。37°C孵育5分钟后,将板冷却至室温,使用SpectraMax M3平板阅读器(Molecular Devices)测量600 nm处的吸光度。
2.4 热分析
采用差示扫描量热法(DSC、Discovery DSC、TA仪器)分析,以评价不同AmpB制剂及其单个脂质体组分的吸热行为。简言之,将约5mg冻干AmpB制剂、AmpB标准品、HSPC、DSPG-Na和胆固醇单独密封在铝盘中,在50 mL/min的动态氮气氛中以10°C/min的速率从25°C加热到250°C。用空铝盘作为基准盘进行校准。
2.5 AmpB聚集状态研究
通过测量AmpB的紫外吸收光谱评价各制剂中AmpB的聚集状态。用去离子水将所有制剂稀释至50μg/ml和1μg/ml。同时,将AmpB标准品溶于DMSO配制成4mg/ml,用去离子水或甲醇稀释至50μg/ml和1μg/ml,以生成两种标准品:低聚物(AmpB溶于水)和单体(AmpB溶于甲醇)。所有样品的紫外吸收光谱均使用SpectraMax M3平板阅读器(Molecular Devices)获取,扫描范围为300 nm至440 nm,扫描步长为0.5 nm,在室温下进行测量。
对于圆二色谱扫描,用去离子水将所有制剂稀释至50μg/ml。将AmpB标准品溶于DMSO配制成4mg/ml,用去离子水或甲醇稀释至50μg/ml。使用1mm比色皿在Jasco J - 815光谱仪上进行815扫描。在室温下以100 nm/min的扫描速率记录扫描,数据间隔为0.5nm。
2.6 体外药物释放
使用我们先前开发的方法,在USP-4仪器(推荐使用华溶DS-7CP流池法溶出系统)上进行不同制剂的体外药物释放。释放介质为含5%蔗糖、0.01%叠氮化钠和5% γ-环糊精的10 mM HEPES(pH 7.4)。将所有AmpB制剂用释放介质稀释至0.5 mg/mL,并立即将1.6 mL稀释后的溶液置于透析装置中。然后将透析装置插入USP-4流通池中,每个池体释放介质为78.4 mL,以获得10μg/ml的最终AmpB浓度。介质以闭环方式灌注,流速为16 mL/min,温度为55℃。同时,将等量游离药物(10μg/ml)作为100%释放对照品直接置于释放介质中。采用在线紫外吸收法,在414 nm波长下,每小时检测一次AmpB的释放量。通过将供试品制剂中释放的AmpB吸光度除以各时间点100%释放对照品中释放的AmpB吸光度,计算累积释放(%)。AmBisome®与其他制剂的相似度采用f2检验,公式如下:
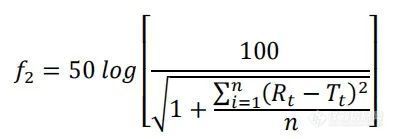
式中,n为时间点数量,Rt为参考批次在时间点t的累积释放度(%),Tt为检测批次在同一时间点的累积释放度(%)。所有24个时间点的数据均用于f2计算,并且f2≥50认为与参比批次相似。
2.7 体外毒性评价
通过测定红细胞溶血率(通过测定破裂RBC的钾释放量测定)评价体外毒性。取大鼠全血3000 g, 4℃离心12 min。收集红细胞,用冷PBS缓冲液(147 mM氯化钠、3mg氯化钾、10mg磷酸氢二钠,用盐酸调节pH至7.4)洗涤两次,并在使用前稀释至原始全血体积。用5%葡萄糖将AmpB制剂稀释至1000、500、100、50、20、10、5、2μg/ml。通过用5%葡萄糖将4mg/ml AmpB DMSO溶液稀释至上述相同浓度制备游离药物样品(对于游离药物和Fungizone®组,我们还添加了1μg/ml和0.5μg/ml)。对于各稀释制剂,将200 μL样品与900 μL 红细胞混悬液和900 μL PBS缓冲液混合。将200 μL 5%葡萄糖与900 μL红细胞混悬液和900 μL PBS缓冲液混合,制成阴性对照(0%钾释放),阴性对照中添加20 μM 缬氨霉素制成阳性对照(100%钾释放)。在37°C下孵育12h后,将样品750 g离心10 min,并将上清液转移至洁净小瓶中。使用钾离子选择性电极(Thermo Sciences)测量各样品的钾浓度。通过以下公式(C,钾浓度)计算各样品的溶血率:
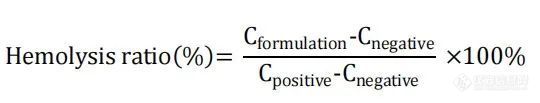
最后,计算每种制剂的红细胞释放50%钾的浓度(K50)。
2.8 体外抗真菌活性实验
将白色念珠菌在25℃的酵母霉菌培养液中培养。在抗真菌活性研究之前,将酵母在35℃的沙氏葡萄糖琼脂中传代培养24小时,然后用RPMI-1640稀释至1~5×103 CFU/mL(加入谷氨酰胺,不含碳酸氢盐,用0.165M的啉丙烷磺酸缓冲至pH7.0),所有AmpB制剂均用RPMI-1640稀释至32 μg/mL。对于游离药物组,首先将AmpB溶于DMSO配制成1.6 mg/ml,再用RPMI - 1640稀释至32μg/mL。 采用微量肉汤稀释法测定不同AmpB制剂对真菌池的最低抑菌浓度(MIC)。在96孔板中,以32 μg/μL浓度的AmpB制剂100 μL,依次1:2稀释至每孔50 μL AmpB制剂。接下来取50 μL稀释的酵母(1~5 × 103 CFU/mL),每孔酵母终浓度为0.5~2.5×103 CFU/mL,每孔AmpB终浓度分别为16、8、4、2、1、0.5、0.25、0.125、0.625、0.03125 μg/mL。无药对照为50 μL RPMI-1640 + 50 μL酵母,空白为100 μL RPMI-1640。所有条件一式三份。在35°C下孵育24h后,向各孔中加入10μL alarma blue试剂(ThermoFisher),然后在37°C下孵育4h。微孔红色说明真菌生长/存在,而蓝色为真菌阴性。将MIC确定为出现蓝色的最低药物浓度。
2.9 统计分析
所有数据均以平均值±标准差表示。采用单因素方差分析(ANOVA)进行统计学比较。
三、结果
3.1 粒径分布和Zate电位
我们使用动态光散射(DLS)和纳米粒子跟踪分析(NTA)来确定每种制剂的粒径分布。所有脂质体制剂尺寸都在100 nm左右,多分散指数约为0.2(表2,图1A),由于含有磷脂组分,表面电荷为负(表2)。Amphonex®和AmpB脂质体-35:48-7的负电荷小于AmBisome®。胶束制剂Fungizone®远小于脂质体制剂,约为20 nm(表2,图1A)。通过NTA分析时,所有脂质体制剂的平均直径略大于DLS测定值,但在所有制剂中保持相似。NTA还被用来定量各制剂中的颗粒浓度。总体而言,AmBisome®及其仿制产品中的颗粒浓度约为1-1.5×109颗粒/mL,但一批AmBisome®和一批Amphonex®的颗粒浓度较高。然而,相对于AmBisome®,脂质体AmpB制剂35:48-7显示了颗粒浓度的显著差异(表2,图1B)。在脂质体制造的生产工艺中,通常使用挤出或均质法降低颗粒尺寸并改善均匀度。虽然这三种上市产品的生产工艺仍然是商业秘密,但我们知道35:48-7是通过7个均质化周期生产的。我们假设均质化诱导的物理应力可能破坏脂质体,导致观察到的35:48-7相对较低的颗粒浓度。
表2.通过DLS和NTA系统检测到的不同脂质体AmpB制剂的粒径分布和zeta电位结果。数据表示为平均值± SD(n=3)。
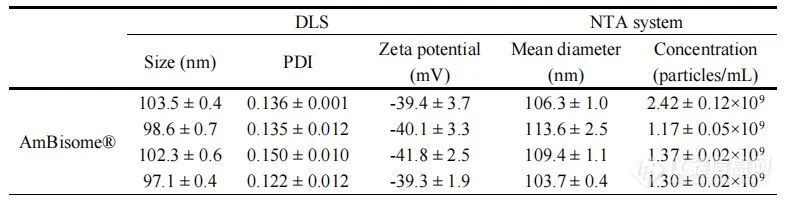
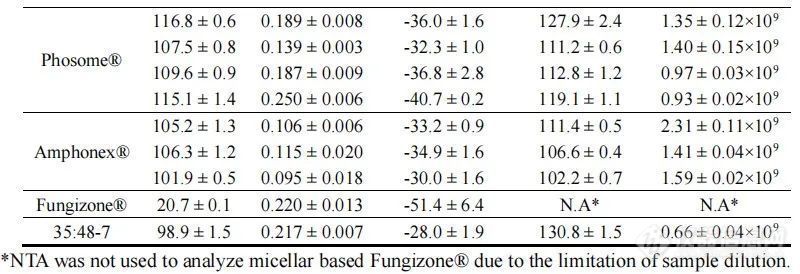
图1.通过DLS(A)和NTA系统(B)检测到的不同AmpB制剂的粒径分布图。
3.2 AmpB和脂质组分的定量
建立了几种定量测定不同制剂中AmpB及其他脂质成分的方法。根据包装说明书,每瓶AmBisome®含有50mg两性霉素B,插入到由约213 mg HSPC、52 mg 胆固醇、84 mg DSPG和0.64 mg α-生育酚组成的脂质体膜中。AmBisome®复溶操作后的AmpB浓度为4mg/ml;因此,我们基于4mg/ml 的AmpB计算了所有其他成分的浓度。对多批产品进行定量分析。AmBisome®所有批次中测定的AmpB浓度比报告的浓度高3-10%,而在Phosome®和Amphonex®中测得的AmpB浓度约低10%。对于脂质,AmBisome®中的HSPC浓度比报告的浓度高5-10%,AmBisome®中检测到的DSPG和胆固醇浓度与报告的相似。且在Amphonex®中检测到的脂质浓度与报告值相似,而Phosome®的所有脂质浓度均较低。AmBisome®和Amphonex®中α-生育酚的浓度都略高于报告浓度(见表3)。这些定量方法的验证见补充数据。
表3.不同AmpB制剂的组分定量。
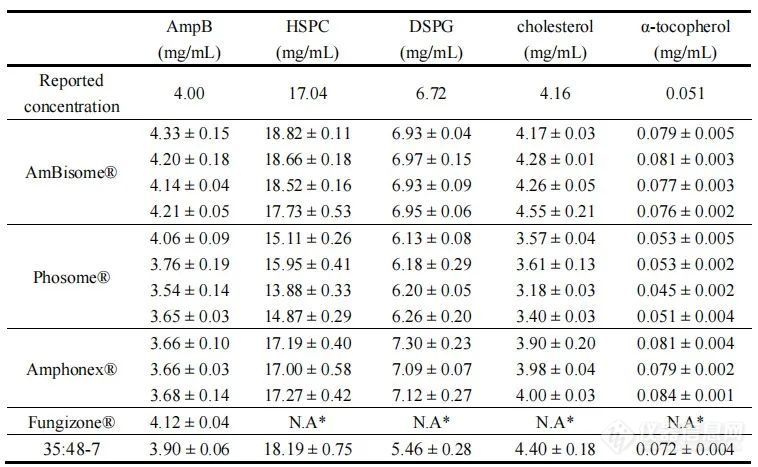
Fungizone®是由脱氧胆酸钠溶解的两性霉素B的注射用AmpB制剂,不含脂质成分。数据表示为平均值± SD(n=3)。
3.3 热分析
对于Fungizone®,在AmpB标准品中观察到的在120℃和206℃左右的两个吸热峰变为约85°C和170°C(图2B),与先前的文献报道一致。由于Fungizone®是一种冻干产品,结晶AmpB可能导致吸热峰偏移。对于AmBisome®、Phosome®和Amphonex®,差示扫描量热图均相似,仅在210 ℃附近有一个明显的吸热峰,这意味着AmpB被完全装载到脂质体中。在所有三个样品中均观察到60 °C左右的小峰,可能与HSPC和DSPG的存在相关(图2C)。对于35:48-7,在178°C附近也观察到另一个小峰。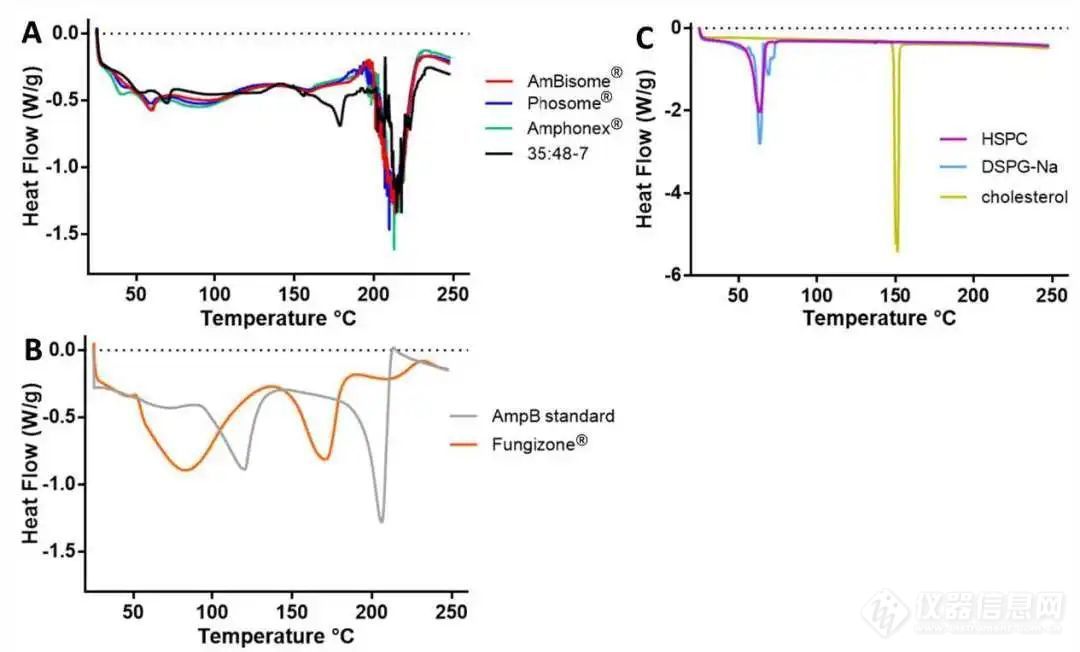
图2 不同脂质体AmpB制剂(A)、AmpB标准品和Fungizone® (B)、和主要脂质组分(C)的DSC图
3.4 AmpB聚集状态
由于内酯环的分子结构,AmpB具有两亲性。它可以通过与相邻的多烯链相互作用自缔合和聚集。因为AmpB的聚集状态被认为与AmpB的活性和毒性相关,所以AmpB的聚集状态很重要。AmpB在水中以低浓度保持单体状态,但当浓度增加时进入低聚状态(也称为可溶性聚集体)。据报道,AmpB的聚集状态很容易通过分光光度法区分。在本研究中,AmpB溶于甲醇和水被作为对照。在高浓度(50μg/ml)下,甲醇中的AmpB显示出典型的单体状态光谱,在363nm、383nm和406nm附近有三个吸收峰。水中的AmpB在328-349nm处显示出单一宽带,这是低聚态光谱的典型特征(图3A)。在低浓度(1μg/ml)下,甲醇中的AmpB仍保持其单体状态,而水中的AmpB明显从低聚物转变为单体;在长波长处,这三个峰的强度显著增加,328-349nm峰消失(图3B)。先前,研究人员使用第一个峰(328-349nm)与第四个峰(406nm)的比值监测AmpB的聚集状态。根据吸收光谱的形状,单体AmpB的该比值将非常低,低聚AmpB的该比值将越来越高。在我们的研究中,在50μg/ml水和甲醇中,AmpB的峰1与峰4的比值分别为4.37和0.28,在1μg/ml水和甲醇中,AmpB的峰1与峰4的比值分别为0.63和0.16。
所有市售水溶液制剂(AmBisome®、Phosome®、Amphonex®和Fungizone®)中的AmpB似乎处于低聚状态(50μg/ml)(图3A)。每一种制剂的峰1和峰4的比值在5-6之间。然而,一些制剂在1μg/mL AmpB时显示出不同的聚集状态。AmBisome®、Phosome®和Amphonex®在该低浓度下保持低聚状态,并且这三种脂质体制剂的峰1与峰4的比值几乎等于50μg/mL时的比值(图3)。在各制剂的多个批次中未观察到AmpB聚集状态的显著差异(图S1)。Fungizone®在1μg/mL AmpB下转变为单体状态,与在水中观察到的AmpB相似,并在5.6-0.65之间显示出峰1与峰4比值的显著变化(图3B)。聚集状态的差异可能是由于脂质体中存在DSPG和胆固醇。AmpB和DSPG可结合形成稳定的离子络合物,胆固醇在脂质体双层使药物包封稳定。因此,脂质体中AmpB与脂质双层之间的相互作用可能有助于在低浓度下维持低聚物状态。
Phosome®和Amphonex®的吸收光谱与AmBisome®相似,但在两种AmpB浓度下,35:48-7的吸收光谱与AmBisome®不同。与在320-330nm处具有单一宽峰的AmBisome®光谱不同,35:48-7光谱在350nm处具有肩峰,并且在363nm、383nm和410nm处具有单体AmpB特征的多个独特峰。尽管35:48-7的AmpB浓度与AmBisome®相似(表3),但颗粒浓度显著降低(图1B)。根据我们的结果,我们假设高应力均匀化过程损害了一些脂质体。35:48-7热分析和聚集状态表征的结果进一步支持了这一假设,因为178℃下DSC热谱图中存在异常吸热峰(图2A),紫外光谱中存在单体AmpB特征峰(图3),说明存在泄漏的AmpB。
除紫外吸收外,圆二色谱(CD)是另一种用于AmpB聚集状态研究的技术。水性介质中AmpB聚集体(低聚物)的代表性CD光谱显示,以约340 nm处为中心的不对称偶联,最大值和最小值分别为328和350 nm处。我们还对不同的AmpB制剂进行了CD分析(图S2)。水中的AmpB(图S2A)显示了典型的低聚CD光谱,而甲醇中的AmpB(图S2B)显示了由于单体状态导致的完全不同的CD光谱。所有脂质体制剂(AmBisome®、Phosome®和Amphonex®)均显示相似的CD光谱(图S2C),Fungizone®(图S2D)和脂质体制剂均显示具有典型寡聚特征的CD光谱。然而,当我们叠加CD谱时,所有公式中的椭圆率值完全不同(图S2E)。这是因为每种制剂的介质中的成分不同,介质环境可能会强烈影响CD仪器的响应。难以保持介质相同,也难以比较多种制剂之间的CD光谱相似性。然而,通过CD扫描,我们确实观察到了AmBisome®、Phosome®和Amphonex®之间的相似性,并证实了所有水性制剂中存在低聚态。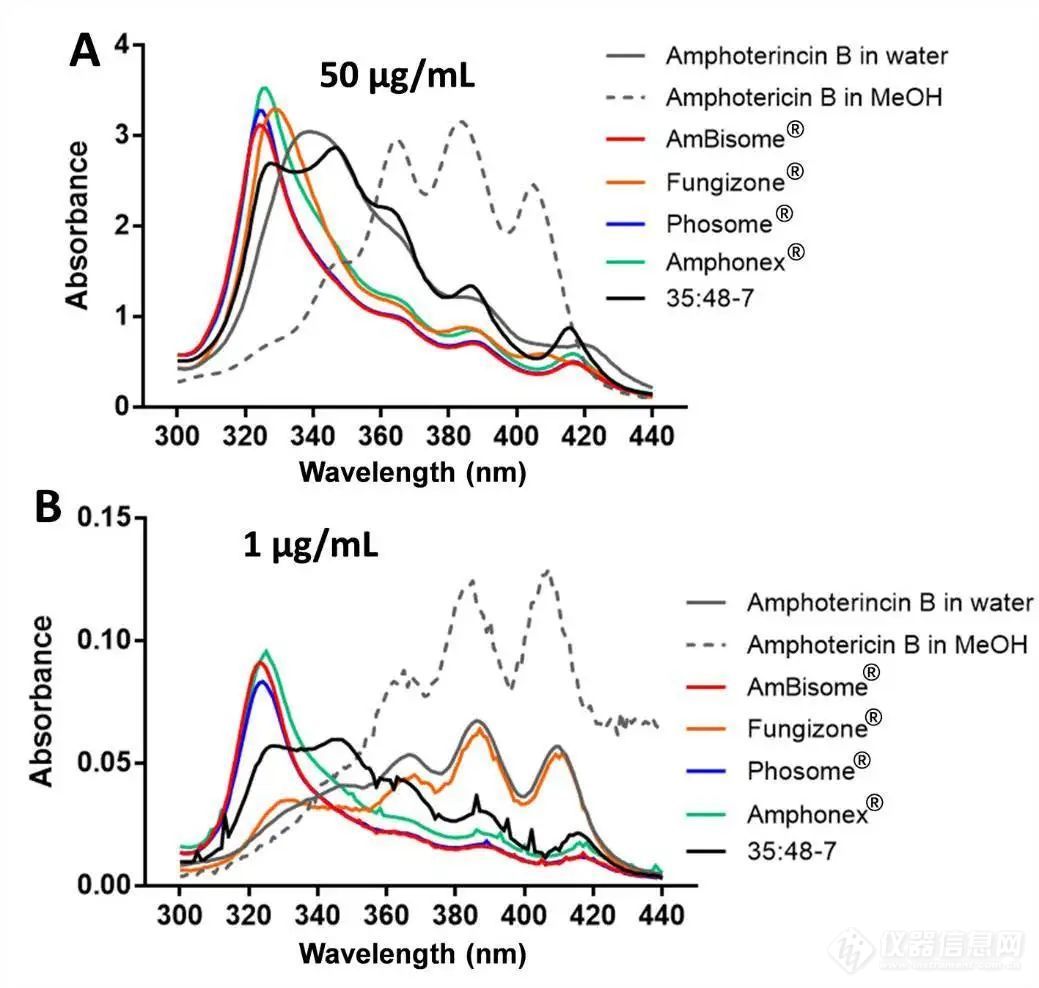
图3. 50μg/ml(A)和1μg/ml(B)不同AmpB制剂的吸收光谱与水和甲醇中的AmpB相比。
3.5 体外药物释放
我们使用我们先前建立的AmpB脂质体的USP 4流池装置药物释放试验来比较不同的AmpB制剂。Amphonex®的释放曲线与AmBisome®几乎相同,f2值约为85(图4)。Phosome®的药物释放略慢于AmBisome®,f2值为65。认为Amphonex®和Phosome®的释放行为与AmBisome®相似,f2值大于50。与AmBisome®相比,胶束制剂Fungizone®的药物释放显著更快,f2值约为17,6h内释放出近90%的药物。35:48-7也显示出比AmBisome®更快的药物释放,f2值为37。各制剂的多个批次之间的释放曲线无显著差异(图S3)。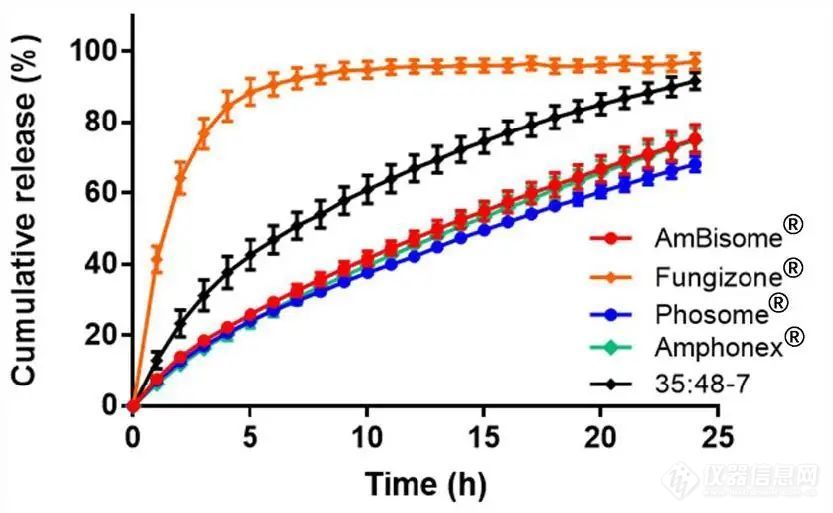
图4.不同AmpB制剂的累积释放曲线。数据表示为平均值± SD(n=3)。
3.6 体外毒性进行了红细胞溶血研究,以确定AmpB脂质体的体外毒性。基于溶血红细胞释放的钾量计算溶血率。三种上市药物之间或每种制剂的多个批次之间的毒性无显著差异(图5、图S4)。计算的Amphonex® 的K50(导致50%钾释放的AmpB浓度)略高于AmBisome®,但在溶血曲线中未观察到显著差异。与脂质体制剂相比,游离药物和Fungizone®显示出更高的毒性和显著更低的K50值(图5,表4)。当AmBisome®上市时,它声称其毒性降低是相对于其他现有治疗的最大改善。AmBisome®中存在的脂质(包括HSPC和DSPG)具有相对较高的转变温度,增强了37°C下的脂质体稳定性以延长循环时间。AmpB与DSPG/胆固醇之间的结合还通过形成在体内显示最小毒性的刚性AmpB脂质体增加稳定性。因此,我们认为完整的脂质体结构对降低毒性非常重要。我们认为35:48-7是脂质体和游离AmpB的混合物,与AmBisome®相比表现出更大的毒性(图5,表4),与更快的药物释放一致(图4)。
进行了红细胞溶血研究,以确定AmpB脂质体的体外毒性。基于溶血红细胞释放的钾量计算溶血率。三种上市药物之间或每种制剂的多个批次之间的毒性无显著差异(图5、图S4)。计算的Amphonex® 的K50(导致50%钾释放的AmpB浓度)略高于AmBisome®,但在溶血曲线中未观察到显著差异。与脂质体制剂相比,游离药物和Fungizone®显示出更高的毒性和显著更低的K50值(图5,表4)。当AmBisome®上市时,它声称其毒性降低是相对于其他现有治疗的最大改善。AmBisome®中存在的脂质(包括HSPC和DSPG)具有相对较高的转变温度,增强了37°C下的脂质体稳定性以延长循环时间。AmpB与DSPG/胆固醇之间的结合还通过形成在体内显示最小毒性的刚性AmpB脂质体增加稳定性。因此,我们认为完整的脂质体结构对降低毒性非常重要。我们认为35:48-7是脂质体和游离AmpB的混合物,与AmBisome®相比表现出更大的毒性(图5,表4),与更快的药物释放一致(图4)。
表4.体外毒性和抗真菌活性结果。不同AmpB制剂的K50值,表示为平均值±SD(n=3)。* *表示与AmBisome ®相比,p值小于0.01。不同AmpB制剂对白色念珠菌的最小抑制浓度,显示为三倍结果范围。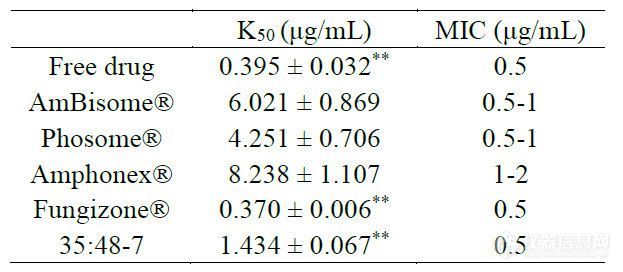
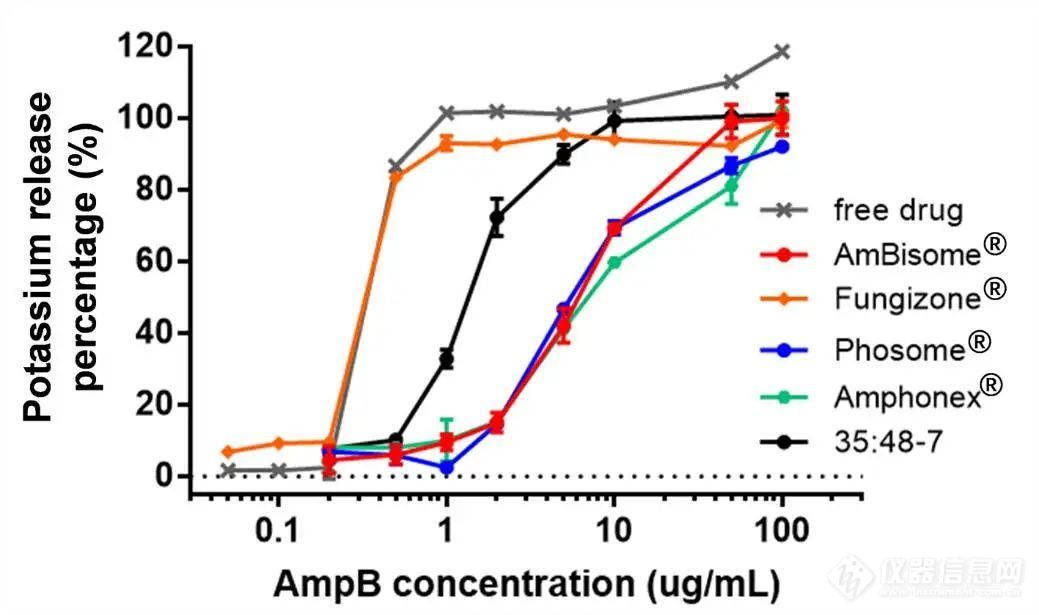
图5.随着不同AmpB制剂浓度的增加,在37°C下孵育12h后测定大鼠红细胞中的钾释放。数据表示为平均值± SD(n=3)。
3.7 体外抗真菌活性
根据临床和实验室标准研究所M27-A2参考方法的微量肉汤稀释法进行抗真菌研究。尽管不同制剂的红细胞毒性不同,但所有制剂对白色念珠菌的抗真菌作用相似(图6)。除Amphonex®的MIC稍高外,其他制剂的最小抑制浓度(MIC)大致为0.5μg/mL AmpB,(见表4)。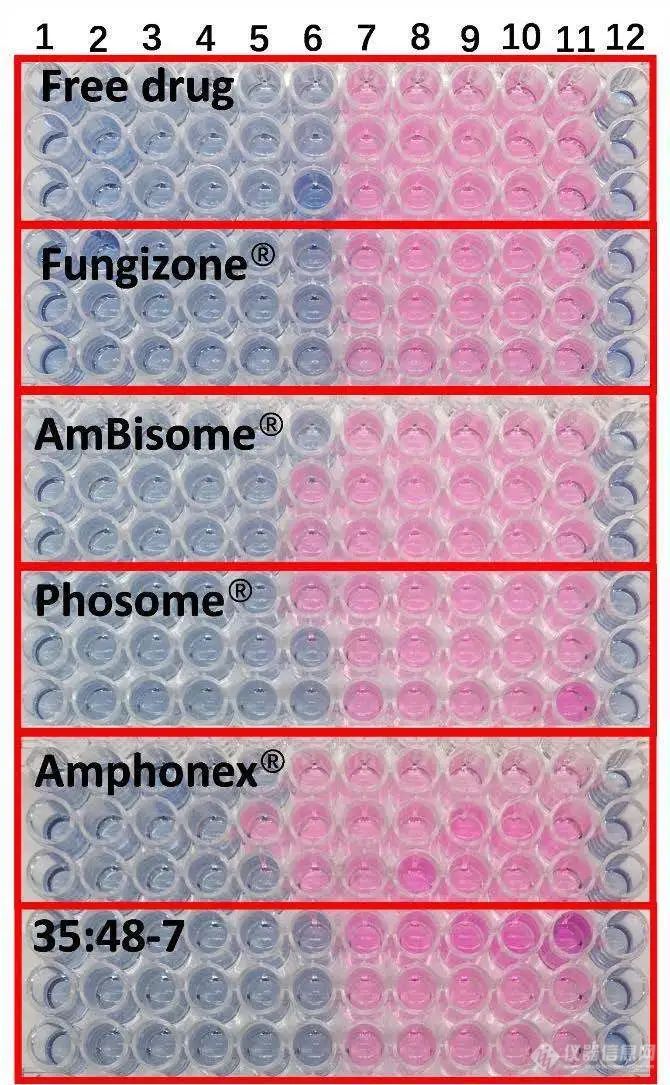
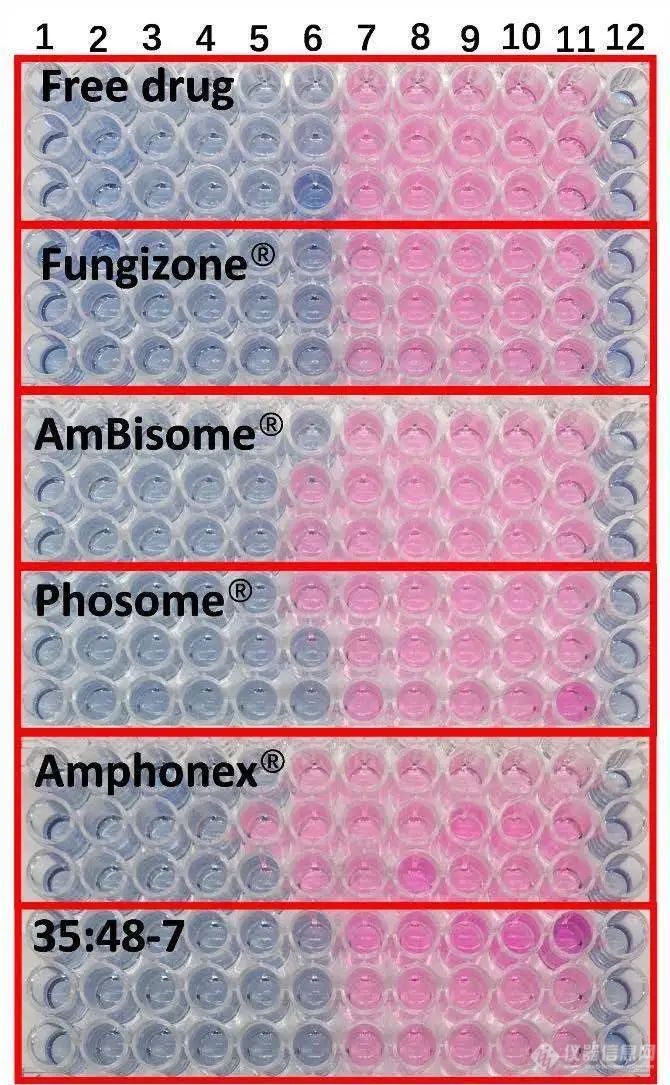
图6.不同AmpB制剂对白色念珠菌的抗真菌活性。1-10号孔的药物浓度分别为16、8、4、2、1、0.5、0.25、0.125、0.0625和0.03125 μg/ml。11号孔含有无药物对照品,12号孔为空白(n=3)。
四、讨论
迄今为止,有三种经FDA批准的AmpB制剂上市:AmpB注射液(常规注射液,X-GEN Pharmaceuticals, Inc.),AmBisome®(脂质体注射液,Astellas Pharma US, Inc.)和Abelcet®(脂质复合物注射液,Leadiant BioSciences, Inc.)。AmBisome®是美国唯一的AmpB脂质体产品。AmBisome®的几种仿制药在其他国家上市,包括Phosome®((Cipla Ltd.)、Amphonex®(Bharat Serums and Vaccines Ltd.)和AmBiL®(台湾脂质体有限公司)。尽管Phosome®和Amphonex®的组成与AmBisome®相同,但我们观察到这些产品之间存在一些差异。Amphonex®的AmpB浓度比AmBisome®低10%,四个批次Phosome®中所有组分的浓度均低于AmBisome®。尽管成分组量不同,Phosome®和Amphonex®在理化性质、药物释放、体外毒性和抗真菌方面与 AmBisome®相似。
由于AmBisome®在2016年失去了美国专利保护,制药行业对开发AmpB脂质体仿制药非常感兴趣。但FDA尚未批准AmBisome®的仿制药。这可能是由于在开发产生与参比产品具有相似质量、疗效和安全性特征的仿制产品的生产工艺方面存在技术困难。对于胃肠外纳米颗粒产品,了解生产工艺如何影响纳米颗粒超分子结构,产品性能始终复杂。在AmBisome®中,AmpB与脂质双层相关,生产工艺参数的轻微变化可能会改变脂质体中的药物分布状态,并导致产品质量差异。同时,AmpB的低溶解度和脂质组分的高转变温度要求在生产过程中进行关键酸化步骤和严格的温度控制。所有这些障碍使得仿制AmBisome®的开发成为一个巨大挑战。
缺乏标准分析方法也是仿制AmBisome®开发的一个障碍。由于独特的超分子结构,很难建立胃肠外纳米颗粒药品表征的通用标准指南。FDA为仿制药开发起草了多份产品特定指南。在本研究中,我们尝试建立符合FDA指南的脂质体AmpB分析方法。我们已建立了AmpB以及每种脂质组分的定量方法。我们还建立了脂质体粒径分布和表面电荷分析的DLS和NTA方法、脂质双层相变的DSC分析以及体外药物释放的USP-4装置释放试验。在FDA指南中,我们缺失的唯一推荐研究是脂质体中层数的评估,可通过透射电子显微镜(TEM)、磁共振或小角X射线散射(SAXS)进行。本研究主要关注AmpB脂质体的体外理化特性。为了全面评价这些产品,需要进行体内研究,比较不同制剂的药代动力学和安全性指标。
AmpB的使用因其剂量依赖性急性和慢性毒性而受到高度限制。几项比较AmpB制剂的研究显示,AmBisome肾毒性降低,但AmpB -脂质复合物的毒性与常规AmpB注射几乎相似,表明脂质体结构对降低毒性至关重要。AmBisome®具有完整的脂质体结构,在循环稳定性方面优于竞争对手。脂质组分的高转变温度以及两性霉素B和脂质双层之间的强烈关联有助于延长AmBisome®的循环时间、增强稳定性和降低体内毒性。在Olson等人的两项研究中,比较了脂质体AmpB产品的毒性,虽然它们的化学成分相同,但Anfgen®和Lambin®的毒性是AmBisome®毒性的5-10倍。因此,生产差异可能解释了这些不同的毒性。
在本文中,我们的结果与理论一致。AmpB脂质体35:48-7采用高压均质工艺生产,其组成与AmBisome®完全相同。虽然35:48-7中检测到的AmpB浓度与AmBisome®中的浓度相似,但通过NTA测量的35:48-7的颗粒浓度远低于AmBisome®中的浓度(表2)。我们假设几个高压均质循环的机械力破坏了脂质体结构,从而从脂质体中释放出一些AmpB,并导致AmpB聚集状态的显著差异(图3)。与AmBisome®相比,35:48-7中游离AmpB的存在也可能诱导药物更快的释放(图4)和更高的毒性(图5)。因此,为了防止毒性增加,必须在整个生产工艺中保持脂质体AmpB的超分子结构。
五、结论
在本研究中,我们建立了一系列用于表征AmpB脂质体的分析方法,包括粒径分布、组分定量、热分析、AmpB聚集状态分析、药物释放测定、体外毒性分析和抗真菌效应评价。在这些表征研究中,将在印度上市的两种仿制药(Phosome®和Amphonex®)、一种胶束制剂(Fungizone®)和一批内部制备的AmpB脂质体(35:48-7)与AmBisome®进行比较。根据我们的结果,AmpB脂质体制剂Phosome®和Amphonex®与AmBisome ®相似,而胶束AmpB处方Fungizone®存在显著差异。通过高压均质法生产的35:48-7脂质体,在理化性质上表现出显著差异,包括更快的药物释放和更高的毒性。我们认为,本研究中概述的系统方法将有助于优化仿制AmpB脂质体制剂的生产工艺,并确认仿制制剂与参比制剂之间的相似性。
六、参考文献
略
下载本篇解决方案:
更多![]()
好文推荐 |依匹哌唑原位凝胶植入剂的体外释放研究
目的 建立一种依匹哌唑原位凝胶植入剂的体外释放方法,研究处方在体外的释放行为和缓释机制。 方法 以抗精神病依匹哌唑为模型药物,制备以聚乳酸⁃羟基乙酸共聚物( polylactide gly⁃ colic acid,PLGA)/醋酸异丁酸蔗糖酯( sucrose acetate isobutyrate,SAIB)为基质的原位凝胶植入剂。开发体外释放检测方法,采用多种体外释放装置研究依匹哌唑原位凝胶植入剂的释放差异, 考察体外释放的影响因素。
制药/生物制药
2024/06/24
好文推荐 | 水杨酸片在流池法溶出仪性能验证试验中的应用
流池法溶出仪是控释剂型、难溶性药物和许多特殊剂型(如混悬液、软胶囊、植入剂、微球和脂质体)溶出度测试的首选仪器。虽然流池法溶出仪已列入药典多年,但一直没有正式的性能验证试验(PVT)方法。在这项研究中,水杨酸片被用来开发流池法的PVT。水杨酸片在篮法和桨法装置上相同的溶蚀和零级释放机制,可作为流池法装置中PVT的潜在参考标准品。在第一阶段,采用实验设计法(DoE)系统考察了四个参数对水杨酸片溶出度的影响。片剂装载方式是影响溶出度的最重要参数;流速和池体内径(ID)也有显著影响,温度对溶出的影响可以忽略不计。在第二阶段,由四名不同的分析人员在不同的流池法装置上(即四名合作者)进行溶出试验,以进行重复性和重现性评估,并确定PVT的初步可接收标准。第二阶段的实验条件是将片剂放置在带有玻璃珠的片剂支架上,池体ID为12 mm,流速为16 mL/min,温度为37℃,90分钟采集样品。第五个合作者的数据证实了PVT的可重复性。
制药/生物制药
2024/06/14
介质脱气小能手 | 华溶DGU-900在线溶媒脱气机,只为溶出仪而生
在进行溶出实验过程中,介质中溶解气体的释放是影响溶出结果的主要变动因素之一。因此,对溶出介质进行脱气处理变得尤为重要,并应将具体脱气程序写入溶出检测操作的标准操作规程。
制药/生物制药
2024/04/15
好文推荐 | 奈帕芬胺眼用混悬液的体外释放试验方法
体外释放试验(IVRT)方法对于监测制药生产过程中批次间的质量变化以及表现仿制药与原研药的药物等效性非常重要。为了满足批准眼用混悬液仿制药的监管要求,需要进行体外释放研究。目前尚无药典或非药典方法用于奈帕芬胺眼用混悬液的体外释放研究。 目前的研究旨在筛选使用不同的常规和非常规的各种方法,以建立最合适的奈帕芬胺眼用混悬液的技术,然后优化方法参数并进行验证。试验使用带透析袋的桨法装置(USP 2型)、流通池装置(USP 4型)、水浴转瓶装置和Franz扩散池装置。使用USP 4型装置,在pH 7.4的模拟泪液(STF)中,药物在120分钟内的释放度约为83%,添加表面活性剂月桂醇硫酸酯钠(SLS)后,释放度增加到约97%。使用USP 2型和Franz扩散池装置,药物释放缓慢或未接近完全释放。然而,在水浴转瓶装置的情况下,观察到了突释曲线。药物释放量的估计是通过HPLC方法进行的,所有方法验证参数,如专属性、准确度、线性和精密度都在可接受标准范围内。
制药/生物制药
2024/04/02










