注射用醋酸奥曲肽微球体内外释放度分析
2023/11/09 12:05
阅读:68
分享:方案摘要:
产品配置单:
华溶注射泵流池法溶出系统DS-7SAT
型号: DS-7SAT
产地: 广东
品牌: 华溶仪器
¥100万 - 150万
参考报价
联系电话
方案详情:

作者:梁苑英竹,袁松、郭宁子等
注射用醋酸奥曲肽微球体内外释放度分析
目的:研究注射用醋酸奥曲肽微球体外释放度加速试验方法,并探讨与体内释放的相关性,为该制剂 的有效性评价研究提供参考。方法:分别采用转瓶法和流池法考察了温度、pH、转速、流速、样品池的种类、膜的排列方式、玻璃珠以及加样方式等影响因素,建立了体外加速释放在温度 37 ℃、片剂池(22.6 mm)、流 速 16 mL ·min-1 和 pH 10.0 缓冲液中进行的流池法,并与在温度 37 ℃、转速6r ·min-1 和 pH 10.0 缓冲液中进行的转瓶法进行对比。结果:注射用醋酸奥曲肽微球在流池法中的释放均快于转瓶法中的释放;且2种制剂样品不同方法测定结果趋势一致,制剂A释放快于制剂B;对流池法体外加速释放 - 体内释放进行线性回归,制剂A和B相关系数r分别为0.998 2、0.960 9 。结论:采用流池法测定的体外加速释放快于转瓶法,且与体内释放具有良好的相关性(r>0.9),为评价奥曲肽微球制剂的体内外释放提供参考。

一、简介
注射用醋酸奥曲肽微球临床主要用于治疗肢端肥大症等疾病,肌肉注射给药,给药周期为28d。该微球制剂由诺华制药原研,于2003年在我国获批上市,目前国内尚未有仿制制剂上市。奥曲肽微球在处方和工艺上均与亮丙瑞林等其他多肽微球注射剂不同,采用葡萄糖星型丙交酯和乙交酯共聚物作为生物可降解缓释辅料,采用相分离法制备微球,其质量控制与药学评价技术方法面临挑战。释放度是评价缓释微球制剂的关键质量指标,体外释放试验一般分为突释释放、加速释放和常速释放。针对注射用醋酸奥曲肽微球的体外释放度,FDA溶出度数据库推荐采用流池法、桨法等装置进行研究;文献建立了常速释放转瓶测定法,试验周期为 36d,重 点对突释阶段进行了研究;尚未见体外加速试验方面的研究报道。为提高注射用微球制剂质量监测与评价的效率,有必要对该制剂的体外加速释放度试验方法进行研究。
文献报道注射用微球制剂的体外释放度方法有直接释药法、透析膜扩散法、流池法等,各有特点。采用水浴转瓶装置的直接释药法,虽然操作简便,但微球易聚集或浮动,且在进行分离时样品容易损失,对最终试验结果产生影响。流池法即美国药典溶出度测定第Ⅳ法,包括开环和闭环2 种模式,将微球置于样品池中,释放介质往复通过样品池中的微球,定时取样并补充相应的释放介质。此方法因能更好的模拟人体内环境,生物相关性良好,被美国FDA推荐作为测定PLGA微球释放度的最适方法,但其成本过高,且存在反压力和过滤器堵塞的风险。
本文通过考察温度、流速、pH、样品池、样品装填方式等条件,建立了流池法测定注射用醋酸奥曲肽微球体外加速释放度,并与转瓶法进行对比研究,同时采用LC-MS法测定大鼠血浆中奥曲肽的浓度,探讨分析体外加速释放和体内释放行为,为醋酸奥曲肽微球注射剂的有效性评价研究提供参考。
二、材料与方法
2.1仪器与试药
仪器:Agilent1260高效液相色谱仪、Agilent1290高效液相色谱(Agilent 公司);QTRAP 5500MS/MS系统(Agilent 公司);转瓶装置(Rotating Bottle Apparatus,Agilent 公司);流通池(推荐使用华溶DS-7CP流池法溶出系统);真空脱气仪(推荐使用华溶DGU-900在线溶媒脱气机);Fresco21 XIR台式离心机(ThermoHeraeus 公 司);VORTEX 多功能漩涡混合器(Scientific公司); Turbo Vap 蒸发仪(Biotage 公司)。
试药:醋酸奥曲肽对照品(批号140730-201303,含量87.6%,中国食品药品检定研究院);13C6-Lys Octreotide Tri(TRC 公司);注射用醋酸奥曲肽微球和溶 媒样品(生产企业 A、生产企业 B);滤膜(GF/F:0.7 μm,批号 9565828,GF/D:2.7 μm,批号 9739611,Whatman 公司);滤头(2μm;Upchurch公司);固相萃取柱(Oasis WCX 1 cc/30 mg,30µm,WATERS OASIS 公司)。
试剂:甲醇(批号SB6SF66072;MERCK 公司)、 甲酸(批号402907,FLUKA 公司); 丙酸(批号SHBC7498V,FLUKA公司);磷酸(≥ 85.0%)、冰醋酸(≥99.5%)、三水乙酸钠(≥99.0%)、氯化钠 (≥99.5%)、氯化铵(≥99.5%)均来源国药集团化学试剂有限公司;四甲基氢氧化铵五水合物(97%,北京百灵威科技有限公司);乙腈(99%,Fisher Scientific 公司);十二烷基硫酸钠(批号100809-201302,≥ 95%,中国食品药品检定研究院)。
2.2 体外释放度测定——转瓶法
缓冲液(pH4.0):称取0.9g冰醋酸,用250mL水溶解,用5mol ·L-1氢氧化钠溶液调节pH4.0。加入5.25g十二烷基硫酸钠,慢慢搅拌使溶解。缓冲液(pH7.0):称取 1.35 g 氯化铵至250mL量瓶,用水溶解后用三乙胺调节pH为7.0±0.1。 加入5.25g十二烷基硫酸钠,慢慢搅拌使溶解。缓冲液(pH10):称取2.7g氯化铵至500 mL 量瓶,用450mL水溶解,量取6.0mL三乙胺加入瓶中,混匀,用水定容至刻度。用三乙胺调节pH为10.0±0.1,加入10.5 g十二烷基硫酸钠,慢慢搅拌使溶解。
供试品溶液:取适量微球,置40mL 转瓶中,加入30mL 缓冲液,拧紧瓶盖,立即将转瓶与装置连接并开始旋转。在1、4、24h 从装置上移除转瓶,取出500μL,过滤,将300μL 滤液倒回转瓶中,将剩下的200 μL滤液置于自动进样瓶中。
2.2.2实验装置
水浴转瓶装置(Rotating Bottle Apparatus,Agilent 公司)。
2.3 体外释放度测定——流池法
2.3.1 试液配制
缓冲液(pH 4、7、10):同“2.2”项下方法。
供试品溶液:取适量微球,置样品池中,加入60mL 缓冲液于瓶中。在 1、4、8、12、24、36、48h时取 出500μL 等分部分,过滤,将300μL滤液倒回瓶中, 将剩下的200μL 滤液置于自动进样瓶中。
2.3.2 实验装置
采用美国药典溶出度测定第Ⅳ 法 - 流池法装置。
2.4 HPLC 条件
色谱柱:Brownlee NEW GUARD,RP-18,Aquapor,(7 μm,3 mm×15mm),Brownlee Spheri-5,RP-18(5 μm,4.6 mm×100mm );流动相:水-乙腈 - 四甲基氢 氧化铵溶液(1200 ∶600 ∶200 );流速:1.2mL ·min-1;检测器DAD;检测波长:210nm;柱温:室温;进样器温度: 8 ℃; 进样体积:10μL;等度洗脱。
2.5 体内释放测定
2.5.1 动物实验
供试品溶液制备:分别精密称取微球样品(生产厂A和B)适量,加入溶媒5mL,配制成质量浓度约为2mg ·mL-1混悬液。
动物与给药:取18只雄性成年鼠,体重为200~ 250g,均分为3 组,分别为A 组、B组、空白组,每组6只。按给药体积为1.0 mL ·kg-1,对A组、B组分别肌肉注射给药样品 A、B混悬液,各组应在5min之内完成给药,避免悬浮液中沉淀生成。
样品的采集与储存:于 0、0.25、0.5、1、2、6 h 和 1、2、3、4、7、9、11、13、15、18、21、25、28、32、35、42、 49、56 d 从 SD 大鼠的眼眶后静脉丛采血0.5mL,将血液加入预置5µL浓度为50 TIU ·mL-1的抑肽酶和5µL肝素的抗吸附EP管中(冰盒上),混匀。4℃下,12000r ·min-1离心10min,取上清液至另一抗吸 附EP管中,-80℃保存待测。
2.5.2 样品前处理
精密移取大鼠空白血浆100µL,加稀释液(甲醇-水-甲酸(60∶40∶0.2 )100µL,内标(13C 6Octretide 20 ng ·mL-1 )100µL,于1.5mL 离心管中,加入4% 磷酸水溶液100 µL,混匀;活化固相萃取柱;将样品加于固相萃取柱中后离心,先后加洗涤液,离心洗去杂质,再加入洗脱液洗脱样品,离心( 1 000 r ·min-1,2 min )用玻璃管收集洗脱液;洗脱液 置于50 ℃水浴,N2吹干后,用100µL稀释液溶解后进样至液相色谱质谱仪。
2.5.3 LC-MS 分析法
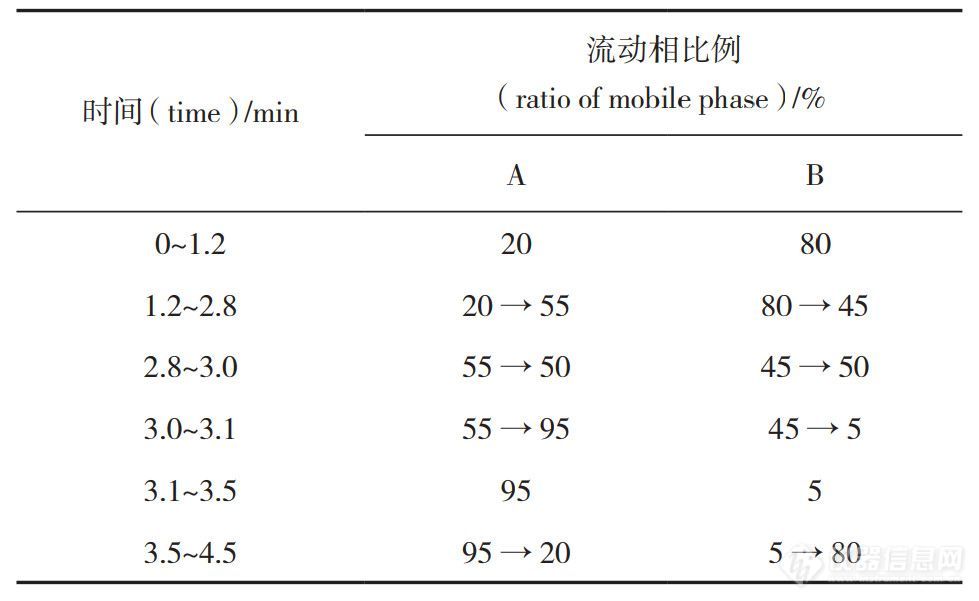
色谱条件:色谱柱Eclipse plus RRHD C18(50mm×2.1mm,1.8 μm ),流动相甲醇(A )-0.02% 丙酸水溶液(B),流速0.5mL ·min-1,柱温 45℃,进样体积10μL,梯度洗脱(见表 1)。
表 1 梯度洗脱程序
质谱条件:离子源,电喷雾离子化源,正电子方式检测;温度 500 ℃ ; 气帘气体(CUR,N2 )压力0.2MPa;离子喷射电压 5000 V;源内气体1(GS1,N2 )压力0.4 MPa;源内气体 1( GS2 ,N2)压力0.4 MPa;扫描方式,多反应监测(MRM );奥曲肽m/z 510.4>120.1;去簇电压(DP)120V;碰撞能量(CE),25 V;内标13C6Octretidem/z513.5>120.1;去簇电压 (DP)100 V;碰撞能量(CE):25V
三、结果
3.1体外加速释放实验影响因素考察
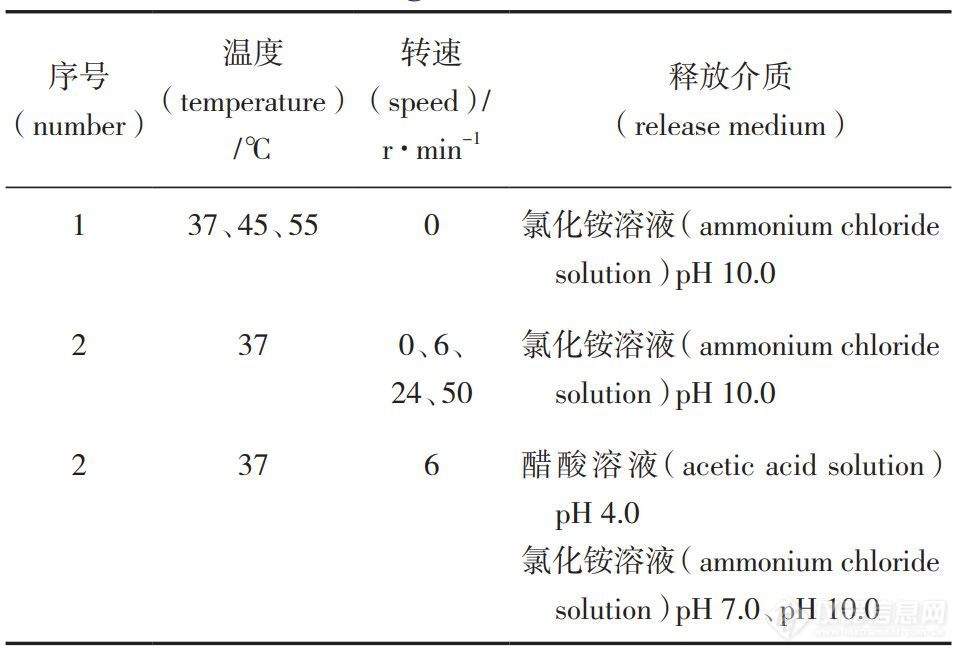
3.1.1 转瓶实验法影响因素
转瓶法实验按照表2设计进行,实验因素考察结果见图1。温度:如图1-a所示,4h内微球在45℃、55 ℃条件下释放较慢,推测是由于高温使聚合物 PLGA 发生形态变化,闭合了表面孔隙从而减少了药物的扩散;4h后在 55 ℃时条件下微球中药物释放突增,推测是由于更高的温度加快了聚合物的溶蚀作用,这与文献报道相一致; 在37℃下释放平稳且24h释放量超过 60%。综合考虑,最终选择37℃作为体外加速释放试验的温度。
转速:由图1-b可见,转瓶法转速24 r ·min-1以 内,转速增加释放增多,转速超过24r ·min-1释放并未继续增加。
释放介质:如图1-c所示,pH 4.0、pH 7.0 条件下24h内基本不释放,pH10条件下24h内释放量超过60%。根据酸碱催化理论,大量的氢离子或氢氧根离子都会诱导 PLGA 内酯键裂解,从而达到加速释放的目的。
转瓶法体外加速释放条件最后选择为温度37℃、转速 6 r·min-1、pH10 释放介质。
表 2 转瓶法实验条件
3.1.2 流通池实验法影响因素
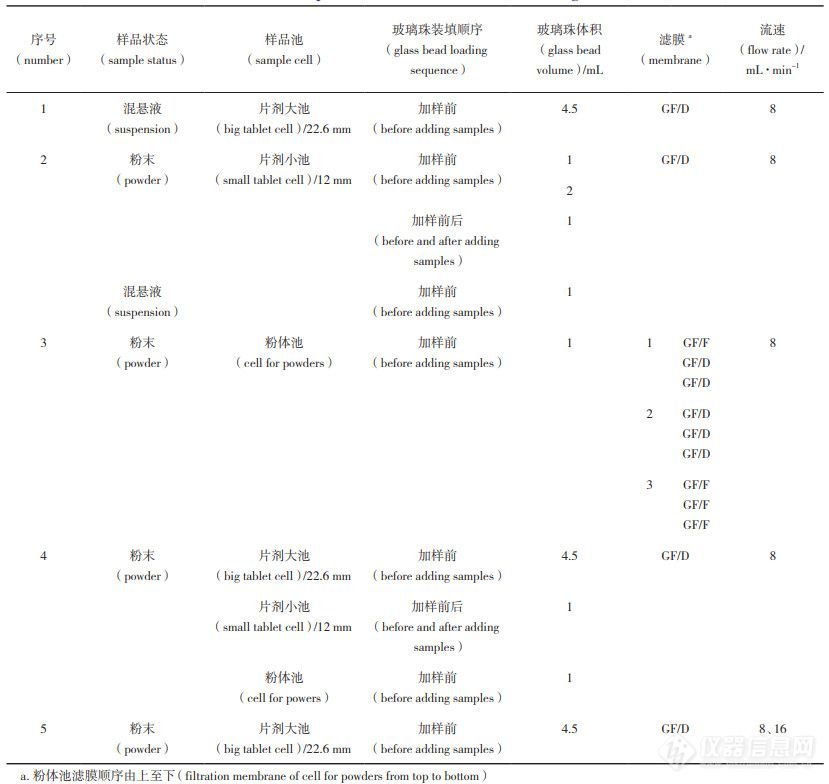
在转瓶法实验条件基础上,利用流通池对玻璃珠及样品装填方式、粉体池滤膜、样品池、样品浓度、流速等条件进行考察,实验按照表3设计进行。
图 1 不同影响因素的释放度曲线
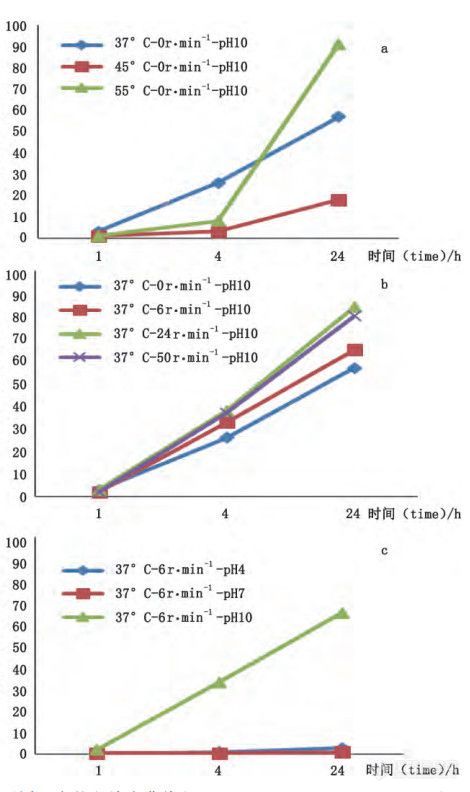
a. 不同温度的释放度曲线
b. 不同转速的释放度曲线
c. 不同缓 冲液的释放度曲线
样品量:由图2-a 可见,含 3.10 mg ·mL-1 奥曲肽的混悬液释放最快。
玻璃珠体积及样品装填方式:由图 2-b 可见,玻璃珠体积、溶媒的加入对微球释放的影响较小,加样前后均加入玻璃珠释放较快。
粉体池中过滤膜:膜的典型排列方式如图3,由图2-c结果可见,膜的排列方式对释放的影响不大。
样品池:由图2-d可见,使用片剂大池(22.6 mm )、片剂小池(12 mm)、粉体池的释放度依次递减,这可能是由于片剂小池(12 mm)和粉体池的体积较小,微球中PLGA溶胀后易堵住过滤器而造成的。
流速:从图2-e 可知,流速增加释放度增大。
表 3 流池法实验条件
流池法最后选择的条件为温度37 ℃、片剂大池、流速16 mL ·min-1、pH 10释放介质。
3.2 体外加速释放度测定
本研究通过改变温度、pH、转速/流速等条件加 速了药物从PLGA微球中释放,最终建立了流池法体外加速释放测定方法,分别测定不同企业微球样品,并与转瓶法结果进行对比。由表4 可见,2种方法测定的体外加速释放度,4h后样品A的释放度均大于 样品B,且采用流池法测定体外释放度,样品A和B的释放度均明显大于转瓶法。
3.3 体内释放测定
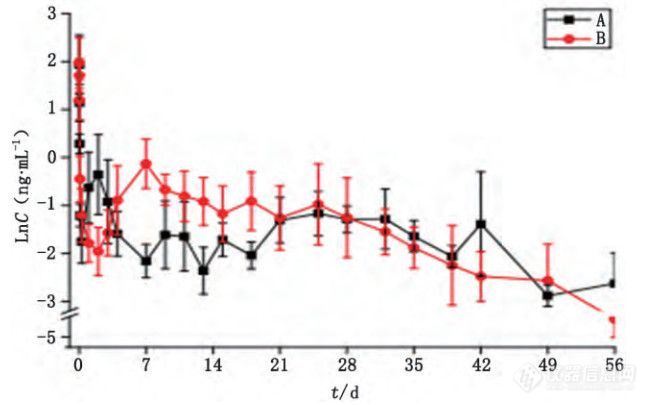
微球经皮下或肌肉注射给药后,药物从微球中释放后通过皮下或骨骼肌的结缔组织扩散,再经毛细血管吸收进入血液循环分布到靶器官发挥药效。本文利用大鼠对2家企业的醋酸奥曲肽微球 进行体内释放试验,通过LC-MS 检测大鼠体内奥曲 肽血药浓度,研究该微球制剂药物的体内释放行为。 A、B 2 组大鼠血浆中奥曲肽浓度测定结果见图 4。
图 2 流池法释放曲线
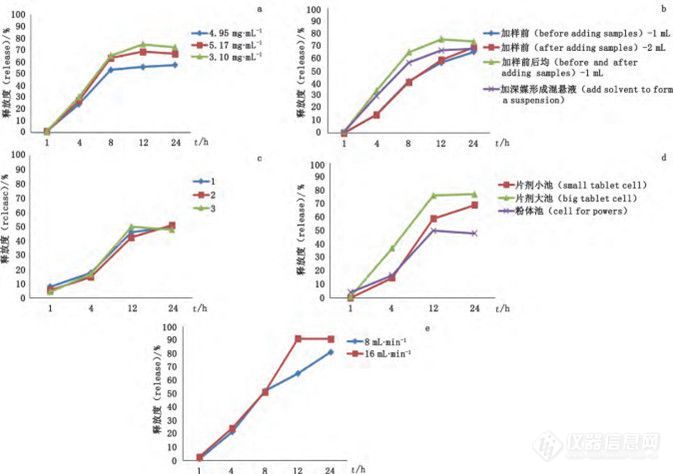
a. 不同浓度
b. 不同玻璃珠体积及样品装填方式
c. 不同膜排序方式
d. 不同样品池
e. 不同流速的释放曲线
图 3 膜的典型排列方式
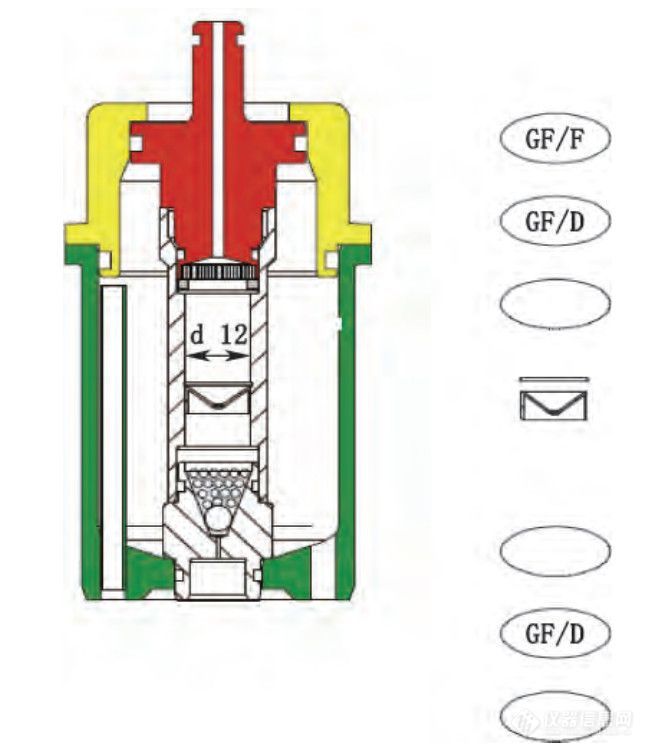
表 4 体外加速试验释放度结果( mean±SD,%,n=6)
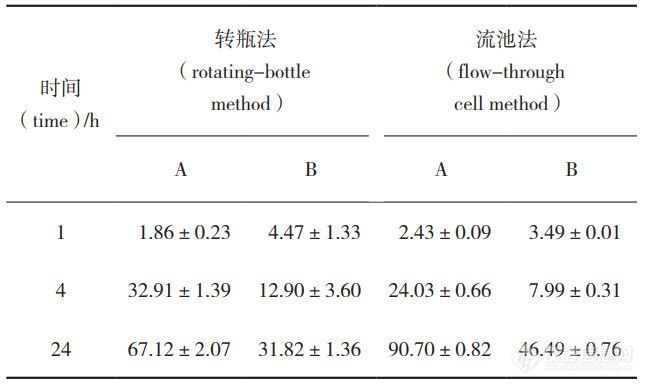
图 4 A、B 组大鼠平均血浆奥曲肽浓度
四、讨论
4.1 体外加速释放测定方法
对比2种体外加速释放测定方法,转瓶法的操作更为简单,但需注意取样时勿粘取微球造成损失,导致释放结果偏低;流通池法需要选择合适的样品池,避免微球溶胀,池内压力过大,导致释放结果不准确。 微球样品在流池法条件下的释放速率快于转瓶法,针对释放机制为扩散和溶蚀作用的微球而言,流池法更为适合作为体外加速释放的测定方法。
4.2 体内释放曲线和数学模型
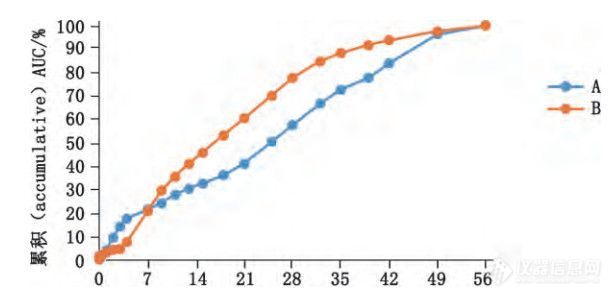
将大鼠体内释放数据与流池法体外加速释放数据利用Origin Pro 8.0软件进行相关性分析。根据D’SouzaS等。的研究,体内释放度可以利用曲线下面积的百分数所表示,图5为微球样品 A、B 的体内释放曲线。
图 5 样品 A、B 的体内释放度
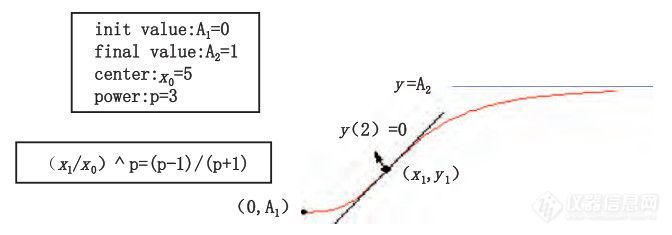
对体内释放数据利用Origin Pro 8.0 软件中的Boltzmann、Logistic 等数学模型拟合曲线。Boltzmann方程:y=A2+(A1-A2 )/(1+exp(x-x0/dx))见图6Boltzmann曲线;Logistic 方程:y=A2+(A1-A2 )/( 1+(x/x0 )p )见图7Logistic曲线。
图 6 Boltzmann 曲线
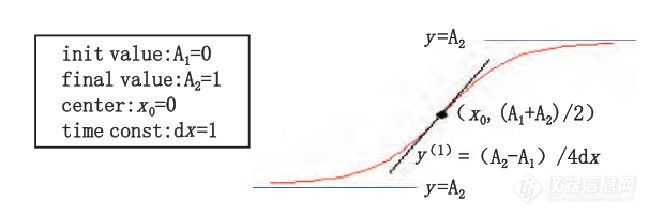
图 7 Logistic 曲线
4.3 体内外释放度分析
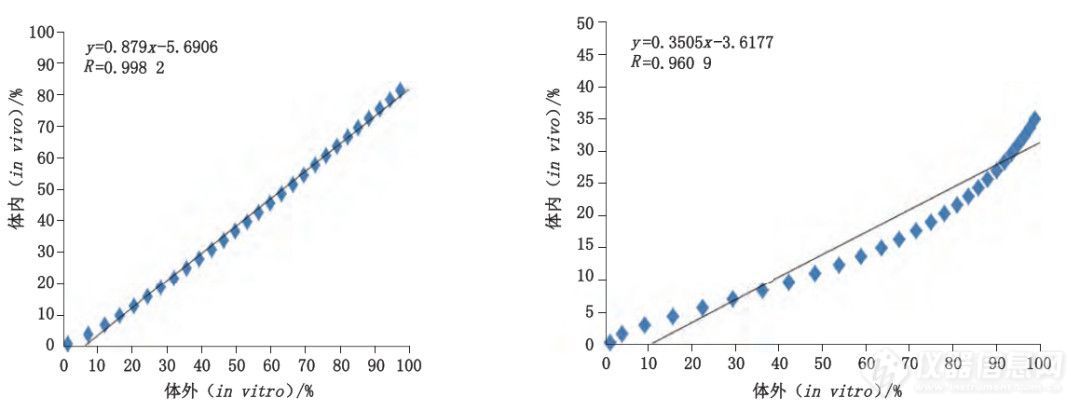
本文结合体内药动学研究,对体内与体外释放数据进行分析,探索体外加速释放-体内释放的相关性。由表5和图8-10可见,体外加速释放(流池 法)线性拟合后,与将体内释放拟合曲线对应的点利用最小二乘法进行线性回归。微球样品 A、B体外加速释放线性拟合曲线的决定系数r2分别为0.987 3、0.9275;对体外加速释放-体内释放进行线性回归相关性分析,样品A、B回归直线的相关系数r分别为0.9982、0.9609。
结果表明,采用流池法测定体外加速释放度,微球样品A和样品B的体外释放与体内释放均具有良好的相关性。
五、小结
本文以注射用醋酸奥曲肽微球为研究对象,进行了体外释放度测定方法研究和体内外释放相关性初步研究。通过体外加速释放试验方法研究,探索了影响奥曲肽微球释放的因素,如温度、pH、转速、流速、样品池的种类、膜的排列方式、玻璃珠以及样品装填方式等。建立了流池法测定奥曲肽微球制剂的释放度,并比较了与转瓶法的适用性。通过体内外释放相关性的探索性研究,建立了体内释放、体外加速释放的拟合曲线,结果表明体外加速释放与体内释放呈线性相关。本文建立的体外加速释放流通池测定方法对于不同微球样品有较好的区分力和良好的体内外线性相关,可用于注射液醋酸奥曲肽微球的质量控制,与FDA推荐的PLGA缓释微球体外释放分析策
图8 不同数学模型的样品体内吸收拟合曲线
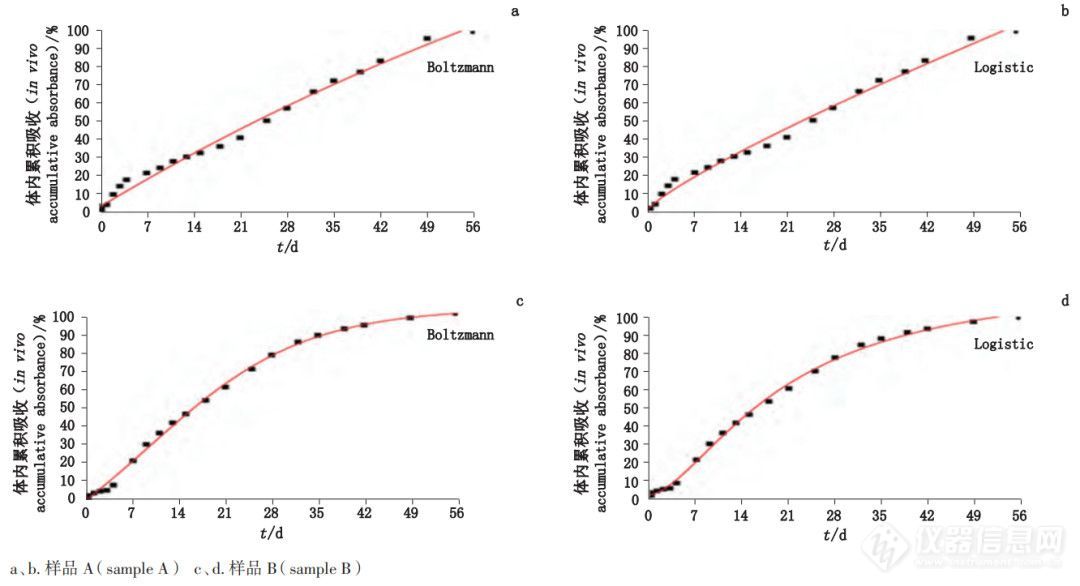
a、b. 样品 A c、d. 样品 B
表 5 体内释放 - 体外加速释放相关性分析
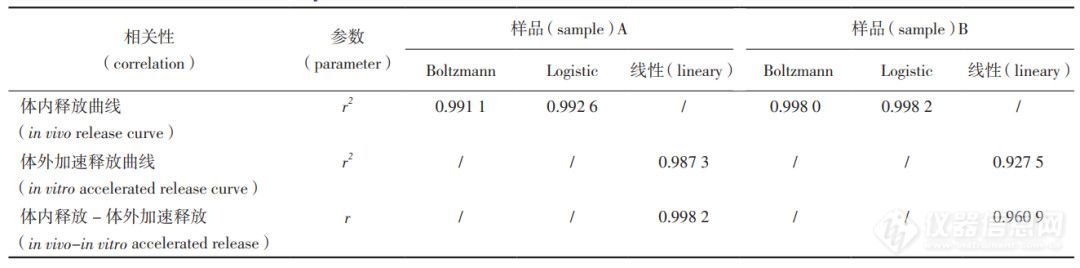
图 9 样品 A( a )、B( b )体外加速释放曲线
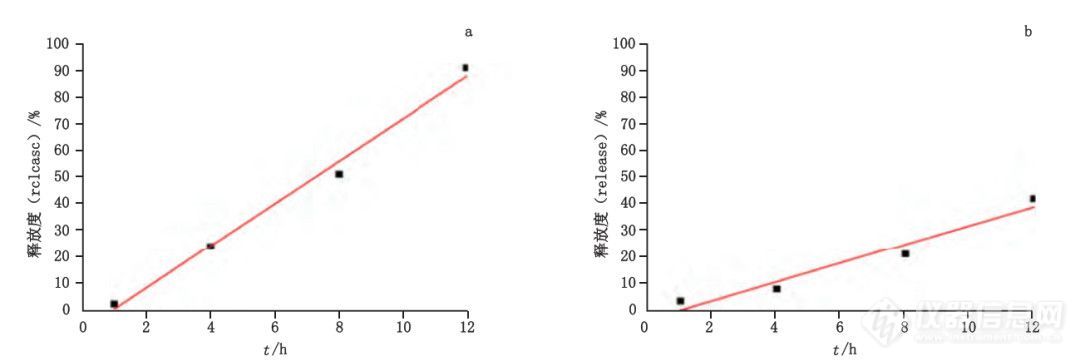
图 10 样品 A、B体内 - 体外加速释放相关性
略一致,本研究为评价奥曲肽微球制剂的体外释放度提供了新的测定方法,为深入开展肽类缓释注射剂体内药代参数的预测研究积累了技术数据。
六、参考文献
略
下载本篇解决方案:
更多![]()
好文推荐 |依匹哌唑原位凝胶植入剂的体外释放研究
目的 建立一种依匹哌唑原位凝胶植入剂的体外释放方法,研究处方在体外的释放行为和缓释机制。 方法 以抗精神病依匹哌唑为模型药物,制备以聚乳酸⁃羟基乙酸共聚物( polylactide gly⁃ colic acid,PLGA)/醋酸异丁酸蔗糖酯( sucrose acetate isobutyrate,SAIB)为基质的原位凝胶植入剂。开发体外释放检测方法,采用多种体外释放装置研究依匹哌唑原位凝胶植入剂的释放差异, 考察体外释放的影响因素。
制药/生物制药
2024/06/24
好文推荐 | 水杨酸片在流池法溶出仪性能验证试验中的应用
流池法溶出仪是控释剂型、难溶性药物和许多特殊剂型(如混悬液、软胶囊、植入剂、微球和脂质体)溶出度测试的首选仪器。虽然流池法溶出仪已列入药典多年,但一直没有正式的性能验证试验(PVT)方法。在这项研究中,水杨酸片被用来开发流池法的PVT。水杨酸片在篮法和桨法装置上相同的溶蚀和零级释放机制,可作为流池法装置中PVT的潜在参考标准品。在第一阶段,采用实验设计法(DoE)系统考察了四个参数对水杨酸片溶出度的影响。片剂装载方式是影响溶出度的最重要参数;流速和池体内径(ID)也有显著影响,温度对溶出的影响可以忽略不计。在第二阶段,由四名不同的分析人员在不同的流池法装置上(即四名合作者)进行溶出试验,以进行重复性和重现性评估,并确定PVT的初步可接收标准。第二阶段的实验条件是将片剂放置在带有玻璃珠的片剂支架上,池体ID为12 mm,流速为16 mL/min,温度为37℃,90分钟采集样品。第五个合作者的数据证实了PVT的可重复性。
制药/生物制药
2024/06/14
介质脱气小能手 | 华溶DGU-900在线溶媒脱气机,只为溶出仪而生
在进行溶出实验过程中,介质中溶解气体的释放是影响溶出结果的主要变动因素之一。因此,对溶出介质进行脱气处理变得尤为重要,并应将具体脱气程序写入溶出检测操作的标准操作规程。
制药/生物制药
2024/04/15
好文推荐 | 奈帕芬胺眼用混悬液的体外释放试验方法
体外释放试验(IVRT)方法对于监测制药生产过程中批次间的质量变化以及表现仿制药与原研药的药物等效性非常重要。为了满足批准眼用混悬液仿制药的监管要求,需要进行体外释放研究。目前尚无药典或非药典方法用于奈帕芬胺眼用混悬液的体外释放研究。 目前的研究旨在筛选使用不同的常规和非常规的各种方法,以建立最合适的奈帕芬胺眼用混悬液的技术,然后优化方法参数并进行验证。试验使用带透析袋的桨法装置(USP 2型)、流通池装置(USP 4型)、水浴转瓶装置和Franz扩散池装置。使用USP 4型装置,在pH 7.4的模拟泪液(STF)中,药物在120分钟内的释放度约为83%,添加表面活性剂月桂醇硫酸酯钠(SLS)后,释放度增加到约97%。使用USP 2型和Franz扩散池装置,药物释放缓慢或未接近完全释放。然而,在水浴转瓶装置的情况下,观察到了突释曲线。药物释放量的估计是通过HPLC方法进行的,所有方法验证参数,如专属性、准确度、线性和精密度都在可接受标准范围内。
制药/生物制药
2024/04/02










