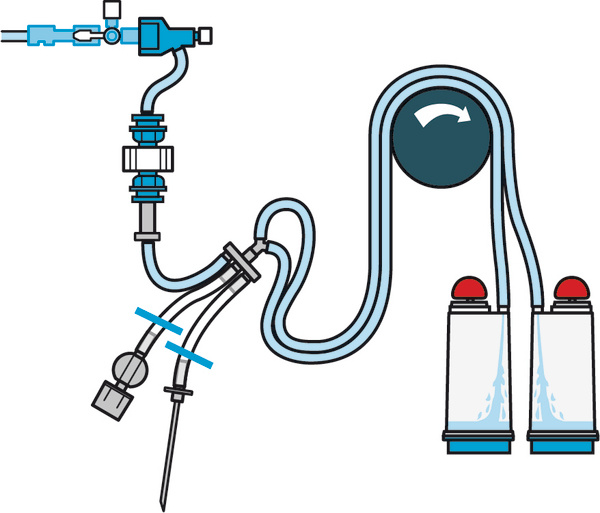
密理博 适用于医疗器械测试的 Steritest 装置 TZHAMD210
Steritest EZ 无菌检验套筒• 新颖的设计令使用更方便:管理预装卡箍,带翼的红色塞子,有标记区分的管路• 进口设计减少了泡沫的产生,提高了过滤速度• 双层包装设计,方便了洁净室内的传递,降低了传递过程的污染• 人体工程学设计的针头适配器,使操作人员更易使用,且保证了检验的安全可靠• 标准的自动化生产流程,百分百的测试检验体系,保证了套筒的高质量** 产品信息描述产品目录编号TZHAMD210ReplacesTTHA MD2 10商名Steritest描述适用于医疗器械测试的 Steritest 装置概述The Steritest™ NEO Device for medial devices provides three adapters: male Luer, female Luer or single needle allow connection to a variety of test devices. A separate vent is used for the transfer of culture media or rinse buffer. The Steritest™ NEO Device for medical devices can be used with NovaSepturn® for sterile sampling devices. The blue canister base indicates mixed ester of cellulose membrane. This membrane provides an optimal filtration flow rate for standard products.产品信息Device Configuration2 个滤罐色码蓝色最 大入口压力[巴(psi)]3.1 bar (45 psi) @ 25°C最 高工作温度45 °C应用应用医疗器械主要应用Pharmaceutical Sterility TestingSterility TestingUSP 71生物信息媒质MF-Millipore灭菌伽马射线灭菌理化信息孔径0.45 μm尺寸体积120 mL (graduation marks at 50, 75 and 100 mL)材料信息化学混合纤维素酯(MCE)装置材料苯乙烯 丙烯腈结构材料PVC双腔管,850mm长,不锈钢和聚酰胺6-6针头适配器包装信息数量10订货信息Steritest EZ蓝色底座套筒(0.45μm MCE膜,SAN滤杯)样品类型数量/包装货号安瓿瓶或软袋液体注射剂10TZHALA210玻璃瓶大容量液体注射剂10TZHALV210西林瓶小容量液体注射剂10TZHASV210塑料瓶液体注射剂10TZHAPC210安瓿瓶可溶性粉针剂10TZHADA210西林瓶可溶性粉针剂10TZHADV210医疗器械及带有Luer接口的软袋或导管类产品10TZHAMD210预装针10TZHASY210Steritest EZ蓝色底座套筒,双层包装(0.45μm MCE膜,SAN滤杯)样品类型数量/包装货号安瓿瓶或软袋液体注射剂10TZHALA205玻璃瓶大容量液体注射剂10TZHALV205西林瓶小容量液体注射剂10TZHASV205Steritest EZ红色底座套筒(0.45μm PVDF膜,SAN滤杯)样品类型数量/包装货号抗生素类或含抑菌物质的液体注射剂10TZHVAB210抗生素类或含抑菌物质的粉针剂10TZHVDV210Steritest EZ绿色底座套筒(0.45μm PVDF膜,尼龙滤杯)样品类型数量/包装货号有机溶剂,乳膏剂,软膏剂和兽用注射剂10TZHVSL210Steridilutor复溶稀释装置样品类型数量/包装货号带扩展室的Steridilutor装置1TZVC00010不带扩展室的Steridilutor EZ装置1TZV000010单针头液体转移套件1TZA000010无菌检查培养基以及冲洗液Fluid Thioglycollate Medium(USP/EP/JP)硫乙醇酸盐培养基1.08191.0500500gTryptic Soy Broth(USP/EP/JP)胰蛋白胨大豆肉汤1.05459.0500500gTrypcase Soy Broth胰酪大豆胨液体培养基STBMTSB12100ml×12瓶Fluid Thioglycollate Medium硫乙醇酸盐液体培养基STBMFTM12100ml×12瓶Trypcase Soy Broth胰酪大豆胨液体培养基,双层包装STBMTSB12DP100ml×12瓶Fluid Thioglycollate Medium硫乙醇酸盐液体培养基,双层包装STBMFTM12DP100ml×12瓶USP Rinse Fluid A0.1%无菌蛋白胨水溶液,冲洗液ASTBMRFA12100ml×12瓶USP Rinse Fluid A0.1%无菌蛋白胨水溶液,冲洗液A,双层包装STBMRFA12DP100ml×12瓶USP Rinse Fluid A0.1%无菌蛋白胨水溶液,冲洗液ASTBMRFA34300ml×4瓶USP Rinse Fluid A0.1%无菌蛋白胨水溶液,冲洗液ASTBMRFA64600ml×4瓶USP Rinse Fluid A0.1%无菌蛋白胨水溶液,冲洗液ASTBMRFA94900ml×4瓶USP Rinse Fluid D0.1%无菌蛋白胨水溶液,含吐温80,冲洗液DSTBMRFD34300ml×4瓶USP Rinse Fluid K0.1%无菌蛋白胨水溶液,含吐温80,牛肉膏,冲洗液KSTBMRFK34300ml×4瓶默克密理博Steritest™ Symbio无菌检测公司简介默克密理博是德国默克集团旗下的生命科学部门。为生命科学领域提供广泛的创新的高性能产品、服务以及专业的合作。在新科学和工程领域专业的视角与合作,位列全球三大生命科学研发合作伙伴之一,默克密理博将成为生命科学领域的客户们战略伙伴,帮助他们提升其在生命科学的能力。默克密理博总部位于美国马萨诸塞州的比尔里卡。默克是全球知名的无菌测试专家。1974年我们首次推出了Steritest 封闭式过滤系统时,我们已成功实现安全可靠的无菌测试。使用新一代智能无菌检测系统Steritest Symbio泵,使无菌测试更安全可靠,操作更简便。加快您的工作流程,提高工作效率,最 大程度地提高安全性、可信度和便利性。产品简介易于使用的独特设计降低了泵的高度,使其更方便层流台内操作。Steritest Symbio泵结构紧凑,无需占用隔离器内的工作空间,提高了隔离器的装载能力。可适用于垂直气流和水平气流。可靠自动泵头外罩确保可快速简便地安装一次性过滤套筒以及更准确地分流液体样品。高精度计时功能:可以非常高的精度提取非常少量的样品。安全适用于洁净室的硬件:气密性极 佳的外壳和被动式冷却方式可防止颗粒物散发。两种压力模式—包括自动泵速降低—可提醒操作人员,减少测试中的风险,最 大程度减少可能存在的对各种微生物的伤害。易于清洗,适用于各种隔离器消毒剂。符合人体工程学要求外壳符合人体工程学要求的外形使用户更便于装载管路;无任何夹紧手套和因此导致的测试中断的风险。可调瓶托高度,可倾斜显示屏,使屏幕具有更完美的可见性。专业设计的按钮,便于隔离手套进行操作。11cm(4.3寸)彩色LCD屏上可显示清晰的用户界面。可选择操作语言(简体中文、英语、法语、德语、意大利语、日语、葡萄牙语或西班牙语)。测试方法库:可存储高达250个过滤规程,并且可在LCD屏上一步一步地按这些规程进行操作。操作简便,测试可靠,重复率高一步一步的屏幕指导您正在使用不同的测试程序测试许多产品吗?是否担心混杂各种过滤速度、稀释液体或大量冲洗步骤?是否非常烦恼手动更改速度和计时器数值?是否想要在不同操作人员进行操作的情况下仍能保证较高的重复性?无论何种原因,Steritest Symbio泵都可完全保护您的测试程序,确保测试方法的重复性,并帮助您节省宝贵的时间。测试方法模式可以一种非常简便的一步一步的方式显示无菌测试规程,包括用户定制的处理信息。可在Steritest Symbio泵的测试方法库中非常简便地选择所需的测试规程。可显示测试方法修订编号,以便进行合规性检查,该方法也可显示所需使用的正确的Steritest™ 一次性过滤套筒。由于预先设置了速度和计时器值、自动启动注射器稀释配件或压力调节模式,您将大大节省宝贵的实验时间。• 三种型号适用于洁净室,层流台和隔离器版本• 泵头自动闭合,监测套筒管子的位置,简单安全• 压力监测模式,减低微生物受压,保证人员安全• 测试方法管理软件,每一步操作显示在大屏幕上• 仪器安装,IQ/OQ验证,维护服务,满足法规要求技术参数主要组件与材质*泵外壳,泵保护盖,泵头,泵手柄,排水托盘,样品支架,调节按钮,显示屏外壳316L不锈钢*显示屏钢化玻璃*泵操作面板聚酯纤维高温灭菌泵保护盖,泵手柄,排水托盘,样品支架,121℃30 minutes或134℃10 minutes化学消毒剂耐受性H2O2等多种化学消毒剂以及UV耐受泵体尺寸LFH层流台:633mm×372mm×410mmISL隔离器:588mm×313mm×354mmFLEX隔离器:611mm×361mm×356mm检测方法管理软件250种检测方法,USB/数据线传输泵速1-150,大样品量的过滤速度计时器0.5 to 999,小样品量精确定量Steritest™ Symbio-3 无菌检测系统Steritest™ Symbio LFH-3 Steritest™ Symbio ISL-3 Steritest™ Symbio FLEX-3订货信息产品描述数量/包装货号Steritest™ Symbio LFH 3头1SYMBLFH03CNSteritest™ Symbio ISL 3头1SYMBISL03CNSteritest™ Symbio FLEX 3头1SYMBFLE03CNIQ/OQ验证文本1SYMBA4VP1泵脚踏开关1SYMBFSW01Steritest™ Symbio-2 无菌检测系统Steritest™ Symbio LFH-2 Steritest™ Symbio ISL-2 Steritest™ Symbio FLEX-2订货信息产品描述数量/包装货号Steritest™ Symbio LFH 2头1SYMBLFH01CNSteritest™ Symbio ISL 2头1SYMBISL01CNSteritest™ Symbio FLEX 2头1SYMBFLE01CNIQ/OQ验证文本1SYMBA4VP1泵脚踏开关1SYMBFSW01SteriSecure 无菌检验套筒订货信息SteriSecure两头无菌检测套筒 (0.45μm MCE, SAN滤杯)样品类型数量/包装货号安瓿瓶或软袋液体注射剂10CNHALA210玻璃瓶大容量液体注射剂10CNHALV210西林瓶小容量液体注射剂10CNHASV210SteriSecure三头无菌检测套筒 (0.45μm MCE, SAN滤杯)安瓿瓶或软袋液体注射剂10CNHALA310西林瓶粉针剂10CNHALV310西林瓶小容量液体注射剂10CNHASV310

 400-860-5168转6027
400-860-5168转6027
 留言咨询
留言咨询

 400-860-5168转4226
400-860-5168转4226
 留言咨询
留言咨询

 400-860-5168转2141
400-860-5168转2141
 留言咨询
留言咨询