推荐厂家
暂无
暂无




 400-860-5168转0230
400-860-5168转0230
 留言咨询
留言咨询

 400-886-5615
400-886-5615
 留言咨询
留言咨询

 400-825-5669
400-825-5669
 留言咨询
留言咨询

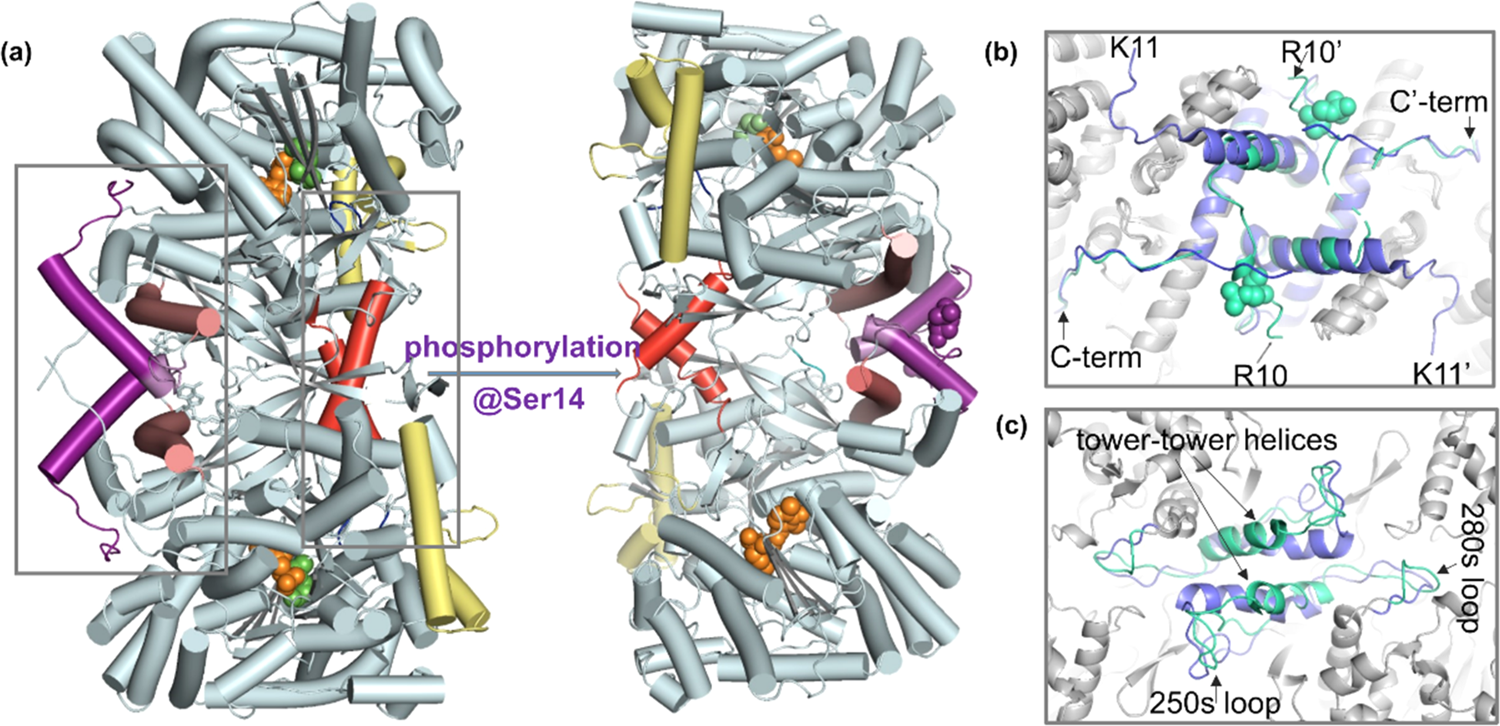
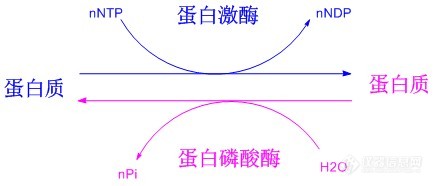
生命活动与蛋白质的动态变化密切相关, 很多情况下某些蛋白质是通过各种翻译后修饰来完成或改变其功能。在数量众多的蛋白质翻译后修饰中,蛋白质磷酸化修饰无疑是最重要的一类,它是指通过蛋白激酶(Protein kinase,PK)介导的酶促反应把磷酸基团从一个化合物转移到另一个化合物上的过程(Figure 1所示),是生物体内存在的一种普遍的调节方式。现今发现的所有人类蛋白质中超过30%可被磷酸化修饰,这一修饰在细胞信号的传递过程中占有极其重要的地位,与生命活动的许多过程都密切相关,对此的研究已经成为蛋白质科学的热点之一。 http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918444_small.jpg磷酸化多肽(主要指肽链中的酪氨酸、丝氨酸和苏氨酸残基的侧链羟基被磷酸化生成酸式磷酸酯的修饰多肽)是研究蛋白质磷酸化过程的必不可少的工具,它可作为磷酸酶模型底物,或作为可产生抗磷酸化蛋白抗体的抗原,也可以在确定磷酸化蛋白的物理参数时作为参考化合物等。因此磷酸化多肽的合成在过去的几年中吸引了相当大的兴趣,目前已确定了较为成熟的合成路线,使磷酸化多肽的合成趋于常规。目前磷酸化多肽的合成主要有两个策略:后磷酸化法(Global phosphorylation)和单体法(Building block approach),如Figure 2所示。前者是在多肽序列合成结束后再在固相载体上对丝氨酸、苏氨酸或酪氨酸的侧链羟基进行磷酸化,可以在同一次合成中同时得到带有和不带有磷酸化位点的多肽;而后者则将适当保护的磷酸化氨基酸直接引入到多肽序列中,操作较前者更为简单,现已成为磷酸化多肽合成的首选策略。在采用单体法构建磷酸化多肽时,目前广泛采用的原料为侧链单苄基保护的氨基酸:Fmoc-AA(PO(OBzl)OH)-OH (AA = Ser, Thr or Tyr)。这类保护的磷酸化位点由于侧链磷酸化基团的离子化而产生较大的位阻效应,并且磷酸化位点的引入往往能促进肽链二级结构的形成,故而磷酸化位点及其后的氨基酸的引入会比较困难。这些问题在合成含有多个磷酸化位点的多肽时将会变得尤为严重,往往会使最终产物的组成非常复杂,难以进行纯化,甚至直接导致合成的失败。http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918477_small.jpg一般来讲,增加投料量和延长反应时间都能促使连接反应趋于完全,但增加投料量无疑会提高合成成本,对于较昂贵的带有保护的磷酸化氨基酸更是这样,而延长反应时间则可能增加其它副反应发生的风险,故而在合成磷酸化多肽时,需要对氨基酸投料量、反应方法以及反应时长等进行优化调整以期达到更理想、更经济的合成效果。我们有针对性地对磷酸化多肽合成条件进行了探索和调整,采用最终的优化条件成功合成了含有多达六个磷酸化丝氨酸残基的多肽:FAM-Ahx-X(pS)XX(pS)X(pS)X(pS)XX(pS)X(pS)-NH2(客户肽,详细序列未给出;其氨基端标记FAM以进行荧光检测),经过RP-HPLC纯化后最终纯品的纯度高达95%(见Figure 3)。http://img.dxycdn.com/trademd/upload/userfiles/image/2012/09/1346918493_small.jpg参考文献:1. P. Cohen, “The Role of Protein Phosphorylation in Neural and Hormonal Control of Cellular Activity”, Nature, 1982, 296 (5858): 613-620.2. From: http://en.wikipedia.org/wiki/Protein_kinase.3. L. A. Pinna, A. Donella-Deana, “Phosphorylated Synthetic Peptides as Tools for Studying Protein Phosphatases”, Biochim. Biophys. Acta., 1994, 1222 (3): 415-431.4. W. C. Chan, P. D. White, “Fmoc Solid Phase Peptide Synthesis-A Practical Approach” (2000), Oxford University Press.
磷酸化的Ser、Tyr和Thr修饰的多肽:我们国肽生物提供单磷酸化和多磷酸化多肽服务,目前我们已经能够提供四个磷酸化位点修饰的多肽。[img=,434,186]https://ng1.17img.cn/bbsfiles/images/2019/04/201904191649355554_2764_3531468_3.jpg!w434x186.jpg[/img][img=,486,498]https://ng1.17img.cn/bbsfiles/images/2019/04/201904191649358877_2957_3531468_3.jpg!w486x498.jpg[/img]我们主要提供:多肽定制、磷酸肽、生物素标记肽、荧光标记肽、同位素标记肽、人工胰岛素、药物肽、多肽合成、目录肽、偶联蛋白、化妆品肽、多肽文库构建、抗体服务、糖肽、订书肽、RGD环肽等。合肥国肽生物官网:http://www.bankpeptide.com欢迎咨询服务热线:17718122172;17718122684;17730030476;17718122397
[font=宋体]磷酸化抗体是一种特殊的抗体,能够识别并结合到已经被磷酸化的蛋白质。磷酸化是一种重要的蛋白质修饰方式,通过将磷酸基团结合到特定的氨基酸残基上,可以改变蛋白质的结构和功能。在许多生物学过程中,磷酸化都扮演着重要的角色,因此磷酸化抗体成为了研究生物学和生物化学的重要工具。[/font][font=宋体] [/font][font=宋体]蛋白质磷酸化是指蛋白在激酶作用下在特定氨基酸位点(最常见的是丝氨酸、苏氨酸、酪氨酸残基)发生磷酸化的过程。蛋白磷酸化是极其重要的翻译后修饰,其动态调控是信号转导中不可或缺的一环,调控着细胞生长、分化、代谢、凋亡等等过程。[/font][font=宋体] [/font][font=宋体]磷酸化抗体主要是针对磷酸化位点制备的,可以特异性识别磷酸化氨基酸位点,对磷酸化蛋白进行定性、定量分析,检测蛋白受刺激后磷酸化水平变化情况。[/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州可以为客户提供一系列具有高特异性(经内源性、磷酸化特异性等多方面验证)、高灵敏度([/font][font=Calibri]1:200000[/font][font=宋体]稀释度)特点的磷酸化抗体,满足[/font][font=Calibri]WB[/font][font=宋体]、[/font][font=Calibri]IHC[/font][font=宋体]等应用。同时我们还可以为客户提供定制化的磷酸化抗体定制服务。[/font][/font][font=宋体] [/font][font=宋体][b]义翘神州磷酸化抗体服务优势:[/b][/font][font=宋体] [/font][font=宋体][font=宋体]①专业高效的多肽设计软件及高效偶联方法,保证多肽免疫成功率[/font][font=Calibri]95%[/font][font=宋体]以上。[/font][/font][font=宋体]②多种纯化策略,正负筛选平台,确保得到高特异识别指定磷酸化位点的抗体。[/font][font=宋体]③竞争性的价格[/font][font=宋体] [/font][font=宋体] [/font][font=宋体][font=宋体]义翘神州提供多种生物的制备服务,包括磷酸化兔多克隆抗体制备服务、磷酸化鼠单克隆抗体制备服务、磷酸化兔单克隆抗体制备服务[/font][font=宋体]……详情可以关注[/font][font=Calibri]https://cn.sinobiological.com/services/phospho-specific-antibody-service[/font][/font][font=宋体] [/font][font=宋体]总之,义翘神州[url=https://cn.sinobiological.com/services/phospho-specific-antibody-service][b]磷酸化抗体定制服务[/b][/url]能够满足您的个性化需求,帮助您在研究领域获得更多的突破。我们致力于为您提供高质量、高效率的抗体定制服务,助力您的科研事业更上一层楼。[/font]