推荐厂家
暂无
暂无




 400-860-5168转3941
400-860-5168转3941
 留言咨询
留言咨询

 留言咨询
留言咨询

 400-860-5168转4655
400-860-5168转4655
 留言咨询
留言咨询


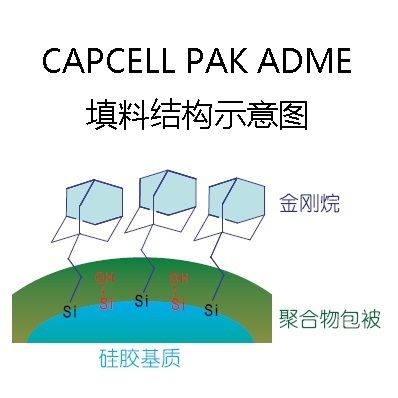
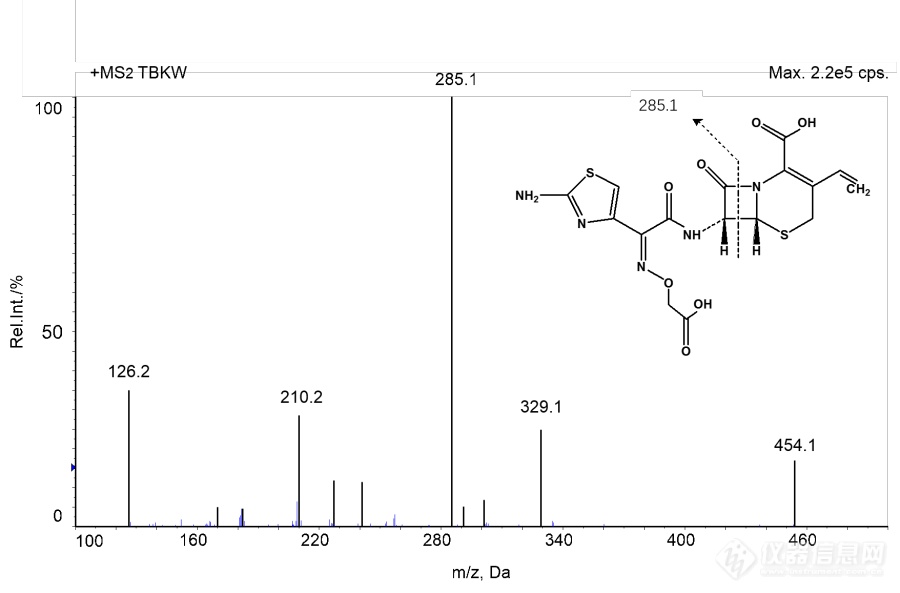
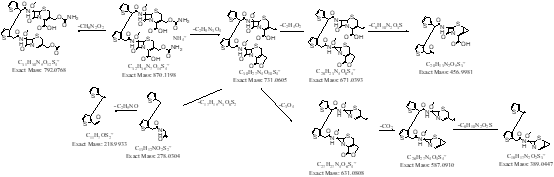
[align=left][b][size=32px][color=#ff0000]本篇文章暂不授权任何公众号发布[/color][/size][/b][/align][align=center][b]高脂肪饮食对头孢克肟片的药动学影响 [/b][/align][align=left][b]摘要:[/b]目的:研究比较空腹和高脂餐后单剂量口服用头孢克肟的药代动力学和生物利用度。方法:采用双交叉给药实验设计,12名健康男性受试者空腹及餐后单剂量口服1mg头孢克肟片,以头孢他美为内标,HP[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS法测定血药浓度,DAS 2.0软件处理药动学参数。结果:头孢克肟空腹和餐后单剂量给药的主要药动学参数为:Cmax分别为([color=black]3.805 ±0.710[/color])μg/ml和([color=black]1.604 ±0.483[/color]) μg/ml,Tmax 分别为([color=black]4.792±0.582[/color]) h和([color=black]4.000±1.225[/color]) h,AUC[sub]0-t [/sub]分别为([color=black]32.923±7.804[/color]) μghmL[sup]-1[/sup]和([color=black]12.785±4.688[/color]) μghmL[sup]-1[/sup],AUC[sub]0-[/sub][sub][color=#231f20]∞[/color][/sub]([color=black]33.955±8.484[/color]) μghmL[sup]-1[/sup]和([color=black]13.082±4.932[/color]) μghmL[sup]-1[/sup]。两种给药方案的Cmax和AUC取自然对数后经方差分析,Tmax经非参数检验,发现Cmax,AUC和Tmax的差异有统计学意义(P<0. 05)。结论;与空腹组给药相比,餐后组吸收速率减慢,消除半衰期延长,生物利用度降低。[/align][align=left][b]关键词:[/b]头孢克肟;药动学;空腹餐后;生物利用度;[/align][align=left]头孢克肟(Cefixime)是一种重要的头孢菌素类抗生素,属于可口服的第三代头孢菌素类抗生素,临床上应用于敏感菌引起的肺炎、支气管炎、泌尿道感染、淋病、胆囊炎、胆管炎、猩红热、中耳炎、副鼻窦炎等。本研究参考有关人血浆中头孢克肟的定量方法,志愿者在空腹和餐后两种情况下服用进口头孢克肟片后取血,采用灵敏的[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS分析技术评价饮食对头孢克肟在人体内的药动学影响,为临床用药提供指导。[/align][align=left][b]材料与方法[/b][/align][align=left][b]1 仪器与试药[/b][/align][align=left]API4000型三重四级杆串联离子肼质谱仪,美国Applied Biosystem Sciex公司;Aglient 1260型液相色谱系统,包括G1312B二元泵,G1322A在线脱气机,G1316A柱温箱,Aglient Technology公司; NASCA F5100型自动进样器,日本SHISEIDO公司;资生堂CAPCELL PAC ADME柱(2.1*100mm,3mm,日本SHISEIDO公司);保护柱:Phenomenex C18(4*3.0mm,5mm,Torrance,CA,USA);梅特勒-托利多AG135电子天平,梅特勒-托利多仪器上海有限公司;Heraeus Multifuge XIR型离心机,美国Thermo Fisher公司;IKA VIBRAX VXR型振荡器;KQ5200DE型数控超声清洗机,昆山市超声仪器有限公司;Eppendorf可调式及自动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]电动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液器[/color][/url][/color][/url],德国Eppendorf公司。[/align][align=left]头孢克肟标准品(批号:130503-201716,纯度:89.2%,中国食品药品检定研究院);头孢他美(批号:130564-201601,纯度>99.8%,中国食品药品检定研究院);甲醇:美国Fisher公司,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url] 级,批号:LOT180821;甲酸:美国MREDA公司,色谱纯,批号:LOT095224;乙腈:美国Fisher公司,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url] 级,批号:LOT180821;超纯水:屈臣氏重蒸水,批号:20180815.[/align][align=left][b]2 试验方法[/b][/align][align=left][b]2.1 试验方案[/b][/align][align=left][b]2.1.1 受试对象[/b][/align][align=left]12名健康男性受试者,年龄在18-45岁,体重指数在19-24范围内,健康,无心血管、肝脏、肾脏、消化道、精神神经等疾病史,无药物过敏史。试验前详细询问既往病史,作全面的体格检查及实验室检查,心电图、血压、肝肾功能及血尿常规检查均正常,试验前两周未用任何药物。所有受试者均签署知情同意书,试验方案经本院伦理委员会审批同意。[/align][align=left][b]2.1.2 给药方案与样品采集[/b][/align][align=left] 试验采用双交叉设计。12名受试者随机分成两组,每组6人。1组为空腹组,另1组为餐后组。受试者在试验前1 d的17:00进人I期临床试验病房,晚上统一清淡饮食,并禁食10h,但不禁水。次日晨1组空腹口服药物,用250mL水送服。另1组则统一进食高脂标准餐,进餐时程为30 min,后即用250 ml温开水送服试验药物。0, 0.5,1,1. 5,2,2.5,3,3.5,4,4.5,5,6.5,7,8,10,12,15和24小时,抽取静脉血4 ml,置肝素化抗凝试管中,分离血浆于-80℃贮存,待测。[/align][align=left][b]2.2 色谱及质谱条件[/b][/align][align=left]色谱条件:流动相:乙腈(0.5%甲酸):水(0.5%甲酸)=40:60等度洗脱;柱温:40℃;流速:0.2 mL/min;进样量:5 mL;运行时间:4min。洗针程序:50%甲醇洗针5s,超声洗针5s(纯水),再次用50%甲醇洗针5s。[/align][align=left]质谱条件:离子源:电喷雾(ESI);扫描方式:多反应监测(MRM);离子化方式:正离子;检测离子对:TBKW m/z454.2/285.1;内标:389.2/241.1.离子源电压:4800V;离子源温度:400℃;气帘气:15psi;碰撞气:4psi 雾化气:60psi;辅助气:55psi;解簇电压:70V;碰撞诱导解离电压:TBKW:28V,TBTM :21V。[/align][align=left][b]2.3 溶液配制及样品处理[/b][/align][align=left][b]2.3.1溶液配制[/b][/align][align=left]对照品溶液:精密量取头孢克肟对照品11.21 mg,置于15 mL EP管中,用自动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]精密加入10 mL甲醇溶解,得到1 mg/mL的对照品储备液,置于-20℃备用。用50%甲醇-水配制成系列头孢克肟标准工作液,浓度分别0.5,1,5,10,20,50,100,160 mg/mL。4℃冰箱避光保存。[/align][align=left]质控工作液:精密量取头孢克肟对照品11.15 mg,置于15 mL EP管中,用自动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]精密加入10 mL甲醇溶解,得到1 mg/mL的对照品储备液,置于-20℃备用。用50%甲醇-水配制成系列头孢克肟标准工作液,浓度分别1,5, 20,130mg/mL。4℃冰箱避光保存。[/align][align=left]内标工作液:精密量取头孢他美对照品10.02 mg,置于15 mL EP管中,用自动[url=https://insevent.instrument.com.cn/t/9p][color=#3333ff][url=https://insevent.instrument.com.cn/t/9p][color=#3333ff]移液枪[/color][/url][/color][/url]精密加入10 mL甲醇溶解,得到1 mg/mL的内标储备液,置于-20℃备用。用纯甲醇稀释至500 ng/mL,4℃冰箱避光保存。[/align][align=left][b]2.3.2生物样本处理方法[/b][/align][align=left]a.血浆标准品及质控样品处理方法:取药前血浆190 uL,加10 uL适当浓度的标准溶液,混匀,加400 uL甲醇(含内标500 ng/mL),涡旋2min,离心(4℃,14000r/min)15min, 取100 uL上清液,加流动相A相200uL混匀,取5μL进样。[/align][align=left]血浆标准曲线范围: 0.025,0.05,0.25,0.5,1,2.5,5,8 u g/ml。[/align][align=left]质控样品浓度为: 0.075,1,6.5μg/ml 最低定量限: 0.075 ng/mL。[/align][align=left]b.血浆样品处理方法:取给药血浆200 uL,加400 uL甲醇(含内标500ng/mL),涡旋2min,离心(4℃, 14000 r/min) 15min, 取100 μL上清液,加流动相A相200μL混匀,取5μL进样。[/align][align=left][b]2.3.3数据统计处理方法[/b][/align][align=left]使用AB Secix公司Analyst 1.5.2软件采集处理数据。[/align][align=left][b]3方法学确证[/b][/align][align=left]对建立的方法进行方法验证, 参照中国药典2015版《生物样品定量分析方法指导原则》(草案),从方法的选择性、标准曲线和定量下限、精密度和准确度、稳定性、回收率、基质效应、残留效应和同位素效应等各方面进行方法验证。[/align][align=left][b]3.1选择性 [/b]分别取6份不同来源的人空白血浆样品以及相应人空白血浆配制的LLOQ 样品进行[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]LC-MS[/color][/url]/MS分析测定,考察空白血浆中的内源性物质是否干扰待测物及其内标的测定。接受标准为:空白血浆中待测物保留时间处色谱峰面积不高于LLOQ色谱峰面积的20%;空白血浆中内标保留时间处色谱峰面积不高于内标色谱峰面积的5%。[/align][align=left][b]3.2 标准曲线[/b] 标准曲线设计8个浓度点, 头孢克肟血浆浓度分别为0.025, 0.05,0.25,0.5,1,2.5,5,8 u gmL-1, 按“血浆标准品及质控样品处理方法”项下操作, 以每个待测物浓度为横坐标, 待测物与内标物的峰面积比值为纵坐标, 用加权 ([i]W [/i]= 1/[i]x[/i]2) 最小二乘法进行回归运算, 求得的直线回归方程即为标准曲线。接受标准为:校正标样回算的浓度一般应该在标示值的±15%以内,定量下限处应该在±20%内;至少75%校正标样,含最少6个有效浓度,应满足上述标准标准;曲线的相关系数的值r≥0.990。[/align][align=left][b]3.3 残留考察 [/b]在标准曲线最高浓度点后连续进样2个空白样品, 考察样品与内标的残留效应。接受标准为:空白血浆中待测物保留时间处色谱峰面积不高于LLOQ色谱峰面积的20%;空白血浆中内标保留时间处色谱峰面积不高于内标色谱峰面积的5%。[/align][align=left][b]3.4 定量下限 [/b]根据血浆标准品处理方法,配制头孢克肟定量下限浓度的血浆样品6份(2.50ng/mL) ,考察其准确度和精密度。[/align][align=left][b]3.5 精密度与准确度[/b] 按“血浆标准品及质控样品处理方法”项下操作,配制最低定量限、低、中、高4个浓度的血浆样品,每浓度进行6个样本分析,分别在3日内测试,根据当日标准曲线计算质控样品的测得浓度,根据结果计算本法的日内、日间精密度与准确度。接受标准:批内精密度:低、中、高浓度批内变异系数≤15%,定量下限的变异系数≤20%。批间精密度:低、中、高浓度批间变异系数≤15%,定量下限的变异系数≤20%。准确度:所有质控样品准确度均值一般应在标示值的±15%之内,定量下限准确度应在标示值的±20%之内。[/align][align=left][b]3.6 回收率和基质效应 [/b]取6份不同来源的空白人血浆,加入人脂肪,制备不同来源的含20%的高脂肪血浆,另取同样6份不同来源的空白人血浆,加入人全血,制备不同来源的含4%的溶血血浆,按比例加入内标溶液和沉淀蛋白溶剂,混匀,离心,取上清,将基质提取出来,分别加入低,中,高浓度质控溶液,经流动相稀释进样分析,测定血浆,高脂血浆,溶血血浆三种处理后的基质下的低、中、高浓度质控样品TBKW及其内标的峰面积。 [/align][align=left]取6份不同来源的空白人血浆及6份水,按“血浆标准品及质控样品处理方法”项下操作,测定空白血浆,标准溶液状态下的低、中、高浓度质控样品TBKW及其内标的峰面积。 [/align][align=left]基质因子(效应)=处理后的空白血浆归一化后的峰面积/标准溶液归一化的峰面积*100% [/align][align=left]提取回收率=未处理空白血浆归一化后的峰面积/处理后的空白血浆归一化后的峰面积*100%。[/align][align=left]接受标准:提取回收率不一定需要满足接近100%,但是必需是稳定而可重现的。基质因子不一定需要接近100%,但是在不同个体的基质中应是稳定而可重现的。不同来源的内标归一化基质因子精密度应≤15%。[/align][align=left][b]3.7 溶液稳定性 [/b]按“血浆标准品及质控样品处理方法”项下操作,新鲜配制头孢克肟储备液并用50%甲醇稀释到低,高质控溶度,每个浓度各3个;取-20℃存放7天,30天的储备液稀释到高质控浓度3个以及4℃对应存放7天,30天储存的低,高浓度质控工作液各3个,进样分析,分别评价储备液和工作液溶液7天,30天的稳定性。接受标准:各储备条件下和对照(新鲜配制)的溶液的归一化峰面积的比值偏差在±15%之间。[/align][align=left][b]3.8 血浆样品稳定性 [/b]室温放置:取多份空白血浆适量,分别加入相应浓度的TBKW标准溶液,配制低、中、高三个浓度血浆样品室温放置5h、处理后的样本室温放置6h、冰箱4°C放置20h,按“血浆标准品及质控样品处理方法”项下操作,进样分析,考察血浆质控样品室温放置稳定性。另取精密度试验第二批三个浓度血浆样品,测定后于自动进样器(10°C)中放置16h后再进样分析,考察血浆质控样品于自动进样器(10℃)中放置16h后稳定性。[/align][align=left]冻融:取多份空白血浆适量,分别加入定量的TBKW标准溶液,配制低、中、高三个浓度血浆样品放置-30°C至少12h,分别经1次冻融、2次冻融、3次冻融冷冻解冻循环,每次溶解时流动自来水溶解不超过15min,放置室温15 min后冷冻,按“血浆标准品及质控样品处理方法”项下操作,处理后进样分析,观察各次循环后稳定性。[/align][align=left] 长期冷冻:取多份空白血浆适量,分别加入定量的TBKW标准溶液,配制低、中、高三个浓度血浆样品,于-30°C放置3天、8天和27天,按“血浆标准品及质控样品处理方法”项下操作,处理后进样分析,观察-30°C条件下冷冻保存稳定性。接受标准:各储备条件下每一浓度水平测定值的精密度≤15%,准确度应在±15%之内。[/align][align=left][b]3.9 批分析 [/b]将精密度实验组样本中最低定量限、低、中和高四个浓度的样品进行了8轮进样,在实验样品开始前证实生物分析方法的效能。[/align][align=left][b]4实验结果[/b][/align][align=left][b]4.1 质谱结果 [/b]由于 TBKW 的结构中既含有碱性氮原子, 也含有羧基, 所以本实验比较了正、负两种离子检测。结果发现, TBKW 的甲醇-水 (50∶50) 溶液 (在正离子模式下响应约为负离子的10倍, 故优先选择ESI 源下正离子检测方式。在正离子检测模式下,TBKW 及内标 TBTM 分别主要生成 m/z454.2 和m/z389.2 的 [sup]+[/sup]峰, 选择性对 [sup]+[/sup]峰进行产物离子扫描分析, TBKW 生成的主要碎片离子分别为[i]m/z [/i]285.1 ,[i]m/z[/i]126.1和[i]m/z[/i]210.1,TBTM生成的主要碎片离子有[i]m/z [/i]241.1。但实验过程中发现,[i] m/z[/i]126.1和[i]m/z[/i]210.1 的碎片离子响应弱, 且噪音高, 故最终选择[i]m/z [/i]285.1 和[i]m/z [/i]241.1 分别作为TBKW 及内标 TBTM 定量分析时的产物离子。待测物及内标的[sup]+[/sup]产物离子全扫描质谱图及相应出峰时间见图1-4。[/align][align=center] [img=,562,319]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241116590213_28_3255306_3.png!w562x319.jpg[/img] [/align][align=center]图1 TBKW二级特征碎片质谱图[/align][align=center][img=,555,315]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241117114646_9141_3255306_3.png!w555x315.jpg[/img] [/align][align=center]图2 TBTM二级特征碎片质谱图[/align][align=center][img=,559,296]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241117239993_3223_3255306_3.png!w559x296.jpg[/img] [/align][align=center]图3 TBKW色谱质谱图[/align][align=center][img=,567,326]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241117339148_8729_3255306_3.png!w567x326.jpg[/img] [/align][align=center]图4 TBTM色谱质谱图[/align][align=left][b]4.2 方法学验证结果[/b][/align][align=left][b]4.2.1 选择性 [/b]结果表明, 空白人血浆中的内源性物质不干扰头孢克肟和内标头孢他美的测定, 且同位素内标头孢他美不干扰头孢克肟的测定。[/align][align=left][b]4.2.2 标准曲线[/b] 用加权 ([i]W [/i]= 1/[i]x[/i][sup]2[/sup])最小二乘法进行回归运算, 求得的标准曲线的相关系数 ([i]r[/i][sup]2[/sup]) 均大于0.99。根据标准曲线,头孢克肟的线性范围为0.025~8 ug/ml。典型标准曲线如下所示: [i]y [/i]= 0.828 [i]x [/i]+4.35e[sup]-3[/sup]([i]r[/i][sup]2[/sup]= 0.9994)。[/align][align=left][b]4.2.3 残留考察 [/b]结果显示,样品与内标保留时间处均未出现干扰杂质峰, 在本实验选择的色谱和质谱条件下, 待测物及内标无残留。[/align][align=left][b]4.2.4 定量下限[/b] 其准确度和精密度见“精密度与准确度”项下。[/align][align=left][b]4.2.5 精密度与准确度[/b] 头孢克肟每一浓度水平的QC样品的日内、日间平均准确度均在15%之内,相对标准偏差均<15%,日内、日间精密度与准确度结果符合生物样本测定要求。相关数据见表1。[/align][align=center]Table 1 Precision and accuracy of TBKW (n=18).[/align][align=center] [img=,610,133]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241121176922_9541_3255306_3.png!w610x133.jpg[/img][/align][align=left][b]4.2.6 回收率和基质效应 [/b]待测物TBKW基质效应的平均值为27.7-42.9% 内标TBTM基质效应的平均值为2.1-52.1%,经内标归一化计算后得出TBKW内标归一化基质效应平均为59.1-62.8%,RSD符合要求。待测物TBKW高脂血浆基质效应的平均值为25.3-28.4% 内标TBTM的高脂血浆基质效应平均为41.9-47.6%,经内标归一化计算后得出TBKW内标归-化高血脂基质效应平均值为59.0-60.4%,RSD均符合要求。待测物TBKW溶血血浆基质效应的平均值为22.0-25.5%,内标TBTM的高血脂基质效应平均为38.6-43.9%,经内标归一化计算后得出TBKW内标归一化高血脂基质效应平均值为55.9-62.6%,RSD均符合要求。表明在试验选择的样品处理、色谱与质谱条件下,待测物和内标均表现出较强的基质效应,均表现出较强的离子抑制作用,特别是TBKW,但该机制效应对待测物和内标作用方向致、稳定,经内标校正后,虽然还存在基质效应,但对分析结果不会产生明显影响。TBKW及其内标TBTM的提取回收率结果,分别见表7-3。待测物TBKW在低、中、高三个QC浓度水平上提取回收率的平均值在138.2%-148.2%之间,内标的提取回收率的平均值在124.0%-130.4%之间,内标校正后提取回收率的平均值在110.4-114.1%之间,RSD符合要求。待测物和内标物在不同浓度水平的提取回收率结果是精密和可重现的,相关数据见表2。[/align][align=center]Table 2 Extraction recoveryand matrix effect of TBKW (n = 6).[img=,631,234]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241121399474_1836_3255306_3.png!w631x234.jpg[/img][/align][align=left][b]4.2.7 溶液稳定性[/b] 用甲醇配制的TBKW储备液1mg/mL-20℃冻存7、22天后的含量均值为新鲜配制的TBKW的106.5%和106.0%,未见降解;TBKW工作液储备液75、6500ng/mL 4℃冷藏7、30天后的含量均值分别为新鲜配制的TBKW的94.5%,113.4% 和89.8%,109.2%,不存在明显降解。[/align][align=left][b]4.2.8 血浆样品稳定性 [/b]TBKW血浆样品在室温放置5h、处理好的血浆样本室温放置6h、自动进样器放置16h,冻融3次、长期冷冻(27天,高于待测样本保存时间)试验条件下,各浓度质控样本的准确度均值在85-115%之间,RSD%均小于15%,表明TBKW血浆样品在上述所考察的情况下稳定。血浆样品稳定性测试结果满足人体血浆样本检测需求。[/align][align=left][b]4.2.9 批分析 [/b]对8轮试验数据进行了比较。结果表明在同一进样批中,每浓度含 48个样本,共计192个样本,其中LLOQ中有6个点准确度20%,少于总样品数的20% (12.5%),且LLOQ准确度和精密度平均值均15%,QC-L、 QC-M 和QC-H的准确度和精密度平均值均15%,总进样时间约18小时。即除血浆标准曲线外和质控点,同批次测定 180个样本能够满足生物样本分析要求.[/align][align=left][b]4.3 药时曲线[/b] 12名志愿者单剂量空腹及餐后口服300 mg头孢克肟胶囊后,平均药-时曲线见图5[/align][align=center][img=,507,279]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241122298854_2799_3255306_3.png!w507x279.jpg[/img] [/align][align=center]图5 12名健康受试者在空腹和餐后口服单剂量头孢克肟后平均药-时曲线 [/align][align=left][b]4.4药代动力学参数及统计结果 [/b]见表3。[/align][align=center]Table 3 Mainpharmacokinetic parameters of cefixime capsules taken on an empty stomach andafter meals[/align][align=center] [img=,546,175]https://ng1.17img.cn/bbsfiles/images/2019/10/201910241122478527_4468_3255306_3.png!w546x175.jpg[/img][/align][align=left][b]5 讨论[/b][/align][align=left]比较空腹和高脂餐后口服头孢克肟的血药浓度的达峰时间[color=black]Tmax,[/color]达峰浓度[color=black]Cmax[/color][color=black]及曲线下面积[/color]AUC的数值,发现餐后口服头孢克肟的达峰时间推迟约0.792 h,达峰浓度约为空腹时的42.2%,餐后相对于空腹给药的相对生物利用度为39%,证明食物对头孢克肟的吸收速率、消除半衰期及吸收总量等药动学参数有显著的影响,故推荐头孢克肟片剂饭前空腹服用。[/align][align=left]饮食因素对口服药物的影响常为病人所忽视,为了避免药物对胃肠道的刺激常喜饭后服药,但餐后服药易受食物等因素的影响。本文结果提示:头孢克肟片不宜餐后服药,较合理的给药方案应是在空腹或饭前2h服用。[/align][align=left]食物降低头孢克肟的吸收速率及吸收程度的原因可能有以下几点: ①食物的存在降低了胃排空速率,使药物在胃中停留时间延长,使胃中的药物浓度降低,药物的吸收减慢,从而导致达峰时间延长 ②头孢克肟为弱酸性药物,主要在小肠吸收,食物会使肠液的 pH 减小,降低了头孢克肟的溶解性和溶出度,从而导致头孢克肟的吸收量降低。这些研究结果为头孢克肟片在临床安全合理用药提供重要的参考依据。[/align][align=left][b]参考文献[/b][/align][align=left]张羽长,李明铭,隋欣蕙,赵春杰.头孢克肟胶囊人体药动学研究及生物等效性评价.药学服务与研究,2008,8(06):429-431.[/align][align=left] Meng, Fang, et al."Sensitive liquid chromatography-tandem mass spectrometry method for thedetermination of cefixime in human plasma: Application to a pharmacokineticstudy." Journal of Chromatography B 819.2 (2005): 277-282.[/align][align=left]KREMER JM,WESTHOVENSR ,LEON M ,et al .Treatment of rheumatoid arthritis by selective inhibition ofT-cell activation with fusion protein CTLA4lg. N Engl J Med ,2003,349(20):1907 - 1915.生物样品定量分析方法指导原则(草案),中国药典,2015。[/align]

抗生素头孢喹肟的动物体内药动学分析 头孢喹肟是目前唯一一个动物专用第四代头孢类抗生素,具有抗菌谱广,抗菌活性强的特点,适用于非肠道用药;源于基本头孢菌素结构的化学修饰提供了头孢喹肟的两性离子性质。头孢喹肟的这一特性可以促进其迅速跨生物膜渗透作用(包括细菌细胞壁的孔蛋白),从而增强生物利用度,较第二代和第三代头孢菌素抗菌谱更广。它对临床重要细菌的染色体和质粒编码的β-内酰胺酶高度稳定。被用于治疗动物呼吸道的疾病,牛的急性乳腺炎和腐蹄病,小牛败血症,猪子宫炎,乳房炎,无乳综合征,马驹败血病,其也是治疗羊的各类疾病的药物。 材料和方法: 头孢喹肟,、色谱乙腈、色谱甲醇、三氟乙酸(TFA)、去离子水。 岛津高效液相色谱仪、SPD-10AVP UV-VIS检测器268纳米处进行检测、柱温箱40°C、Phenomenex Gemini C18色谱柱 (250 mm ×4.6 mm; 5u m)。 流动相为乙腈和0.1%三氟乙酸水溶液,以0.9 ml/min的流速进行洗脱。 标准溶液配制: 头孢喹肟的储备溶液通过直接称量干燥后的标准物质溶解于水中,浓度1mg/ ml,并将该溶液保存于-70℃。头孢喹肟标准溶液通过加入空白血浆配制成溶度为0, 0.02, 0.04, 0.10, 0.40, 1, 2, 4, 10,和 12 ug/ml的溶液。 样品制备:200ul血浆中加入1.5毫升微量离心管中,加入等体积的甲醇使蛋白质沉淀,离心(4000转/min)10分钟后,300ul的上清离心液移入新鲜小瓶中,加入150ul去离子水混合,再吸取50ul上清液进样分析。 液相方法的验证: 选择性-选择性通过分析空白血浆、加入头孢喹肟的血浆、从羊服用头孢喹肟药代动力学研究中获得的血浆样品进行评价,无内源性化合物对目标化合物的干扰。 线性标准曲线-本方法的线性通过在0.02-12ug/ml的范围内的校正曲线评价。 灵敏度-通过进样 0.01ug/ml-0.1 ug/ml评价其信噪比。 精密度和准确度-头孢喹肟样品分低中高浓度分别进样分析,每个浓度分别进样六次日间、日内测定。 回收率-为了计算头孢喹肟的绝对回收率分别加入 0.4ug/ml, 2ug/ml, 和10ug/ml浓度样品,每个浓度分别重复6次进行加入和提取。 稳定性-标准
有谁做过头孢噻肟钠 俄罗斯标准的,溶解度和化学鉴别中的试药是什么?