推荐厂家
暂无
暂无



 400-611-9236
400-611-9236
 留言咨询
留言咨询
 400-860-5168转1663
400-860-5168转1663
 留言咨询
留言咨询
 400-860-5168转1663
400-860-5168转1663
 留言咨询
留言咨询


多聚体的混合聚合物怎么分离及含量的测定?是三到七倍体的混合物
[align=center]聚合物整体柱的制备及其在蛋白质分离中的应用[/align][align=center]摘 要[/align][align=center][color=black] [/color][/align][align=left][color=black]整体柱作为第四代分离介质,具有制备简单、通透性好、传质快等优点,在生物分离分析中发挥的作用日益增加。多孔聚合物整体柱具有高通透性和高柱空间利用率,与填充柱相比优势明显。至今已成功地用于分离科学,特别是用于分离型生物分子。本文简要综述了聚合物整体柱的制备及其在蛋白质分离中的应用,并对其应用做了展望。[/color]关键词:[color=black]聚合物整体柱;蛋白质分离;综述[/color][b]1 引言[/b]蛋白质在人体生命过程中发挥着极其重要的作用,某些蛋白质在体内的含量水平严重影响着生命的质量,这就要求对其进行定量研究,而对其实现分离分析成为首要任务。对蛋白质进行分离鉴定通常使用电泳[color=black]—[/color][color=black]质谱、液相色谱[/color][color=black]—[/color][color=black]质谱联用技术,但这些方法并不能完全满足蛋白质分子对操作环境和分析方法要求较高的要求,并且费用较高。而聚合物单体种类繁多,且其上面的官能团可以有多种修饰方法从而对不同的生物分子具有不同的作用,从而对其实现快速分离。[/color]色谱柱是色谱分离的核心,整体柱代表了色谱柱技术发展的方向[sup][color=black][/color][/sup][color=black]。整体柱[/color][color=black]( Monolithiccolumn) [/color]又称连续床层( Continuous bed) [color=black],是一种用有机或无机聚合方法在色谱柱内进行原位聚合的连续床固定相[/color][sup][color=black][/color][/sup][color=black]。[/color][color=black]整体柱具有独特的双孔结构,具有灌注色谱的特点,比填充柱的通透性更好,可实现快速分离[/color][sup][color=black][/color][/sup][color=black]。根据整体材料基质的不同,整体柱分为硅胶整体柱、有机聚合物整体柱、有机[/color][color=black]-[/color][color=black]硅胶杂化整体柱。硅胶整体柱具有良好的稳定性和机械强度,通透性好,但制备周期长,需要柱后衍生[/color][sup][color=black][/color][/sup][color=black]。有机聚合物整体柱则制备简单、[/color][color=black]pH [/color][color=black]值适用范围广,具有良好的通透性、独特的比表面积和较好的化学稳定性,并且能在玻璃毛细管、不锈钢柱管、[/color][color=black]tip [/color][color=black]头甚至是微流控芯片的通道等多种模具中制备[/color][sup][color=black][/color][/sup][color=black]。[/color][b]2 聚合物整体柱的制备[/b]多孔聚合物整体柱出现在上世纪90年代初,继而在制备和应用中得到发展[sup][/sup]。与采用溶胶凝胶技术制备的无机硅胶整体柱相比,通过自由基聚合方式制备的聚合物整体柱更容易制备。除了传统的自由基聚合,其他方法预期制备一种具有均匀结构的新型聚合物整体柱。2006年,Hosoya等人报道了一种将环氧单体与二胺类开环聚合的高性能有机聚合物整体柱,在毛细管液相色谱上,其对苯的分离塔板高度(H)可以达到小于5μm[sup][/sup]。值得注意的是,相比链生长聚合(比如自由基聚合反应)产生的球状结构,逐步聚合方式导致整体柱有完全不同的形态。[b]3 聚合物整体柱的分类[/b]多种多样的功能单体使整体柱设计变得更容易,按单体不同,聚合物整体柱可分为聚丙烯酰胺类,聚甲基丙烯酸酯类和聚苯乙烯类[sup][/sup]。单体决定其适用范围,整体柱已被广泛用于不同的色谱模式,包括反相液相色谱(RPLC)、亲水相互作用色谱(HILIC)、离子交换色谱(IEC)等[sup][/sup]。而[color=black]从制备工艺上,聚合物整体柱可分为三类:后修饰整体柱、原位合成整体柱和结合微加工技术的整体柱。[/color]原位合成整体柱是一定温度或紫外光条件下,将交联剂、单体、引发剂、致孔剂,在不锈钢色谱柱管中充分反应,再冲洗除去致孔剂和残余未反应物得到。除研究可用单体外,新的制备方法和制备工艺和的研究也取得了很好发展。通过调节交联剂、单体、致孔剂之间的比例,可以较好地控制制备的整体柱的柱效和通透性[sup][color=black][/color][/sup][color=black]。原位聚合制备的整体柱并不能满足某些特定的分离需求。原位聚合时,很多功能团被包埋在颗粒内部,暴露在表面上的并不多,这导致聚合物整体柱的性能明显下降。后修饰整体柱则会改善这一问题。聚合物整体柱的后修饰方法使用最多的是在聚合物表面接枝[/color][sup][color=black][/color][/sup][color=black]。近年来,利用甲基丙烯酸缩水甘油酯[/color][color=black]( GMA) [/color][color=black]的环氧基团的接枝方法较为流行,并成功运用到离子交换色谱、亲和色谱等色谱柱的制备中[/color][sup][color=black][/color][/sup][color=black]。相对于接枝的方法,将功能化的纳米颗粒包被在聚合物的表面的方法较为简单,也常用于制备功能化的聚合物柱。作为固定相载体,微加工整体柱是芯片色谱柱所独有的。[/color]原位合成聚合物整体柱最为便捷,根据分离要求的不同,已经开发了各种各样的单体材料和制备工艺。对于一般分离需求,是很好的选择。采用后修饰的方法在固定相表面连接功能基团可以提高柱效,而微加工整体柱仅适用于芯片色谱。[b]4 聚合物整体柱的应用[/b]一般来说,多孔聚合物整体柱具有典型球状结构,其通孔之间的聚合微球显著有利于提高聚合物整体柱的通透性,并且使其在高流速下能够有效地分离蛋白质分子。然而,聚合物整体柱对小分子的分离通常表现为低的柱效,据研究是由于表面积较硅胶整体柱小造成的。为了解决这个问题,研究者提出了几种试图增加表面积的方法,如将纳米粒子引入聚合物整体柱和制备超交联整体柱[sup][/sup],分离能力在一定程度上得到了提高。此外,斯韦克系统地阐述了各种多孔聚合物整体柱的制备技术[sup][/sup]。例如,2,2,6,6-四甲基-1-哌啶(TEMPO)介导的活性自由基聚合。Kanamori等合成的聚合物(二乙烯基苯)单体具有明确的连续形态,高的比表面积[sup][/sup]。[b]5 展望[/b][color=black]实际有机分子样品结构复杂、种类众多,而且对操作环境和分析方法要求较高。不同色谱模式的液相色谱方法不仅对特定的生物分子具有较好的选择性,且制备方法简单易得,结构可控。此外,聚合物单体的种类繁多,且其上面的官能团可以有多种修饰方法从而对不同的生物分子具有不同的作用。因此,随着液相色谱固定相的发展,聚合物整体柱以其独有的优势也会在生物分子的分离与分析中得到越来越广泛的应用。[/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][color=black] [/color][b]参考文献[/b] 杨帆, 毛劼, 何锡文. 基于巯基-烯点击反应制备有机-无机杂化硼酸亲和整体柱用于糖蛋白的选择性富集. 色谱, 2013, 31(6): 531-536. 平贵臣, 袁湘林, 张维冰等. 整体柱的制备方法及其应用.分析化学,2001,29(12):464-469. Jing Liu, Fangjun Wang, Zhenbin Zhang. Reversed phasemonolithic column based enzymereactor for proteinanalysis. Chinese Journal of Analytical Chemistry,2013, 41(1):10-14. Motokawa M, Ohira M, Minakuchi H [i]et al[/i]. Performance ofoctadecylsilylated monolithic silica capillary columns of 530μm innerdiameterin HPLC. J.Sep Sci,2006, 29(9): 2471-2477. 王超然, 王彦, 高也等. 聚(4-乙烯基苯硼酸-季戊四醇三丙烯酸酯)亲和整体柱的制备与应用. 分析化学研究报告,2012, 40(8):1207-1212. 李晶, 周琰春, 张嘉捷等. 阴离子交换聚合物整体柱的制备及其在[url=https://insevent.instrument.com.cn/t/3p][color=#3333ff]离子色谱[/color][/url]中的应用.分析测试学报,2012, 31(9):1089-1094. 张振宾, 欧俊杰, 林辉等. 有机-硅胶杂化整体柱的制备及应用研究进展.高等学校化学学报,2013,34(9):2011-2019. 刘婵, 江茜, 陈蕾等. 金纳米粒子修饰的氨基硅胶整体柱的制备及超灵敏表面增强拉曼散射检测.高等学院化学学报,2013,34(11):2488-2492. Yongqin Lv, Zhixing Lin, Frantisek Svec. Thiol-ene clickchemistry: a facile and versatile route for the functionalization of porouspolymer monoliths.Analyst,2012,137(9):4114-4118. 吕仁江, 丁会敏, 李英杰. 丙烯酰胺-β-环糊精毛细管电色谱手性整体柱的制备及应.应用化学,2012,29,(5):604-607. Frantisek Svec, Yongqin Lv. Advances and recent trends in thefield of monolithic columns for chromatography. Analytical Chemistry,2014,87(9):250-273. Zhongshan Liu, Junjie Ou, Hui Lin. Preparation of monolithic polymercolumnswithhomogeneousstructure viaphotoinitiated thiol-yne click polymerization and their application inseparation of small molecules.Analytical Chemistry,2014,86,(105):12334-12340. Trojer L, Lubbad S H, Bisjak C [i]et al[/i]. Monolithicpoly( p-methylstyrene-co-1,2-bis(p-vinylphenyl) ethane) capillary columns as novel styrene stationary phases forbiopolymer separation.J. Chromatogr. A, 2006, 1117(1): 56-66. Luo Q Z, Zou H F, Xiao X Z [i]et al[/i]. Chromatographic separation of proteins on metal immobilizediminodiacetic acid-bound molded monolithic rods of macroporous poly( glycidylmethacrylate-co-ethylene dimethacrylate) . J. Chromatogr. A,2001,926(2):255-264. 郑晖, 李秋顺, 马耀宏等. 微流控芯片上电色谱聚合物整体柱研究进展.山东科学,2013,26(1):16-21. J. Zhang, HL. Zou, Q. Qing [i]et al[/i]. Effect of chemical oxidation on the structure of singlewalled carbon nanotubes. J. Phy. Chem. B, 2003, 107(16):3712-3718. Junjie Ou, Zhongshan Liu, Hongwei Wang. Recent development ofhybrid organic-silica monolithic columns in CEC and capillary LC.Electrophoresis ,2015, 36(9):62-75. 王玺, 何健, 季一兵. 聚甲基丙烯酸酯毛细管整体柱的制备及其性能考察.中国药科学学报,2012, 67(7):78-85.[/align]
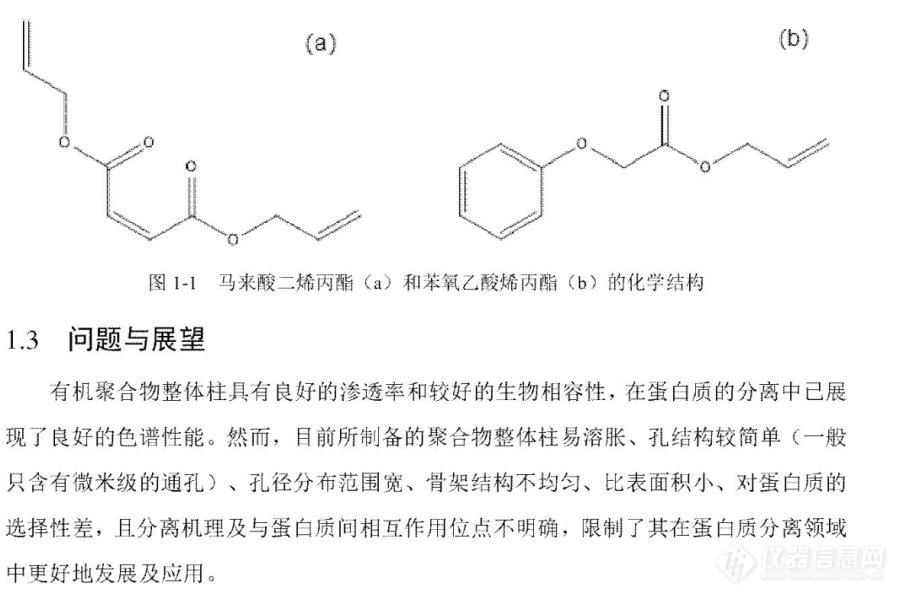
[img=,690,756]https://ng1.17img.cn/bbsfiles/images/2019/09/201909131431365814_1070_3890113_3.jpg!w690x756.jpg[/img][img=,690,933]https://ng1.17img.cn/bbsfiles/images/2019/09/201909131431510074_3856_3890113_3.jpg!w690x933.jpg[/img][img=,690,890]https://ng1.17img.cn/bbsfiles/images/2019/09/201909131432032364_7396_3890113_3.jpg!w690x890.jpg[/img][img=,690,457]https://ng1.17img.cn/bbsfiles/images/2019/09/201909131432156284_6468_3890113_3.jpg!w690x457.jpg[/img]为了充分发挥整体柱在分离蛋白质方面的优势,课题组下一步拟将针对聚合物整体柱孔结构不均匀和易溶胀或收缩的缺点,选用抗冲击强度、较高的硬度和较低的收缩率的烯丙酯类单体制备整体柱,有助于得到机械性能良好且孔结构均匀的整体柱,从而改善整体柱易溶胀的缺点。并将进一步探究蛋白质的分离机理,明确蛋白质的表观保留时间与蛋白质性质之间的关系。


