使用共价标记质谱区分组氨酸互变异构体
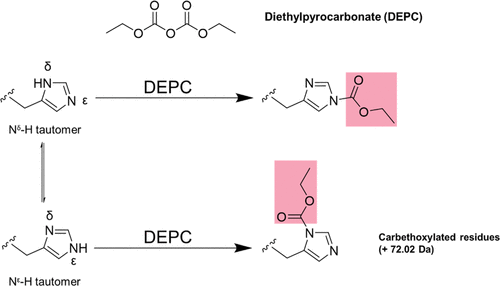
大家好,本周为大家分享一篇发表在Anal Chem.上的文章,Distinguishing Histidine Tautomers in Proteins Using Covalent Labeling-Mass Spectrometry [1]。该文章的通讯作者是来自马萨诸塞大学阿默斯特分校的Richard W. Vachet教授。组氨酸是人体蛋白质结构中的重要组成氨基酸,研究发现,组氨酸具有Nδ-H和Nε-H两种互变异构体,通过两种互变异构体的转换,可以在蛋白质中介导质子转移。目前常使用2D NMR技术进行区分,但操作相对繁复。共价标记质谱是一种研究蛋白质结构的有力方法,具有操作简单,灵敏度高,结构分辨率高等优点。在本文中,作者尝试以焦碳酸二乙酯(DEPC)为标记试剂,采用共价标记质谱区分组氨酸互变异构体。组氨酸侧链的咪唑上具有两个氮原子,其中一个氮上的孤电子对参与芳香环π键的组成,而另一个氮原子仍保留孤对电子,更容易与DEPC等亲电子试剂反应。而组氨酸的两个互变异构体中都只有一个保留孤对电子的氮原子,且该氮原子位置不同,Nδ-H互变异构体中的Nε2与DEPC反应,而Nε-H互变异构体中的为Nδ1。因此以DEPC标记组氨酸以区分两个互变异构体的方法是可行的(图1)。图1. DEPC 结构及其与两种不同组氨酸互变异构体的反应 为了测试DEPC 标记区分两种互变异构体的能力,作者以几种含组氨酸的肽,在确保DEPC仅标记组氨酸条件下进行实验。以Fmoc-DGHGG-NH2为例子,该肽在N端包括一个Fmoc基团以确保仅标记组氨酸。采用等度洗脱来最大限度地利用LC分离两种异构体,并确保流动相组成不影响肽段电离效率,从而可以更好地量化每个互变异构体的比率。结果发现,在11.4和13.6分钟洗脱的峰具有相同的m/z值(图2)。根据串联MS数据,发现这两个峰代表着组氨酸上成功标记DEPC的单一物质(图3)。并且,这些同量异位离子的串联质谱不同,表明这两种物质为带有不同组氨酸互变异构体的物质。作者将先洗脱出的物质命名为修饰物质1,后洗脱出的为修饰物质2。根据MS/MS数据,两者的主要区别为修饰物质2具有更加丰富的羧基化a3离子(a3*)。图2. 未标记(蓝色迹线)和 DEPC 标记(红色迹线)肽 Fmoc-DGHGG-NH 2的提取离子色谱图。DEPC浓度比肽浓度高10倍,反应1分钟图3. 两种修饰的His异构体的串联质谱。(a)来自图2中的色谱图的修饰物质 1 的串联质谱。(b)来自图2中的色谱图的修饰物质2的串联质谱。标有星号 (*) 的产物离子包含羧基化产物此外,在重复实验中,作者发现物质2与物质1的丰度比为3.9± 0.2。而研究发现,在中性pH条件下,游离氨基酸Nε-H 互变异构体与 Nδ-H 互变异构体的比接近于4:1。因此,两物质的峰面积比表明物质1可能为 Nδ-H 互变异构体,而物质2可能为 Nε-H 互变异构体。结合以上发现,并考虑肽解离途径等因素,作者对两物质质谱图谱差异做出推测。当物质2为Nε-H互变异构体侧链时,DEPC 标记在Nδ1上,有利于肽通过bx-yz途径解离,随后通过bx-ax途径损失CO,因此物质2富含a3*离子。当物质1为Nδ-H 互变异构体时,DEPC 标记在Nε2上,肽通过组氨酸途径解离,并形成了稳定五元环,因此优先形成更稳定的b3*离子(图4)。以上发现进一步证明了Fmoc-DGHGG-NH2中物质1为 Nδ-H 互变异构体,物质2为 Nε-H 互变异构体。根据丰度比以及肽解离途径不同,作者在其他模型肽标记实验中也成功区分两互变异构体。由于组氨酸的pKa在一定程度上会影响互变异构体的比例,因此两互变异构体的丰度比可能会略有变化。总之,以上结果表明,DEPC共价标记质谱可以识别两个组氨酸互变异构体。图4. DEPC 标记的含组氨酸肽 CID 过程中两种异构体的肽片段化途径。左侧通路为物质1(Nδ-H互变异构体),右侧通路为物质2(Nε-H互变异构体)之后,作者还进一步研究了不同DEPC浓度对实验的影响。结果发现,在 DEPC 浓度范围超过一个数量级时,Fmoc-DGHGG-NH2的两种修饰形式的比率基本在4左右保持恒定,其他模型肽的比率略有不同(图5),但随着 DEPC 浓度的增加,给定肽的标记比率保持不变。在质谱可以确认互变异构体结构的肽中,Nε-H互变异构体总是丰度相对更高,洗脱相对较晚。此外,作者发现当组氨酸不是位于N末端残基时,Nε-H 互变异构体的an */bn *比率总是比Nδ -H 互变异构体的更高。但是,若组氨酸残基位于肽的N末端时,在质谱中观察不到b1和a1离子,将对结果造成影响。图 5. 在 DEPC 浓度增加时选择肽的两种修饰形式的标记比率。(a) Fmoc-DGHGG-NH2;(b) Ac-IQVYSRHPAENGK(Ac);(c) Ac-VEADIAGHGQEVLIR;(d) Ac-LFTGHPETLEK(Ac)。MS/MS 用于通过测量an /bn离子的比率来确认每个互变异构体总而言之,作者成功使用DEPC共价标记质谱区分肽与蛋白质中的组氨酸互变异构体,利用丰度比与洗脱时间,以及CID期间的肽解离模式,区分两种互变异构体。利用该方法,作者团队已经确定了几种蛋白质组氨酸互变异构体比率,并且相对于2D NMR方法,该方法更简单、更快、更精确,有利于探索蛋白质中组氨酸残基周围的局部结构,提供高分辨率的结构信息。[1]Pan X, Kirsch ZJ, Vachet RW. Distinguishing Histidine Tautomers in Proteins Using Covalent Labeling-Mass Spectrometry. Anal Chem. 2022 Jan 18 94(2):1003-1010.




 400-622-8982
400-622-8982
 留言咨询
留言咨询

 留言咨询
留言咨询

 留言咨询
留言咨询