长效注射混悬液体外释放试验方法开发
2023/06/15 17:55
阅读:226
分享:方案摘要:
产品配置单:
华溶自动取样溶出系统DS-1206AT
型号: DS-1206AT
产地: 广东
品牌: 华溶仪器
¥10万 - 50万
参考报价
联系电话
方案详情:

翻译:华溶应用中心
审核:工业药剂发烧友
长效注射(Long acting injectables,LAI)混悬液是一种复杂的肠外给药制剂,能够在几天至几个月内持续释放药物。所有不可预测的药物释放行为都可能导致严重的副作用。因此,了解这些产品的体内外特性以及体内外相关性(IVIVC)非常重要。美国FDA推荐了一些LAI混悬液的体外释放测试方法。但释放时间都⼩于两天,考虑到其在体内的疗效达几周至几个月,可能不适用于建立LAI的IVIVC。本研究以醋酸甲羟孕酮注射混悬液为参比药物,制备了三种不同粒径、成分相同的醋酸甲羟孕酮混悬液,建立了与体内释放时间更相关的体外释放测试方法。使用了USP2法(配置透析袋、浸没池和自制适配器)和USP4(使用半固体适配器)四种不同方法。使用浸没池法和半固体适配器的USP4法对所研究的LAI混悬液的区分力和重现性最好。
一、介绍
长效注射剂(LAIs)旨在几周至几个月内达到长效治疗的药物,如抗精神病药、避孕药、抗糖尿病药和抗前列腺癌药物。长效注射剂一般分为:油溶液、油混悬液、纳米晶体混悬液、微球和植⼊剂。与传统剂型相比,肠外注射LAIs有许多优势:1)药代动力学的表观半衰期由吸收速率常数控制;2)剂量和血浆水平之间有可预测的相关性;3)可能简立体内外相关性(IVIVCs);4)可减少血浆浓度的峰谷水平;5)降低了用药负担,提高了患者的依从性。肠外LAI混悬液的长效作用是通过给药后难溶性药物在注射部位的缓慢溶解和分配来实现的。LAI混悬液比聚合物控释更有优势,因为其可用最少的药用辅料达到更高的载药量。迄今为止,美国FDA(表1)已批准的LAI混悬液有6种用于治疗精神分裂症,2种用于避孕(FDA橙皮书)。这些市售LAI混悬液的剂型可分为三类:粉末混悬剂(阿立哌唑注射混悬剂和奥氮平)、纳⽶混悬液(阿立哌唑月桂醇和1个月帕利培酮棕榈酸酯)和微米混悬液(阿立哌唑十二烷酸酯、1个月帕利培酮棕榈酸酯和醋酸甲羟孕酮注射液)。
因此,建立一种稳定可靠的体外释放试验方法来评估不同制剂的体外释放特性至关重要。理想的体外释放试验方法可以更易建立IVIVC,从而减少临床研究。表1列出了现有美国FDA推荐的LAI混悬液的溶出或释放测试方法。LAI混悬液推荐使用桨法或流池法。溶出方法持续时间为45min至2880min(2天)。这些方法可能不适合建立IVIVC,因为在临床周期从几周到几个月,体外释放持续时间比产品的体内疗效持续时间要短得多。美国药典推荐使用USP4用于USP通则<1092>以下的缓释注射混悬液。但目前还没有关于LAI混悬液释放测试的指南或专著。理想情况下,一种体外释放测试方法可用于多种目的,包括处方优化、产品质量控制和建立体内外相关性。为了在LAI混悬液中实现这一目标,必须开发更长持续时间释放测试的方法。
醋酸甲羟孕酮(MPA)是一种用于避孕的皮下注射剂,每三个月注射一次,于2004年获得美国FDA批准。该产品没有USP或FDA推荐的释放测试方法。在本研究中,选择RLD醋酸甲羟孕酮(MPA)皮下注射剂作为参比药物进行测试。如前所述,制备了定性和定量(Q1/Q2)等效的MPA混悬液(与RLD的组成和浓度相同)。药物粒径是研发LAI混悬液的一个关键属性,因为它可能会影响这些制剂的体内外特性。以RLD醋酸甲羟孕酮(MPA)皮下注射剂为参考,使用3种不同粒径的Q1/Q2等效混悬液配方(F1,F2和F3)来研究粒径对MPA混悬液药物释放的影响。为了建立一种灵敏度高、可靠且区分力强(即粒径)的MPA-LAI混悬液的体外释放测试方法,我们使用了两种使用了USP2法和USP4法,并对其进行了部分修改和优化。
二、材料和方法
2.1 材料
醋酸甲羟孕酮(MPA,微粉化,USP级)、聚乙二醇(PEG)3350(NF-USP)、吐温80(NF级)、甲硫氨酸(USP级)、对羟基苯甲酸甲酯(NF级)和对羟基苯甲酸丙酯(NF级)( Spectrum Chemical Manufacturing Corp. New Brunswick, NJ, USA)。一水合磷酸钠和十二水合磷酸氢二钠(Sigma MA,USA)。PVP K17 PF(BSFA,Germany)。氯化钠和十二烷基硫酸钠(SDS)( Sigma MO,USA)。除非另有说明,所有材料均为分析级。
2.2 醋酸甲羟孕酮HPLC分析方法
使用安捷伦1290 HPLC系统分析醋酸醋甲羟孕酮样品,流动相为乙腈-水(65/35,v/v)混合物,流速为1.5mL/min,色谱柱为C18柱(Kinetex,250×4.6mm,5μm,Phenomenex),柱温30℃,紫外检测波长244 nm,进样量为50μL。使用安捷伦OpenLAB CDS工作站进行分析。MPA的保留时间为5.4分钟。标准曲线在0.2–5μg/ml和5–100μg/ml两个范围内均显示出良好的线性(R2=1)。
2.3 Q1/Q2等效的MPA混悬液的制备与表征
如前所述,制备Q1/Q2等效MPA混悬液。根据RLD处方将原料药分散到混悬介质中。在本研究中,制备了三种不同粒径的MPA LAI混悬液,以评估粒径对药物释放的影响。处方1(F1)使用的原料药粒径接近13µm。处方2(F2)使用更⼤的粒径,将API从丙酮-水(1:1,水作为反溶剂)中重结晶制得。重结晶API的物理性质(例如熔点和焓)以及物理形态与初始API相同。处方3(F3)使用更小粒径,用探头超声减⼩粒径,将F1超声5min(10%功率超声10s,每个周期停止1s)制备F3。使用马尔文 3000和Hydro MV(中等体积)自动分散装置对所有制剂的颗粒大小进行了表征。将混悬液添加到分散装置的腔室中于以1640rpm的速度下搅拌。记录混悬液的粒径(体积加权)和粒径分布(D10,D50,D90)。所有测量均重复3次,数据以平均值±标准差表示。
2.4 体外释放试验方法的建立
2.4.1 配透析管的USP2法
使用300 mL小溶出杯并配备透析管USP2法进行MPA混悬液的体外释放测试。将截留分子量(MWCO)为100 kD到1000 kD的1 mL Float-A-Lyzers G2透析装置(纤维素膜)连接到取样针上。按要求处理透析管,去除甘油添加剂并用去离子水冲洗。在释放测试之前,将透析管于释放介质中浸泡过夜。将100uL MPA混悬液(共16 mg MPA)与900uL pH7.4的磷酸盐缓冲液(PBS)混合,并将这1 mL混合物装入透析管中。在含1% w/v SDS的300 mL pH7.4的PBS(37士0.5 C)中进行释放试验。搅拌速度为100±1 rpm,每天抽取1 mL样本,并补充等体积新鲜介质。每7天完全更换并补充新鲜介质。药物在释放介质中的溶解度为545.98µg/mL。装有透析管的容器中应保持良好的漏槽条件。回收试验应使用同一仪器,唯一的区别是将药物溶液而不是混悬制剂加入透析管中。在设定的时间间隔取出1mL样品,并补充1ml新鲜介质。使用0.22um尼龙注射过滤器过滤样品。考虑采样或更换介质过程中的药物损耗,计算累积释放量。所有实验均重复3次。
2.4.2 配浸没池的USP2法
使用带浸没池(接触面积为4cm2)的USP2法和200 mL平底溶出杯进行MPA混悬液的释放测试(图2)。上样量为50µL MPA混悬液(总MPA为8 mg)。用预先在介质中浸泡好的膜(Whatman,GF/D,2.7µm)盖好样品。浸没池按要求组装。介质为150 mL含1% w/v SDS的pH7.4PBS, 转速120 rpm, 温度37±0.5℃。每天取样并补充等体积介质。样品经0.22μm的过滤器过滤后再进行HPLC分析。所有实验重复3次。
2.4.3 使用自制装置的USP2法
使用自制装置(接触面积:3.14 cm2)的USP2法和1L溶出杯进行释放测试(图3)。通过滑动而不是旋扭来避免样品移动。注入50µL的MPA混悬液并使用2.7um的膜覆盖样品室。将约束帽滑入隔室固定好膜。介质为500 mL 1% w/v SDS水溶液,转速为100±1 rpm,温度为37±0.5℃。每天取样1mL并补充等体积介质。样品经0.22μm的过滤器过滤后再经HPLC分析。所有实验重复3次。
2.4.4 带半固体适配器的USP4法
使用USP4法配半固体适配器(深度:1 mm)进行MPA混悬液的释放测试(图4)。即将50µL的MPA混悬液装入半固体适配器中,放入流通池。采用两种孔径玻璃纤维滤膜(Whatman® GF/D(孔径为2.7µm)和GF/F(孔径为0.7µm))。释放介质为500 mL 1% w/v SDS,温度37±0.5℃。采用3种流速(2 mL/min、4 mL/min和8 mL/min)考察流速对药物释放曲线的影响。每天取样并补充等体积介质。样品经0.22μm的过滤器过滤后再进行HPLC分析。所有实验重复3次。
USP2法,长时间的释放实验会有介质蒸发,但可以通过适当的方法来缓解。为了最大限度地减少介质蒸发,所有可能导致介质损失的开口都使用了垫圈、塞子和O形圈。标记每个溶杯的介质的高度,每天进行观察,确保没有显著的介质损失。USP4法是一个封闭系统,实验过程中没有介质损失。药物在释放介质中是稳定无降解的。体外释放试验表明,终浓度与理论浓度吻合较好。在HPLC色谱中未观察到降解峰。
2.5 统计分析
使用OriginPro 2017软件(OriginLab Corporation)进行数据分析。数据以均数±标准差(SD)表示。
三、结果与讨论
3.1 Q1/Q2等效的MPA混悬液的粒径
为了解药物粒径对药物释放的影响,制备了3种不同粒径的Q1/Q2等效MPA混悬制剂。RLD和制备的MPA混悬液的粒径和粒径分布如图5所示。所述处方的平均粒径遵循F3
3.2 不同方法进行MPA混悬液的体外释放试验
不能确定商品化的RLD的辅料来源和生产工艺。F1的组成和浓度与RLD相同,但粒径小很多。体外释放试验方法应该能够检测RLD和F1之间的任何差异。所有的释放度检测均采用RLD和配方F1,以检验所建立的检测方法的区分能力。介质的选择取决于装置的属性和漏槽条件。为了使透析管合适地安装,透析方法(2.4.1)使用了300mL介质。USP2浸没池装置(2.4.2),所使用的溶出杯为USP规定的200mL的小杯。由于浸没池占有一定的体积,所以介质使用150mL。USP2自制适配器装置(2.4.3),使用标准的1L溶杯,以便在必要时有更⼤的空间调整到更高的释放量。USP4法,介质体积可以随意设置。为使两种方法保持相似的漏槽条件,介质和体积与USP2自制适配器装置法一致。无论使用哪种方法与参数,释放测试方法应能够区分Q1/Q2两制剂,且该方法应具有可接受的重现性。
3.2.1 使用透析管的USP2法
3.2.1.1 透析管的回收率
为确保透析管没有药物吸附问题,对其进行处理。将含1% w/v SDS的PBS的MPA药物溶液装入透析管。实验参数的设置与体外释放试验相同,然后在规定的时间点取出样品。MPA的回收率在24小时内几乎达到100%,这表明MPA在透析管不存在吸附问题。
3.2.1.2 使用带透析管的USP2法测定RLD和F1的释放曲线
RLD和F1的释放曲线如图6所示。LAI混悬液的释放持续时间超过100天,与其他LAI混悬液的体外释放试验相比,这个时间非常长。透析管的MWCO对制剂的释放速度和区分能力都有影响。当使用100 kD MWCO的透析管时,RLD和F1的释放曲线重叠(图6A)。较高MWCO (1000 kD)的透析管具有较高的释放率和更好的区分能力(图6B)。然而,Float-ALyzer方法在区分RLD和F1时灵敏度较低,尽管具有较高MWCO (1000 kD)的Float-A-Lyzer方法略好。区分处方的灵敏度低可能是由于透析带中不满足漏槽条件所致。虽然这种方法缺乏区分力,但使用MWCO大于1000 kD的透析膜或孔径较大的膜可能有有所改善。不幸的是,市售透析管最高MWCO为1000 kD。所以后面的研究中考虑了合适孔径的膜过滤器。所有配方都在微米尺寸范围内(参见图5),只有可忽略不计的部分在亚微米尺寸(低于截止尺寸)。当使用更高的截留分子量时,药物释放更快,是药物分子的扩散速度更快,而不是亚微米颗粒的存在。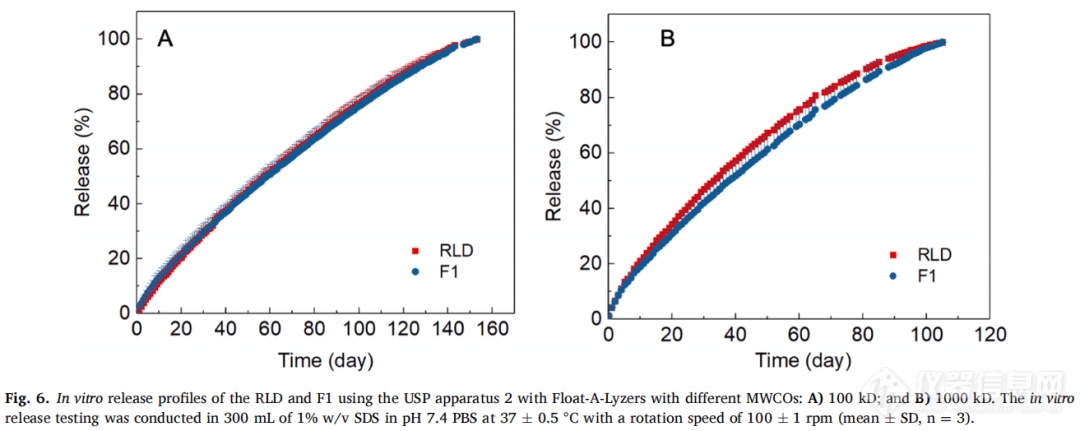
3.2.2 使用浸没池装置的USP2法
近期,USP2浸没池装置被用于软膏和凝胶等半固体剂型。从透析法的结果来看,浸没池可能是LAI混悬液释放测试的一个可行选择,因为使用USP2浸没池装置,市面上有比透析管孔径更大的膜过滤器,RLD和F1的透析持续时间约为两周,与透析法相比大大缩短。此外,该方法能够区分RLD和F1(图7)。该方法在除几个早期时间点(第5天之前)外的所有时间间隔内均显示出可接受的重现性(15%RSD)。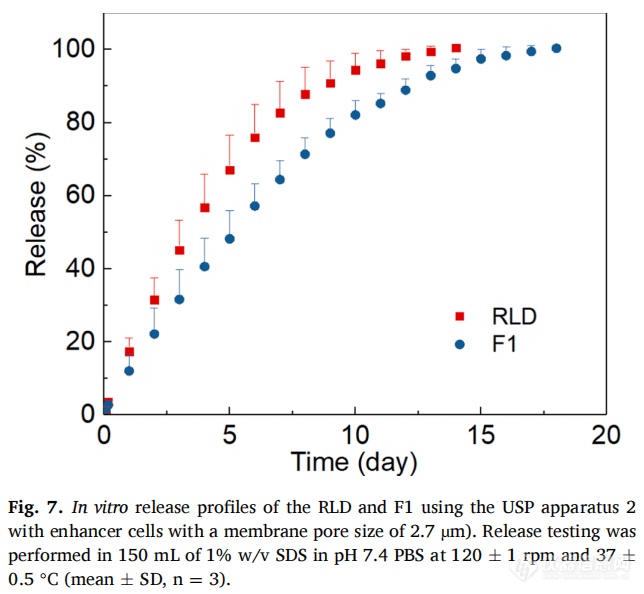
3.2.3 使用自制适配器的USP2法
为了使用USP2法的标准1 L溶出杯进行MPA混悬液的体外释放测试,开发了一种适配器。这种适配器比浸没池薄得多,且有不同帽的设计,浸没池的固定帽需要拧紧,操作时可能会引起膜起褶皱。膜褶皱可能导致药物泄漏或者与膜不完全接触,造成结果重现性差。自制适配器的帽是通过滑动组装的,这对膜和样品的影响更少。两种配方的释放持续时间(~1个月)都比浸没池法长(~2周)(图8)。尽管误差条很高,但使用自制适配器测定的RLD和F1的释放曲线显示出良好的区分力。与浸没池法相比,RLD和F1的释放曲线之间差值较大。然而,该装置的缺点是释放曲线变异较大,需要进一步的制造设计优化(正在进行中)。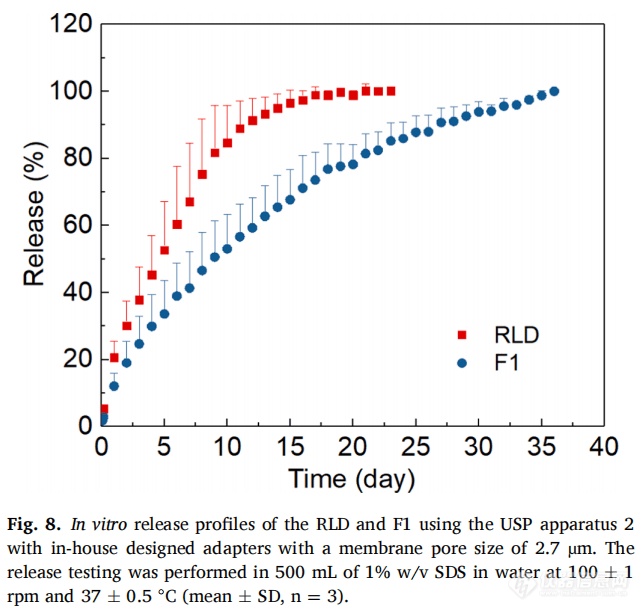
3.2.4 使用半固体适配器的USP4仪器
USP4法仪器加半固体适配器首次被报告是测试眼部软膏制剂(Xu et al.2015;Bao et al. 2017)。在本研究中,该方法也被用于混悬液的体外释放测试,半固体适配器用来装载样品,适配器中不使用膜(图9)。RLD和F1的释放持续时间均约为1周。此方法对RLD和F1显示出良好的区分力和重现性(小于5% RSD)。与USP2的浸没池法和自制适配器法相比,USP4的半固体适配器法显示出最好的重现性。这可能是因为USP4半固体适配器法中未使用膜,消除了膜对LAI混悬液样品产生的误差。USP2法中使用的膜(浸没池或自制适配器)是为了便于装样,膜不会对药物释放产生扩散障碍或影响漏槽条件。但膜可能在组装过程中起皱,或导致泄漏,从而引起误差。
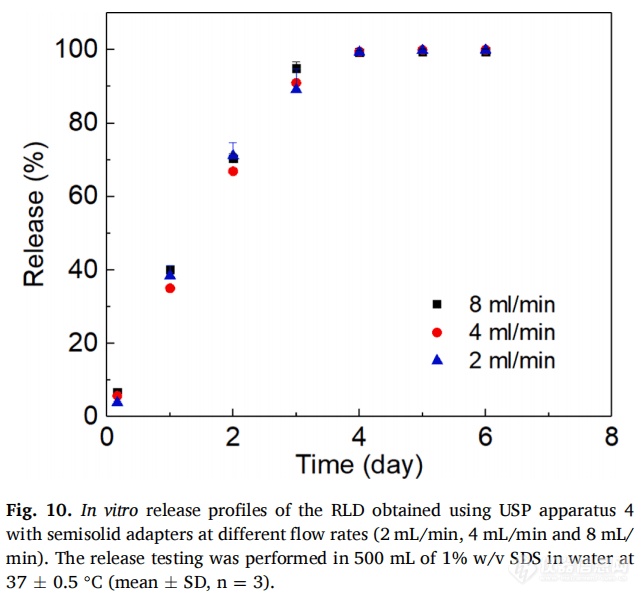
为了研究流速对释放曲线的影响,以2mL/min、4mL/min和8 mL/min流速对RLD进行释放测试(图10)。不同流速下RLD的释放曲线相互重叠,表明流速对LAI混悬液的药物释放曲线影响较⼩。另外,释放曲线的误差较小,证实了该方法具有良好重现性。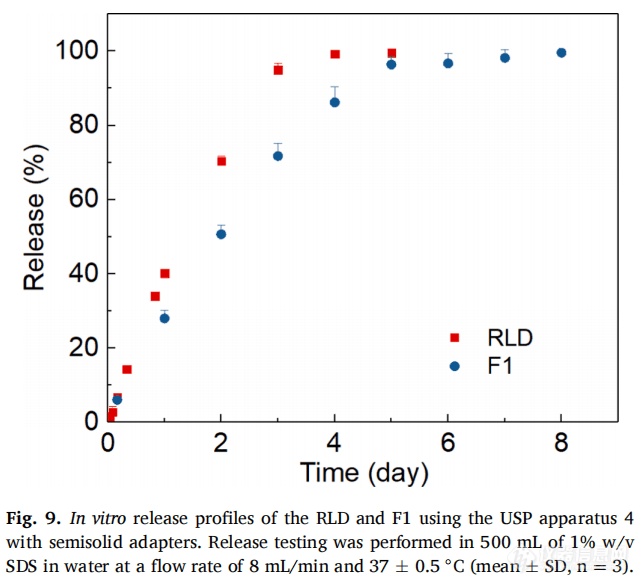
3.3 RLD和Q1/Q2等效MPA混悬液的释放曲线
使用USP2浸没池法(图11A)、USP2自制适配器法(图11B)和USP4半固体适配器法(图11C)三种方法对RLD和三种Q1/Q2等效MPA混悬液进行释放测试。三种方法均具有对不同粒径的Q1/Q2等效MPA混悬液的区分能力。USP2自制适配器法对F1和F2的区分力较低。所有方法中,RLD和Q1/Q2等效MPA混悬液的释放速率表现出相似的趋势,顺序依次为F3>RLD>F1>F2。由图5可知,MPA混悬液的粒径大小依次为F3
使用不同方法测试的MPA制剂的整体释放特性表现出非常相似的趋势和顺序。所有方法的药物释放时间均有所延长,这是本研究所期望的。然而,使用不同的释放试验方法,药物的释放持续时间从大约1周到7周不等。这可能是由于三种方法之间介质的流体动力学差异所致。USP4半固体适配器法没有使用膜覆盖样品,混悬液直接接触释放介质,所以药物释放速度更快或释放时间更短。相反,在USP2的两种方法(使用浸没池或自制适配器)中,在混悬液的上方都加了玻璃纤维膜。薄膜本不应该成为药物扩散的屏障,但混悬液处方中的药物颗粒在浸没池或自制适配器的腔体中保持不动,导致释放速率变慢。两种USP2法的药物释放率的差异在于:1)膜和装置附近的流体动力学;浸没池法中使用的小溶出杯和小桨,自制适配器法中使用的是1L标准溶出杯和桨;2)所用膜的接触面积(浸没池4 cm2,而自制适配器为3.14cm2);3)介质体积(浸没池为150 mL,自制适配器为500 mL),所以漏槽条件不同;4)浸没池和自制适配器样品室的设计。
四、结论
本研究使用微小改动的药典方法(USP2法和USP4法)进行了LAI混悬液的体外释放测试。使用标准USP仪器可以在不同的实验室进行比较。尽管使用透析管的USP2法释放测试时间较长,但市售不同截留分子量(100 kD和1000 kD)的透析膜的区分能力都较差。USP2(使用浸没池和自制适配器)和USP4(使用半固体适配器)法对不同粒径的Q1/Q2等效LAI混悬液显示出良好的区分能力,证实了药物粒径对LAI混悬液体外性能的影响(即粒径越⼩释放速率越快,反之亦然)。另外,USP4法结合半固体适配器的重现性最好,而USP2法对不同Q1/Q2等效MPA混悬液区分能力更好(误差较大)。USP2法两种装置的释放速率差异是由流体动力学、接触面积、介质体积和样品室设计等因素造成的。这些体外释放测试方法的释放持续时间较长,从一周到几个月不等。所以可能更能反映LAIs的体内释放情况,为IVIVCs的建立提供了一种有效的方法。
五、参考文献
略
如需原文,请联系小编(15012941165)
下载本篇解决方案:
更多![]()
好文推荐 |依匹哌唑原位凝胶植入剂的体外释放研究
目的 建立一种依匹哌唑原位凝胶植入剂的体外释放方法,研究处方在体外的释放行为和缓释机制。 方法 以抗精神病依匹哌唑为模型药物,制备以聚乳酸⁃羟基乙酸共聚物( polylactide gly⁃ colic acid,PLGA)/醋酸异丁酸蔗糖酯( sucrose acetate isobutyrate,SAIB)为基质的原位凝胶植入剂。开发体外释放检测方法,采用多种体外释放装置研究依匹哌唑原位凝胶植入剂的释放差异, 考察体外释放的影响因素。
制药/生物制药
2024/06/24
好文推荐 | 水杨酸片在流池法溶出仪性能验证试验中的应用
流池法溶出仪是控释剂型、难溶性药物和许多特殊剂型(如混悬液、软胶囊、植入剂、微球和脂质体)溶出度测试的首选仪器。虽然流池法溶出仪已列入药典多年,但一直没有正式的性能验证试验(PVT)方法。在这项研究中,水杨酸片被用来开发流池法的PVT。水杨酸片在篮法和桨法装置上相同的溶蚀和零级释放机制,可作为流池法装置中PVT的潜在参考标准品。在第一阶段,采用实验设计法(DoE)系统考察了四个参数对水杨酸片溶出度的影响。片剂装载方式是影响溶出度的最重要参数;流速和池体内径(ID)也有显著影响,温度对溶出的影响可以忽略不计。在第二阶段,由四名不同的分析人员在不同的流池法装置上(即四名合作者)进行溶出试验,以进行重复性和重现性评估,并确定PVT的初步可接收标准。第二阶段的实验条件是将片剂放置在带有玻璃珠的片剂支架上,池体ID为12 mm,流速为16 mL/min,温度为37℃,90分钟采集样品。第五个合作者的数据证实了PVT的可重复性。
制药/生物制药
2024/06/14
介质脱气小能手 | 华溶DGU-900在线溶媒脱气机,只为溶出仪而生
在进行溶出实验过程中,介质中溶解气体的释放是影响溶出结果的主要变动因素之一。因此,对溶出介质进行脱气处理变得尤为重要,并应将具体脱气程序写入溶出检测操作的标准操作规程。
制药/生物制药
2024/04/15
好文推荐 | 奈帕芬胺眼用混悬液的体外释放试验方法
体外释放试验(IVRT)方法对于监测制药生产过程中批次间的质量变化以及表现仿制药与原研药的药物等效性非常重要。为了满足批准眼用混悬液仿制药的监管要求,需要进行体外释放研究。目前尚无药典或非药典方法用于奈帕芬胺眼用混悬液的体外释放研究。 目前的研究旨在筛选使用不同的常规和非常规的各种方法,以建立最合适的奈帕芬胺眼用混悬液的技术,然后优化方法参数并进行验证。试验使用带透析袋的桨法装置(USP 2型)、流通池装置(USP 4型)、水浴转瓶装置和Franz扩散池装置。使用USP 4型装置,在pH 7.4的模拟泪液(STF)中,药物在120分钟内的释放度约为83%,添加表面活性剂月桂醇硫酸酯钠(SLS)后,释放度增加到约97%。使用USP 2型和Franz扩散池装置,药物释放缓慢或未接近完全释放。然而,在水浴转瓶装置的情况下,观察到了突释曲线。药物释放量的估计是通过HPLC方法进行的,所有方法验证参数,如专属性、准确度、线性和精密度都在可接受标准范围内。
制药/生物制药
2024/04/02











