计算机化系统的数据完整性管理,您做对了吗
“数据完整性”主题已经成为我国和国际检查的关注焦点。我国药监局发布的许多检查报告中都重点提及数据完整性问题。药监机构十分重视每个公司在产品完整生命周期中的数据完整性管理,其中计算机化系统的数据完整性管理是至关重要的环节。
本文将根据我国GMP附录《计算机化系统》的法规要求,同时参考美国《联邦法规21章》第11款(21 CFR Part 11)和数据完整性相关指导原则,总结并分类列举出计算机化系统数据完整性管理的具体做法:
1. 用户管理
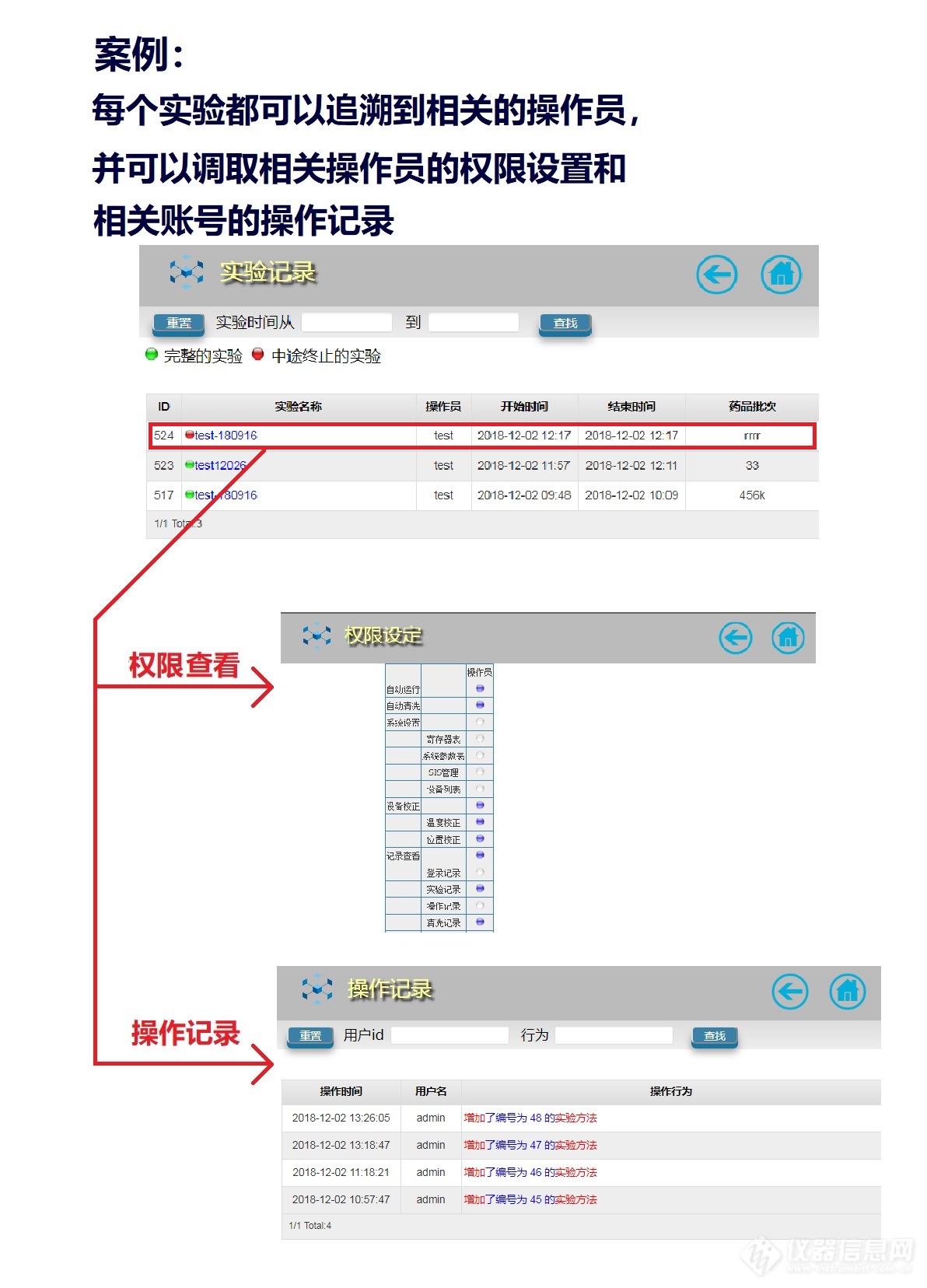
(1) 不可以共用登录账号/登陆密码,任何登录的动作可以追溯到指定的用户个体。
(2) 仅能由授权人员进入系统。建议建立一个用户管理清单,详细列出授权人员以及他们的访问和操作权限。系统管理权限只能授权给系统维护角色人员(如IT人员),这些人员完全独立于实验室分析人员和管理人员。
(3) 账号权限分配应该合理,对应账号只具有与完成其工作职责相当的操作权限。例如测试人员账号不应该具备管理和删除账号的权限。
(4) 任何用户(包括系统管理员)执行的变更必须纳入由质量管理体系,并经过质量体系批准后方可实施。
(5) 系统服务器机房的进出权限应该受控。
2. 数据管理
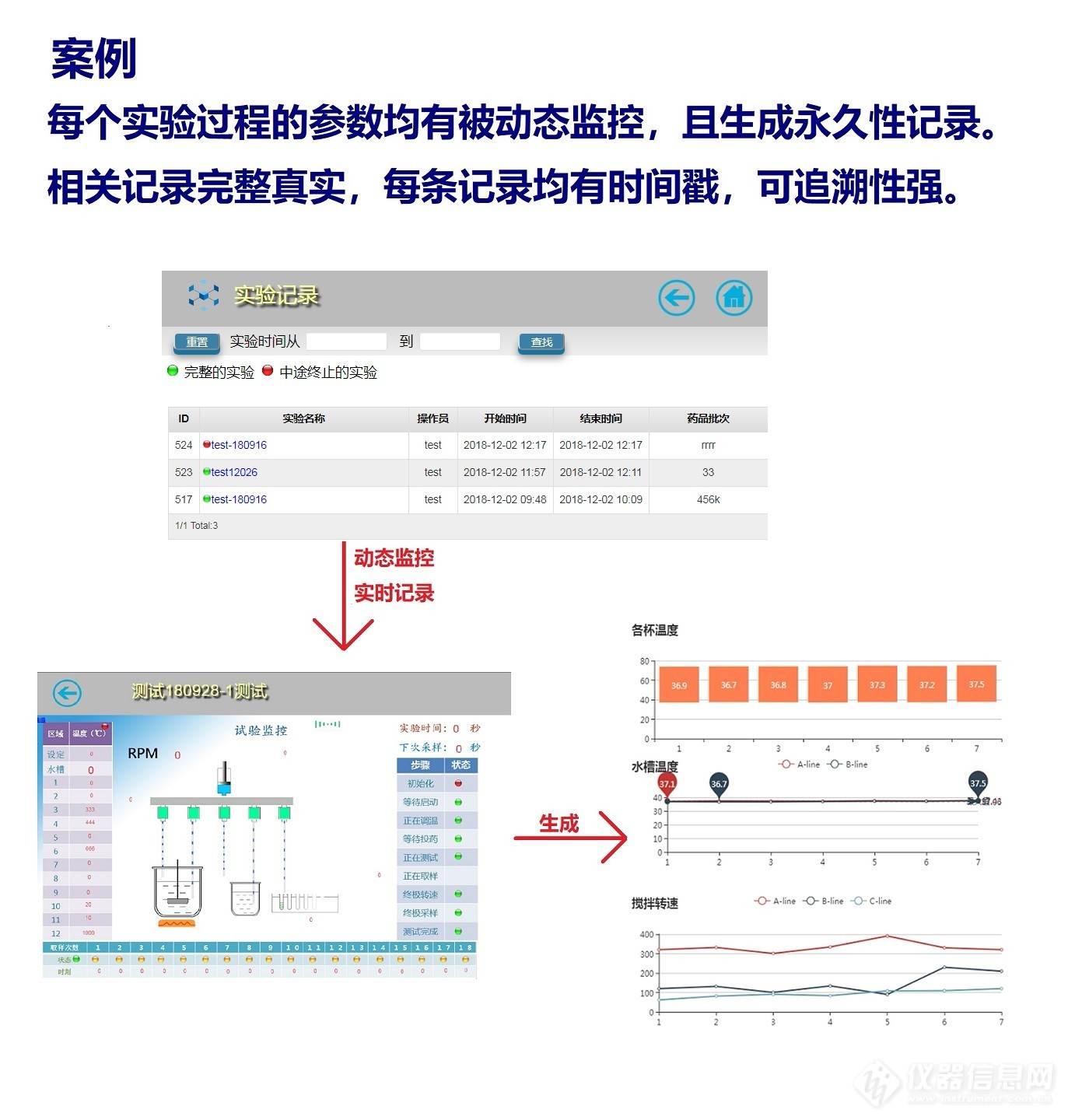
(1) 电子数据能够打印出清晰易懂的纸质文档,打印数据应完整无误。
(2) 日常运行维护和系统发生变更(如计算机设备或其程序)时,所存储数据应可访问且确保完整,不可因系统缺陷导致测试数据损失。
(3) 不可擅自删除和覆盖原始数据。原始数据应该完整真实,具体测试细节可以被实时记录,可以被追踪和溯源。
(4) 应建立数据备份与恢复的操作规程,定期对数据进行异备份,包括本地备份和远程备份,以确保数据安全和可被调用。备份的数据同样需要被保护,以保证其不能被擅自篡改或删除。
(5) 数据备份和恢复过程需要进行验证。
(6) 当电子数据产生后应立即被存储成记录,电子数据在创建成记录之前不可保存到临时存储器中。
(7) 关键数据的修改(例如重新积分)需要得到批准,并记录更改数据的理由。
(8) 修改系统日期和时间的权限应该受控,实验室内所有设备和计算机的时间应该同步。
3. 审计追踪
(1) 用户不可修改或关闭审计追踪。
(2) 审计追踪应该能记录系统内发生的所有关键动作,如用户登陆,测试过程,生成结果,错误信息,以及监控擅自删除/修改数据的等违规动作。
(3) 审计追踪应该定期审核。一般来说,在样品放行前,相关测试的审计追踪应该完成审核。
(4) 影响到测试和数据的系统报警或故障应该被记录和调查。
(5) 限制无法被审计追踪的行为,例如直接在仪器上对测试样品进行单次进样。
4. 系统验证
(1) 建立包含药品生产质量管理过程中涉及的所有计算机化系统清单,清单中应标明系统与药品质量管理相关功能和系统相关信息。
(2) 系统验证的范围和程度应该根据风险评估来制定,风险评估应充分考虑该系统与GXP系统的相关性,对产品质量的影响程度,系统复杂程度等。
(3) 系统应该通过验证并经过质量体系批准后方可使用。计算机化系统验证需要有验证计划书,此验证计划书应基于风险评估制定,用于描述相关的验证活动、验证文件审核流程和可接受标准等。
(4) 应当在计算机化系统生命周期中保持其验证状态,需要定期再验证。系统变更后应对变更进行评估,并根据评估结论执行再验证。
锐拓仪器,作为国内能够做到真正的数据完整性的溶出度仪生产厂商,有信心为用户提供完全符合计算机化系统数据完整性管理要求的产品和服务。
更多![]()
RT7流池法溶出系统应用案例-注射用纳米晶(冻干粉)的体外释放研究
厂商
2024.01.10
RT7流通池溶出系统应用案例-注射用脂质体的体外释放研究
厂商
2023.12.29
从研发到质控:锐拓仪器助力2023药物研发与质量控制大会圆满落幕
厂商
2023.12.29
汇聚医药精英!锐拓仪器邀您共赴2023药物研发与质量控制大会!
厂商
2023.12.29