推荐厂家
暂无
暂无
 金牌4年
金牌4年
 400-860-5168转4713
400-860-5168转4713
 留言咨询
留言咨询
 钻石17年
钻石17年
 400-877-0075
400-877-0075
 留言咨询
留言咨询
 金牌15年
金牌15年
 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询

 400-860-5168转4662
400-860-5168转4662
 留言咨询
留言咨询
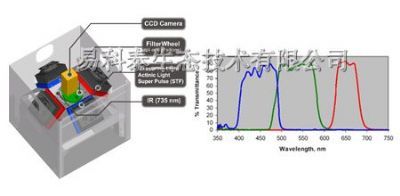
 400-860-5168转1895
400-860-5168转1895
 留言咨询
留言咨询






[align=center][size=16px][/size][/align][size=16px] 光合作用是地球上最重要的化学反应,植物、藻类及光合细菌等吸收光能、将[/size][size=16px]CO[/size][font='calibri'][sub][size=16px]2[/size][/sub][/font][size=16px]和水转化为有机物并释放[/size][size=16px]O[/size][font='calibri'][sub][size=16px]2[/size][/sub][/font][size=16px]。获得光能的叶绿素分子从基态跃迁到激发态,激发态的叶绿素分子可通过三种途径释放能量回到基态:推动光化学反应、以热的形式耗散、释放光子产生荧光。这三种途径的总和是一定的,因此叶绿素荧光的变化反映了光化学效率和热耗散能力的变化。叶绿素荧光成像是[/size][size=16px]广泛应用[/size][size=16px]的[/size][size=16px]光合生理研究的重要探针[/size][size=16px],[/size][size=16px]叶绿素荧光显微成像又将研究尺度进一步拓展到细胞、亚细胞水平。叶绿素荧光技术发展出了很多不同的测量程序,以慢诱导荧光动力学曲线为例,通过测量光([/size][size=16px]ML[/size][size=16px])、作用光([/size][size=16px]AL[/size][size=16px])、饱和脉冲光([/size][size=16px]SP[/size][size=16px])激发样品,记录动力学曲线并计算叶绿素荧光参数[/size][size=16px],[/size][size=16px]可以用于反映植物光合作用机理和光合生理状况([/size][size=16px]朱新广[/size][size=16px],[/size][size=16px]2021[/size][size=16px])。[/size][size=16px][/size][size=16px] 叶绿素荧光成像技术能记录整个叶片、植株等样品不同区域的荧光动力学分布变化,实现从宏观到微观的光合机理研究。叶绿素荧光成像由于其无损、高通量的技术特征,在光合作用相关突变体筛选领域成为了广泛应用的重要技术,为光合作用机理及抗[/size][size=16px]逆研究[/size][size=16px]提供了强大的技术支持。叶绿素荧光显微成像技术最早出现于[/size][size=16px]2000[/size][size=16px]年,[/size][size=16px]K[/size][size=16px]ü[/size][size=16px]pper[/size][size=16px]等人将叶绿素荧光脉冲调制式激发光源与显微镜结合,首次获得了显微尺度的叶绿素荧光图像([/size][size=16px]K[/size][size=16px]ü[/size][size=16px]pper[/size][size=16px] [/size][size=16px]et al.[/size][size=16px], 2000[/size][size=16px])。叶绿素荧光显微成像技术在国外已经展开多方面研究应用,[/size][size=16px]目前国内的叶绿素荧光成像显微研究尚处于起步阶段,多个课题组都[/size][size=16px]正[/size][size=16px]在[/size][size=16px]探索[/size][size=16px]这项技术[/size][size=16px]在[/size][size=16px]不同研究领域中[/size][size=16px]的[/size][size=16px]应用。[/size][size=16px][/size][size=16px] 叶绿素荧光技术[/size][size=16px]适用研究样品微观结构上光[/size][size=16px]合功能[/size][size=16px]的空间差异,例如叶片横截面栅栏组织与海绵组织的差异,[/size][size=16px]C[/size][size=16px]4[/size][size=16px]植物花环结构[/size][size=16px]中维管束鞘细胞与叶肉细胞的差异[/size][size=16px],藻类中有差异的单个细胞、异形胞[/size][size=16px]等。我们多年来与[/size][size=16px]吉林师范大学、四川省农业科学研究院[/size][size=16px]等[/size][size=16px]单位[/size][size=16px]合作[/size][size=16px],[/size][size=16px]目前已合作发表的[/size][size=16px]3[/size][size=16px]篇相关论文是国内该领域[/size][size=16px]开创性[/size][size=16px]的应用成果,[/size][size=16px]以叶绿素荧光显微成像的特色优势技术[/size][size=16px]为光合作用的微观[/size][size=16px]探究提供有力支撑[/size][size=16px]。[/size][size=16px][/size][size=16px] Yu[/size][size=16px]等[/size][size=16px]发现[/size][size=16px]狗枣猕猴桃[/size][size=16px]([/size][size=16px]A[/size][size=16px]ctinidia [/size][size=16px]kolomikta[/size][size=16px])[/size][size=16px]的白化[/size][size=16px]叶片[/size][size=16px]通过调整叶片结构及基因表达调控,仍然保持了相对较高的光合能力[/size][size=16px]。[/size][size=16px]应用[/size][size=16px]叶绿素荧光显微成像技术[/size][size=16px]比较了[/size][size=16px]白化和绿色叶片栅栏组织、海绵组织的叶绿素荧光参数,[/size][size=16px]揭示了白化叶片海绵组织光[/size][size=16px]合能力[/size][size=16px]增强的机理[/size][size=16px]。[/size][size=16px]绿叶中栅栏组织[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px](最大光化学效率)[/size][size=16px]更高,而白叶中海绵组织[/size][size=16px]显著增厚,[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]更高[/size][size=16px],[/size][size=16px]光[/size][size=16px]合能力[/size][size=16px]增强,补偿[/size][size=16px]了[/size][size=16px]白化的影响,成为叶片光合作用主力组织[/size][size=16px]([/size][size=16px]Yu [/size][size=16px]et al.[/size][size=16px], 2022[/size][size=16px])[/size][size=16px]。[/size][size=16px]接下来[/size][size=16px]Chen[/size][size=16px]等又比较了两种猕猴桃白化叶片的光保护策略差异[/size][size=16px],狗枣猕猴桃的白叶[/size][size=16px]主要通过反射实现光保护,强光下花青素[/size][size=16px]积累,叶片[/size][size=16px]转变为粉色[/size][size=16px],更有效地保护叶片[/size][size=16px];[/size][size=16px]而[/size][size=16px]葛[/size][size=16px]枣猕猴桃([/size][size=16px]A[/size][size=16px]ctinidia[/size][size=16px] [/size][size=16px]polygama[/size][size=16px])[/size][size=16px]强光下[/size][size=16px]仍为白色[/size][size=16px],[/size][size=16px]具[/size][size=16px]有更[/size][size=16px]强[/size][size=16px]的叶绿[/size][size=16px]素荧光参数,说明[/size][size=16px]它[/size][size=16px]具有更高的强光适应能力[/size][size=16px]([/size][size=16px]Chen[/size][size=16px] [/size][size=16px]et al.[/size][size=16px], 202[/size][size=16px]3[/size][size=16px])。[/size][size=16px]Liu[/size][size=16px]等比较了干旱处理下的玉米叶肉细胞和维管束鞘细胞,发现这两种细胞具有不同的不同光保护策略[/size][size=16px]。对玉米[/size][size=16px]完整叶片的分析显示,[/size][size=16px]随着干旱处理程度增强,[/size][size=16px] [/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]、[/size][size=16px]Φ[/size][font='calibri'][size=14px][sub][size=16px]PSII[/size][/sub][/size][/font][size=16px](实际光化学效率)[/size][size=16px]降低,[/size][size=16px]NPQ[/size][size=16px](非光化学猝灭[/size][size=16px]系数[/size][size=16px])[/size][size=16px]显著升高[/size][size=16px]。进一步应用[/size][size=16px]叶绿素荧光显微成像[/size][size=16px]的分析结果[/size][size=16px]与完整叶片[/size][size=16px]相符合,并且发现[/size][size=16px]与叶肉细胞相比,维管束鞘细胞[/size][size=16px] [/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]v[/size][/sub][/size][/font][size=16px]/[/size][size=16px]F[/size][font='calibri'][size=14px][sub][size=16px]m[/size][/sub][/size][/font][size=16px]、[/size][size=16px]Φ[/size][font='calibri'][size=14px][sub][size=16px]PSII[/size][/sub][/size][/font][size=16px]更低,干旱胁迫后[/size][size=16px]NPQ[/size][size=16px]升高更显著[/size][size=16px],[/size][size=16px]不同细胞的变化趋势[/size][size=16px]差异[/size][size=16px]表明它们[/size][size=16px]具有不同的光保护策略[/size][size=16px],[/size][size=16px]维管束鞘细胞中可能具有更强的热耗散能力[/size][size=16px]([/size][size=16px]Liu [/size][size=16px]et al.[/size][size=16px], 2022[/size][size=16px])。[/size][size=16px][/size][size=16px] 叶绿[/size][size=16px]素[/size][size=16px]荧光显微成像技术在光合作用的微观研究领域具有独特的技术优势,在[/size][size=16px]光合作用机理研究、环境及毒理胁迫与抗性筛选、优良品系选育等领域[/size][size=16px]具[/size][size=16px]有广阔的应用前景。目前多家单位的科研人员[/size][size=16px]都[/size][size=16px]在[/size][size=16px]探索该技术[/size][size=14px][size=16px]的新应用,我们也正在[/size][size=16px]将该技术拓展到[/size][size=16px]多个新的领域,例如对[/size][size=16px]原生质体[/size][size=16px]以及[/size][size=16px]种子、茎秆等非叶片器官的[/size][size=16px]研究[/size][size=16px]。[/size][/size][font='黑体']参考文献:[/font][font='calibri'][size=13px][1] [/size][/font][font='calibri'][size=13px]朱新广[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]许大全主编[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]光合作用研究技术[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]上海科学技术出版社[/size][/font][font='calibri'][size=13px], 2021[/size][/font][font='calibri'][size=13px][2] [/size][/font][font='calibri'][size=13px]H[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Küpper[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]I[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]?etlík[/size][/font][font='calibri'][size=13px], [/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Trtílek[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Photosynthetica[/size][/font][font='calibri'][size=13px], 2000, 38, s553-570 [/size][/font][font='calibri'][size=13px][3] [/size][/font][font='calibri'][size=13px]M[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Yu, [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Chen, [/size][/font][font='calibri'][size=13px]D[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] H[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Liu[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Front. Plant Sci.[/size][/font][font='calibri'][size=13px], 2022, 13: 856732 [/size][/font][font='calibri'][size=13px][4] [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Chen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] D[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]Q[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Wen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] G[/size][/font][font='calibri'][size=13px]. [/size][/font][font='calibri'][size=13px]L[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] Shi[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]et al.[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Physiol. Plant.[/size][/font][font='calibri'][size=13px], 2023, [/size][/font][font='calibri'][size=13px]175:[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]e13880[/size][/font][font='calibri'][size=13px][5] [/size][/font][font='calibri'][size=13px]W[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] J[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Liu, [/size][/font][font='calibri'][size=13px]H[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Liu, [/size][/font][font='calibri'][size=13px]Y[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] E[/size][/font][font='calibri'][size=13px].[/size][/font][font='calibri'][size=13px] [/size][/font][font='calibri'][size=13px]Chen[/size][/font][font='calibri'][size=13px],[/size][/font][font='calibri'][size=13px] et al. [/size][/font][font='calibri'][size=13px]Front. Plant Sci.[/size][/font][font='calibri'][size=13px], 2022, 13: 885781[/size][/font]
请问是否有一种仪器,能够测植物光合、叶绿素、叶面积,等对植物生理的检测系统
[size=16px] 叶绿素测定仪是一种用于测量植物叶片中叶绿素含量的设备。叶绿素是植物中进行光合作用的关键色素,它们吸收光能并将其转化为化学能以支持植物的生长和发展。以下是一般情况下使用叶绿素测定仪测量植物叶绿素相对含量的步骤: 样本准备: 从要测量的植物中选取代表性的叶片样本。这些叶片应该是健康的、没有损伤的,并且尽可能避免太老或太嫩的叶片。 叶片处理: 如果需要,将叶片处理成较小的块状或碎片,以确保测量时样本的均匀性。同时,避免过度损伤叶片,因为这可能会影响叶绿素的测量结果。 提取叶绿素: 使用适当的提取液(比如乙醇、乙醚等)将叶片中的叶绿素提取出来。提取的过程通常需要在低温下进行,以防止叶绿素的降解。 测量光吸收: 将提取液中的叶绿素溶液置于叶绿素测定仪中。这种仪器通过照射样本并测量样本对不同波长光的吸收来确定叶绿素的含量。最常见的方法是使用分光光度计,它可以测量不同波长下样本吸收的光强度。 建立标准曲线: 使用已知浓度的叶绿素标准溶液,进行一系列测量以建立标准曲线。标准曲线可以用来将样本吸收的光强度值转换为叶绿素浓度值。 测量样本: 使用同样的方法测量你的样本,获取其吸收的光强度值。 计算叶绿素含量: 根据标准曲线,将样本的光吸收值转化为叶绿素浓度。如果你感兴趣的是叶绿素的相对含量,可以将不同样本的叶绿素浓度与标准样本进行比较。 请注意,使用叶绿素测定仪需要一定的实验操作技能和基本的化学常识。在操作之前,云唐建议仔细阅读仪器的操作手册,并根据实际情况调整实验步骤。另外,确保在实验过程中遵循安全操作规范,使用适当的防护措施。[/size]