推荐厂家
暂无
暂无
 400-801-3126
400-801-3126
 留言咨询
留言咨询
 400-860-5168转0264
400-860-5168转0264
 留言咨询
留言咨询
 400-860-5168转6039
400-860-5168转6039
 留言咨询
留言咨询

 400-801-3126
400-801-3126
2、混合器;3、四波长UV-VIS检测器;4、自动进样器馏分收集一体机;5、溶剂槽;6、模块化液相工作站;7、电脑 ; 技术指标泵1、流量范围:0~200mL/min单泵,0~400mL/min双泵;
2、压力范围:标准300bar;紫外检测器1、检测器范围:190~850nm;2、检测器光源:氘灯-钨灯组合光源;3、波长精度:±1nm;重复性0.2nm;4、检测方式:UV-VIS检测器,4波长实时显示;自动进样模块1、定量环:10mL;2、进样位数:108位;
3、试管规格:13*100mm;馏分收集模块1、馏分收集容器:400位(标配);2、试管规格:18*180mm,(其它规格可定制); 可选配件1、 蒸发光散射检测器;2、二极管阵列检测器; 由于技术不断进步,本公司保留设计更改之权利,更改恕不通知,敬请谅解。 留言咨询
留言咨询

 400-875-3676
400-875-3676
 留言咨询
留言咨询







细胞液量很少,几乎澄清,稀释50倍后直接进样分析。菜鸟求助:不知道前处理需不需要蛋白沉淀呢?细胞液中的蛋白质是否会干扰元素测定。另外,想求合适的前处理方法。谢谢。
关键词:单细胞凝胶电泳目的:为便于各室单细胞凝胶电泳试验结果的可比性背景知识:略原理:在细胞核中,DNA是环状附着在核基质上,细胞裂解过程中,核基质被溶解、抽提,DNA的结构则未发生变化。如果DNA链上存在缺口,则使DNA超螺旋变的松弛,DNA环向外展,同时由于暴露了阴电荷,在电场力的作用下,松动的DNA环向阳极迁移,但是由于这种松动的DNA环一端仍附着于核DNA,其迁移距离受到限制,因此尾长并不总是真实反映链缺口的多少。实际应当依靠尾长与尾部的荧光强度同时来进行分析。主体内容:操作步骤见下文主要参考文献:略操作步骤:1. 分离制备单细胞悬液:(1) 体外培养的细胞株:用胰酶消化,吹打成单细胞悬液(2) 体内脏器细胞:处死动物,取出脏器,于Hanks’液中制备成单个细胞悬液。2. 胶板制备:(1) 取20~50μl于56℃水浴中保温的0.5%普通熔点琼脂糖,铺于磨沙载玻片上,形成底胶。(2) 取100~150μl 0.5%普通熔点琼脂糖加在底胶上,再于其上加盖玻片,4℃冷凝10分钟。(3) 取下盖片,取50~100μl于37℃水浴中保温的1.0%的低熔点琼脂糖与50~100μl细胞悬液(105个细胞/ml)混匀,立即铺片,加上盖玻片,4℃冷凝10分钟。(4) 去掉盖玻片,取70~100μl于37℃水浴中保温的0.5%的低熔点琼脂糖铺片,加盖玻片,4℃冷凝。3. 细胞裂解与电泳:(1) 将制备好的胶板去掉盖玻片后,浸于4℃预冷的细胞裂解液中,4℃裂解1小时。(2) 取出胶板,放入电泳槽中,浸泡在电泳液中解旋20分钟。(3) 4℃电泳20分钟(25V,300mA)。4. 中和与染色:(1) 电泳结束,将胶板浸泡于中和液中,每次15分钟,共中和两次,注意更换中和液。(2) 取出胶板,置于染色架上,滴加5μg/ml的PI,暗处染色20分钟。(3) 蒸馏水脱色15分钟。5. 镜检和分析:(1) 在荧光显微镜下观察,绿光激发吸收滤片590nm。必要时照相记录。(2) 记数观察的细胞,记录彗星细胞出现的频率,用目镜测微尺测头长与全长,计算核DNA迁移距离。* * * * *使用两层凝胶法,经裂解、DNA解旋、电泳和中和得到湿琼脂糖凝胶片。将湿琼脂糖凝胶片置于冰冷无水乙醇中脱水10分钟,后置于空气中自发干燥。每人制备2张琼脂糖凝胶片。全部操作在采血后8小时内完成,操作过程中注意避光。脱水干燥的琼脂糖凝胶片装于含有干燥剂的载片盒中运回实验室。使用50μl 30μM的溴乙锭溶液染色、照相。使用单细胞凝胶电泳软件分析所有照片,每人随机测量100个以上细胞的尾长和olive尾矩,以尾长和olive尾矩的算术均数代表个体DNA损伤情况。
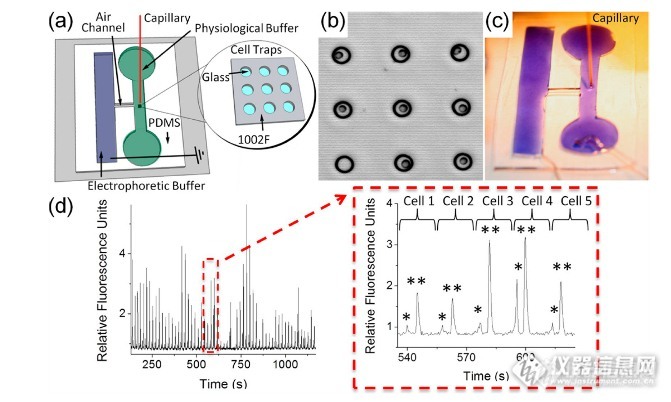
题名:自动化毛细管电泳的快速单细胞分析(Automated Capillary Electrophoresis System for Fast Single-Cell Analysis)作者:Alexandra J. Dickinson , Paul M. Armistead , andNancy L. Allbritton (一群美国滴家伙)杂志:Analytical Chemistry年卷页: 2013, 85 (9), pp 4797–4804 正文:毛细管电泳在单细胞分析上显示了其独特而强有力的优势,这是HPLC和UPLC等难望其项背的优势之一。以下就给大家介绍一个该项技术在单细胞分析上的应用,很牛很强大~ 为了介绍全面一点,我把整段摘要给翻译了。毛细管电泳用于单细胞分析是一种非常有前景的技术,但是在生物研究上其具有低通量的局限性。本文提出了一个微型细胞捕获器和三通道体系的自动化分析平台,在该系统上可进行快速缓冲液交换以进行快速单细胞分析。导入的细胞跟荧光素和俄勒冈绿一起被分离分析,通量为3.5 细胞/分,荧光素和俄勒冈绿的分离度为2.3±0.6。细胞蛋白激酶B(PKB)的活性是通过检测免疫荧光染色后的二氧膦基-PKB来检测的。结果显示,PKB在并没有变化,说明在CE分析过程中应激活化蛋白酶没有被上调,而且在细胞溶膜之前基底细胞的生理机能也没有被扰乱。在癌细胞中鞘氨醇激酶(SK)通常情况下是会被上调的。在此实验中,通过将神经胺-荧光黄(SF)基底引入细胞中而对SK进行检测。SF、神经胺-1-磷酸荧光黄(S1PF)和1/3荧光种类在单细胞中得到分析。219个细胞中,单细胞通量为2.1细胞/分钟。虽然这些亚种群细胞(此类细胞SK活性差异很大,这些差异跟种群均值有关)很容易被测定到,但88%的细胞具有上调SK的活性。该系统稳定,重现性好,可用于上百个贴壁和非贴壁细胞的生物组分的分离分析;还可用于检测非表征的生物学现象。生物方面的知识翻译起来颇费功夫,有些地方翻译得不一定地道。不过生物知识在这里不是重点,亮点在仪器上。比如微型细胞捕获器,这个装置至于毛细管入口端上面50微米处,那个三通道系统也一副牛掰哄哄的样子。如下图: http://ng1.17img.cn/bbsfiles/images/2014/01/201401202053_488354_1624715_3.png其他参数:溶膜方式:激光脉冲生理盐水和分离缓冲液的控制方式:接地电位进样方式:电动进样(-5kV,1s),此时横跨毛细管的电压设为0,1s,毛细管被从air gap移动到分离缓冲溶液中。结语:如果没有多年的科研积累和强大的平台是做不出这样的实验的。纵观这两年发到AC上的文章,动则CE-MS,剩下的就是类似这种:需要很多电化和物化知识外加搞技术难度的仪器创新。革命尚未成功,同志们需多努力啊~~~~~~~


