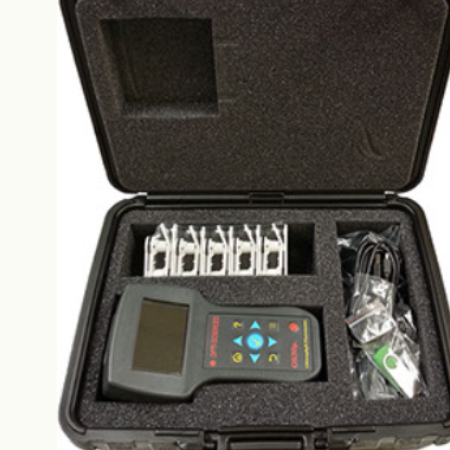
应用Y(II)或ΔF/FM’ 或 (FM’ – FS )/FM’) 是经受时间考验的光适应测量参数,比FV/FM对更多类型的植物胁迫更加敏感。已有的大量证据表明FV/FM对许多种植物胁迫和健康植物的光系统II的测量十分出色,而Y(II)或光量子产额则可测量实际光照下光适应环境和生理状况的光系统II的效率。原理 采用调制饱和脉冲原理,测量植物的叶绿素荧光,通过相关文献的研究成果,计算植物的光量子产额及相对电子传递速率,同时可测量PAR、叶温、相对湿度等环境参数。 特点叶片吸收测量:提供叶片吸收测量及随环境变化导致的叶片吸收变化。根据Eichelman (2004) 叶片吸收在健康植物的变化范围在0.7~0.9 之间。因此,为获得准确的ETR或“J”,Y(II)测量仪提供了一个可靠的测量方法,FV/FM测量单元:可额外选配FV/FM测量仪,用于暗适应测量。具有暗适应叶夹阳光下屏幕可见图形显示FV/FM曲线2GB存储空间USB通讯数据Excel查看 先进的PAR叶夹:采用底部叶夹打开装置,防止测量时误操作打开叶夹。对传感器进行余弦校正,确保叶片相对测量光的角度不变。 FM’校正:对于具有高光照强度历史的植物,完全关闭光反应中心是一个问题,Y(II)测量仪使用Loriaux &Genty 2013的方法进行FM’校正,确保误差最小。自动调制光设定:快速准确自动的调整合适的调制光强,避免人工操作的误差。先进算法避免饱和脉冲NPQ:采用25ms内8点的平均值确定FM’,消除饱和脉冲NPQ的影响。更精确的叶温测量:采用非接触式红外测量,测量精度可达±0.5℃。直接测量相对湿度:含有测量气体交换使用的固态传感器,可测量相对湿度。降低叶片遮挡的设计:倾斜的角度减少对叶片的遮挡,可以测量拟南芥等小叶。 系统组成标配:Y(II)光量子产额测量仪、充电器、USB电缆、便携箱、2个吸收测量单元、U盘(包含说明书)。可选:FV/FM测量仪及10个暗适应叶夹、三脚架。 技术指标测量参数:Y(II)或ΔF/Fm‘、ETR、PAR、T、FMS或FM’、Fs、α(叶片吸收)。监测模式:可使用电脑,长时间监测Y(II)、ETR、叶片吸收、PAR、叶温、相对湿度、及计算NPQ。相对湿度:5%~95%,±2%。可选参数:FV/FM、FV/FO,FO, FM, FV。可使用AC或USB供电,可配三脚架。技术参数:光源饱和脉冲:白色LED具有PAR时7000μmols调制光:红色LED 660nm,具有690nm短波过滤。光化光源:仅可使用外部光源检测方法:调制脉冲法检测器&过滤器:具有700~750nm带通过滤的PIN光电二极管取样速率:1~10000点/秒自动切换。测量时间:3s或长期监测存储空间:2GB输出:USB尺寸:便携箱尺寸为14”x 11”x 6”,仪器为9’’长质量:Y(II) 测量仪0.45 kgFV/FM测量仪0.36 kg.总重1.95 kg.产地美国文献Adams & Demming-Adams 2004 – Chlorophyll Fluorescence as a tool to Monitor Plant Response to the Environment. William W. Adams III and Barbara Demmig-Adams, From Chapter 22, “Chlorophyll a Fluorescence a Signature of Photosynthesis”, edited by George Papaqeorgiou and Govindjee, published by Springer 2004, PO Box 17, 3300 AA Dordrecht, The Netherlands, pages 598 -599Adams WW III, Demmig-Adams B. (1994) Carotenoid composition and down regulation of Photosystem II in three conifer species during the winter. Physiol Plant 92: 451-458Ball MC. (1994) The role of photoinhibition during seedling establishment at low temperatures. In: Baker NR. And Bowyer JR. (eds) Photoinhibition of Photosynthesis. From Molecular Mechanisms to the Field, pp365-3376 Bios Scientific Publishers, OxfordBall MC., Butterworth JA., Roden JS., Christian R., Egerton JJG., (1995) Applications of chlorophyll fluorescence to forest ecology. Aust. J. Plant Physiology 22: 311-319Baker N.R, Rosenquist E. (2004) Applications of chlorophyll fluorescence can improve crop production strategies: an examination of future possibilities, Bukhov & Carpentier 2004 – Effects of Water Stress on the Photosynthetic Efficiency of Plants, Bukhov NG., & Robert Carpentier, From Chapter 24, “Chlorophyll a Fluorescence a Signature of Photosynthesis”, edited by GeorgePapaqeorgiou and Govindjee, published by Springer 2004, PO Box 17, 3300 AA Dordrecht, The Netherlands, page 627-628 Burke J. (2007) Evaluation of Source Leaf Responses to Water-Deficit Stresses in Cotton Using a Novel Stress Bioassay, Plant Physiology, Jan. 2007, Vol 143, pp108-121Burke J., Franks C.D. Burow G., Xin Z. (2010) Selection system for the Stay-Green Drought Tolerance Trait in Sorghum Germplasm, Agronomy Journal 102:1118-1122 May 2010Cavender-Bares J. & Fakhri A. Bazzaz 2004 – “From Leaves to Ecosystem: Using Chlorophyll Fluorescence to Assess Photosynthesis and Plant Function in Ecological Studies”. Jeannine Cavender Bares, Fakhri A. Bazzaz, From Chapter 29, “Chlorophyll a Fluorescence a Signature of Photosynthesis”, edited by George Papaqeorgiou and Govindjee, published by Springer 2004, PO Box 17, 3300 AA Dordrecht, The Netherlands, page 746-747 ETR Drought stress and npqCazzaniga S, Osto L.D., Kong S-G., Wada M., Bassi R., (2013) “Interaction between avoidance of photon absorption, excess energy dissipation and zeaxanthin synthesis against photo oxidative stress in Arabidopsis”, The Plant Journal, Volume 76, Issue 4, pages568–579, November 2013 DOI: 10.1111/tpj.12314Cheng L., Fuchigami L., Breen P., (2001) “The relationship between photosystem II efficiency and quantum yield for CO2 assimilation is not affected by nitrogen content in apple leaves.”Adams WW III, Demmig-Adams B., Vernhoeven AS., and Barker DH., (1995) Photoinhibition during winter stress – Involvement of sustained xanthophyll cycle-dependent energy-dissipation. Aust J. Plant Physiol 22: 261-276 Journal of Experimental Botany, 55(403):1607-1621Journal of Experimental Botany, 52(362):1865-1872Crafts-Brandner S. J., Law R.D. (2000) Effects of heat stress on the inhibition and recovery of ribulase-1, 5- biphsphate carboxylase/ oxygenase activation state. Planta (2000) 212: 67-74all’Osto L, Cazzaniga S, Wada M, Bassi R. (2014) On the origin of a slowly reversible fluorescence decay component in the Arabidopsis npq4 mutant. Phil. Trans. R. Soc. B 369: 20130221.da Silva J. A. & Arrabaca M.C. (2008).Physiologia Plantarum Volume 121 Issue 3, Pages 409 – 420 2008Eichelman H., Oja V., Rasulov B., Padu E., Bichele I., Pettai H., Niinemets O., Laisk A. (2004) Development of Leaf Photosynthetic Parameters in Betual pendula Roth Leaves: Correlation with Photosystem I Density, Plant Biology 6 (2004):307-318Eyodogan F., Oz M. T. (2007) Effect of salinity on antioxidant responses of chickpea seedlings. Acta Physiol Plant (2007) 29:485-493Flexas 1999 – “Water stress induces different levels of photosynthesis and electron transport rate regulation in grapevines”J. FLEXAS, J. M. ESCALONA & H. MEDRANO Plant, Cell & Environment Volume 22 Issue 1 Page 39-48, January 1999Flexas 2000 – “Steady-State and Maximum Chlorophyll Fluorescence Responses to Water Stress In Grape Vine Leaves: A New Remote Sensing System”, J. Flexas, MJ Briantais, Z Cerovic, H Medrano, I Moya, Remote Sensing Environment 73:283-270 Physiologia Plantarum, Volume 114, Number 2, February 2002 , pp. 231-240(10)Gonias E. D. Oosterhuis D.M., Bibi A.C. & Brown R.S. (2003) YIELD, GROWTH AND PHYSIOLOGY OF TRIMAX TM TREATED COTTON, Summaries of Arkansas Cotton Research 2003Hendrickson L., Furbank R., & Chow (2004) A simple alternative approach to assessing the fate of absorbed Light energy using chlorophyll fluorescence. Photosynthesis Research 82: 73-81Kramer D. M., Johnson G., Kiirats O., Edwards G. (2004) New fluorescence parameters for determination of QA redox state and excitation energy fluxes. Photosynthesis Research 79: 209-218Krause G.H., Weis E. (1984) Chlorophyll fluorescence as a tool in plant physiology. II. Interpretation of fluorescence signals. 5, 139-157.Krupa Z., Oquist G., and Huner N., (1993) The effects of cadmium on photosynthesis of Phaseolus vulgaris – a fluorescence analysis. Physiol Plant 88, 626-630 D Edwards GE and Baker NR (1993) Can CO2 assimilation in maize leaves be predicted accurately from chlorophyll fluorescence analysis? Photosynth Res 37: 89–102Laisk A and Loreto F (1996) Determining photosynthetic parameters from leaf CO2 exchange and chlorophyll fluorescence. Ribulose-1,5-bisphosphate carboxylase / oxygenase specificity factor, dark respiration in the light, excitation distribution between photosystems, alternative electron transport rate, and mesophyll diffusion resistance. Plant Physiol 110: 903–912Photosynthesis in the water-stressed C grass is mainly limited by stomata with both rapidly and slowly imposed water deficits. Flexas (2002) Steady-state chlorophyll fluorescence (Fs) measurements as a tool to follow variations of net CO2 assimilation and stomatal conductance during water-stress in C plants Flexas J., Escalona J. M., Evain S., Gulías J., Moya I., Charles Barry Osmond C.B., and Medrano H. 4 Setaria sphacelataEarl H., Said Ennahli S., (2004) Estimating photosynthetic electron transport via chlorophyll fluorometry without Photosystem II light saturation. Photosynthesis Research 82: 177186, 2004.Laisk A., Oja V, Eichelmanna H., Luca Dall' Osto L. (2014) Action spectra of photosystems II and I and quantum yield of photosynthesis in leaves in State 1, Biochimica et Biophysica Acta 1837 (2014) 315–325Loriaux S.D., R.A Burns,Welles J.M., McDermitt D.K. Genty B. (2006) “Determination of Maximal Chlorophyll Fluorescence Using A Multiphase Single Flash of Sub-Saturating Intensity”. Abstract # P13011 August 1996.American Society of Plant Biologists Annual Meetings, Boston MA LORIAUX S.D, AVENSON T.J., WELLES J.M., MCDERMITT D.K., ECKLES R. D., RIENSCHE B. & GENTY B. (2013) Closing in on maximum yield of chlorophyll fluorescence using a single multiphase flash of sub-saturating intensity Plant, Cell and Environment (2013) 36, 1755–1770 doi: 10.1111/pce.12115Maai E., Shimada S., Yamada M.,, Sugiyama T., Miyake H., and Taniguchi M., (2011) The avoidance and aggregative movements of mesophyll chloroplasts in C4 monocots in response to blue light and abscisic acid Journal of Experimental Botany, Vol. 62, No. 9, pp. 3213–3221, 2011, doi:10.1093/jxb/err008 Advance Access publication 21 February, 2011Moradi F. and Ismail A. (2007) Responses of Photosynthesis, Chlorophyll Fluorescence and ROS-Scavenging Systems to Salt Stress During Seedling and Reproductive Stages in Rice Annals of Botany 99(6):1161-1173Nedbal L. Whitmarsh J. (2004) Chlorophyll Fluorescence Imaging of Leaves and Fruits From Chapter 14, “Chlorophyll a Fluorescence a Signature of Photosynthesis”, edited by George Papaqeorgiou and Govindjee, published by Springer 2004, PO Box 17, 3300 AA Dordrecht, TheNetherlands, page 389 -407Netondo G., Onyango J., and Beck E., (2004) Sorghum and Salinity I. Response of Growth,Water Relations, and Ion Accumulation to NaCl Salinity, Crop Science 44:797-805Siffel P., & Braunova Z., (1999) Release and aggregation of the light-harvesting complex in intact leaves subjected to strong CO2 deficit. Photosynthesis Research 61: 217-226Strasser R.J, Tsimilli-Michael M., and Srivastava A. (2004) - Analysis of Chlorophyll a Fluorescence Transient. From Chapter 12, “Chlorophyll a Fluorescence a Signature of Photosynthesis”, edited by George Papaqeorgiou and Govindjee, published by Springer 2004, PO Box 17, 3300 AA Dordrecht, The Netherlands, page 340 Tripathy BC, Bhatia B., Mohanty P., (1981) Inactivation of chloroplast photosynthetic electron transport activity by Ni ++. Biochim Biophys Acta 638:217-224Vredenberg W., Kay J. and Russotti R. (2013) The instrumental implementation of a routine for quantitative analysis of photochemical-induced variable chlorophyll fluorescence in leaves: Properties and prospects. ISPR conference in St. Louis, Poster e-mail: e-mail: ?iv ák M., Bresti M., Ol?ovská K., Slamka P.(2008) Performance index as a sensitive indicator of water stress in PLANT SOIL ENVIRON., , 2008 (4): 133–139Oquist G., and Huner N., (1991) Effects of Cold acclimation on the susceptibility of photosynthesis to photoinhibition in Scots pine and in winter and spring serials: A fluorescence analysis. Functional Ecology 5: 91-100
 留言咨询
留言咨询
 留言咨询
留言咨询
 留言咨询
留言咨询
 留言咨询
留言咨询
 400-860-5168转4433
400-860-5168转4433
 留言咨询
留言咨询

 400-860-5168转2933
400-860-5168转2933
 留言咨询
留言咨询

 400-860-5168转2933
400-860-5168转2933
 留言咨询
留言咨询








