









概要背景:乙型肝炎病毒(HBV)肝细胞整合与肝癌
病毒感染宿主细胞后,会劫持多种细胞功能,以促进其复制和有利于病毒粒子的后代。为了确保这一点,一些病毒进化出将其基因组整合到宿主染色体中的能力,对宿主细胞产生各种后果,包括破坏基因、致癌或细胞过早死亡,并可能最终通过病毒DNA遗传信息在此过程中的改变、被筛选遗促进自身演化。病毒基因组整合到宿主基因组中,是逆转录病毒等病毒的必经步骤,而乙型肝炎病毒(HBV)作为逆转录病毒,早在1980年代即发现其可整合在宿主基因组中。
HBV作为DNA致癌病毒之一,是被感染者产生肝细胞癌(HCC)的主要原因。在被感染的肝细胞中,HBV的DNA可以通过插入式诱变过程整合到宿主的基因组中,造成基因组稳定性异常或者导致癌基因的异常激活等,从而诱发肿瘤的发生。越来越多的证据表明,整合的HBV基因组片段,会产生病毒蛋白,即使在未整合的HBV病毒复制被抑制后,也可能持续存在而导致细胞损伤。HBV整合片段几乎存在于全部HBV感染后肝癌中,从这个角度,它也类似肿瘤基因组突变,可以作为肿瘤标志物,继而出现靶向肿瘤中HBV蛋白的免疫治疗方案,促进HCC新型治疗策略的发展。因而针对HBV病毒整合检测的新的方法和技术,慢慢被重视,类似其他基于肿瘤突变检测的手段,可用于监测HBV慢性感染患者中肝癌的发生,并可用于治疗后肿瘤复发监测。
HBV整合检测: 杂交、克隆、扩增和下一代测序(NGS)解决方案
相对于巨大的人类基因组(3Gb),数百到2000个碱基的HBV DNA片段非常短,插入后会被淹没在宿主基因组背景中。此外,单个肝细胞含有的病毒整合数量有限。虽然目前没有充分的单细胞DNA水平证据探讨明确的单个肝细胞内的病毒整合数量,在携带HBV整合的基因组背景较为均一的细胞系中,HBV不超过10个。例如,HepG2.2.15细胞系最多可能包含5个整合【1】, PLC/PRF/5细胞系有9个整合区【2】。根据体外模型感染肝脏细胞的观察,估计每103∼104个细胞中约有1个整合【3】。因此,需要有足够灵敏度的检测方法来识别组织大量细胞中相对有限的事件。
早在20世纪80年代,研究人员用杂交方法证明细胞系和肿瘤组织中存在HBV病毒DNA的整合【4,5】。简单来说,在Southern印迹杂交中,经过限制性酶处理后的消化DNA与32P标记的HBV DNA探针杂交,对分离凝胶中的消化后DNA条带进行放射自显影,从而确定携带放射性片段的目标DNA片段,纯化的得片段可以连接入质粒中,并可以用于放射性标记制备后续原位杂交的探针。对携带整合的这些质粒克隆可以进行Sanger测序之前,应用原位杂交技术查看这些探针与染色体的结合,用这种经典细胞遗传学方法确定病毒整合体的染色体位置【6】。后续结合克隆测序,可以确定病毒整合位点的基因组序列及整合的病毒序列【7】。然而克隆策略本身效率较低,在大量克隆中筛选到的目标克隆较为繁杂,需要完成对大量克隆的单独测序也是制约分析通量的原因,因而对病毒整合的分析刻画缺乏一个全面、高效的技术平台。
1995年,Minami等人开发了Alu PCR策略,改进HBV整合分析的方法【8】。Alu序列,作为常见的重复序列,在人类基因组中散在分布,将整个基因组间隔成相对较小的区域,长度适合于进行PCR扩增,在扩增引物引物对中,其中一个可以设计为特异性结合Alu片段,另一个特异性结合HBV序列(多选择HBV的X基因),即可以成功扩增病毒-宿主嵌合区域【9】。采用这种方法,Devrim等人在一项研究中快速从18名患者中发现了21个病毒整合【10】。类似的思路,为实现把巨大基因组分割成适合扩增的小区域,Mason等人首先用NcoI将肝细胞总DNA裂解成片段,同时NcoI在HBV基因组的核苷酸1374处切割DNA,然后将这些片段连接成环,用于病毒-宿主细胞连接处的嵌套PCR,作为整合检测的【11-14】。尽管如此,不是所有的整合都紧挨着Alu元件或NcoI的裂解位点,或者恰好整合了病毒X基因,分析受到扩增引物设计覆盖的影响,未必能无偏发现病毒整合事件。
基于第二代测序平台(NGS)的解决方案,无论是直接测序还是病毒DNA富集后的靶向测序,可实现对几十到几百个样本的整合事件平行及近似无偏分析。提取的组织DNA被随机打断以构建测序库,生物信息学分析识别测序数据中所谓的 "交界读长 junction read"或 "嵌合读长 chimeric read",即源于整合事件的边界,由HBV和人类DNA共同组成的测序读长。前面提到HBV整合的频率相对较低,直接对组织核基因组测序需要足够的测序覆盖率/深度来发现边界区的嵌合片段。Jiang等人采用深度全基因组测序(80X,每个样本240G;240X,每个样本720G),在三个HBV阳性的HCC患者的成对肿瘤和邻近肝脏组织中发现了255个整合【15】。然而这种策略的高成本和高数据分析要求,限制其在人群中的广泛应用。目标DNA片段富集策略被证明在人类基因组外显子测序中非常有效降低了费用和分析负荷,激发了使用病毒DNA探针进行HBV DNA富集后再进行测序分析,从而大大降低测序量,每个组织样本仅用2G测序量即可实现对整合片段的深度测序【1,16】。基于此,Zhao等人在一项研究中从426名患者组织样本中,获得了4225个整合断点,从而为断点规律的分析提供更充分的数据支持,引发后续各研究团队的跟进【16-21】。
HBV整合检测与肝癌液体活检
病毒DNA富集策略在HCC组织中成功应用不久,2018年开始先后有团队公布在外周血游离DNA(cf DNA)中的尝试。我们的团队在2018年4月EASL年会上以Late Breaker摘要形式收录于Journal of Hepatology,在国际上首次用利用探针捕获方式实现对外周血HBV-宿主细胞整合片段富集,完整研究发表在亚太肝脏研究协会(APASL)会刊Hepatology International上【1】。同年,台湾中研院团队也报道其在肝癌手术前后的外周血监测结果,术后入血的HBV整合片断显著降低甚至消失,依旧存在外周血病毒整合片断检出的个体出现复发【22】。之后,我们在外周血游离DNA全基因组甲基化数据中意外发现,既往报道的病毒整合区域,无论病毒整合是否发生,在HCC组织中均出现显著的去甲基化现象,一些候选区域可作为cf DNA甲基化的标志物用于HCC筛查,表现出极佳的灵敏度合特异性(BMC Medicince,2021)【23】。今年,“无创产检之父”卢煜明教授在Nature Reviews Gastroenterology & Hepatology 2022撰写最新肝癌液体活检综述 《Circulating biomarkers in the diagnosis and management of hepatocellular carcinoma》 将上述三篇文章列为基于HBV整合的HCC检测的标志性技术进展。
“没有配套治疗方案的检测不是好应用”,这应该是基因检测从业者在过去十几年学到的刻骨铭心的经验。明确诊断结果后患者最关心的问题是,然后怎么治疗呢?
值得指出的是,2019年Antonio Bertoletti教授团队在Gastraneterology杂志提出利用针对源于病毒整合片断的HBV蛋白谱设计用于HCC免疫治疗的T细胞,并表明即使是整合入肝癌细胞的病毒DNA片段,即便不编码完整的HBsAg而仅是其部分片段,也可产生HBsAg衍生的表位,用于基于T细胞的肝癌免疫治疗【24】;2020年,de Beijer等人尝试确定HBx和聚合酶衍生的T细胞表位,用于有效的HBV抗原特异性免疫疗法【25】。慕尼黑工业大学病毒学研究所所长Ulrike Protzer教授作为科学创始人之一成立新加坡SCG细胞治疗公司,进一步拓展此种T细胞疗法对于HBV感染后HCC的临床治疗,其SCG101是第一个在美国、新加坡和中国获得临床试验批准的细胞疗法产品。可以预见,HBV整合位点的外周血无创检测配合HCC新兴免疫治疗方案,一方面可以动态检测肿瘤的复发,另一方面对HBV整合片断的分析可以协助此类个体化免疫治疗方案的制定与评估。
肿瘤液体活检技术中,针对特定基因组突变进行检测,后期在临床推广过程中,受成本控制的要求,往往放弃NGS平台,检测仅需要针对特定位点进行PCR扩增后,对产物进行分析,反而带热了整体检测成本更为低廉、擅长候选位点分析的荧光定量PCR、核酸质谱平台。但病毒整合位点,断裂位点无论在病毒基因组还是在宿主基因组,均存在随机性,无法针对特定位点的检测。DNA序列捕获一方面克服了引物设计扩增无法全面涵盖全部病毒整合的特征,另一方面需要依赖NGS测序平台对断点进行序列分析,同时测序量不高,单个样本1-2G测序量,有可能成为医院小型测序平台,除无创产前诊断外新的拓展应用。此外,除HBV外,各种致癌病毒相关肿瘤的免疫治疗方案也迅速涌现,例如HPV的方案也逐渐浮出水面,未来病毒整合相关的临床检测应用,可真正赋能医院小型自建测序平台,充分展现其临床检测价值。
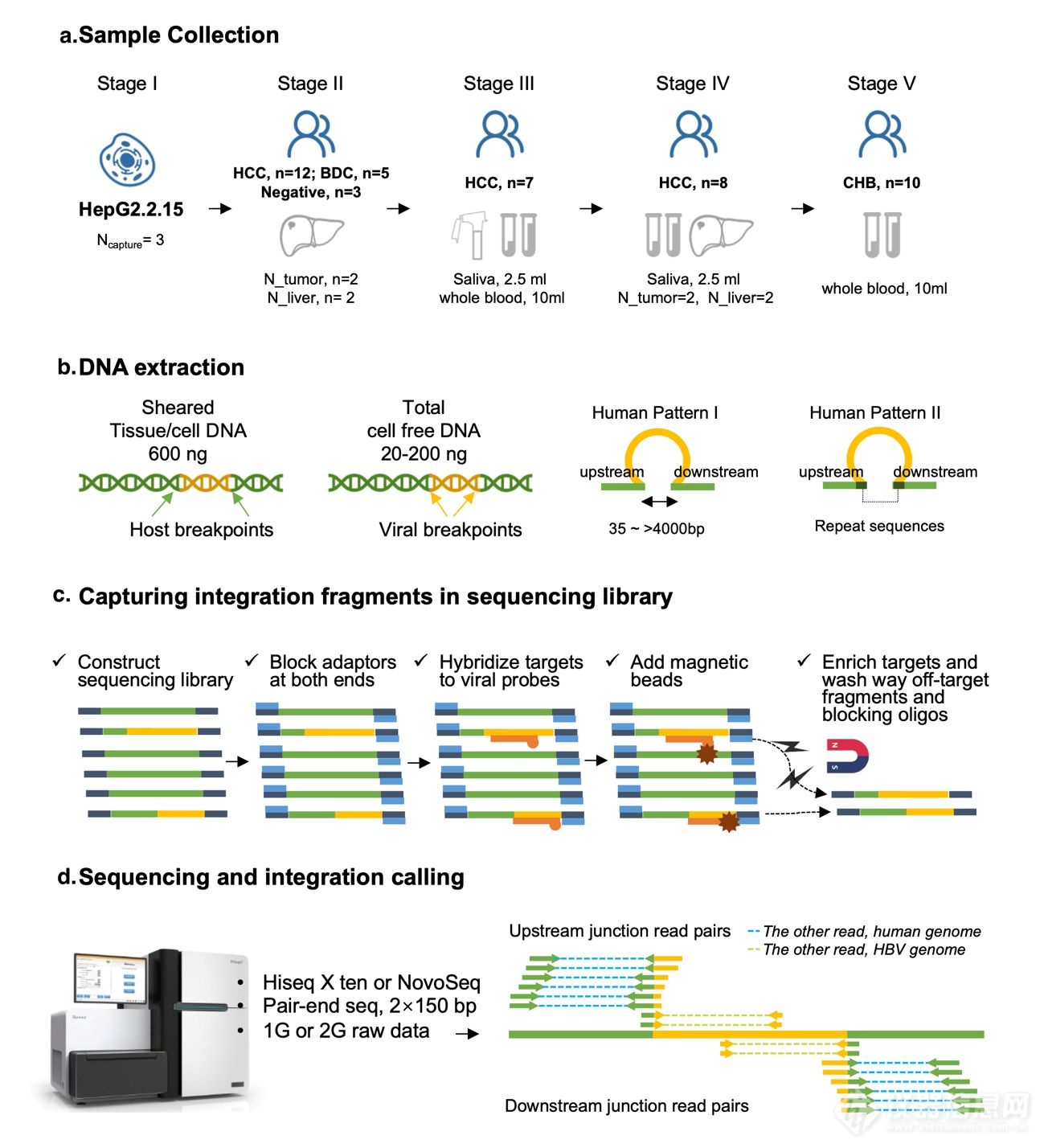
图1 HBV整合断点捕获检测
a.研究的阶段设计:阶段I:HepG2.2.15细胞系中捕获探针的设计验证;2)HBV感染后肝癌、胆管癌肿瘤和癌旁组织中的病毒整合检测;3)肝癌患者外周血、肝癌、癌旁配对样本的病毒整合片断分析;4)慢肝患者外周血的病毒整合片断检测;
b.宿主DNA打断即整合边界人基因组序列模式特征示意: 整合位点有微缺失,整合区域两侧存在重复序列;
c. DNA捕获富集病毒整合的原理;
d. NGS平台测序通量要求及测序数据中整合边界来源的HBV-宿主嵌合测序读长的序列比对特征示意。
参考文献详见附件: 参考文献.docx
参考文献.docx
作者简介:

张大可博士
张大可博士、北京航空航天大学北京生物医学工程高精尖创新中心副研究员,中国科学院青年创新促进会会员。主要研究方向: 疾病发生、进展及治疗过程中的组织损伤或受累细胞群体的表观遗传重塑,主持及参加国自然、科技部国家“十三五”精准医学重点研发计划、863计划、973计划、国家科技支撑计划、中科院重点部署项目等十余项,任中国抗癌学会肿瘤测序与大数据分析专家委员会委员;国家消化系疾病临床医学研究中心(上海)Cancer Screening and Prevention 杂志编委;北航生物医学工程高精尖期刊Medicine in Novel Technology and Devices 杂志编委;Cell旗下The Innovation杂志青年编委;JCTH《临床与转化肝脏病杂志》2021年度优秀青年编委,共发表SCI论文30篇,其中第一作者或通讯作者SCI论文21篇。
如有技术干货、科研成果、仪器使用心得、生命科学领域热点事件观点等内容,欢迎相关行业朋友投稿。投稿邮箱:lizk@instrument.com.cn
[来源:仪器信息网] 未经授权不得转载

丹纳赫合并Cytiva和Pall,打造75亿美元的生物工艺巨头
2022.09.24

2022.09.23

2024.07.09


重磅!20项推荐性卫生行业标准发布,流式细胞仪、PCR、血细胞分析仪等被提及
2024.07.08

54亿!广东省医疗卫生领域设备更新有关项目可行性研究报告审批前公示
2024.07.05
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~