







中山大学药学院教授,博士生导师。主要从事生物质谱新技术的开发及应用。


大家好,本周为大家分享一篇发表在Angew. Chem. Int. Ed.上的文章,A Membrane-Permeable and Immobilized Metal Affinity Chromatography (IMAC) - Enrichable Cross-Linking Reagent to Advance In Vivo Cross-Linking Mass Spectrometry,该文章的通讯作者是德国莱布尼茨分子药理学研究所的Fan Liu教授。
交联质谱 (XL-MS) 已被用于在全蛋白质组范围内表征蛋白质的结构和蛋白间相互作用。目前,由于能够穿透完整细胞的交联试剂和富集交联肽的策略的缺乏,体内交联质谱研究的深度远远落后于细胞裂解液的现有应用。为了解决以上限制,本文开发了一种含膦酸盐的交联剂-tBu PhoX,它能够有效地渗透各种生物膜,并且可以通过常规的固定化金属离子亲和色谱 (IMAC) 进行稳定富集。文章建立了一个基于 tBu-PhoX 的体内 XL-MS 分析流程,在完整的人类细胞中实现了较高的交联识别数目,并大大缩短了分析时间。总的来说,本文开发的交联剂和 XL-MS 分析流程为生命系统的全面交联质谱表征铺平了道路。
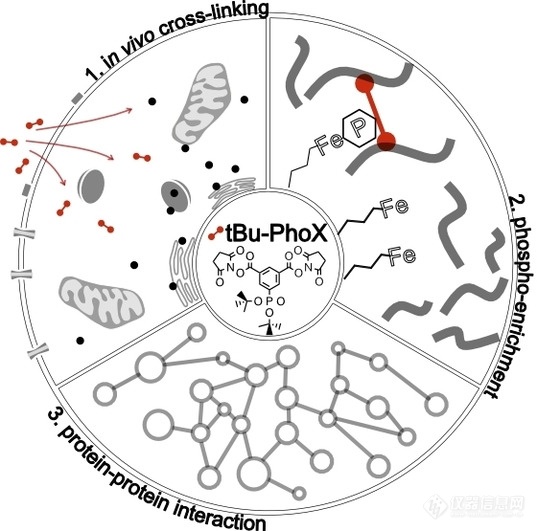
细胞蛋白质组通过广泛的非共价相互作用网络进行组织,表征蛋白质-蛋白质相互作用 (PPIs) 对于了解细胞的调节机制至关重要。交联质谱 (XL-MS) 是系统研究细胞 PPIs 的一种强有力的方法,在 XL-MS 中,天然蛋白质接触通过交联剂共价捕获,交联剂是一种由间隔臂和两个对特定氨基酸侧链具有反应性的官能团组成的有机小分子,交联样品经过蛋白酶水解后,可以通过基于质谱的肽测序来定位氨基酸之间的交联。由于交联剂具有确定的最大长度,检测到的交联揭示了蛋白质内部或蛋白质之间的氨基酸的最大距离。以上这些信息提供了对蛋白质构象、结构和相互作用网络的见解。
虽然最初仅限于纯化的蛋白质组装,但如今 XL-MS 已经可以应用于复杂的生物系统——这是通过开发先进的交联搜索引擎、样品制备策略和交联剂设计而实现的。特别是,已进行的几项全蛋白质组范围的 XL-MS 研究表明,可以通过使用可富集的交联剂来改进交联产物的鉴定,例如,通过添加生物素或叠氮化物/炔烃标记,使得消化混合物中的交联肽段能够基于亲和纯化或点击化学富集。最近,一种基于膦酸的交联剂 PhoX 被引入作为现有生物素或叠氮化物/炔烃标记试剂的高效和特异性替代品。PhoX 可通过固定化金属离子亲和色谱 (IMAC) 实现交联富集,这是一种非常快速和稳健的富集策略。 然而,尽管 PhoX 已被证明可用于从细胞裂解液中进行交联鉴定,但它无法渗透细胞膜,因此不适合体内的 XL-MS检测。
基于以上讨论,本文开发了交联剂 tBu-PhoX ,其中,膦酸羟基被叔丁基保护以掩盖负电荷(图 1)。为了检测 tBu-PhoX 的膜通透性,文章交联了各种膜封闭的生物系统,包括人 HEK293T 细胞、从小鼠心脏分离的线粒体和革兰氏阳性枯草芽孢杆菌,并在 SDS-PAGE 上监测了蛋白质条带的变化(图 2)。在SDS-PAGE中,观察到在交联剂浓度为0.5和1.0mM时,蛋白质向更高分子量的浓度依赖性迁移,这表明了有效的膜渗透和交联。相比之下,将 PhoX 应用于完整的 HEK293T 细胞将产生与非交联对照相同的条带模式。
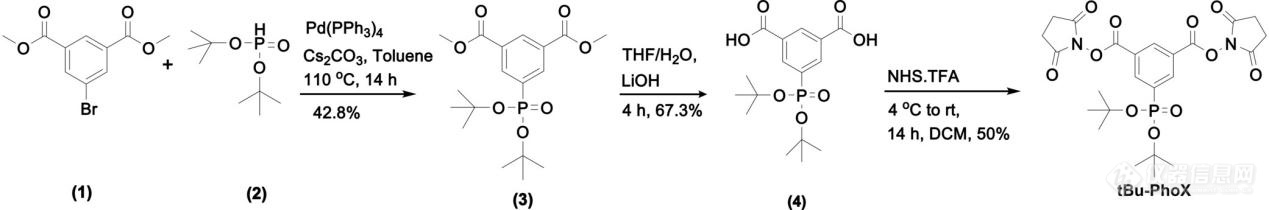
图1 tBu-PhoX交联剂
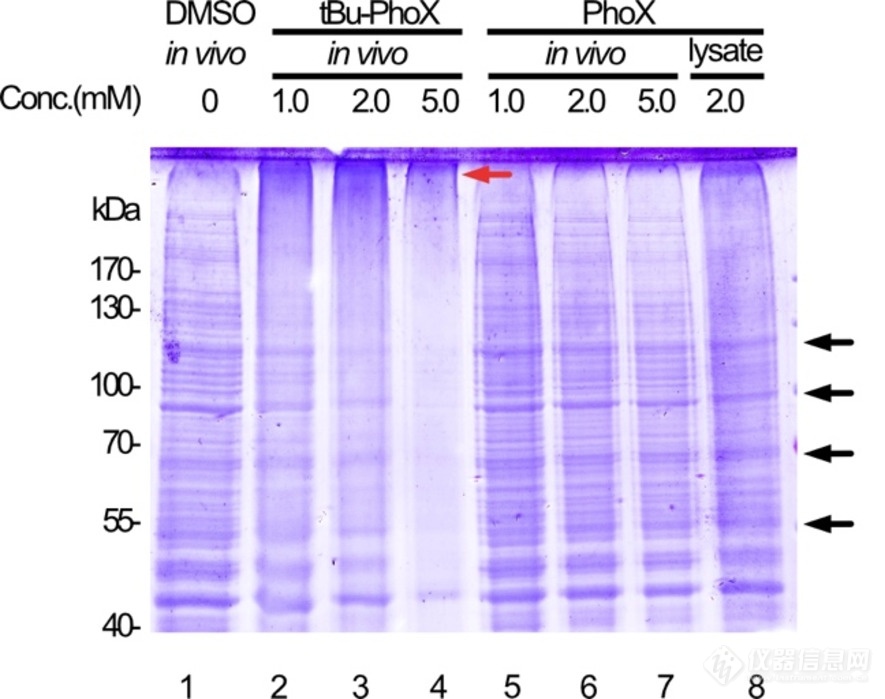
图2 PhoX或tBu-PhoX交联HEK293T细胞的SDS-PAGE
在证明了 tBu-PhoX 可渗透各种生物膜系统后,文章接下来开发了一种基于 tBu-PhoX 的体内 XL-MS 工作流程,相比于之前的全蛋白质组 XL-MS 策略,该工作流程提高了样品处理和交联富集的速度和效率(图 3)。首先,按照标准蛋白质消化方案将交联蛋白质消化成肽;其次,使用 IMAC 珠对消化混合物进行预清除步骤以去除内源性修饰(特别是磷酸化);第三,预清除的消化混合物(从 IMAC 流出)在稀释三氟乙酸 (TFA) 溶液中孵育以去除叔丁基并暴露膦酸基团以进行二次 IMAC 富集。第四,使用标准 IMAC 程序丰富交联产物,最后通过 LC-MS 分析以进行交联产物鉴定。
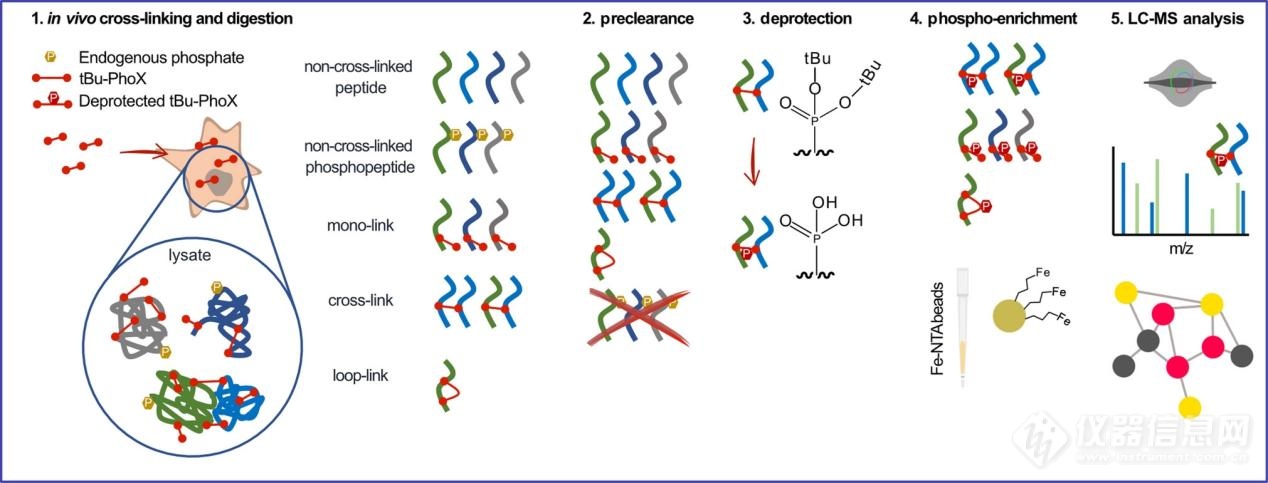
图3 与tBu-PhoX进行体内交联和后续样品处理的工作流程
接下来,文章优化了体内 XL-MS 工作流程的几个分析参数,以最大限度地提高交联检测的效率。首先,通过使用 IMAC 珠预清除评估了去除磷酸肽的效率;之后,使用 tBu-PhoX 交联完整的 HEK293T 细胞,经酶切成肽后,并应用预清除 IMAC 步骤去除内源性磷酸肽。在去保护步骤之后,利用 IMAC 富集交联,并通过单次 120 min LC-MS 运行测量富集的样品。通过测量 IMAC 洗脱液中磷酸肽和交联产物的数量,发现第二个 IMAC 中只有数百条磷酸肽,而预清除 IMAC 中有 4,128 条磷酸肽,这突出了通过预清除 IMAC 步骤去除磷酸肽的效率。此外,与单阶段 IMAC 结果相比,使用预清除 IMAC 的工作流程鉴定了 22% 以上的交联(1165 对 952 交联),证明了该两阶段工作流程去除干扰修饰肽的好处(图 4A)。
其次,文章在肽水平上研究了膦酸盐去保护的功效。使用 tBu-PhoX 制备了体内交联的 HEK293T 样品,并分析了在不同的酸度(TFA 浓度)和孵育时间下,去保护后交联的数量如何变化。结果显示,不同浓度的 TFA 下获得了相似数量的交联。为简化处理(即在接下来的IMAC富集步骤中保持相对较低的样品体积),选择 0.5% TFA 的去保护条件,持续两个小时(图 4B,C)。
第三,文章测试了 Orbitrap Tribrid 质谱仪的不同采集参数如何影响交联识别,即在高场非对称波形离子迁移率质谱法 (FAIMS) 中应用的电荷态选择和补偿电压 (CVs)。当考虑电荷状态 +3 和更高时,确定了最多数量的 tBu-PhoX 交联肽(图 4D)。
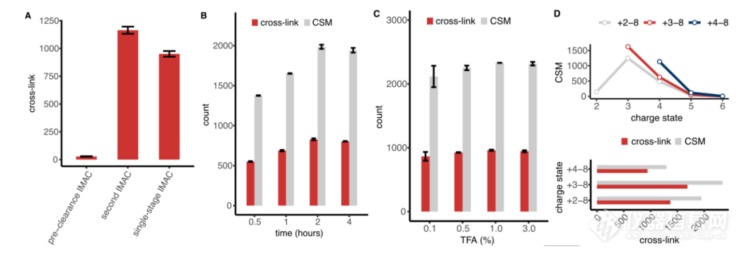
图4 样品处理和LC-MS参数的优化
文章将优化参数后的体内 XL-MS 工作流程应用于完整的 HEK293T 细胞。使用 180 min的 LC 梯度和优化后的分析参数,文章从体内 tBu-PhoX 交联的 HEK293T 细胞中获得了 9,547 个交联(图 5A)。基因本体分析表明,交联蛋白参与了广泛的分子功能、生物过程和细胞成分,表明 tBu-PhoX 可以揭示所有细胞区域的 PPIs(图 5A)。
另外,文章还考察了完整细胞的体内 XL-MS 是否捕获了与细胞裂解液的 XL-MS 不同的 PPIs。为了验证这一点,从 HEK293T 细胞中制备 tBu-PhoX 交联裂解液,并使用与体内 XL-MS 实验相同的工作流程处理样品。 结果显示,从五个 SEC 部分中确定了 9,393 个交联。这表明 tBu-PhoX 允许以类似的效率进行裂解和体内 XL-MS。比较本文的体内和裂解数据表明,在体内 XL-MS 实验中,蛋白质间交联的数量更高,从而产生了更加相互关联的 PPI 网络(图 5B,C)。这种效应可以通过细胞环境的拥挤来解释,其中蛋白质紧密堆积并参与多种相互作用,这些相互作用被细胞裂解和稀释部分破坏。文章在 8 种选定蛋白质复合物的已知 3D 结构上可视化了 145 个体内检测到的交联(图 5C),另外,还观察到 96.6% 的交联在 35 Å 的最大距离限制内(图 5D),表明此 XL-MS 工作流程对内源性蛋白质复合物的体内结构分析的适用性。最后,文章比较了 tBu-PhoX 与 PhoX 在表征细胞裂解液的 PPI 网络方面的性能。使用与上述 tBu-PhoX 裂解液交联实验相同的交联条件从 HEK293T 细胞制备 PhoX 交联裂解液。为了去除内源性磷酸肽,在单阶段 IMAC 富集之前,用碱性磷酸酶处理消化的肽两小时。使用与 tBu-PhoX 相同的 LC-MS 方法进行 LC-MS 分析。该实验产生了 2,117 个交联,与使用 tBu-PhoX 识别的交联数量(1,942 个交联)相比略高。然而,基于 PhoX 的 XL-MS 流程需要更长的样品制备时间,因为需要进行碱性磷酸酶再处理和之后的额外脱盐步骤。
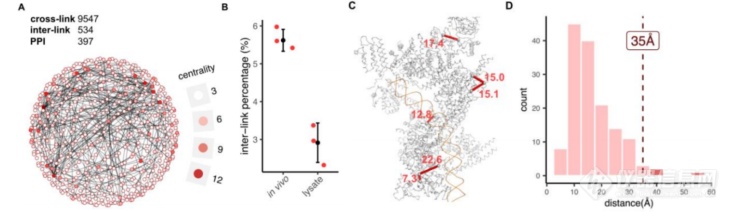
行体内交联
综上所述,本文开发并应用了一种新型的、可富集的、用于体内 XL-MS 的膜渗透交联剂 tBu-PhoX。在广泛使用的交联条件下(交联剂浓度为 1-5 mM),tBu-PhoX能够有效地穿透各种生物膜,为完整的细胞器和活细胞提供交联的机会。tBu-PhoX上的叔丁基基团使得高效的两阶段IMAC样品制备方案成为可能;首先,使交联剂对 IMAC 呈惰性,以促进基于 IMAC 快速而彻底地提取不需要的磷酸化肽,然后,通过去除叔丁基暴露膦酸基团,从而有效地二次 IMAC 富集交联剂修饰的肽。通过随后的 SEC 分馏,可以进一步富集交联肽段以进行 LC-MS 分析。
XL-MS 在表征生命系统中的蛋白质结构和相互作用方面发挥着越来越重要的作用。为了促进这一发展,迫切需要有效的体内 XL-MS 方法。文章报告的体内 XL-MS 工作流程满足了这一需求,提供了与之前基于裂解液的 XL-MS 研究类似的交联识别能力,但需要的测量时间不到之前报告的十分之一。这一结果突出表明,本文开发并应用的 tBu-PhoX 交联剂和集成样品制备流程为推进体内相互作用组学和结构生物学提供了一种非常有前景的化学方法。
[来源:仪器信息网] 未经授权不得转载
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~