







中山大学药学院教授,博士生导师。主要从事生物质谱新技术的开发及应用。


大家好,本周为大家分享一篇发表在Journal of the American Society for Mass Spectrometry上的文章,Comparing Selected-Ion Collision Induced Unfolding with All Ion Unfolding Methods for Comprehensive Protein Conformational Characterization ,文章的通讯作者是美国威斯康星大学的李灵军教授和南开大学的李功玉教授。
近年来,离子迁移质谱(Ion mobility−mass spectrometry, IM−MS)不断发展,成为了探究生物分子结构和稳定性的有力工具。IM-MS实验中测量得到的漂移时间可以转换为与分析物的大小或形态相对应的碰撞截面值(CCS)。碰撞诱导去折叠(collision-induced unfolding, CIU)通过将碰撞能量(CE)应用于气相分析物,研究其在去折叠过程中CCS值的变化,从而提供更多的结构细节。尽管电荷分离的CCS分布代表了气相中丰富的结构信息,但预测具有最接近native状态结构的蛋白质离子电荷态仍然存在困难。另一种方法是记录所有蛋白质电荷状态的四极杆无选择全离子去折叠方法(all ion unfolding, AIU)。如图1所示,本文中作者首先比较了四极杆选择对去折叠的影响及其产生的数据质量。然后,作者引入了一种CCS积累方法,用一个新的CCS参数——CCSacc(accumulated CCS)进行去折叠数据解析,该参数对所有观察到的电荷状态的数据进行汇总,以更好地区分气相中蛋白的结构和构象。作者发现,使用这种CCSacc方法生成的去折叠差异图更稳健,对nESI过程中产生的蛋白质电荷状态的变化具有更高的耐受性。此外,作者观察到用于比较的整体信号强度的增加,使去折叠指纹图谱质量得到改善。另外,这种CCSacc方法保留了电荷分离的CIU信息,也可以按需提取。
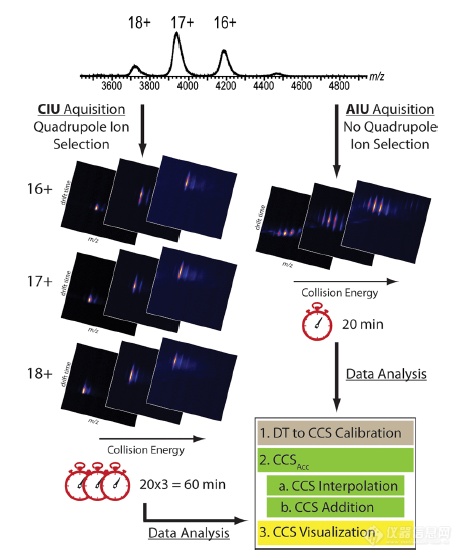
图1.AIU和CIU工作流程比较
图2a展示在不同的碰撞电压下,HSA的CCSacc的分布。CCSacc是综合的气相离子特征,以红色表示。通过CCSacc特征可以分析每个离子对结构的贡献,有助于全面了解现有的HSA结构异质性。通过计算HSA的CCSacc数据可以创建一个新的去折叠指纹图谱,将其与HSA的两种主要电荷态进行比较(图2c)发现,如果只分析单个电荷状态数据,而不将收集到的所有信息合并,就会导致信息丢失。CIU50值揭示的构象稳定性信息也显示了累积指纹图谱与单电荷态指纹图谱的差异,进一步强调了考虑所有电荷态结构信息的必要性。(图3)
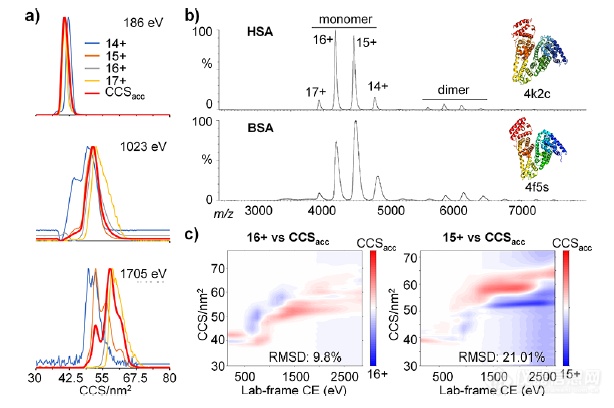
图2.CCSacc结构分析
AIU指纹图谱结合CCSacc数据处理可以更全面地阐明蛋白质变体之间的构象差异。为了证明这一点,作者获取了BSA和HSA的AIU数据,然后提取CCSacc数据,用CIUSuite软件进行定量分析。总的来看,基于CIU50的构象稳定性比较和基于RMSD的整体去折叠指纹图谱比较都清楚地表明,AIU和CCS的累积能够提供更全面的结构信息,并对生物相似性蛋白的细微结构差异进行全面表征。
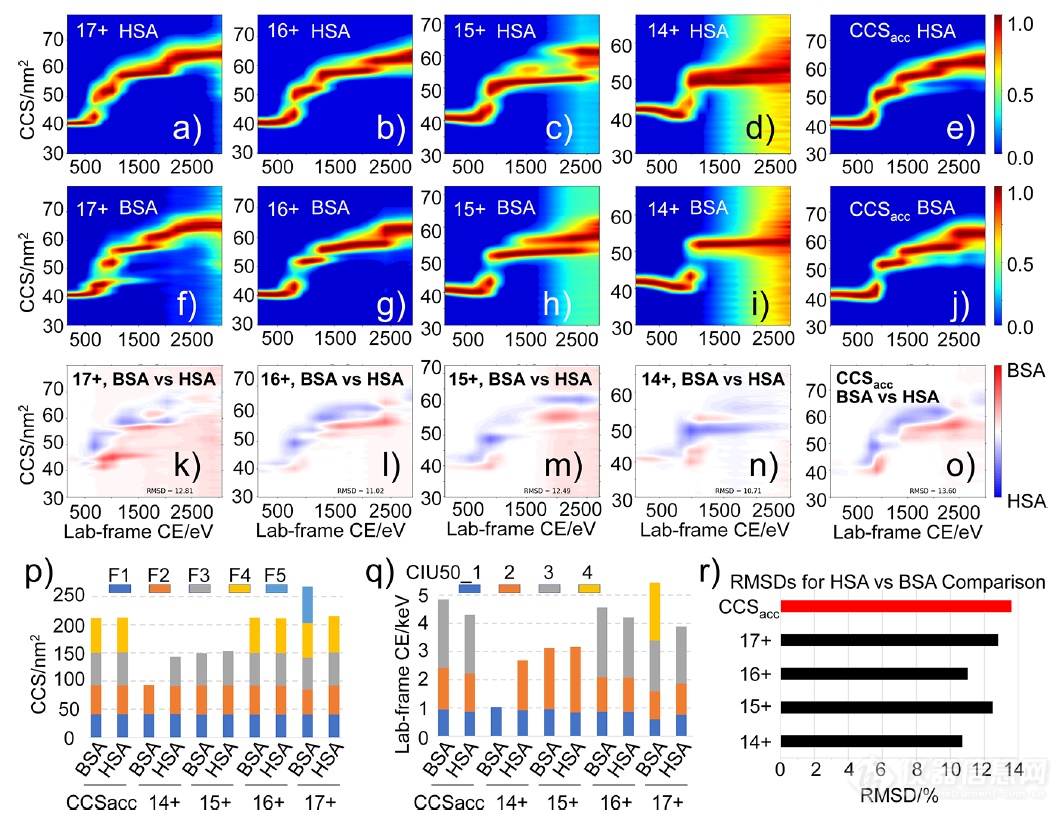
图3.利用CCSacc全面比较HSA和BSA结构
最后,作者将CCSacc应用于唾液化的糖蛋白bovine transferrin(bTF),快速分析糖基化对蛋白质结构的影响。图4a显示了bTF的非变性质谱图以及相应的漂移时间热图。先前的糖链研究证明,转铁蛋白是一种具有多种糖型的异质性蛋白,作者的非变性质谱数据(图4a)也明确支持多种糖型的存在。接下来,作者在AIU操作模式下追踪bTF的逐步去折叠行为(图4b-e)。图4f展示了通过CCSacc获得的累积去折叠指纹图谱。可以清楚地观察到,四种不同的构象主导了bTF去折叠过程。CCSacc弥补了不同离子种类观察到的结构差异。此外,构象特征CCS分析和相应的基于CIU50的稳定性分析表明,CCSacc主导的数据与传统CIU分析中常用的最丰富的电荷态所得数据不匹配。这些差异应该主要源于离子种类的贡献,而不是最丰富的离子种类,结果突出了在溶液中使用单一电荷态作为整个蛋白质种类的结构特征时存在的潜在偏差和/或结构损失。
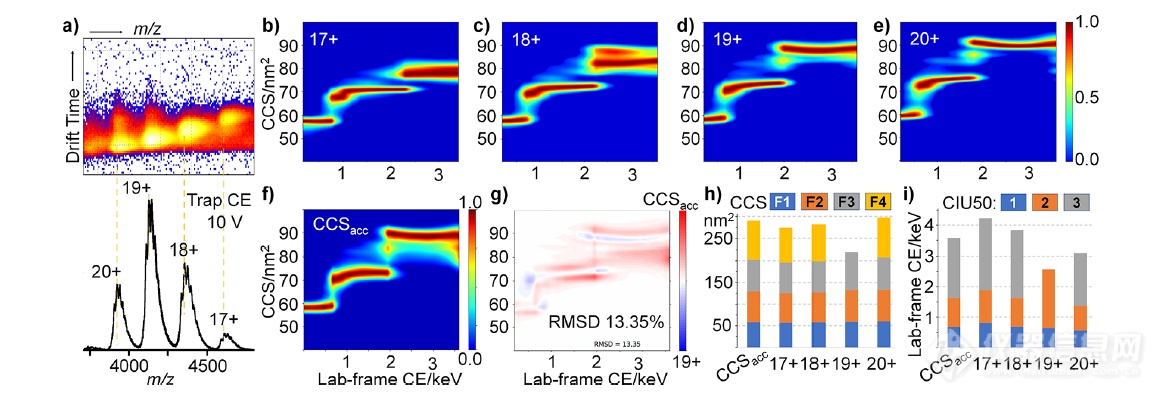
图4.通过CCSacc探究唾液酸化糖蛋白的结构
CCSacc策略可以更好地维持蛋白质的天然构象,并降低由于仪器条件或溶液中蛋白质电荷态变化造成的影响。在提高去折叠指纹图谱的信噪比并丰富拓扑结构信息的情况下,该策略可以得到更广泛的应用。
参考文献:Ashley Phetsanthad, Gongyu Li, Chae Kyung Jeon, et al. Comparing Selected-Ion Collision Induced Unfolding with All Ion Unfolding Methods for Comprehensive Protein Conformational Characterization. Journal of the American Society for Mass Spectrometry, 2022.
[来源:仪器信息网] 未经授权不得转载
2022.05.05

2024.07.25

2024.07.25

1.3亿大单!中国科学院2024年仪器设备部门批量集中采购项目招标
2024.07.25

1090万!中国科学院场发射透射电子显微镜和高分辨场发射扫描电子显微镜采购项目
2024.07.25

1240万!中国科学院超高分辨率激光共聚焦显微镜和原位液体环境透射电镜采购项目
2024.07.25
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~