









北京时间5月24日凌晨,北京软物质科学与工程高精尖创新中心、北京化工大学生命学院冯越教授研究组在Nature在线发表了题为Structural basis of ubiquitin modification by theLegionella effector SdeA的研究长文(Article),报道了嗜肺军团菌内一种新型的泛素修饰与连接酶——SdeA及其与泛素复合物的晶体结构,揭示了其修饰泛素及催化新型泛素化过程的工作机理。这是北京化工大学历史上首篇发表在Nature、Science、Cell三大国际顶级学术期刊主刊的研究论文。

泛素化是泛素在特定酶的作用下,对底物蛋白进行特异性修饰的过程,几乎参与一切生命活动的调控,与肿瘤、心血管等疾病的发病也密切相关【1】。常规的泛素化过程是由E1、E2、E3三个酶的级联反应催化的,最终将泛素蛋白转移到底物的赖氨酸残基上【2】。然而,美国普渡大学罗招庆研究组在2016年的Nature文章中报道,嗜肺军团菌(嗜肺军团菌是一种条件性致病菌,引起人的以非典型性肺炎为主要症状的军团菌病,该菌通过其Dot/Icm
IV型分泌系统输送超过300个效应蛋白到宿主细胞内,改变宿主的多种信号通路以构建其在宿主内的最适生长环境)中以SdeA为代表的SidE家族可以通过一种全新的、完全不同于经典泛素化的方式修饰泛素,并催化其对几种内质网相关蛋白的泛素化过程,实现all-in-one的泛素化模式【3】。紧接着,在2016年底,Ivan
Dikic研究组报道了对该反应过程的进一步研究,明确了SdeA的mART和PDE结构域经过两步催化反应最终完成对底物的泛素化过程【4】。在该过程中,泛素第42位的精氨酸先在mART结构域的作用下被修饰成ADP核糖基化泛素。随后,该修饰形式的泛素在PDE结构域的作用下生成磷酸核糖基化泛素,并转移到底物或SdeA自身的丝氨酸残基上。此外,罗招庆实验室的另一项工作证明SidJ具有去泛素化功能以逆转由SidE家族蛋白对底物的修饰,其活性不依赖于活性的半胱氨酸残基【5】。
巧合的是,在Ivan Dikic组Cell文章在线发表的同一天(2016年12月1日),冯越研究组获得了SdeA核心区231-1190区域的初步结构信息(图1a),确认了SdeA中mART和PDE组成活性中心,C端结构域形成scaffold的基本结构组成方式(图1b)。通过结构分析和功能实验,冯越研究组发现,与PDE结构域自身即具备催化活性(即可以以ADP核糖基化泛素作为底物催化该新型泛素化反应)不同的是,mART结构域则需要PDE结构域的稳定作用才能维持正常的活性。在维持mART活性的结构要素中,mART结构域一段伸到PDE结构域中的loop(789-797段氨基酸)发挥了重要功能,在该文章中被命名为“Plug” loop。随后,冯越研究组又进一步获得了该区段SdeA与泛素复合物、及与泛素-NADH复合物的晶体结构,从而揭示了泛素与mART结构域的结合模式。在二者结合的过程中,mART结构域的ARTT和PN loop,以及α-helical lobe均发挥了重要作用(图1c)。而泛素分子中参与结合的则主要是其C端区域,尤其是泛素的R72和R74两个氨基酸分别结合到mART结构域表面的两个带负电的凹槽中(图1d),起到最关键的锚定作用。这两个氨基酸的单突变均可使得泛素失去被SdeA的mART结构域修饰的能力。
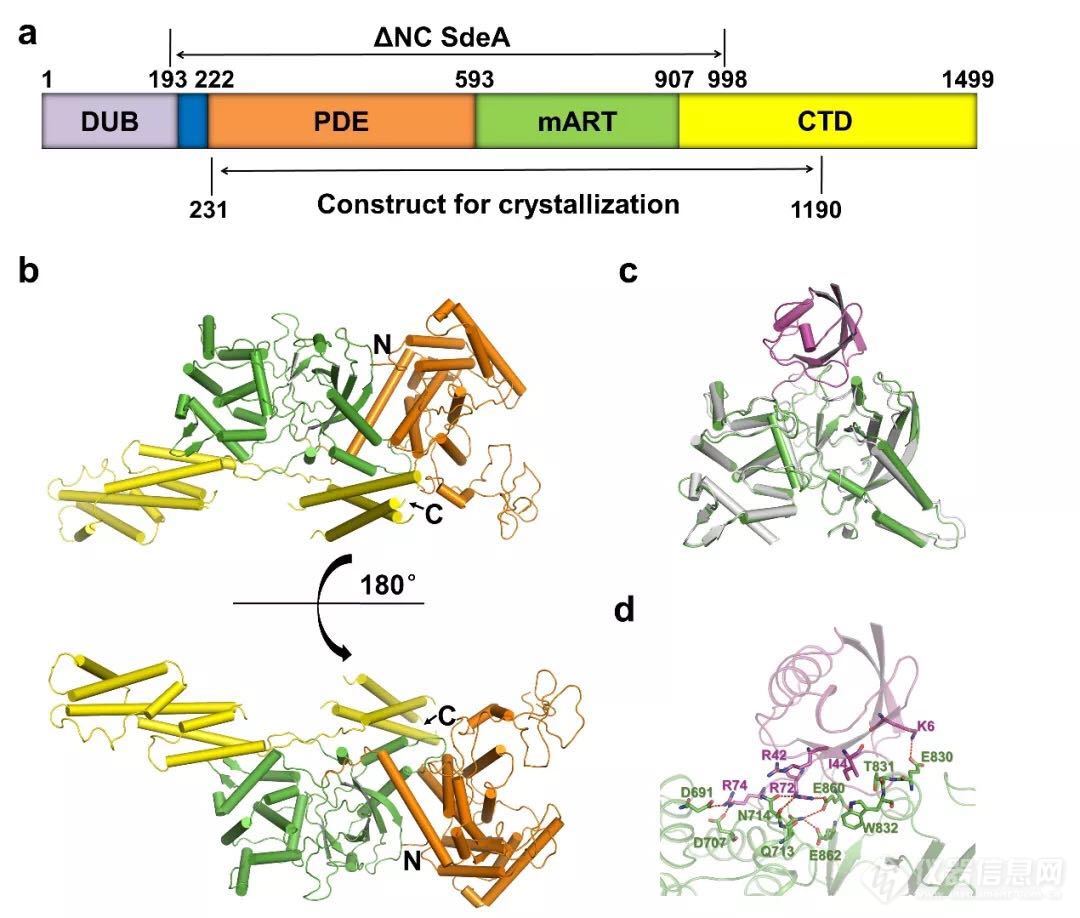
图一
在SdeA
mART和泛素-NADH复合物结构中,最令人吃惊的一点在于,R72要比被修饰的R42更靠近活性中心(作为亲核基团的R42的ε氨基N原子距离作为亲电基团的NAD+中与烟酰胺基团相连的核糖C1原子之间的距离为11.7埃)。从直观上看,这与R42被mART修饰是相矛盾的。经过查阅文献,冯越研究组发现部分mART蛋白的催化机制被认为是SN1反应,即烟酰胺基团会先从NAD+中脱离,使得NAD+转变为活性中间体(oxocarbenium
cation
intermediate),之后发生亲核攻击反应。受此启发,冯越研究组将复合物结构中的NADH替换成该活性中间体,并对该体系进行了分子动力学模拟。其结果显示,R72在模拟过程中远离了活性中心,而R42则进入活性中心并占据了之前R72所在的位置,最终使得R42的亲核基团和NAD+的亲电基团之间的平均距离缩短至4.46埃。
文章的最后部分还对SdeA的C端结构域的功能进行了研究,通过体外pull
down和凝胶过滤层析实验,冯越研究组证明了SdeA的C端结构域结合IcmS-IcmW蛋白复合物,并且其1191-1350区域可与IcmS-IcmW及DotL的C端形成四元复合物。这表明SdeA的C端结构域可能在SdeA转移到宿主细胞的过程中发挥功能。
SdeA是目前为止世界上首个鉴定出的新型泛素连接酶,其与泛素复合物结构的解析揭示了一种全新的泛素化结构机理。由于哺乳动物也含有类似结构,同时其他细菌可能也具有类似的、尚未发现的泛素化系统,所以在未来,该研究将帮助鉴定出其它新型泛素化系统,从而丰富我们对细胞生命过程的认知;同时,嗜肺军团菌是军团菌肺炎这一潜在致死性肺炎的致病微生物,SdeA的结构解析也为设计针对该家族蛋白的小分子抑制剂,作为治疗军团菌肺炎的潜在抗生素奠定了重要基础。
据悉,北京化工大学硕士研究生董亚南、穆雅娟、解永超及清华大学博士研究生张玉鹏依次为本论文的共同第一作者,冯越教授为本文的通讯作者,北京软物质科学与工程高精尖创新中心及北京化工大学为第一完成单位。

冯越教授课题组合影
BioArt后记:冯越研究组的这篇文章是与Ivan Dikic研究组和美国康奈尔大学的Yuxin Mao研究组一起以back-to-back的形式共同向Nature投稿的(2017年9月24日投稿,2018年3月28日接收)。在这三篇文章中,冯越研究组以mART结构域为主要研究对象,而另外两个研究组的重点则是PDE结构域。在三篇文章投到Nature四个多月后,中科院生物物理所高璞组将SidE家族的另一蛋白SidE的结构功能研究投稿到Cell杂志,该文章也于日前发表(Cell丨高璞组揭示新型泛素化修饰的作用机制——胡荣贵、王丰点评)。值得一提的是,在这四篇文章中,冯越研究组报道的结构所包含的SidE家族蛋白的长度是最长的,同时该文章也是四篇文章中最早接收的。

Nature同期发表的Ivan Dikic研究组和Yuxin Mao研究组的研究论文
冯越教授简介:

冯越,1985年生,辽宁锦州人,教授、博士生导师。2013年7月博士毕业于清华大学结构生物学中心,经高层次人才引进进入北京化工大学生命科学与技术学院工作,主要以蛋白质结构生物学为手段,对多酶生物分子机器及重大疾病相关蛋白质的结构与功能进行研究。共发表SCI论文23篇,其中第一作者或通讯作者论文11篇,分别发表在Nature (两篇,第一作者和通讯作者各一篇)、Nature Plants (通讯作者)、PNAS (共同第一作者)等国际著名期刊上。作为项目负责人主持国家及省部级项目3项,其中国家自然科学基金青年项目和面上项目各一项,北京市自然科学基金项目一项。
参考文献
1. Hershko, A., A. Ciechanover, and A. Varshavsky, Basic Medical Research Award. The ubiquitin system.Nat Med, 2000. 6(10): p. 1073-81.
2. Komander, D. and M. Rape, The ubiquitin code. Annu Rev Biochem, 2012. 81: p. 203-29.
3. Qiu, J., et al., Ubiquitination independent of E1 and E2 enzymes by bacterial effectors. Nature, 2016.533(7601): p. 120-4.
4. Bhogaraju, S., et al., Phosphoribosylation of Ubiquitin Promotes Serine Ubiquitination and Impairs Conventional Ubiquitination. Cell, 2016. 167(6): p. 1636-1649 e13.
5、Qiu, J., Yu, K., Fei, X., Liu, Y., Nakayasu, E. S., Piehowski, P. D., ... & Luo, Z. Q. (2017). A unique deubiquitinase that deconjugates phosphoribosyl-linked protein ubiquitination. Cell research, 27(7), 865.
[来源:BioArt]
 复杂单克隆抗体的对比分析
复杂单克隆抗体的对比分析版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~