差示扫描荧光法表征蛋白配体互作
2022/08/17 16:02
阅读:236
分享:方案摘要:
方案详情:
方案标题: 差示扫描荧光法表征蛋白配体互作
检测样品:热休克蛋白Hsp90,醛脱氢酶1A1 (ALDH1A1)
检测项目:蛋白小分子Thermal shift assay
应用领域: 制药
方案摘要
差示扫描荧光法(DSF),也被称为thermal shift assay(TSA),是表征蛋白热稳定性的常用方法之一,广泛应用于蛋白配体互作表征,突变体、缓冲液、去垢剂筛选等领域。DSF可以通过荧光染料或蛋白内源荧光信号监测升温过程中蛋白构象的变化计算其熔解温度Tm(折叠蛋白与去折叠蛋白相等时的温度)。
方案详情:
染料法DSF最常用的是SYPRO Orange染料,蛋白去折叠疏水区暴露时,疏水染料SYPRO Orange便会结合至该区域,荧光强度增加(图1)。无标记DSF则是基于蛋白去折叠过程中色氨酸发射光谱的位移进行检测(图2)。
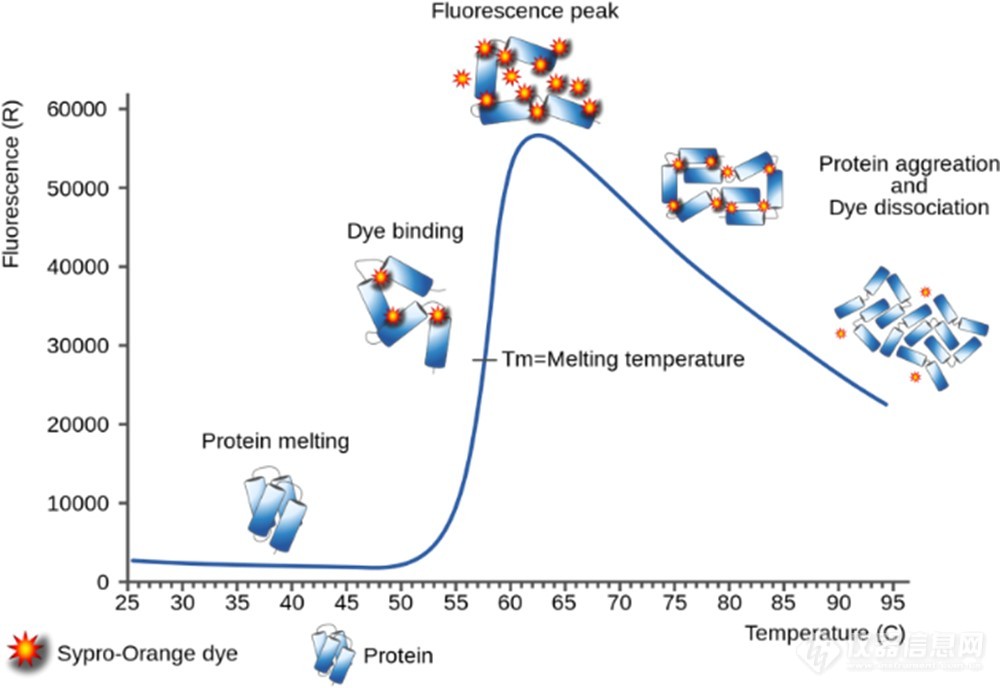
图1. 染料法DSF
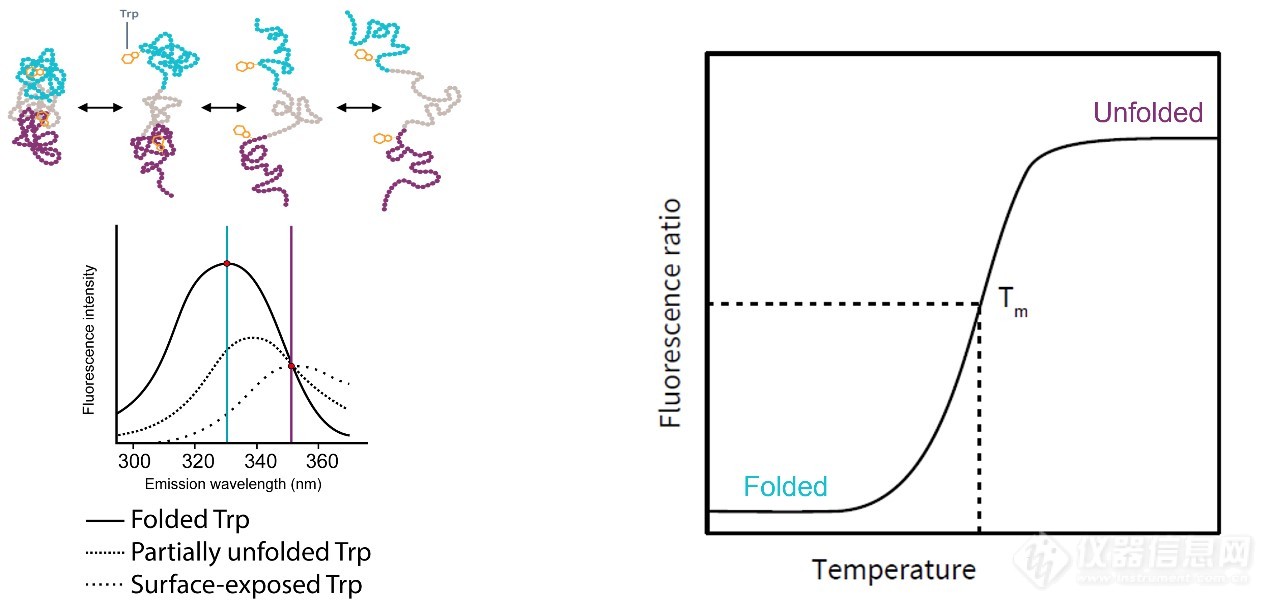
图2. 无标记DSF
当配体的结合增强蛋白稳定性时,其熔解温度Tm也会升高。如下图所示,未加入ATP时,Hsp90 蛋白的Tm为63.46℃,在加入ATP后,结合增强了Hsp90蛋白的稳定性,Tm升高至67.53℃。因此我们可以利用该方法进行蛋白结合活性的快速验证或高通量配体定性初筛。
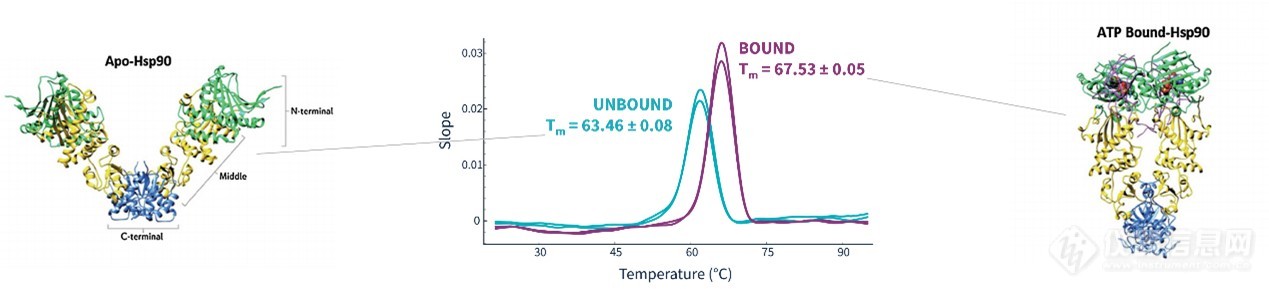
图3. PR蛋白稳定性分析仪表征蛋白配体互作
在进行蛋白配体互作表征时,染料法DSF存在一定的局限性。外源加入的染料结合至蛋白可能会直接影响蛋白的稳定性或干扰蛋白与配体的结合,并且在蛋白形成聚集时,染料会发生解离,不适用于多结构域蛋白的检测。例如醛脱氢酶1A1 (ALDH1A1)在用SYPRO Orange染料检测时仅有一个热变性峰,并且在加入辅因子NAD+和已知的抑制剂NCT-501后并没有出现明显的Tm变化(图4a)。而使用PR蛋白稳定性分析仪进行无标记DSF检测时,ALDH1A1呈现出两个热变性峰,在加入辅因子NAD+后,第一个热变性峰明显右移。继续加入抑制剂NCT-501后,第一个热变性峰消失,蛋白稳定性增强(图4b)[1]。
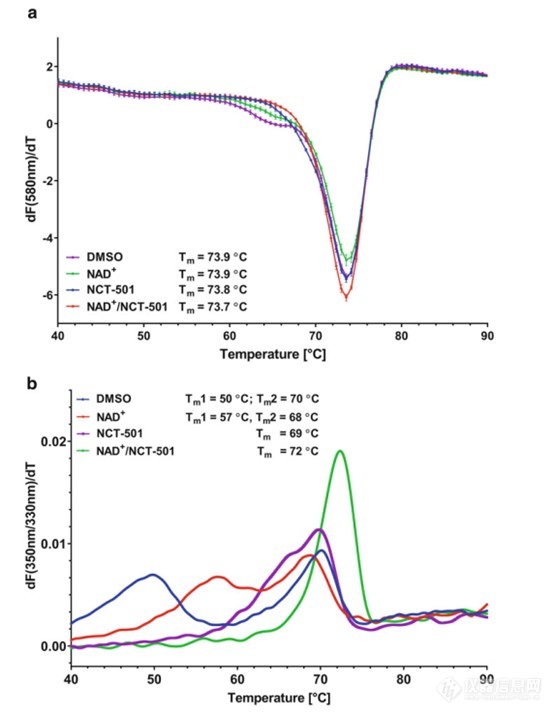
图4 ALDH1A1 DSF检测对比
此外,染料法DSF的实验操作较繁琐,需要根据蛋白的特性及去垢剂兼容性选择合适的染料,优化蛋白和染料的比例,在配制样品时还要考虑染料自带的有机溶剂对蛋白的影响。而用PR蛋白稳定性分析仪进行无标记DSF实验时,稀释好样品就可以直接上机检测了。
除了无标记DSF(nanoDSF)检测模块外,PR蛋白稳定性分析仪还可搭载动态光散射(DLS),静态光散射(SLS)和背反射(Backreflection)模块,只需要10μl样品就可以完成均一性,热稳定性,胶体稳定性的检测。我们还提供自动化解决方案,便于客户进行无人值守的高通量筛选。

图5 机械臂自动上样的PR蛋白稳定性分析仪
[1] Labrou N E . Targeting Enzymes for Pharmaceutical Development Methods and Protocols: Methods and Protocols[J]. Methods in Molecular Biology, 2020.
仪器链接 https://www.instrument.com.cn/netshow/C485840.htm
下载本篇解决方案:
更多![]()
结构生物学膜蛋白研究必看!
NanoTemper 与美国麻省理工学院 Imperiali 实验室及德国 Cube Biotech 公司进行深度合作,共同开发了一种更加简化的工作流程,通过使用Prometheus Panta 多参数蛋白稳定性分析仪进行快速筛选来自NativeMPTM平台的共聚物纳米盘(Copolymer nanodiscs),从而事半功倍的找到结构分析的最佳溶解条件。
制药/生物制药
2024/10/30
【设备更新】NanoTemper抗体药物开发实验指南
我们将介绍用于检测生物治疗药物稳定性的各种技术,阐明单克隆抗体配方的来龙去脉,介绍新药临床试验申请(IND)和新药上市申请(NDA)的典型时间线,并深入研究存储条件如何影响单抗稳定性。
制药/生物制药
2023/07/14
【设备更新】生物制剂研究人员必备宝典-DLS动态光散射技术指南
动态光散射(DLS)是一种强大的技术,是一种测量颗粒大小、低聚化和分散性,以及环境变化(如药物偶联物的添加或储存缓冲液的变化)对它们的影响的方法。可提供有关生物制剂制备物的纯度和聚集状态的信息,并增加对候选物稳定性的更深入了解。 阅读DLS技术指南电子书,了解其工作原理,以及它如何帮助您优化候选药物的筛选过程。 我们介绍了在整个生物制药流程中,DLS技术如何帮助您改善每一个决策,同时也提供了一些设计DLS实验的实用技巧。
制药/生物制药
2023/04/06
【设备更新】MST 技术在中药成分靶点检测中的解决方案
中药成分及天然产物的药效是通过与多个靶点的相互作用来实现的,它们与靶蛋白瞬时、弱亲和力相互作用,这种作用机制的复杂性为其靶点鉴定带来很大挑战。 传统的基于亲和力的靶点垂钓方法取决于小分子化合物和靶点蛋白质的亲和力,这种结合需要足够强,以便从整个蛋白质组中分离目标蛋白质,而NanoTemper的微量热泳动技术(MST)检测结合亲和力的范围非常广,可发现从皮摩尔级 (pM) 到毫摩尔级 (mM) 的极强和极弱结合分子。
制药/生物制药
2023/06/25











