科学家借助全新非接触式亚微米红外光谱,首次成功直观揭示神经元中淀粉样蛋白聚集机理
老年神经退行性疾病,如阿尔茨海默症(AD)、肌萎缩性侧索硬化症、Ⅱ型糖尿病等,目前困扰着全大约5亿人,且这个数字仍在不断迅速增长。尤其是阿尔兹海默症(占70%以上),目前仍未有行之有效的诊断方法,因此无法得到有效的治疗或预防。尽管当代病理学研究已经证实这种病理变化与具有神经毒性的β淀粉样蛋白质的聚集有关,但其在神经元或脑组织中的聚集机制目前尚不清楚。现有的方法, 如电子显微镜、免疫电子显微镜、共聚焦荧光显微镜、超分辨显微镜,通常都需要对样品进行化学加工(标记染色等),可能会对淀粉样蛋白结构本身造成影响。而非标记方法,如表面增强拉曼光谱(SERS)和傅里叶变换红外光谱(FTIR), 前者受限于亚细胞水平上的低信噪比、自发荧光及不可逆的光损伤,后者其空间分辨率受限于红外光波长(?5–10 μm),且光谱可解译性和准确性受到弹性细胞光散射所产生的米氏散射效应(Mie scattering effects)的严重影响,使得直接在亚微米尺度上研究淀粉样蛋白质在神经元内的聚集行为十分困难。
美国Photothermal Spectroscopy(PSC)公司开发的全新非接触式亚微米分辨红外测量系统mIRage, 是基于的光学光热诱导共振(O-PTIR)技术,它克服了传统FTIR技术的衍射限和米氏散射效应,红外光谱空间分辨率高达500 nm,且无需对样品进行标记, 不再需要衰减全反射(ATR)技术进行厚样品测试,且能够无接触和无损探测样品,全程对样品无污染,可以帮助科研人员更全面地了解亚微米尺度下样品表面微小区域的化学信息,使得在亚细胞水平揭示生物分子结构成为了可能。美国Photothermal Spectroscopy(PSC)公司开发的全新非接触式亚微米分辨红外测量系统mIRage(如图1A所示),使用可见探测束(532 nm)来测量样品在脉冲红外光束照射下的红外光热响应,具体体现为样品反射率的变化,由于使用了可见光作为检测光,使得其空间分辨率不再依赖于入射红外光的波长,且单一特定探测光束的使用还可以消除米氏散射效应。
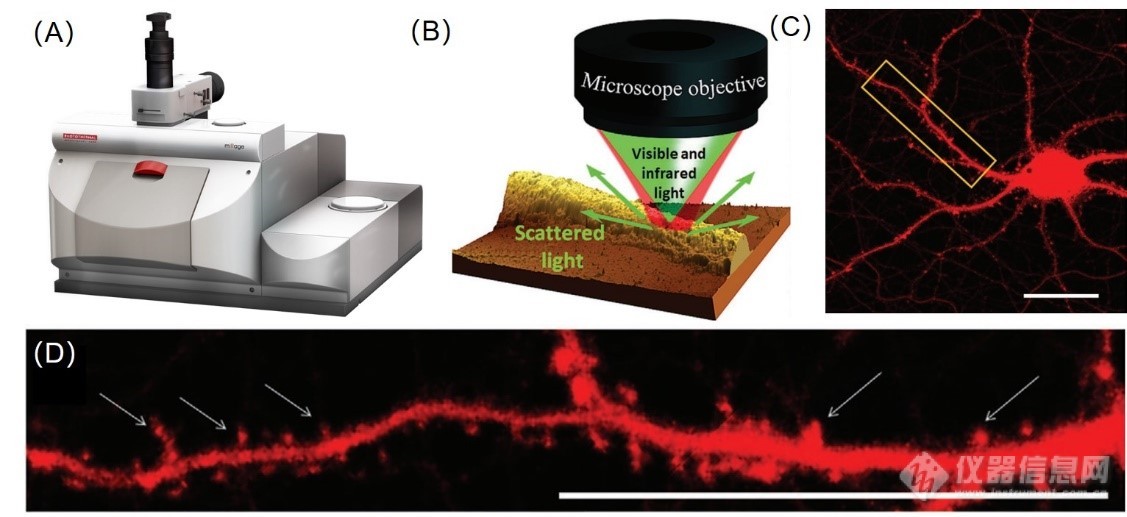
图1. (A) 美国PSC公司非接触式亚微米分辨红外测量系统mIRage实物图;(B)亚微米红外成像示意图:神经元树突的AFM形貌图,其中神经元直接在CaF2基底下生长。mIRage采用两束共线性光束: 532 nm可见(绿色)提取光束和脉冲红外(红色)探测光束,样品的光热响应被检测为样品由于对脉冲红外光束的吸收而引发的绿色光部分强度的损失,使红外检测的空间分辨率提高到?500 nm. (C) 小鼠大脑皮层初神经元, 在CamKII促进下表达为tdTomato荧光蛋白,使得神经元结构填满红色,图片标尺为20 μm。(D) 图C区域放大图片,箭头指示树突上的神经元刺。
因为上述的巨大技术优势和突破,非接触式亚微米分辨红外测量系统mIRage在生物学领域技术有广泛的应用前景和潜力,可应用于诸如细胞学研究(蛋白质、磷脂结构分析,红细胞、巨噬细胞成像等),临床致病菌/病原微生物鉴定,癌症诊断(细胞/组织),牙科/骨病变/眼科检测,生物大分子损伤,生物组织识别,以及生物药物检测,法医学等。
近日,瑞典隆德大学的Klementieva教授团队与美国PSC公司的Mustafa Kansiz博士合作,使用全新非接触式亚微米分辨红外测量系统在亚微米尺度上研究了淀粉样蛋白沿着神经突直到树突棘的聚集行为(图1B和C),这是以往的实验技术手段所不可能实现的。在该研究中,他们使用了大脑皮层初神经元,这是因为它们易发生AD病变,且具有特的结构。初神经元的这种形态特征使得可以在单个神经元层面上来测试全新非接触式亚微米分辨红外测量系统的分辨率和准确性。先,他们在反射模式下获得了高质量的红外光谱,且不受米氏散射或基线失真等人为因素的干扰(图2A,B)。值得注意的是,全新非接触式亚微米分辨红外测量系统其约为400 nm的横向分辨率,使得他们能够通过比较1740 cm-1处的峰强度来检测脂质含量的差异,以及通过对比酰胺II (1540 cm?1)与酰胺I特征峰强度(1654 cm?1)的比值来比较氨基酸(蛋白质)的种类和数量上的差异(图2C,D)。这是科学家们次获取单个树突棘的高分辨率的化学图像和红外光谱,以往其它测试方法是无法做到的。
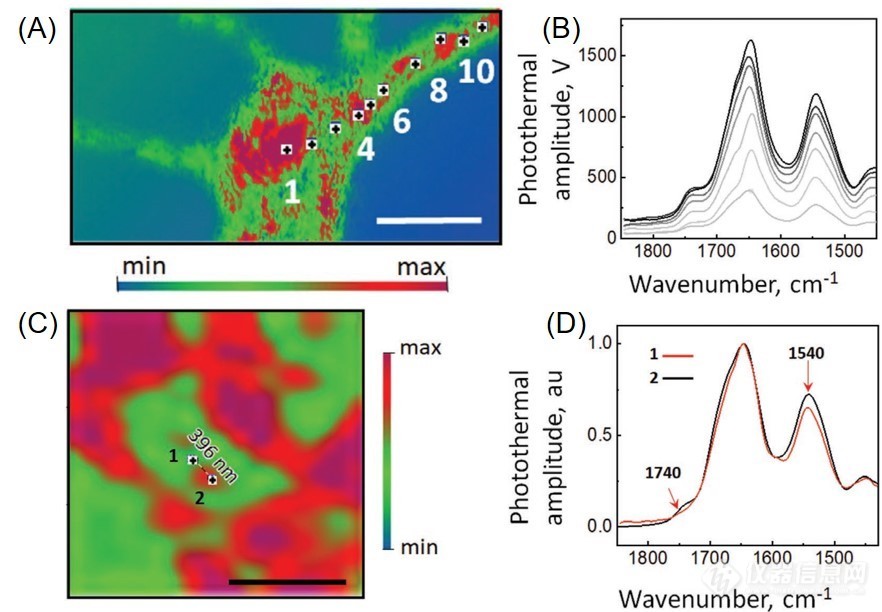
图2. 使用非接触式亚微米分辨红外测量系统mIRage观察初神经元结构。 (A) 在1650 cm-1处获得的神经元的红外图像,显示了蛋白质的分布; (B)中对应原始红外光谱的位置用数字和圆点表示,图片标尺为20 μm;(C)在1650 cm-1处获得的树突的红外图像,数字表示D图中获得光谱的位置,图片中标尺为20 μm;(D)在C图中两点处取的归一化红外光谱,体现了该方法的亚微米空间分辨率。红色箭头表示蛋白质结构的化学变化。
为了在亚细胞层面上定位神经元中β片层结构,作者对APP-KO神经元进行了为时半小时的合成Aβ(1-42)处理(2×10?6 M),并使用非接触式亚微米分辨红外测量系统mIRage进行了化学结构的成像分析(图3A)。对Aβ处理后的APP-KO神经元的红外光谱进行分析证实,β片层结构可以在亚细胞水平上进行分辨。有趣的是,纯Aβ(1-42)纤维在1625 cm-1位置处有特征的红外峰,当加入到神经元结构中后,β片层结构的特征峰移动到1630 cm-1处,表明淀粉样原纤维结构发生了变化,可能是由于其与细胞蛋白和/或细胞膜发生相互作用导致的(图3B, C)。基于该发现,我们可以得出,在神经元中的淀粉样蛋白的构型变化可能会引发阿尔茨海默症进程中的不同机制。为进一步了解其形成机制,更多的方法学研究变得更加必要,如将非接触式亚微米分辨红外与免疫荧光显微镜结合起来,这种多模态成像模式可以在不同的细胞层面上更详细分析特征蛋白的结构变化,如前突触或后突触,囊泡(溶酶体或内溶酶体)或其他细胞器。
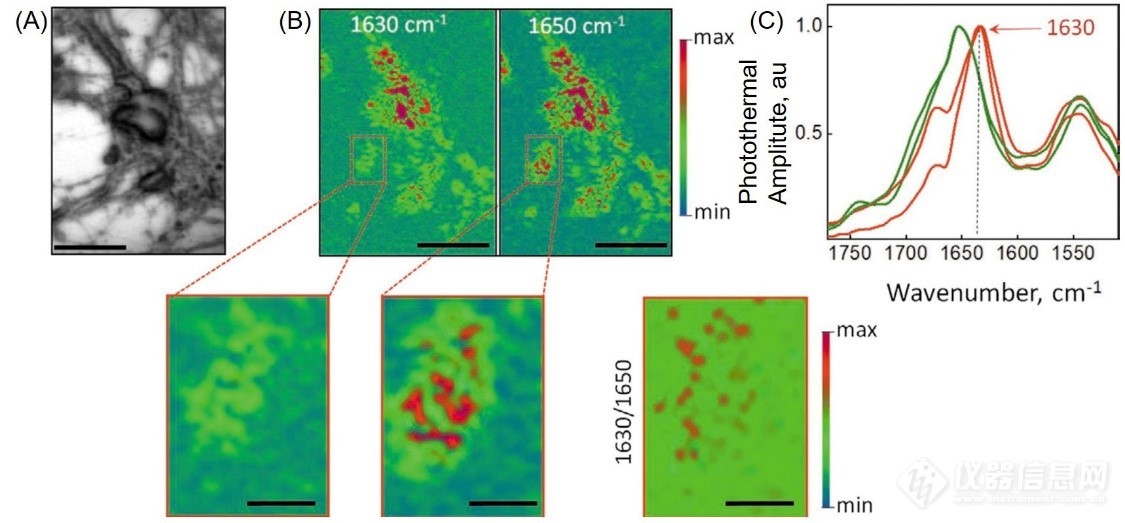
图3. 使用非接触式亚微米分辨红外测量系统Mirage观察β片结构在处理后的初神经元中的聚集行为。(A,B)APP-KO初神经元在1650和1630 cm-1处的明场和光热红外成像,彩色标度表示光热振幅的强度,从小值(蓝色)到大值(红色),阈值为50%(以0为中心),插图为放大或叠加后的红外成像图,图片标尺为20 μm;(C)神经元中淀粉样蛋白结构在2×10?6 M Aβ(1-42) (红色)处理或不处理(绿色)后分别对应的红外光谱。β片结构对应的特征红外峰用红色箭头表示,光谱数据点间距为2 cm?1,数据进行50次均一化处理。
综上所述,借助全新非接触式亚微米分辨红外测量系统mIRage,科学家成功次揭示了初神经元的分子结构,无需标记,且因为该技术是在非接触模式下工作,不会对神经元造成损伤,这在研究脆弱或粘性的物质时显得尤为重要。另外,该技术还能获得亚微米尺度的红外光谱,且不含由于背景失真或米氏散射造成的散射伪影。新的技术进步表明,全新的非接触式亚微米分辨红外测量系统mIRage现在可以用来做活细胞成像,并保持相同的亚微米空间分辨率。在这种情况下,全新的非接触式亚微米分辨红外测量系统有望在β片层结构在活神经元的突触附近的化学成像中发挥关键作用,并提供一个新的机会来研究神经毒性淀粉样蛋白如何从一个患病的神经元传播到一个健康的神经元,揭示阿尔茨海默症的形成和发展机制。该工作发表在2020年的Advanced Sciences上(DOI: 10.1002/advs.201903004)。
更多![]()
easyXAFS用户速递:Joule!南京大学李朝升/闫世成/冯建勇团队提出载人深空探索中的氧回收策
厂商
2024.10.31
10月29日应用研讨会!解锁单外泌体成像表征全新技术
厂商
2024.10.28
极低温10 nm近场光学显微镜,助力多篇Nature子刊等文章发表!
厂商
2024.10.25
Nature!这台光刻机,助力首台芯片级钛宝石激光器问世 !
厂商
2024.10.18