推荐厂家
暂无
暂无
 留言咨询
留言咨询
 银牌10年
银牌10年
 400-860-5168转3646
400-860-5168转3646
 留言咨询
留言咨询
 金牌2年
金牌2年
 400-860-5168转5915
400-860-5168转5915
 留言咨询
留言咨询

 400-886-5615
400-886-5615
 留言咨询
留言咨询

 400-860-5168转2472
400-860-5168转2472
 留言咨询
留言咨询

 400-860-5168转3541
400-860-5168转3541
 留言咨询
留言咨询
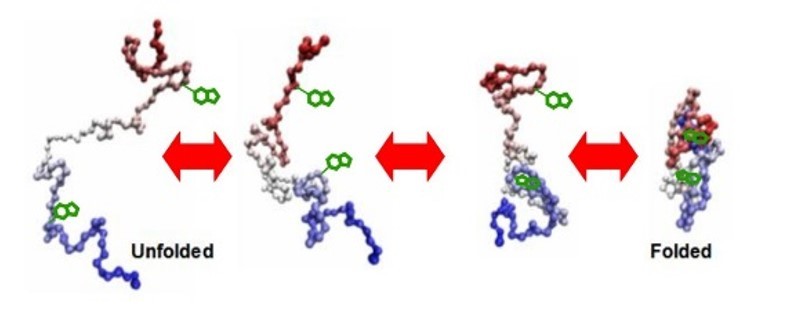




蛋白质结构定量分析具体步骤?谢谢
[align=center]蛋白质热稳定性的研究机理[/align][align=center]西安国联质量检测技术股份有限公司[/align][align=center]食品事业部:魏娜[/align] 疏水作用被认为是决定蛋白质结构的主要作用力。蛋白质的天然结构是由以下类型的共同作用力维持其结构的热稳定性(例如,H键,离子键和范德华力)。德国专家Dil回顾了支持这一理论的证据:(一)非极性溶剂使蛋白质变性 (二)疏水残基可以很典型的把核心部位分开,在其核心部位他们在很大程度上避免了与接触水 (三)在蛋白质核心部位的残基和疏水基团比任何其他一种残基具有更坚固的保守区和结构(核心部位疏水残基的取代物一般比任何一种代替物更具有破坏性)。(四)蛋白质展开涉及大量增加的热容量。给定的疏水作用的中心对在蛋白质折叠也有一定的影响,很容易以为疏水作用还是负责蛋白稳定性的主要动力。在过去20年里,序列、结构和诱变等信息的积累证实了疏水作用,事实上,更是蛋白质稳定性的主要动力。两个观察报告指出常温的和极端嗜热的微生物的同源体具有相同的最基本的稳定性,这种稳定性由保守的蛋白质核心提供:(1)疏水相互作用以及中心残基所影响的二级结构比特征区域表面更保守。(2)在有溶解能力的被暴露的区域发现了大量稳定的代替物(可以在常温及极端嗜热蛋白质结构的比较以及在蛋白质定向突变的实验中观察到)。常温以及嗜热蛋白质同源体的核心具有高度的相似性,这些性质表明常温蛋白质尽可能高效的与那些在核心外部的没有太多空间稳定性的蛋白质进行折叠。极端嗜热蛋白质稳定的相互作用经常在蛋白质的不保守区被发现。如下所示,如表面离子对减少了溶剂暴露疏水面,和与之稳定结合(即N和C末端以及氨基酸循环)的蛋白质表面似乎有助于极端嗜热蛋白质的热稳定性。 在近年来足够的实验证据(如序列,诱变,结构,和热力学)被积累,但没有一个单一的机理可以解释极端嗜热蛋白质的显著的稳定性。增加的热稳定性可以在数量很少的精确突变中找到,这样的突变常常不遵循任何一种固定的法则。[b] 氨基酸组成和内在倾向[/b]蛋白质的氨基酸组成长期以来被认为与其热稳定性有关。第一个数据分析对比了常温和极端嗜热蛋白质的氨基酸组成,发现趋向于Gly→Ala,Lys→Arg的替换,嗜温蛋白质的组成中含有大量Ala,主要是由于Ala最易于螺旋结构的形成。随着更多实验数据的积累(尤其是,全基因组序列的测序 ),通常的嗜热适应规则不能依据显著性差异来定义蛋白质中氨基酸的组成已经变得越来越明显了。通过对8个常温和7个极端嗜热微生物的基因组序列的对比得出常温和极端嗜热蛋白质的残基存在这种趋势的差异(如表4所示)。另外发现,极端嗜热蛋白质比常温蛋白质带有更多的带电残基(多3.24%),以及较少的极性未荷电残基(-4.98% 特别是谷氨酰胺,-2.21%)。嗜热蛋白质比常温蛋白质还含有更多的疏水残基和芳香残基。从基因组测序中获得的这些数据不能普遍化,在极端嗜热的微生物基因组中自身存在着很多的突变。敏捷气热菌实际上比在表4中列出的嗜温菌含有有更少的带电残基(23.64%),更少的大体积的疏水残基(27.29%),以及更少的芳香性残基(7.42%)。相反,敏捷气热菌含有较多的Ala,Gly,Pro,Ser,和Thr残基。因此,极端嗜热蛋白质的氨基酸组成可能经常和突变性有关,而不是与其适应高温的指标有关。蛋白质中氨基酸残基的分布与其相互作用比氨基酸残基的组成对蛋白质的热稳定性更相关。这两种同源蛋白酶解淀粉芽孢杆菌枯草杆菌蛋白酶BPN9和普通高温放线菌嗜热蛋白酶包含数量相同的带电残基,但嗜常温酶的嗜热蛋白酶包含比八个更多的离子对。有关的想法,蛋白质的稳定性取决于稳定的紧密包裹的疏水内核,个别残基的固有倾向是参与螺旋或链结构,这作为一个潜在的稳定机制被研究。比较嗜温和嗜热蛋白结构,Facchiano等人观察到嗜热蛋白质的螺旋结构通常比的嗜温蛋白质更稳定。他们检测到的唯一的趋势是在嗜热蛋白质的螺旋(二支链残基没有得到很好的耐受性螺旋线性残留有)中C[sub]β[/sub]分支残基的减少(Val,Ile,和Thr)。许多实例存在于未遵循这一趋势。该P.球菌和T. litoralisGDHs包含更多数量的Ile。如果将Leu和Ile残基进行比较,这两个残基具有最高的(和等同的)部分特定卷。在蛋白质中,Leu侧链最常发现两种旋转异构体的构象(180°和300°×1),但不是在一个与X1 =60°。在Ile侧链频繁采用四种不同的旋转异构体的构象,以及三个X1值被发现。随着这种构象的柔性,Ile可能能够更好地填补在蛋白质内核折叠时出现的空缺。Dil还指出,环境的影响(例如,盐桥的形成,芳烃相互作用,疏水表面的包埋,以及填充膜腔)可以作为重要内在的螺旋倾向。在许多情况下,二级结构在蛋白质结构不对应于所找到的二级结构预测的内在倾向,表明该固有倾向不足以解释蛋白质中α-螺旋的稳定性。Arg残基的几个特性表明,他们将比Lys残基更好地适应高温:该Argδ-胍基部分由于其高的pKa和共振稳定而降低的化学反应活性。δ-胍基部分比Lys氨基为带电的相互作用提供了更多的表面积。Arg参与多种非共价相互作用的能力。因为在Arg侧链比Lys少一个亚甲基,它具有开发较少不利触点的电位与溶剂。最后,因为它的pKa值(约12)是Lys的1倍以上(11.1),在温度升高的时候,精氨酸更容易保持离子对和净正电荷(因为温度的增加,pKa值下降)(252,354)。在嗜温菌的蛋白质池和在表中列出超嗜4(0.73+ - 0.37和0.87+ - 0.60,分别)平均精氨酸/赖氨酸的比率与大标准偏差相关。(其中超嗜热,精氨酸/赖氨酸的比率范围从Aquifex0.52超嗜热菌蛋白到2.19敏捷气热菌。)这些结果表明,如果增加精氨酸确实会变得稳定,这种机制是不能够普遍使用于极端嗜热菌中。[b] 二硫键 [/b]二硫键被认为主要是通过降低蛋白质裂解状态的熵维持蛋白质的稳定。当两个半胱氨酸键断裂时,二硫键的熵效应成比例地以对数方式增加残基的数量。 因为在高温下,半胱氨酸和二硫键的敏感性遭到破坏,,100℃被认为是蛋白质维持二硫键稳定性的上限。这一概念是基于这样一个事实,早期的研究描述蛋白质活性的研究机理,在那个时期仅形成了一种可利用的酶:常温酶。这些研究确定了所有蛋白质研究,研究包括的二硫键在100℃时β-消除有相同的速率。这个速率不依赖于蛋白质的结构并且在pH=8.0(半衰为1小时)比在pH =6.0(半衰期为12.4小时)时速度快。这些研究的限制是在100℃时所有蛋白质是在展开状态时进行研究的。在最近包括二硫键的蛋白质的描述中,在100℃时这些蛋白质具有最大的活性和稳定性,表明在100℃时二硫键维持了这些蛋白质的稳定性并且构象环境和溶剂可被决定因素保护,防止破坏二硫键。当描述大肠杆菌时,S.solfataricus 5’-甲硫腺苷磷酸化酶形成了不正确,不稳定的二硫键。这一观察间接反映了,二硫键在天然酶中表现出的稳定性。嗜火液丝氨酸蛋白酶被描述为包含8半胱氨酸(无存在于枯草杆菌蛋白酶BPN')。处理二硫苏糖醇从半衰期为90 小时 85℃,减少到少于2小时。在高温下二硫苏糖醇不稳定进一步表明这种酶的确含有二硫键并且它们是高度不稳定的。这种酶在半衰期为6小时 温度为105℃ pH=9.0时,要比它在蛋白质展开中pH=8.0 半衰期为1小时二硫键计算的长,表明这种酶的二硫键通过蛋白质中二硫键的无法靠近以保护二硫键不被破坏。因此,不是所有的二硫键对热稳定破坏具有相同的易感性。[align=center][b]疏水作用[/b][/align] 在极端嗜热蛋白质中,疏水作用是蛋白质热稳定性的一个机理。平均增加1.3千卡/摩尔(±0.5)的稳定性对于增加甲基埋在蛋白质折叠(取决于腔产生突变,这种突变中,大的脂族残基被替换为一个较小的脂族残基)。当突变产生了往往需要局部重排的不利的范德华力作用时,突变试图填充凹处往往是更不稳定的。疏水性相互作用在蛋白质结晶中的热稳定作用的,实验证据是可用于确认所述极端嗜热蛋白质中疏水作用的区域。存在于沃氏甲烷球菌和M.jannaschiladenylate激酶中的这种酶嵌合体的结构的稳定部分表明,更大和更具极端嗜热酶疏水酶核心(这是由于增加的脂肪族残基含量和脂族侧链体积)可能是负责分枝詹氏甲烷球菌的腺苷酸激酶的热稳定性。该从嗜热栖热菌3-异丙基苹果酸脱氢酶热包含亚基间的疏水相互作用的没有在大肠杆菌中酶存在。嗜三异丙基脱氢酶Leu246Glu/ Val249Met和大肠杆菌Glu256Leu/Met259Val突变衍生物构建了动摇并稳定在栖热和大肠杆菌酶,分别的突变体和野生型的聚丙烯酰胺凝胶电泳在尿素的存在下酶表明,疏水性相互作用使二聚体解离更有抵抗力。[b]氢键[/b]由于氢键的作用使得核糖核酸酶T1趋于稳定。核糖核酸酶T1平均长度86 H键。他们的核糖核酸酶T1稳定(约贡献110千卡/摩尔,如通过诱变和展开实验确定),H键贡献(307)1.3千卡/摩尔能力。因为识别H键的高度依赖于距离截止和因为一批超嗜热蛋白质结构没有被细化到足够高的分辨率,通过结构研究的热稳定性H键的作用分析没有提供明确的答案。一项研究由唐纳等人完成的。H键使得蛋白质的热力学稳定:(i)关联的去溶剂化罚与掩埋诸如H键小于去溶剂化罚掩埋离子对的(即包括两个电荷的残基),和(ii)一个充电中立H键的焓奖励是大于由于中性中性H键的电荷 - 偶极相互作用。chargedneutral之间的这种相关性H键和GAPDH稳定性表明的作用在稳定蛋白质电荷的残基可以不限于形成离子对。带电中性h的人数增加债券还发现了T. maritima的铁氧还蛋白(表5)。这些H键或者稳定转弯或锚的结构变为另一个。[b]离子对[/b]因为离子对通常存在于在少量蛋白质和因为它们不是高度保守的,它们是不驱动在蛋白质折叠的力。去溶剂化作用8筒体螺旋A8和A1)还通过测试SDM。在85.5°C,突变Arg241Ala增加酶变性率几乎3.酶的EA的一个因素展开在85℃下降3.2千焦耳/摩尔,这表明Arg241-Glu73对参与的动力学稳定这种酶。在P.球菌确定的离子对网络,P. kodakaraensis,和T. litoralis的GDH的结构进行了研究由SDM。这三种酶是83至87%相同,但它们的thermostabilities减小的方向P.球菌GDH。P. kodakaraensis GDH。T. litoralis的GDH。它们都含有相同的18离子对网络在它们的六聚体界面。突变Glu158Gln,其中去掉2离子对的该网络的中心,显著不稳定P. kodakaraensisGDH的。一个离子,包括六对网络被控残留物只存在于P.球菌GDH。相同的离子对网络在P.kodakaraensis GDH和T. litoralis的创建GDH由SDM。这两种酶是由新稳定的介绍离子对网络(280,348)。这些研究证实离子对网络在巴斯德球菌,P的作用kodakaraensis和T. litoralis的GDH thermostabilities。 Lebbink等。 (203)介绍了16个残基的离子对网络的在T. maritima的GDH亚基界面来创建一个界面类似于在体育球菌的GDH在18离子对网络。该三不稳定的突变组合产生了三重突变酶(Ser128Arg-Thr158Glu-Asn117Arg),这是稍微更稳定和嗜热比野生型酶。这个结果示出合作的高级别存在这种离子对网络的不同成员之间。该结果还支持18个残基的离子对的作用网络中的P.球菌GDH稳定。在早先的研究中,Tomschy等。(337)已拆除2位于两个α-螺旋在T. maritima的表面上的离子对GAPDH。由于这些突变不影响所述酶稳定性,作者得出结论认为,表面离子对不能被认为是热适应的总体战略。选择在本研究Bothion对分别螺旋内的离子对。这些2双可能已经位于蛋白质领域的人过约束,而不是蛋白质的地区之一最容易展开。与此相反,在其它实施例上述说明的热稳定效果非本地离子对和离子对网络,连接不相邻的残基(和二级结构)的序列中。离子配对中的作用的附加的,间接的证据热稳定性是来自基因组测序。与嗜热蛋白质带电残基相比,常温蛋白,主要是在不带电荷的极性为代价残留物。[b]脯氨酸及脯氨酸展开过程中的熵的减少[/b]Matthews等人提出已知的蛋白质三维结构可以通过展开时他们的熵的减少维持稳定。在展开状态下,甘氨酸是带有最高构象熵的残基,没有C[sub]β[/sub]。脯氨酸,可以采用只有几个配置并限制允许前述残余物的配置(313),具有最低的构象熵。因此,该突变Gly3Xaa或Xaa3Pro应该减少熵及的蛋白质的展开状态稳定的蛋白质,只要作为改造的残留不引入不利菌株中的蛋白质的结构。这一技术已被用来工程师酶是热力学更稳定。例如,杆状stearothermophilus中性蛋白酶失活通过自溶,其中针对特定柔性表面环(残基63到69)(93)。脯氨酸在循环中引入使其不易展开。只有定位65至69是适合脯氨酸替换。在其他位置,一脯氨酸将消除非共价相互作用,产生构象株,或有不恰当的扭转角度。许多嗜热和嗜热蛋白也利用这个稳定机构(255)。Pro177和Pro316在两个N个末端螺旋和Pro24中的B-转弯位置2被证明是稳定(215)。(脯氨酸分别在相应的引入地点在拜氏梭菌的酶。)至少有其中仅发生在嗜热芽孢杆菌脯氨酸22位置寡聚1,6-葡糖苷酶。其中大多数脯氨酸是在位置2的溶剂暴露B-圈(七个脯氨酸的),在循环内的线圈(9人),或在N帽一个螺旋在桶结构(其中四个)。脯氨酸是在嗜温的相应位置引入蜡状芽孢杆菌寡-1,6-葡糖苷酶。热稳定性一般随着引入脯氨酸的数量。稳定性增长最为显著时添加的脯氨酸位置两个B-转弯或在一个螺旋瓶盖ñ 。少稳定的突变可能引入不利范德范德华相互作用或删除稳定H键(361)。在那不勒斯栖热袍木糖异构酶包含两个脯氨酸在参与亚基间的相互作用是一个循环。这些脯氨酸缺席在不太稳定的Thermoanaerobacteriumthermosulfurigenes酶。动力学稳定性两个T的性能thermosulfurigenes木糖异构酶突变体Gln58Pro和Ala62Pro说明如何重要突变位置为SDM(313)的结果。两Gln58和Ala62有骨干二面角这使得为脯氨酸,既不参与非共价稳定相互作用,以及Asp57和Lys61不得不二面角那允许前面的脯氨酸残留。的构象在Gln58侧链非常接近的脯氨酸吡咯烷酮环,并且因此没有构象菌株由临介绍 突变Gln58Pro稳定的蛋白质主要是通过降低展开的熵。相反,突变Ala62Pro之间创建一个卷的干扰脯氨酸吡咯烷酮环(镉原子)和Ly61侧链(CB原子),这可能导致不稳定的构象变化。突变Ala62Pro降低了酶的T1 /2为85℃下的10倍。[b] 构象应变作用力的作用[/b]左手螺旋构象的残基(Φ=40至60°,Ψ=20〜 80°)有着末端构象稳定性除非它们通过分子内的非共价相互作用来稳定。(左旋螺旋构象非甘氨酸残基被认为比右旋结构少0.52.0千卡/摩尔而不太稳定)。在左手螺旋构象的残基中,β- 碳和羰基氧的紧密相连在蛋白质结构中产生了一个局部的构象张力。左手螺旋构象的两个残基,谷氨酸15在枯草芽胞杆菌的DNA结合蛋白HU和赖氨酸95大肠杆菌核糖核酸酶H1,在旋转区域,是通过在嗜热酶的相应部分甘氨酸残基取代。突变体谷氨酸15甘氨酸和赖氨酸95甘氨酸分别在枯草杆菌DNA结合蛋白HU和大肠杆菌RNA酶H1,消除在左旋螺旋构象中由残基产生的构象张力,以及两种蛋白质的热力学稳定性的显著增加。在这两个例子中,由于构象张力的释放增加的蛋白质的稳定,通过它的稳定性影响二级结构的相互作用被加强。大肠杆菌核糖核酸酶H1包含两个额外左旋螺旋构象的非甘氨酸残基。残基色氨酸90和天冬酰胺100,而相比之下,赖氨酸95,酶内部的点,并且它们弥补了极性或疏水的相互作用。左旋螺旋构象中,常温的铁氧还蛋白含有三个残基在他们簇结合区域。在海栖热袍菌和T. litoralis的同系物中,簇结合区域的空间位阻通过具有三个甘氨酸残基的左旋螺旋构象的残基取代物被释放。这三个甘氨酸残基都涉及了拥有硫原子簇的H键。其他类型的构象张力释放作为稳定机制已经被提及。例如在α-螺旋中,具有低螺旋倾向的残基可以通过具有高螺旋倾向的残基被替换。这样的替代物通常发生在残基的侧链没有得到很好的安置的α-螺旋时。位于α-螺旋的一个特殊取代物是C末端(或C帽)。因为它缺乏了的支链以允许它采用没有张力的左手螺旋构象,并且由于主链羰基氧可以与溶剂分子形成氢键,所以在C帽甘氨酸是最有利的残基。该P.furiosus柠檬酸合成酶至少包含了7个具有C-帽的甘氨酸螺旋。他们的对稳定性的影响仍是未知的。虽然,在一般情况下,这些构象张力释放的类型不被期望提供显著的稳定性,并且它们在极端嗜热蛋白结构中没有扮演细致的角色。他们还与其他稳定机制相竞争(如倾向疏水相互作用,H键,或离子对)。[b] 螺旋偶极作用力对结构稳定的作用[/b]螺旋偶极可以通过邻近N-末端带负电荷的残基,以及邻近C-末端带正电荷的残基维持稳定。在S.solfataricus吲哚-3-甘油磷酸合成酶中,螺旋的偶极。也被稳定在杆状stearothermophilus和海栖热袍菌PGKs中:常温酶只有9 N帽和12 C帽(猪PGK)和10 N帽9 C帽(酵母PGK)通过相反的电荷被稳定。嗜热脂肪芽孢PGK数量稳定的N和C帽提高到16 N帽和13 C和在海栖热袍菌的PGK的提高到17 N帽和14C帽。尼克尔森等人展示N帽可通过约0.8千卡/摩尔增加酶的△Gstab。虽然,在一般情况下,N和C帽子和其他稳定的以及不稳定机制相竞争(例如,倾向H键或离子对)。[b]金属键对稳定性的影响[/b]长久以来,金属键以稳定和激活酶而众所周知。木糖异构酶连接两个金属离子(选自Co[sup]2+[/sup],Mg[sup]2+[/sup]和Mn[sup]2[/sup][sup]+[/sup])。一种阳离子是直接参与催化 第二种主要是结构。两种金属结合位点具有不同的特异性,并且一种阳离子与另一种阳离子的替换经常显著的改变酶的活性,底物特异性,热稳定性。存在和不存在于地衣芽孢杆菌木糖异构酶的金属键其酶稳定性的研究稳定结果表明的演变动力学稳定性遵循的热力学稳定性以及这两种类型的稳定性是金属呈现出的固有的功能。这些观察表明,主要稳定力与呈现在全酶中的金属相连。 对于金属在极端嗜热蛋白质中的稳定性起的作用的间接证据是在酶中除去金属遇到困难。α-淀粉酶特殊结合Ca[sup]2[/sup][sup]+[/sup]。α-淀粉酶催化位点位于两个领域的分裂结构之间(具有8管和一个回路)。属于这两个领域的配体相调整,Ca[sup]2[/sup][sup]+[/sup]配体对酶的催化活性和热稳定性是必不可少。巴斯德球菌胞外α-淀粉酶最初描述为Ca[sup]2[/sup][sup]+[/sup]无关的酶,因为室温下EDTA处理对其活性没有任何影响。进一步鉴定表明,这种酶包含至少两个Ca[sup]2[/sup][sup]+[/sup]阳离子,这种阳离子在70℃以下不能被EDTA去除。在90℃下处理EDTA30分钟除去大约60%至70%的结合的Ca[sup]2[/sup][sup]+[/sup]。Thermococcus profundusα-淀粉酶做出类似的观察结果(约80%相同的P.furiosua,胞外α-淀粉酶)。这种酶被激活并通过Ca[sup]2[/sup][sup]+[/sup]使其稳定,但室温处理EDTA对活性没有任何影响。 一些嗜热和极端嗜热酶曾被描述为含有金属原子,这些原子不出现在它们同源的常温酶中。来自于Sulfolobus sp.de 铁氧化还原蛋白张力7包含一个额外的40残基的N-末端延伸,这个延伸通过Zn结合位点被连接到核心蛋白上。锌原子通过N-末端结构域的三个组氨酸残基与核心结构域的1个天冬氨酸残基相连接。这种结构(N-末端延伸加锌结合位点)是不存在于真细菌同源微生物中的但是被保存在所有其他的嗜热嗜酸菌中 。逐行N末端缺失和两三个定向突变的配体表明,N端延伸和这两个锌原子对热力学稳定性很重要。虽然,它们的存在或缺失没有任何影响,但是影响着铁氧还蛋白功能。锌原子是负责9°C增加Tm值。它是如此的紧密结合在蛋白质内,在没有移除这两个FeS时锌原子不能被移除。普通嗜热放线菌枯草杆菌蛋白酶型丝氨酸蛋白酶的嗜热蛋白酶包含了三个Ca[sup]2[/sup][sup]+[/sup]结合位点 它们中的一个不出现在其常温酶同系物中(331)。嗜热酶的嗜热同系物,芽孢杆菌AK1蛋白酶比嗜热酶包含更多的Ca[sup]2[/sup][sup]+[/sup],并且它比在嗜热酶中出现的Ca[sup]2[/sup][sup]+[/sup]具有更显著的动力学稳定(半衰期为15小时80℃下与19分钟为嗜热酶)。因为Ca[sup]2[/sup][sup]+[/sup]优先与羧酸盐以及其他含氧等配体结合(它是最有可能被位于蛋白质表面上的金属配位体),这种金属比其他金属在蛋白质稳定性可能扮演更显著的稳定作用。[b] 蛋白质翻译后的修饰作用[/b] 蛋白质糖基化广泛存在于真核生物的酶上,以及一些细菌的胞外酶被糖基化。只有几个例子是公知的被糖基化的极端嗜热蛋白,并且它们的碳水化合物部分还没有被广泛表征。虽然,大多数的酶被糖基化(细菌,古细菌和真核微生物),但在细菌中仍然保留了其催化作用和稳定性。一些研究使用天然糖基化的真核生物蛋白质表明,糖基化可能在不影响蛋白质折叠的方式或它们的构象下造成显著地热稳定作用。较高倾向去糖基化的酶在热失活下聚集,表明糖基化也可以防止部分折叠或来自于聚合蛋白质的展开。牛科胰核糖核酸酶A和核糖核酸酶B区别仅在于连接核糖核酸酶B的Asn34部分的碳水化合物不同。这碳水化合物解释说明了核糖核酸酶B更高的动力学以及热力学稳定性。先进的碳水化合物部分的假说表明,稳定性的不同是由于在第一个糖单元连接到Asn34。 糖基化对热稳定性的影响两个杆菌β-葡聚糖酶在大肠杆菌和酿酒酵母的表达。这两个之一酶在70℃时,通过糖基化有强烈的动力学稳定性,其最佳动力学稳定活性温度更高。对热稳定水平比对糖基化的程度更依赖于碳水化合物部分在蛋白质中的位置。虽然在自然界中糖基化可能不是大众的热稳定方法,上述被引用的几个例子表明,对于酶的热稳定或是溶解,糖基化可能代表了一种替代方法。 翻译后赖氨酸甲基化(形成于 N-ε-单甲基赖氨酸)已经描述为许多硫化的蛋白。天然的小的来自的 S.嗜酸热的DNA结合蛋白Sac7d(单甲基化赖氨酸 Lys5和Lys7)在100℃下发生可逆地变性(pH为7.0)。该重组Sac7d在92.7℃下变性。天然和重组的Sac7d之间的Tm 7°C的区别已被归因于赖氨酸的甲基化,赖氨酸的甲基化不存在于重组蛋白之中。由于Sso7d的稳定性(在S.Sulfolobus中是Sac7d的同系物)是不依赖于甲基化的,赖氨酸的甲基化在Sulfolobales是否是一般的热稳定机制。[b]盐离子的稳定性[/b]无机盐稳定蛋白有两种方式:(ⅰ)通过特定的影响,其中,金属离子于一个构象方式的蛋白质相互作用(参见“金属键”),(ii)通过一般盐的影响,主要影响水活性。 Thauer以及他的同事研究了盐对热稳定性的影响以及5种如甲烷噬热菌产甲烷的酶的活性(36,37,181,224,225)。然而这5种酶通过盐被激活以及机械的被稳定,盐影响的程度是酶的依赖性。 K[sup]+[/sup]和NH[sup]4[/sup][sup]+[/sup]通常比其他阳离子更有效地稳定酶。所有的阴离子,SO4[sup]2[/sup][sup]-[/sup]和HPO4[sup]2[/sup][sup]-[/sup]有最强的激活效应。酶盐的要求并不总是由细胞内盐浓度满足。分枝如甲烷噬热菌细胞内的盐浓度(大于1M钾加1M的环状2,3-二磷酸甘油酸)似乎对MkCH活性有利(最大浓度为1.5M盐)在其稳定(最佳浓度低于0.1M盐)。盐对来自于如甲烷噬热菌,M.thermoautotrophicum, Archaeoglobus fulgidus以及Methanosarcinabarkeri的CHOtetrahydrormethanopterin(H4MPT)甲酰基转移酶的影响进行比较。通过盐在甲酰基转移酶活性的不同是与在不同的生物体细胞内cDPG浓度直接相关。通过盐按照MkFT的活性分析了MkFT的结构。两种功能被提出相关的性质:(一)在疏水性表面MkFT呈现出下降的趋势,以及亚基间的界面在很大程度上是疏水的 和(ii)四聚体表面呈现与24个基本过量的负电荷残基(48个残基)。酸性残基可以形成较强的氢键和多H键的水分子,确保这些残基与无机阳离子或水竞争。所有的残基中,谷氨酸具有结合水分子的最高容量。48个表面带负电荷的,33个是谷氨酸和15是天冬氨酸。高易溶的盐浓度被认为由于在负电荷残基表面增加的无机阳离子增加了表面离子作用,并且间由于盐析的影响提高了亚基疏水相互作用效果。MkFT寡聚物构象显示出了需要比磷酸钾更高的NaCl浓度(更强易溶的盐),表明在MkFT热稳定中盐析的影响起主导作用。这种蛋白质可能有演变为最佳地稳定性表现在高的胞内盐浓度中。 当在98℃时,如甲烷噬热菌细胞中含有约的1M cDPG。cDPG中的钾盐,2,3-DPG以及磷酸盐在激活如甲烷嗜热酶环化酶中同样有效。然而,在同等离子浓度cDPG比在稳定的MkFT中更有效。在如甲烷噬热菌中,cDPG浓度对MkCH和MkFT的活性以及稳定性是最佳的。合成CDPG需要4 分子ATP。在这个合成的最后反应是唯一一个能够放出足够的能量来驱使合成cDPG而非其前体2,3-DPG。此外,在pH=7.0,cDPG是三阴离子,而2,3-DPG是五阴离子 因此cDPG比2,3-DPG在离子强度方面有更小的影响。[color=#ff0000] [/color]M. fervidus[color=#ff0000] [/color]磷酸甘油醛脱氢酶(GAPDH)本质上动力学稳定仅达到75℃。通过盐来研究这种酶的热稳定性表明,相对于盐的效果—K[sub] 3[/sub] PO[sub] 4[/sub]Na[sub]3[/sub]PO[sub]4[/sub][sub] [/sub]K[sub]2[/sub]SO[sub]4[/sub]Na[sub]2[/sub]SO[sub]4[/sub]KCLNaCL—都与他们保持一致各自的能力以减少酶在水溶液中的溶解度。它们的盐析影响了他们活性的分布。 M. fervidus GAPDH可能由cDPG被稳定在体内,它以约为0.2〜 0.3M出现在生物体中。有趣的是,其他的M.fervidus酶是唯一依赖于低于生物体的最佳生长温度的以维持稳定,这表明在该生物体中通过盐的稳定性是共同的机制。 [b]压力的影响[/b] 因为许多高温环境同样也是高压环境并且因为微生物无法逃避压力和温度,所有的大分子细胞成分必须能适应高的压力。因此,并不奇怪的是找到极端嗜生物体也是嗜压微生物(如嗜热barophilus),并发现通过高压使这种酶被稳定以及被激活(例如,M。詹氏甲烷球菌的蛋白酶和氢化酶)。通过压力这种稳定性背后的理论说明压力有利于体积最小的结构。蛋白质主要通过疏水被稳定因此,预计在高呀下被稳定,而通过离子相互作用被稳定的蛋白质应该是不稳定的。例如,P.furiosus 红素氧还蛋白主要是由静电相互作用稳定。这种酶在高压力不稳定。由于许多化学反应在高温高压进行的,在高压下酶的稳定性可能很大程度上对生物催化作用有利。
云唐蛋白质检测仪是一种用于测定食品、生物样品等中蛋白质含量的仪器设备。它在食品科学、生物学、医学和生化等领域具有重要作用,以下是其主要作用: 食品质量控制: 在食品工业中,蛋白质是食品的主要组分之一,其含量影响着食品的口感、质地、营养价值等。蛋白质检测仪可以用于监测食品样品中的蛋白质含量,确保产品的质量稳定性和一致性。 生物学研究: 在生物学研究中,蛋白质是细胞功能和结构的重要组成部分。蛋白质检测仪可以帮助研究人员测定生物样品(如细胞提取物、血清等)中蛋白质含量,从而深入了解细胞的生物学特性和疾病机制。 医学诊断: 在临床医学中,某些疾病的发展可能会导致血清蛋白质含量的改变。蛋白质检测仪可以用于测定血液和尿液中的蛋白质含量,帮助医生进行疾病诊断和监测。 药物研发: 药物研发过程中,蛋白质的定量分析是评估药物效果的重要环节。蛋白质检测仪可以用于分析药物与蛋白质的相互作用,评估药物对蛋白质的影响。 生化实验: 在生化实验室中,蛋白质检测仪常用于定量测定蛋白质样品,用于分析实验数据和评估实验结果的可靠性。 环境监测: 在环境科学领域,蛋白质检测仪可以用于监测水体、土壤等环境中蛋白质的含量,从而评估环境质量。


