表面增强拉曼光谱监测肿瘤的光动力治疗
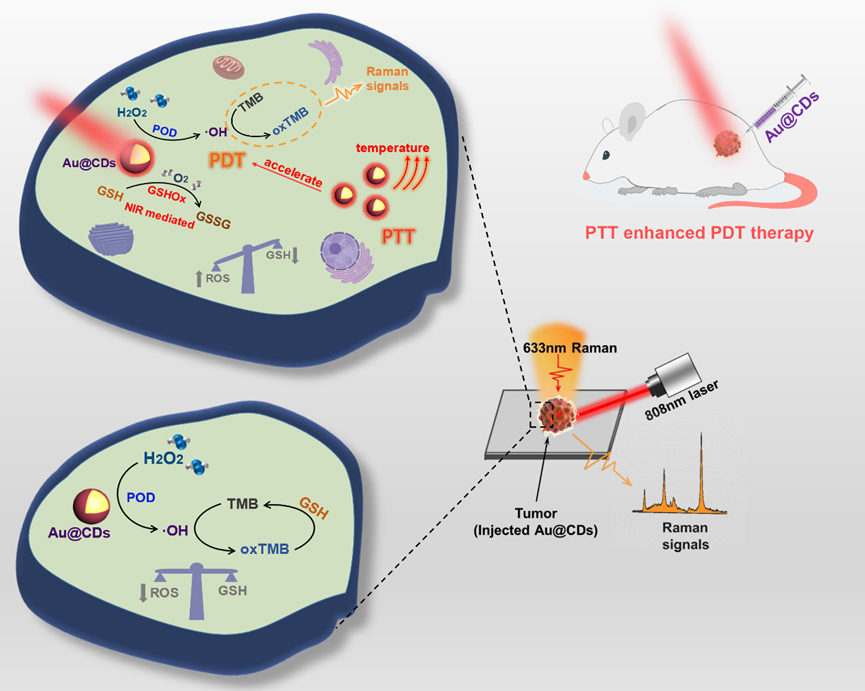
导读 细胞中的氧化还原平衡,是指氧化性物种和还原性物种之间的动态平衡,在大多数生理过程中发挥着至关重要的作用,尤其是细胞凋亡(名词解释)过程。通过提高肿瘤微环境 (名词解释)中活性氧(ROS)的浓度,打破氧化还原稳态,是介导癌细胞死亡,进而达到肿瘤治疗目的的有效手段。目前,基于纳米酶(名词解释)催化的一些新型化学动力治疗、光动力治疗方法被用于肿瘤治疗领域,旨在达到肿瘤细胞中原位催化产生ROS的效果。但是,大多数对于上述治疗的机理研究仍然只停留于纳米酶级联催化反应的结果,无法做到对整个治疗过程的监测。表面增强拉曼光谱(SERS)(名词解释)作为一种快速、无损的测试技术,其灵敏度甚至可以达到单分子级,在监测细胞内相关生化反应方面具有巨大潜力。将SERS技术应用于上述肿瘤的光动力治疗过程的监测,不仅能帮助进一步理解纳米酶催化过程的具体机制,更能得到肿瘤微环境中氧化还原状态的具体信息。研究亮点 近日,吉林大学宋薇教授、刘卓副教授和赵冰教授团队将一种金/碳量子点(Au@CDs)复合材料级联纳米酶用于对肿瘤细胞的光动力治疗,并且采用SERS技术监测了整个光动力治疗过程中肿瘤微环境内氧化还原平衡的打破与再修复过程。该成果以“SERS monitoring of photoinduced-enhanced oxidative stress amplifier on Au@carbon dots for tumor catalytic therapy”为题发表在Light: Science & Applications,吉林大学博士研究生李林甲为第一作者,宋薇教授、刘卓副教授和赵冰教授为论文共同通讯作者。该研究工作得到了国家自然科学基金,吉林省教育厅科技研究计划等项目的支持。研究人员首先以CDs作为模板剂和封端剂设计构筑了一种具有级联模拟酶活性的核壳结构Au@CDs材料,相比于单独的金纳米粒子,CDs外壳避免了Au核的聚集,并提供了致密且均匀的SERS热点。在808 nm近红外光激发下,Au@CDs表现出近红外光致增强的类过氧化物(POD)酶和近红外光诱导的类谷胱甘肽氧化酶(GSHOx)活性:即在近红外光照射下,表面等离子体共振(SPR)激发的大量热载流子可以有效地参与反应,金纳米粒子典型的等离子体光热效应可以增强POD活性;另外Au@CDs介导谷胱甘肽(GSH)参与反应,加速ROS的生成,呈现出光热增强的光动力治疗效果。这种级联纳米酶催化过程将迅速打破肿瘤细胞内的氧化还原稳态,产生大量ROS,最终导致癌细胞凋亡。图1 Au@CDs的级联纳米酶催化机制及其光热增强的光动力治疗肿瘤过程。为了监控这一催化过程,研究人员利用SERS技术,通过对四甲基联苯胺(TMB)底物分子的氧化产物的识别,实现了对光动力治疗肿瘤过程中,肿瘤微环境内活性氧动态变化过程的监控。即在近红外激光的辐照下,肿瘤细胞内活性氧水平会随着Au@CDs催化反应的开始而迅速上升,在很短的时间内(3min)即达到拉曼信号的峰值,实现氧化应激损伤效果;而激光辐照结束后,肿瘤微环境则会在一个相对较长的时间(33 min)进行自修复,即过表达的GSH等还原性物质消耗过量ROS的抗氧化过程,最终肿瘤微环境回到氧化还原平衡态。图2 (a-c)光动力治疗肿瘤过程中拉曼信号的变化及(d-e)对应的肿瘤微环境内氧化还原平衡的打破和再修复过程。总结与展望 Au@CDs级联纳米酶与传统的纳米药物和免疫治疗剂相比,具有通过级联反应中的光热性质促进光动力治疗效果的优点,能快速提高肿瘤内ROS的浓度,打破氧化还原稳态,进而达到肿瘤治疗目的,由于过表达的GSH等还原性物质消耗过量ROS,抑制了ROS向细胞外扩散。通过SERS策略,获得了光动力治疗过程中完整的氧化应激过程,对基于肿瘤微环境氧化应激损伤的光疗机制进行了深入的研究,为肿瘤光动力治疗的实时监测提供了最有价值的机制和数据支持。论文信息 Li, L., Yang, J., Wei, J. et al. SERS monitoring of photoinduced-enhanced oxidative stress amplifier on Au@carbon dots for tumor catalytic therapy. Light Sci Appl 11, 286 (2022).https://doi.org/10.1038/s41377-022-00968-5
 400-629-8889
400-629-8889
 留言咨询
留言咨询

 400-628-5299
400-628-5299
 留言咨询
留言咨询

 留言咨询
留言咨询