推荐厂家
暂无
暂无




 400-801-9298
400-801-9298
 留言咨询
留言咨询
 400-858-8867
400-858-8867
 留言咨询
留言咨询

 400-801-5960
400-801-5960
 留言咨询
留言咨询



10,抽取5个版友);幸运奖5名(2钻石币)zengzhengce163(注册ID:zengzhengce163)千层峰(注册ID:jxyan)翠湖园(注册ID:hhx050)馨语(注册ID:huangdm)dyd3183621(注册ID:dyd3183621)【注意事项】同样的答案,每人只能发一次PS:该贴浏览权限为“回贴仅作者和自己可见”,回复的版友仅能看到版主的题目及自己的回答内容,无法看到其他版友的回复内容。下午3点之后解除,即可看到正确答案、获奖情况及所有版友的回复内容。=======================================================================酒石酸美托洛尔片的检测方法:HPLC基质:动物提取物应用编号:101462化合物:酒石酸美托洛尔固定相:Platisil ODS色谱柱/前处理小柱:Platisil ODS 5u 150 x 4.6 mm样品前处理:【有关物质】 取本品细粉适量(约相当于酒石酸美托洛尔50 mg),精密称定,置25 ml量瓶中,加流动相是两,超声处理30min使酒石酸美托洛尔溶解,放冷,用流动相稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液;精密量取适量,用流动相定量稀释制成每1 ml中含酒石酸美托洛尔10 ug的溶液,作为对照溶液。 【含量测定】 取本品20片,精密称定,研细,精密称取适量(约相当于酒石酸美托洛尔60 mg),置200 ml量瓶中,加流动相适量,超声处理30min使酒石酸美托洛尔溶解,放冷,用流动相稀释至刻度,摇匀,滤过,测定。色谱条件:检测波长:UV 280 nm(有关物质) UV 275 nm(含量测定) 流动相:醋酸盐缓冲液(取醋酸铵3.9 g,加水810 ml溶解,加三乙胺2.0 ml,冰醋酸10.0 ml,磷酸3.0 ml,摇匀)-乙腈(824:146) 洗脱方式:等度 流速:2.0 ml/min 柱温:30 ℃ 进样量:20 ul文章出处:P864关键字:酒石酸美托洛尔,酒石酸美托洛尔片,2010版中国药典,HPLC,含量测定、有关物质,铂金,Platisil ODS谱图:含量测定样品色谱图http://www.dikma.com.cn/Public/Uploads/images/jiushisuanmeituoluoer.GIF有关物质http://www.dikma.com.cn/Public/Uploads/images/jiushisuanmeituoluoer-dz.GIFhttp://www.dikma.com.cn/Public/Uploads/images/jiushisuanmeituoluoer-gs.GIF图例:1. 酒石酸美托洛尔
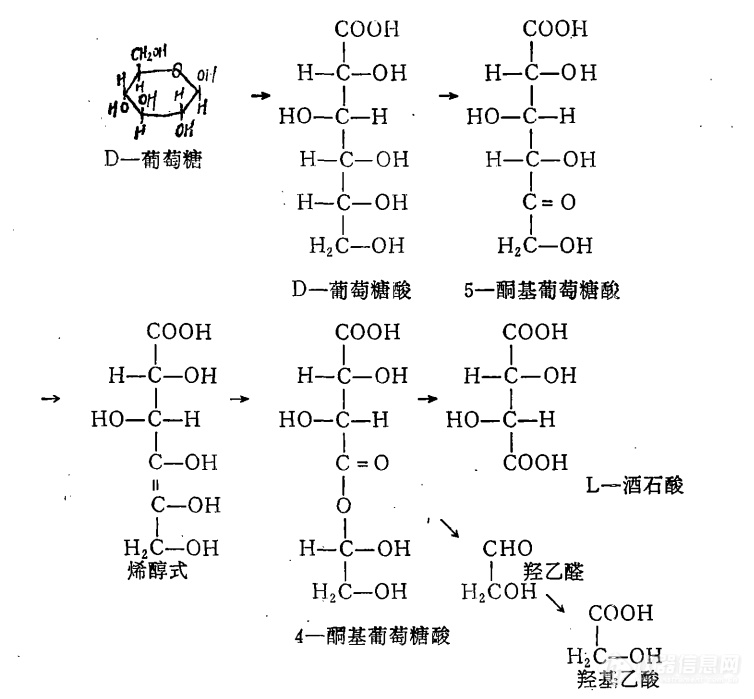
闫丽洁[align=center]关于食品添加剂L(+)-酒石酸的研究[/align]摘要:[size=13px]L(+)-酒石酸是一种天然有机酸,它的酸味值约是柠檬酸的1.25倍,可用于清凉饮料,它和柠檬酸、氧化亚铁产生鲜绿色作为食用色素用于糕点。本文主要介绍了L(+)-酒石酸的检测方法及生产方法。[/size]关键词:[size=13px]L(+)-酒石酸,检测,生产[/size]1 引言L(+)-酒石酸广泛存在与自然界的多种植物果实中,其中成熟葡萄中L-酒石酸含量较多。L-酒石酸时一种用途非常广泛的天然有机酸,主要作为食品添加剂和医药拆分剂应用于食品、医药和化学工业等领域,据报道,L-酒石酸还可以用于纳米材料的制备及作为染料经济性改性剂和抗磨剂。2 L(+)-酒石酸简介2.1 L(+)-酒石酸基本结构L(+)-酒石酸又称为L(+)-2,3-二羟基丁二酸,分子式是C4H6O6,结构简式HOOCCH(OH)CH(OH)COOH。有两个不对称的碳原子,有3个立体异构体,即:右旋型(D型,L型)、左旋型(L型,D型)、内消旋型。通常,外消旋型酒石酸又称为葡萄酸。右旋型酒石酸以游离的或K盐、 Ca盐、Mg盐的形态广泛分布于高等植物中,特别是多存在与果实和叶中。2.2 L(+)-酒石酸的发现酒石酸氢钾存在与葡萄汁中,此盐难溶于水和乙醇,在普通纸酿酒过程中沉淀析出,成为酒石,酒石酸的名称由此得来。在制造葡萄酒时,会沉积大量酒石(氢钾盐)。另外,在霉菌和地衣类中也常见到它的存在。分离到的酒石酸发酵细菌,在体内是通过葡萄糖氧化分解,经由5-酮葡萄糖酸,在形成羟基乙酸的同时形成酒石酸。酒石酸铵受微生物作用,可编程琥珀酸。因此,工业中用酒石酸作为生产琥珀酸的原料。酒石酸主要以钾盐的形式存在于多种植物和果实中,也有少量是以游离态存在的。L(+)-酒石酸在某些植物果实如葡萄、罗望子果等中有较高的含量。1769年舍勒首次从葡萄汁的发酵液内得到游离的无色酒石酸结晶。它的各种立体异构体和外消旋体具有不同的物性。自然界存在的多为右旋体,葡萄汁和其他浆果汁中尤多,故又叫果酸。如用丁烯二酸控制氧化得到的是外消旋体。将上述反应过程中产生的酒石以石灰乳处理生成酒石酸钙,再酸化则得内消旋体。酒石酸盐在历史上对建立有机立体化学起了作用。1848年法国化学家巴斯德从事酒石酸钠铵结晶学研究工作时,看到一种前人未曾注意的有趣现象:无旋光性的酒石酸钠铵是由二种不同结晶组成的混合物,它们的外形互为Chemicalbook镜像关系,实际上是外消旋体。他用放大镜和镊子将混合物细心分成小堆。一堆是右旋体晶体,一堆是左旋体晶体,它们犹如一堆是右手套,一堆是左手套。两堆晶体溶于水都有旋光性。他首次发现了分子的立体异构和旋光的关系,提出了对映异构概念,为有机立体化学的发展奠定了基础。酒石酸常用于制药物、媒染剂和鞣剂等,也常用作拆分外消旋碱性化合物的试剂。它也是食品添加剂中的酸味剂,酸感优于苹果酸、乳酸等。它的几种盐都有重要应用,例如实验室中用酒石酸钾钠配制斐林试剂,用于鉴定有机分子结构中醛基官能团。它的钾钠盐又叫罗谢尔盐,其晶体在压力作用下发生极化而使两端表面产生电势差(压电效应),借此可以制成压电元件,用于无线电和有线电广播的受话器和拾音器。医疗上将酒石酸锑钾(俗称吐酒石)用于治疗血吸虫病。2.2 L(+)-酒石酸的理化性质外观为无色半透明晶体或白色细至粗结晶粉末,有酸味,熔点为170-172°C,比旋光度12°(c=20,H2O),沸点191.56°C,密度1.76,蒸汽密度5.18,蒸气压 5Pa(20°C),折射率12.5°(c=5,H2O),在室温下进行储存,溶解度1M(20℃)无色溶液。毒性:小鼠经口LD50为4.36 g/kg ;ADI 0~30 mg/kg(酒石酸及其盐类)。3 L(+)-酒石酸的检测3.1 国标检测3.1.1 范围本标准适用于以顺丁烯二酸酐和过氧化氢为原料经氧化、酶法水解而制得的食品添加剂L(+)-酒石酸。3.1.2 检测方法以酚酞为指示剂,用氢氧化钠标准滴定溶液滴定干燥试样的水溶液,根据氢氧化钠标准滴定溶液的用量,计算以C4H6O6计的总酸含量为L(+)-酒石酸含量。3.1.3 试剂和材料氢氧化钠标准滴定溶液:c (NaOH) = 1.0 mol / L酚酞指示剂:10 g / L3.1.4 分析步骤称取2.0 g 干燥样,精确至0.0002 g,加40 mL 无二氧化碳的水溶液,加2滴酚酞指示剂,用氢氧化钠标准滴定溶液滴定至微红色,保持30 s 不褪色为终点。在测定的同时,按与测定相同的步骤,对不加试样而使用相同数量的试剂溶液做空白试验。3.1.5 数据计算L(+)-酒石酸(以C4H6O6计,以干量计)的质量分数ω1,数值以 % 表示,按式1计算: ——————————式1式中:V——试料消耗氢氧化钠标准滴定溶液体积的数值,单位为毫升(mL);V0——空白试验消耗氢氧化钠标准滴定溶液体积的数值,单位为毫升(mL);c——氢氧化钠标准滴定溶液浓度的准确数值,单位为摩尔每升(mol/L);m——试料质量的数值,单位为克(g);M——酒石酸(1/2 C4H6O6)的摩尔质量的数值,单位为克每摩尔(g/mol)(M=75.04).取两次清醒测定结果的算术平均值为报告结果。两次平均测定结果的绝对差值不大于0.2 % 。3.2 高效液相色谱3.2.1 检测原理采用高效液相色谱分析测定酒石酸的含量以及与标准酒石酸的分析对比,高效液相色谱分析法是主要具有高压、高速、高效、高灵敏度等特点,对试样进行分析测定。流动相与固定相都是液体,流动相与固定相之间应互不相溶(极性不同,避免固定相流失),有一个明显的分界面。当试样进入色谱柱,[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]在两相间进行分配。达到平衡时,服从于高效液相色谱计算公式:式中,Cs——[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]在固定相中的浓度; Cm——[url=https://insevent.instrument.com.cn/t/Yp][color=#3333ff]液质[/color][/url]在流动相中的浓度; Vs——固定相的体积; Vm——流动相的体积。3.2.2 试剂和仪器试剂:80%乙醇,酒石酸,磷酸二氢铵均为分析纯,实验用水均为二次蒸馏水。仪器:高效液相色谱仪C18色谱柱(250*4.60nm)3.2.3 色谱条件固定相为Phencmenex luna 5μm C18 色谱柱(250*4.60nm),流动相为 0.01 mol/L(NH4)2HPO4溶液,流速1mLmin-1,检测波长为210 nm,柱温为30℃。3.2.4 分析步骤精确称取酒石酸标准品0.25 g,置于烧杯中用二次蒸馏水完全溶解,转移至100 mL容量瓶中加二次蒸馏水稀释并定容,然后用移液管移取分别稀释成2.5 μgmL-1、2.0 μgmL-1、1.5 μgmL-1、1.0 μgmL-1、0.8 μgmL-1 等不同质量浓度的标准品,并用0.45 μm的滤膜过滤,然后超声处理。采用电子天平准确称取1.3206 g (NH4)2HPO4 晶体,于小烧杯中加入二次蒸馏水完全溶解,然后转移到1000 mL容量瓶中稀释并定容至刻度线,最后用0.45 μm的滤膜过滤,超声15 min处理作为流动相。3.2.5 数据处理依次对不同浓度的标准品进行色谱分析,并拟合标准曲线,对样品进行色谱分析,并进行定量计算。3.2.6 方法优点色谱分析法检测线性范围宽,具有操作简便,快捷,选择性好等优点。4 L(+)-酒石酸的生产4.1 L(+)-酒石酸的生产方法一个方法是,以制造葡萄酒时生成的酒石为原料,将其转化为钙盐,再用稍过量的稀酸使其分解而得。或以顺丁烯二酸和过氧化氢为原料,在一定温度下转化为环氧丁二酸,再水解得D L-酒石酸。也可由化学合成法制得的环氧琥珀酸,经琥珀酸诺卡氏菌所含的开环酶的作用而得L(+)酒石酸。另一个方法是,将蒸馏水加到工业品酒石酸中,通蒸气加热并搅拌使之溶解。加入适量活性炭,充分搅拌后静置,过滤,滤液加热浓缩至表面结膜时,趁热抽滤,滤液冷却结晶,待完全后,结晶用少量蒸馏水洗淋后于30~40℃下平铺干燥至不沾勺即可。若控制活性炭脱色温度为80℃,过滤后于80℃减压浓缩,冷却结晶,将得到的结晶在非铁质容器中重结晶精制低温下烘干,可得右旋酒石酸 [ L(+)-酒石酸 ] 成品。4.2 酒石酸的生物合成途径酒石酸的生物合成途径如图1所示:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/07/202107251428084146_7015_1608728_3.png[/img][/align][align=center]图1 酒石酸的生物合成途径[/align]直接发酵法生产酒石酸异性物质多,提取困难,收率低,经济上目前还没有吸引力。4.3 酶法生产L-酒石酸1974年佐藤英次等人首先报道了采用Achromobater lartarogenes 和Alcaligenes epoxylyticus 水解顺式环氧琥珀酸生产L-酒石酸的前体发酵,过程如图二所示:[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/07/202107251428086957_2391_1608728_3.png[/img][/align][align=center]图2 酒石酸生产[/align]以无水马来酸(顺丁烯二酸酐)为原料经水解得到马来酸,再以钨酸钠(Sodium tungstate)作为催化剂将马来酸与过氧化氢反应制得顺式环氧琥珀酸。培养具有L-酒石酸外氧化酶的微生物作酶源将顺式环氧琥珀酸转化为酒石酸。具有L-酒石酸外氧化酶的微生物主要是细菌,目前报道的有无色杆菌、产碱杆菌、醋酸杆菌、不动杆菌、土壤杆菌、诺卡氏菌、根瘤菌、假单胞菌和棒杆菌。酒石酸外氧化酶是一种诱导酶,在培养这类微生物生产酒石酸时通常在培养基中需加入少量顺式环氧琥珀酸进行诱导培养。这种酶的分子量在25000~45000之间,在pH5~9范围内稳定,最适pH 为7.5~8.5,作用温度范围为25~55℃。酶法生产L-酒石酸的工艺流程大致如图3 :[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/07/202107251428088052_2948_1608728_3.png[/img][/align][align=center]图3 酶法工艺流程图[/align]4.4 棒状杆菌固定化细胞生产L-酒石酸采用卡拉胶将含环氧琥珀酸水解酶的诺卡氏菌细胞包埋固定,利用固定化细胞转化底物环氧琥珀酸生成L-(+)-酒石酸,以将环氧琥珀酸水解酶反复多次使用。采用卡拉胶作为载体制得固定化微生物细胞生产L-酒石酸,这种方法具有较高的酶活性回收率和良好的化学和机械稳定性。固定化细胞经过底物活化处理后顺式环氧琥珀酸水解酶酶活性回收率在100%以上。另外此固定化细胞的贮藏稳定性较好,经0.2 molL-1底物溶液浸泡,在4℃冰箱中贮藏90d酶活性基本不变。底物和表面活性剂能大幅度提高固定化细胞的酶活性回收率,这主要是增加了细胞膜对底物的渗透性或造成菌体的自溶,当菌体自溶时,酶被截留在凝胶腔内,不会由凝胶溢出,而底物和产物则易由凝胶网溢出,维持了固定化细胞较高的稳定性。4.5 糖质发酵法[color=#333333]制造L-(+)-酒石酸[/color]在L-酒石酸的生物代谢途径中,认为葡萄糖经过Gluconobater suboxydans 发酵形成葡萄糖酸,继而氧化为2-酮基-D-葡萄糖酸(2-KGA)和5酮基-D-葡萄糖酸(5-KGA),5-KGA在金属催化剂的作用下,可以形成羟基乙酸和L-酒石酸。1972年,Kotera等在研究5-KGA转化为L-酒石酸的过程中,发现了一种能与AbdelAkhel和Smith试剂形成紫红色的物质,并对这种物质进行了分离纯化,通过红外光谱及质谱分析,证实该物质为1,2-二羟乙基氢酒石酸,并命名为“前酒石酸”,同时提出了相关机理如图4,5-KGA通过烯醇化,转化为4-KGA,再形成“前酒石酸”。通过该物质的过渡,5-KGA被催化分解为L-酒石酸和羟基乙酸。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/07/202107251428090793_95_1608728_3.png[/img][/align][align=center]图4 L-酒石酸形成机理[/align]1995年,Klasen等认为5-KGA主要在氧化葡萄糖酸杆菌的细胞质中合成,并在G.oxydans DSM3503中过表达了依赖NADP的GNO,该酶在细胞质中催化葡萄糖酸形成5-KGA,最终酶活提高了85倍;1999年,Shinagawa等通过对G.suboxydans IFO12528静息细胞培养和膜结合部分催化实验发现,5-KGA的形成主要是膜结合蛋白PQQ-依赖的葡萄糖酸脱氢酶,并考察了该酶翠花形成5-KGA的最适pH 为4.0和温度15℃,在此条件下,膜结合蛋白部分催化转化形成5-KGA为110 mmol/L ;因此,在氧化葡萄糖酸杆菌中,酮基葡萄糖酸催化合成途径如图5所示,PQQ-依赖的葡萄糖酸脱氢酶是主要的5-KGA合成酶,而FAD-依赖的葡萄糖酸脱氢酶是合成2-KGA的主要酶,从代谢流上分析为5-KGA的主要分流节点。[align=center][img]https://ng1.17img.cn/bbsfiles/images/2021/07/202107251428091768_3741_1608728_3.png[/img][/align][align=center]图5 氧化葡萄糖酸杆菌中酮基葡萄糖酸的催化反应[/align]糖质发酵法生物制造L-酒石酸因利用可再生生物质资源而日益备受关注。但是,要提高其相对于酶法合成L-酒石酸的竞争力,就必须使用现代生物技术,包括分子生物学、代谢工程以及合成生物学等手段,提高L-酒石酸的前体——5-KGA的发酵水平以及5-KGA到L-酒石酸的转化水平。5 用途及应用5.1 食品添加剂方面首先,L(+)-酒石酸广泛用作饮料和其他食品的酸味剂,用于葡萄酒、软饮料、糖果、面包、某些胶状甜食。其次,可以作为食品中添加的抗氧化剂﹐可以使食物具有酸味。酒石酸最大的用途是饮料添加剂。5.2 药物方面利用其光学活性,作为化学拆分剂,用于制造抗结核病药物中间体DL-氨基丁醇的拆分;还可以作为手性原料用于酒石酸衍生物的合成;利用其络合性,用作电镀、脱硫、酸洗以及化学分析、医药检验中的络合剂、掩蔽剂、螯合剂、印染的防染剂;也是药物工业原料。5.3 工业方面利用其酸性,作为涤纶织物树Chemicalbook脂整理的催化剂,谷维素生产的PH调节剂;利用其还原性,用作化学制镜的还原剂。照相的显影剂。还能与多种金属离子络合,可作金属表面的清洗剂和抛光剂;在制镜工业中,酒石酸是一个重要的助剂和还原剂,可以控制银镜的形成速度,获得非常均一的镀层;金属离子掩蔽剂;防染剂;用于天然产物的手性砌块,也与化合物 TiCl2(O-i-Pr)2形成Diels-Alder 催化剂。最后,可用作生化试剂、掩蔽剂及啤酒发泡剂,也用于鞣革工业。6 结语L(+)-酒石酸是天然的有机酸,应用十分广泛,在食品、医药、纳米材料等各个方面具有显著的应用,L(+)-酒石酸的检测方法主要有滴定法、液相色谱法等。以前L(+)-酒石酸主要从葡萄酒酿造的副产物酒石中提取,但由于酒石供应量有限,来源不稳定,近年来采用化学合成和生物转化相结合的方法来生产L(+)-酒石酸。7 参考文献袁建锋,吴绵斌,林建平,岑沛霖.基于5-酮基-D-葡萄糖酸生物制造L-(+)-酒石酸的研究进展[J].现代化工,2013,33(09):13-16.张建国,黄滕华.微生物转化法生产L-(+)-酒石酸的研究[J].工业微生物,1990,2(2):7-12.刘斌,须辑.半生物合成法合成酒石酸[J].化学世界,1996,8(10):527-531.[color=black]郑璞,孙志浩.用诺卡氏菌酶法转化顺式环氧琥珀酸生产L(+)-酒石酸的研究[/color][J].化工业微生物,1994,3(24):12-17.张建国,钱亚娟.棒状杆菌固定化细胞生产L(+)-酒石酸[J].生物工程学报,2000(02):72-76.万屹东, 蒋志清, 顾松林,等. 一种L(+)酒石酸的生产方法:, CN102093208B[P]. 2015.楼锦芳, 张建国. 酶法合成L(+)-酒石酸的研究进展[J]. 食品科技, 2006, 31(011):162-164.杨阳, 李文鹏, 陆鲁生,等. L(+)-酒石酸发酵法生产工艺改进的研究[J]. 生物工程学报, 2001, 17(3):345-348.柯昌武, 蔡水洪, 叶勤. 卡拉胶固定化Nocardia sp.生产L(+)酒石酸[J]. 华东理工大学学报(自然科学版), 2006.Yamada K. Kodama T. Obata T, et al.Microbial formation tartaric acid from glucose 1 Isolation and identification tartaric acid producing microorganisms[J].Journal of Fermentation Technology, 1971. 49 (2) :85-89.Kotera U, Kodama T, Yamada к, et al.Microbial formation of tartaric acid from glucose 5 lsolation and chemical structure of new oxidation product of 5-ketogluconic acid, and a hypothetical pathway from glucose !o tararic acid through this new compound[J]Agricultural and Biological Chemistry. 1972. 36 (8) 1315-1325.Klasen R. Bringerneyer s, Sahm H.Biochemical characterization and sequence analysis of the gluconate-NADP 5-oxidoreductase gene from Gluconobacter oxydans[J].Journal of Bacteriology, 1995, 177 (10) :2637-2543.Shinagawa E, Matsushita K, Toyama H, et al.Production of 5-ketod-gluconate by acetic acid bacteria iscatalyzed by pyrroloquinoline quinone (PQQ) -dependent membrane-bound d-gluconate dehydrogenase[J].Journal of Molecular Catalysis B:Enzymatic, 1999, 6 (3) :341-350.
如题,这两个是同一个试剂吗,土壤总磷HJ632-2011标准上要酒石酸锑氧钾,可找不到这个名字药品,


