推荐厂家
暂无
暂无
 400-860-5168转2473
400-860-5168转2473
 留言咨询
留言咨询
 留言咨询
留言咨询
 留言咨询
留言咨询
 400-860-5168转1345
400-860-5168转1345
 留言咨询
留言咨询

 留言咨询
留言咨询
 400-860-5168转2809
400-860-5168转2809
 留言咨询
留言咨询




中科院昆明动物所在张亚平院士带领下,该所彭旻晟、贺军栋、樊隆等人开发出针对DNA芯片数据中Y染色体单核苷酸多态性位点的分析策略。相关研究11月27日在线发表于《欧洲人类遗传学》。 随着全基因组关联分析广泛应用于人类遗传学工作之中,相关的DNA芯片(微阵列)也不断得到发展。许多Y染色体单核苷酸多态性位点(Y-SNPs)已被整合在DNA芯片中。然而,这些Y-SNPs数据在全基因组关联分析中都被弃之不顾,没有进行任何评估分析。 为此,研究人员运用开发的分析策略对来自114个缅甸人和3个尼日利亚人共117份男性样本DNA芯片数据中的2041个Y-SNPs进行了评估分析。基于数据过滤后提取出的369个Y-SNPs,研究人员构建了Y染色体单倍型类群树,解析出缅甸人群的父系遗传结构。 该结果得到基因分型实验和Y染色体重测序数据的支持,表明该策略切实可行。研究人员对分析中的数据格式转换、过滤和注释处理后发现,DNA芯片对Y-SNPs的检测灵敏度和准确性依旧有待提高,例如:芯片厂商可依据Y染色体重测序数据重新选择合适的Y-SNPs并设计相关探针。
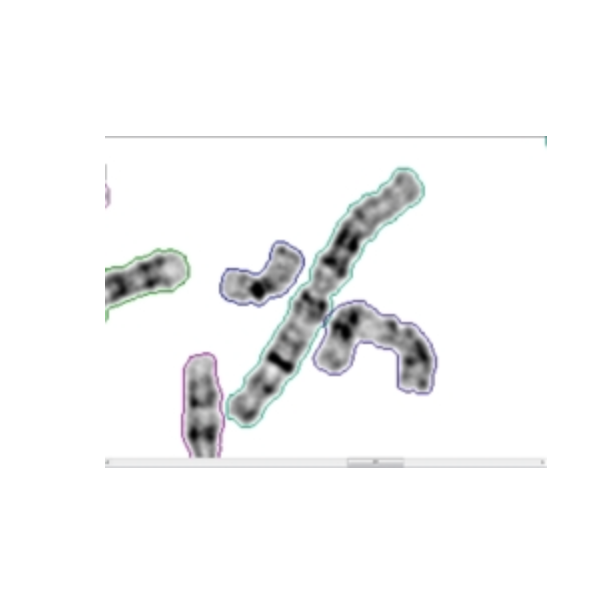
目前,我国试管婴儿技术的成功率平均仅为50%多,最大瓶颈就在于产前染色体异常的筛查。记者昨日获悉,今年3月成立的染色体芯片产前诊断联合实验室(CMA),利用针对中国人群定制的染色体芯片,能够检测出在常规染色体检测中显微镜下无法识别的基因缺陷,可筛查出200多种已知的染色体微缺失或微重复引起的疾病。这一技术不仅可通过产前诊断达到优生目的、降低流产率,而且将会使试管婴儿的成功率整体提高两成达70%,尤其是将会使高龄女性做试管婴儿的成功率提高五成。http://www.ibioo.com/data/attachment/portal/201308/25/094237zntmsn8tmz7tzmit.jpg技术:染色体芯片技术可查缺陷基因据广州医科大学附属第三医院广东省产科重大疾病重点实验室主任、广州妇产科研究所副所长孙筱放教授介绍,随着强制婚检的取消,近年来新生儿出生缺陷率明显升高。目前已知的出生时严重出生缺陷婴儿染色体异常的比率只有10%。而国外学者通过高通量、高分辨率的染色体芯片技术研究发现,大量以前无法确定遗传改变的出生缺陷,实际上都是由常规染色体检查显微镜下无法识别的基因组微缺失和微重复引起的。“正是这个原因,我们与香港中文大学成立了染色体芯片产前诊断联合实验室。”她说,“我们现在已经可以检测出200多种已知的染色体微缺失或微重复引起的各种疾病。我们还可以结合DNA测序技术对已知各种单基因疾病进行诊断。这项技术在全国范围内都属于领先的。”故事1:十次试管婴儿都失败来自湖北的阿丹和阿强(均为化名)结婚十年来一直没有怀上孩子,两人为此焦虑不已。近年来,求子心切的他们居然连续做了十次试管婴儿,但都以失败而告终。每次将胚胎植入之后,他们都满怀希望地等待,但无一例外,没有一次能够怀到“瓜熟蒂落”。漫长的求子之路,让他们身心俱疲。尤其是阿丹,经历了十次“煎熬”之后,精神“几近崩溃”,身体也经受了太多的损伤。他们为什么总不成功?他们还有希望吗?他们抱着最后一线希望来到广医三院。专家解读:植入前做检测 妊娠率可达80%“对于做试管婴儿的夫妻来说,压力之大非外人所能想象,尤其是做了几次不成功的夫妻。”广州医科大学附属第三医院生殖医学中心主任刘见桥教授介绍,“在传统的技术中,胚胎植入前遗传学诊断只能检测少数几条染色体是否异常。但事实上,每一条染色体都有可能发现异常,只是以前很多其他的染色体异常没有筛查出来,所以即使不健康的胚胎也会被植入。”刘见桥说,目前,该院与美国休斯敦生殖医学中心合作,率先开展了利用染色体芯片技术对植入前胚胎筛查,可以检测全部染色体组的异常数目。“通过这种筛选的胚胎,妊娠率可提高到80%。”“目前我们可以做到的是,在胚胎植入前就可以对全部染色体组进行检测,然后进行筛查,再把健康的胚胎植入体内。”刘见桥说,无论是什么年龄阶段的女性,最后的成功率都可达70%,这就大大减少对女性身心的伤害,也为患者免去了许多不必要的经济损失,尤其是对于高龄女性而言,成功率更提高了五成。故事2:孕妈担心再生先心娃今年30岁的周洁(化名)怀孕20周了,然而,新生命并未给她带来多少喜悦,相反,更多的是忐忑和纠结。原因就是她曾经生育过一个患有一种先天性心脏畸形而且面部发育也不正常的女儿。第二个孩子会不会也出现畸形呢?这个胎儿究竟是去还是留呢?周洁来到广医三院的生殖医学中心,医生抽了她患病的女儿外周血和腹中胎儿的羊水分别进行染色体芯片检查。结果发现她女儿的3号染色体有一段较长的微重复,正是这一重复区域,导致了她的先天性疾病。而她腹中胎儿的染色体芯片结果并没有跟她女儿相同的变异区域,说明胎儿再患这种先天性心脏畸形的概率较低。目前,她腹中的胎儿的确也发育良好,未见明显畸形。她终于可以放心地把孩子怀下去了。专家解读:可对比染色体差异并作去留判断“在常规的染色体检测中,一般只是显微镜下识别基因缺陷,有很多缺陷是无法识别的。”广医三院妇产科研究所实验部副主任、CMA实验室负责人范勇介绍,而使用该院正在使用的染色体芯片,不仅能够检测和比较患儿和胎儿的染色体差异,更重要的是,通过结果分析,可能对胎儿的去留作出准确的判断,消除了妊娠者及其家属的顾虑。“染色体芯片技术与传统染色体分析技术相比,具有集高通量和高分辨率的优势,目前已被加拿大遗传学会、欧洲遗传学会和美国遗传学会推荐作为遗传学诊断的首选手段。”范勇说,染色体芯片分析还可以进一步地检测患者双亲,以明确某一类的先天性缺陷的致病变异来源。“这对于指导患者再次怀孕具有很重大的临床意义。”范勇说,实验室成立三个月以来,已为230多名孕妇进行了该项技术检查,确诊十余例染色体结构异常胎儿。
俗话说,每一个伟大的男人背后,都有一个伟大的女人。每一个精子的背后,也有一个X染色体在起作用。在人体中,Y染色体决定人的性别为男性,因此许多研究人员认为:男性发育过程中负责决定性别的相关基因都位于Y染色体上。但是现在有一个科研团队发现,X染色体(“女性染色体”)也可以在此过程中发挥重要的作用。X染色体包含了决定成为精子形成的大量的基因。这一发现改变了我们对性别形成的固有想法,至少在某种程度上X染色体在进化过程中扮演一个令人意外的角色。哺乳动物有一对性染色体。女性的X染色体有两个拷贝,男性有一个拷贝,与Y染色体形成对。而人体只需要X染色体一个拷贝发挥作用,所以在女性体内,第二个拷贝是被“关闭”的。约50年前,遗传学家Susumu Ohno提出,这样的关闭作用减缓了X染色体的进化进程,所以大多数哺乳动物中的X染色体都非常相似。剑桥大学怀特海德生物医学研究所的遗传学家David Page研究了经过80亿年的进化后,上述说法是否在老鼠和人类之间成立,Page和同事得到的研究结果发表在近日的 Nature Genetics杂志上。虽然这两个物种的基因组已经被解码,但这些DNA序列还存在一些缺陷和错误,特别是X染色体的缺陷和错误首先需要被填充和修复。Page的研究团队使用一个特殊的测序技术确定了缺口处的DNA碱基序列,这里包含很多的重复的DNA区域,而此前用现有的技术通过一次测序很难破译这些重复区域。然后,研究人员比较了小鼠和人类的X染色体基因。这两个物种的X染色体共同拥有800个左右的基因,这些共享基因,通常是是男性和女性相对稳定的基因,并且它们以单拷贝的形式存在。这些基因上发生的突变,能引发X-连锁隐性遗传病,例如血友病和杜氏肌营养不良症。与此同时,研究团队也发现了相较前人研究该染色体与众不同的、令人迷惑的一面。人类有144个X染色体基因是小鼠所没有的,而有197个基因是个小鼠基因是特有的。人类的144个基因中,有107个存在于X染色体重复序列中,这些基因的变化较为迅速。基于这样的证据,Page得出结论,在人类和老鼠祖先产生分离的时候,这些基因分化就出现了。“对于人类X染色体和老鼠X染色体上存在如此大量的非共享基因,我感到非常惊讶,” 密歇根大学的进化遗传学家Jianzhi Zhang说。这一发现表明,X染色体上基因可能随时都在变化。基因改变时,就会影响进化,Page认为X染色体基因效用可能是特别强劲的。例如,一些先前发现的X染色体基因,似乎已经在小鼠的形态发育上发挥了作用。他和他的同事调查了八个人类男性和女性的身体组织来观察X染色体基因如何发挥作用。“在许多情况下,这些非共享的基因在女性体内甚至没有表达,” Page说。相反,它们在决定精子形成的睾丸却表现得非常活跃。“我们认为X染色体过着双重的生活,” 其一,它是稳定的,像前人研究描述的一样;其二,它在不停变化并影响男性特征。Page表示,在其它基因上,重复区域在治疗癌症和其他疾病中已经具有了巨大的生物医学意义,他希望其他研究人员能进一步探索X染色体的重复区域是否同样重要,特别是在男性的繁衍和睾丸癌治疗方面。但目前,我们必须先知道这些基因的功能,了解它们对健康和形态的影响。但有一件事是肯定的,人们将开始关注X染色体的进化。http://www.ibioo.com/data/attachment/portal/201307/23/202226bu6vaasv3g6lwfs0.jpg参考文献http://www.ibioo.com/data/attachment/portal/201307/23/202226i11s7d9xysyswvvy.gifIndependent specialization of the human and mouse X chromosomes for the male germ line作者:Jacob L Mueller et al. We compared the human and mouse X chromosomes to systematically test Ohno's law, which states that the gene content of X chromosomes is conserved across placental mammals1. First, we improved the accuracy of the human X-chromosome reference sequence through single-haplotype sequencing of ampliconic regions. The new sequence closed gaps in the reference sequence, corrected previously misassembled regions and identified new palindromic amplicons. Our subsequent analysis led us to conclude that the evolution of human and mouse X chromosomes was bimodal. In accord with Ohno's law, 94–95% of X-linked single-copy genes are shared by humans and mice; most are expressed in both sexes. Notably, most X-ampliconic genes are exceptions to Ohno's law: only 31% of human and 22% of mouse X-ampliconic genes had orthologs in the other species. X-ampliconic genes are expressed predominantly in testicular germ cells, and many were independently acquired since divergence from the common ancestor of humans and mice, specializing portions of their X chromosomes for sperm production.


