









研究背景
RAF激酶家族是 RAS-RAF-MEK-ERK 信号级联(MAPK信号)的核心组成部分,可传导细胞增殖、分化等信号。RAF在细胞质中保持自我抑制状态,并通过活化的RAS募集到质膜,被激活后进行信号传递。该信号通路异常通常会导致癌症发生。尽管对KRAS/RAF识别有比较详细的了解,但这种相互作用如何导致RAF激活仍不清楚。研究中涉及到不同激活状态的RAF复合物和RAS结合,互作体系中将含有到3个及以上的分子,传统的方法很难获得准确互作结果。这次我们带来的这篇文献讲述美国丹娜-法伯癌症研究所的工作人员使用MST技术来解析RAF蛋白激活和与RAS互作的关系。

https://doi.org/10.1038/s41467-023-40299-6IF: 16.6 Q1
研究内容
先前对KRAS与RAF的结构研究主要集中在RAF的两个结构域:富含半胱氨酸结构域CRD和RAS结合结构域RBD。为了更好的了解二者的结合以及RAF的激活,作者分析了在MEK1和14-33二聚体的自抑制状态下,KRAS与完整BRAF结合的冷冻电镜结构,并使用MST技术检测不同状态RAF与KRAS亲和力。综合其他实验发现,KRAS结合不足以激活BRAF,说明了RAS结合和激活RAF是可分离的,并提出小分子抑制剂的新思路。
研究结果
为了探究RBD对KRAS结合的可及性,作者使用MST技术检测了不同结构域的RAF与KRAS亲和力。单独的RBD结构域的亲和力最强(26nM),表明RBD结构域是RAF和KRAS结合的主要区域。此外,通过MST技术检测了RAS蛋白与自抑制(Autoinhibited)和活性状态(Active dimmer)下全长BRAF的亲和力。结果显明,二者亲和力相似(126nM/108nM),也就是RAF在自抑制状态下,RBD参与结合KRAS没有任何空间障碍。在获得自抑制或活性状态时,需将RAF蛋白与MEK或者14-3-3二聚体形成复合物,再检测与KRAS互作。MST技术无需固定样品,避免固定过程对复合物的影响,并且在溶液条件下检测,保证互作分子达到结合解离平衡状态,从而获得更加准确的Kd值。
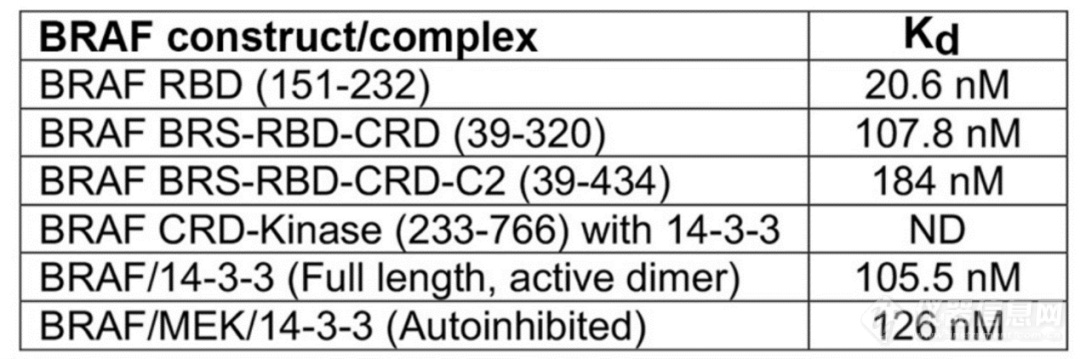
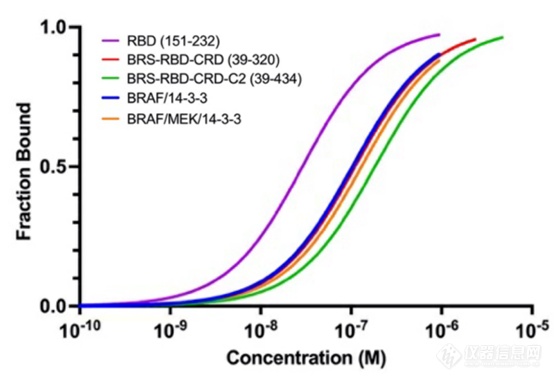
图:MST检测KRAS和BRAF片段或者复合体的亲和力
技术优势
MST技术是在溶液中进行的检测,无需固定操作,能够使靶标蛋白或者复合物保持稳定状态,在涉及到复合物或者多元互作时,可获得更加准确的亲和力结果。

[来源:诺坦普科技(北京)有限公司]

Eurofins Discovery | 片段药物发现新「组合拳」
2024.07.18


IF: 46.9 | 多元互作案例分享--首选NanoTemper的MST技术!
2024.06.21

2024.06.20

2024.06.04

Monolith互作荣登Cell:清华/南方医大团队发现降低胆固醇新激素
2024.05.30
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~