







北京大学化学院教授,主要从事化学和计算驱动的功能蛋白质组学相关研究


近日,北京大学王初课题组与芝加哥大学Ben May癌症研究所赵英明课题组合作,在Science Advances杂志上发表题为“Identification of 113 new histone marks by CHiMA, a tailored database search strategy”的研究文章。在这项工作中,作者详细探索了传统数据分析方法应用于组蛋白修饰组鉴定修饰肽段存在的问题,并进行了针对性优化发展了一种名为“Comprehensive Histone Mark Analysis (CHiMA)”的数据分析方法。应用CHiMA对此前的组蛋白修饰组数据进行重分析发现了113个新的组蛋白修饰位点(histone mark)。
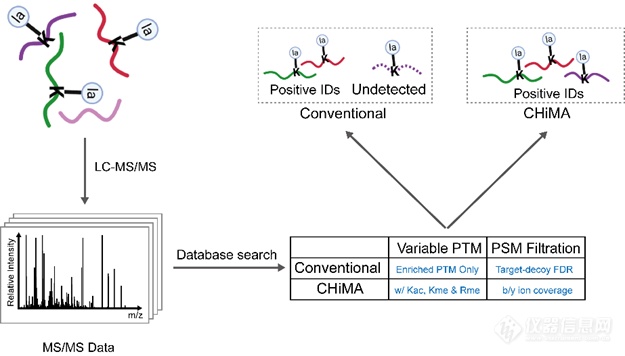
组蛋白翻译后修饰是细胞对DNA转录调控的重要手段之一。蛋白质组作为一种高通量全局性分析蛋白质翻译后修饰的技术,在组蛋白修饰的发现和功能研究中发挥了重要作用。如赵英明课题组在2019年利用蛋白质组手段首次鉴定到了组蛋白上来源于L型乳酸(L-lactate)的赖氨酸乳酰化修饰,并揭示了其在调控基因表达中的重要作用。
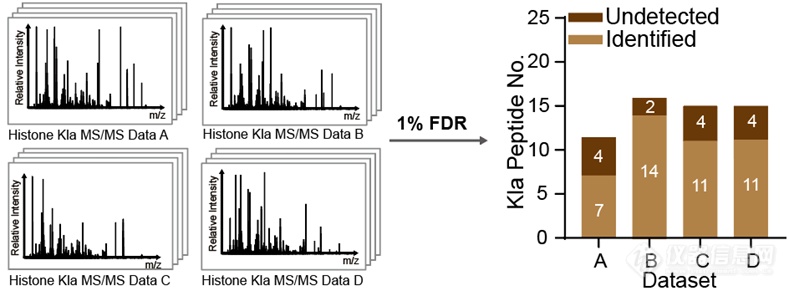
组蛋白修饰组相对于全蛋白质组数据有着显著的区别,譬如:1)组蛋白修饰组中包含的肽段数目远少于全蛋白质组中的肽段数目;2) 组蛋白由于富含赖氨酸和精氨酸,经过胰蛋白酶切后,氨基酸数目小于或等于6个的短肽占比远超全蛋白质组中比例。尽管如此,目前还没有研究探索传统蛋白质组数据分析策略是否适用于组蛋白修饰组中修饰位点的鉴定,以及针对组蛋白修饰组优化开发的搜库方法。为了验证传统蛋白质组数据分析策略应用于组蛋白修饰位点鉴定是否会产生漏报的情况,作者首先准备了四组组蛋白乳酰化修饰组数据。这些数据使用同样色谱条件和质谱条件采集,因此同一条修饰肽段在四组数据中应在相似时间被色谱洗脱并送入质谱鉴定,从而可以利用在其他三组数据中的鉴定肽段来检查漏报。作者使用ProLuCID+DTASelect2.0作为搜库软件并使用传统分析策略进行搜库,发现在这四组数据中均存在着不同比例(12.5%-36.4%)的修饰位点漏报。为了验证这一结果不是由特定搜库引擎的算法所导致,作者使用另一种常用的搜库引擎Andromeda(内置于MaxQuant)进行了同样的测试并得到了相似的结果。
搜库分析首先将实验产生的二级谱图与蛋白质数据库中模拟酶切产生肽段的理论谱图进行比对,以得到每个二级谱图潜在的匹配肽段。随后需要对所有的肽段-谱图匹配(peptide-spectrum matches, PSMs)进行过滤以筛选出高置信度的鉴定结果。传统的搜库方法通常使用target-decoy策略来进行PSM筛选[3]。这一策略首先在蛋白质数据库中产生与正确蛋白质序列(target)同样数目的诱饵序列(decoy,通常为正确序列的反向序列)。诱饵序列不存在于细胞中,所以匹配于诱饵序列的鉴定结果均为假阳性。同时由于数据库中正确序列与诱饵序列数目相同,可以通过decoy PSMs的数目估算出同等打分筛选条件下的target PSMs数目,从而估算出假阳性率(false discovery rate, FDR)。
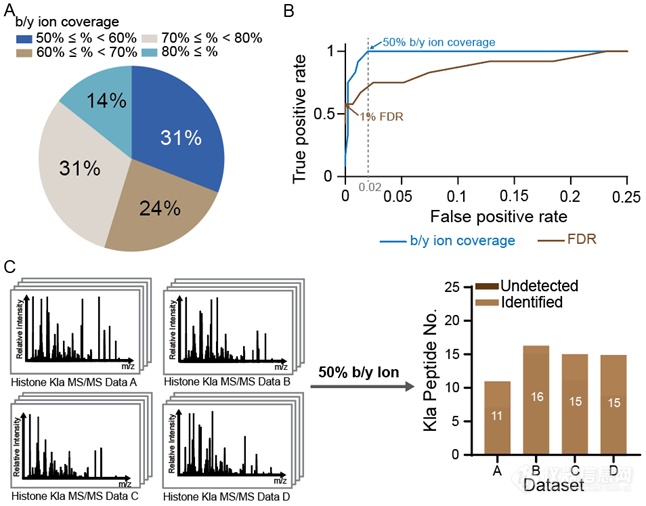
由于组蛋白修饰组通常只含有数十条或最多上百条修饰肽段,作者猜测使用 target-decoy-based FDR进行PSM过滤会导致打分线完全取决于打分最高的1-2个decoy PSM,从而丧失统计效力。为了验证这一猜测,作者对数据A搜库过程每一步的结果进行了仔细检查,发现所有漏报的修饰肽段均被搜库软件正确匹配到了相应的二级谱上,而漏报确实产生于后续的PSM过滤过程。作者随后绘制了测试数据中target PSM和decoy PSM的打分分布曲线,发现两者也几乎完全重合,只有65个target PSMs的打分高于打分最高的decoy PSM,因此在该数据中打分线仅由这一个decoy PSM决定,导致其他正确修饰肽段被漏报。作者随后对搜库策略进行优化以解决这一问题。谱图匹配的质量是最重要的衡量肽段鉴定可靠性的标准。因此,对于组蛋白修饰组这样的小数据集来说,完全可以根据谱图质量来筛选高置信度的PSM。由于数据中仅含有少量阳性肽段,筛选出的鉴定结果可以在随后很方便地进行手动验证。通常来说,一个正确的PSM中肽段的碎片离子(fragment ion)应该尽可能多地被匹配到谱图中的离子。因而,我们选择碎片离子覆盖率(fragment ion coverage,FIC)作为筛选高质量PSM的标准。经过一系列的评测,作者证明基于FIC的筛选策略在测试数据集中显著优于基于FDR的筛选策略,而50% 的FIC可以在不引入过多假阳性鉴定的情况下鉴定到所有的正确修饰肽段。
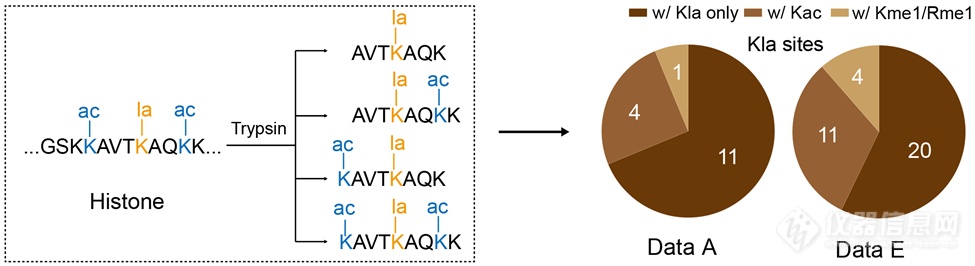
作者随后对组蛋白修饰组数据更进一步探索发现组蛋白赖氨酸乙酰化(Kac)和一甲酰化(Kme1)和精氨酸一甲基化(Rme1)在测试数据集中被广泛发现共存于目标修饰的肽段上。这些赖氨酸和精氨酸上的背景修饰(尤其是Kac)可以导致酶切效率的降低,产生更长的含目标修饰的肽段,从而使得短肽上的修饰位点被鉴定到。因此考虑这些高丰度的背景修饰可以促进对目标修饰位点的鉴定,同时也有助于对组蛋白修饰crosstalk的研究。
在两个测试数据集中,作者证明在搜库时考虑Kac,Kme1和Rme1帮助多鉴定到了45%和75%的组蛋白乳酰化修饰位点。基于以上对搜库分析流程的优化,作者建立了深度组蛋白修饰鉴定分析方法CHiMA (Comprehensive Histone Mark Analysis)。作者在两个测试数据集中对CHiMA进行详细地测试证明其相对传统搜库方法能够多鉴定到近一倍的组蛋白修饰位点。在以上方法开发过程中,所有鉴定结果作者均进行了手动验证以确保准确性。
作者最后使用CHiMA对组蛋白赖氨酸乳酰化、2 -羟基异丁酰化、巴豆酰化和苯甲酰化的数据进行重分析,发现了113个新的组蛋白修饰位点(histone mark),将此前的数目提高了几乎一倍。作者手动检查了所有新鉴定位点肽段的PSM质量,并将其分为了高置信度和中等置信度两类,其中后者的PSM可能有如下瑕疵:1) 肽段碎片离子的信号强度过低;2)谱图中高质核比区间(大于母离子质核比)有无法被解释的高强度离子。为了确保这些新鉴定的组蛋白修饰位点的可靠性,作者合成了所有中等置信度的乳酰化和巴豆酰化新鉴定位点的肽段。所有合成肽段的二级谱图均与鉴定肽段的谱图一致,证明了这些新鉴定位点的正确性。除了这些新鉴定位点之外,作者还总结了所有共存于同一条肽段上的修饰组合,并人工合成了其中部分肽段以验证其正确性。
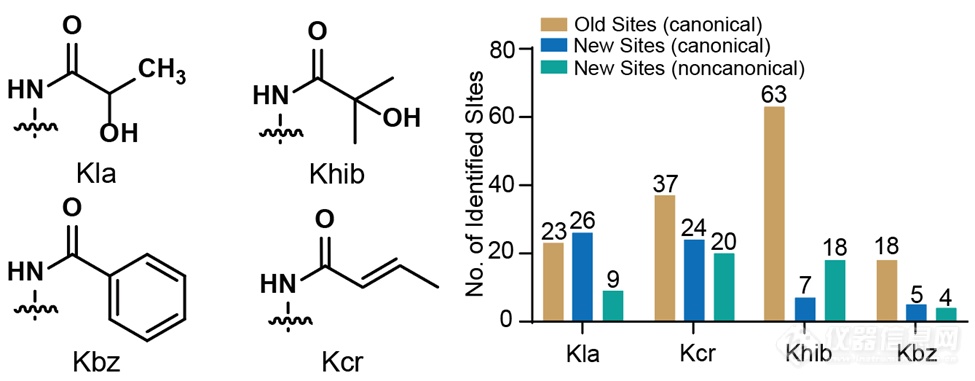
综上所述,CHiMA提供了第一个专为组蛋白修饰鉴定量身定做的数据分析方法,为组蛋白修饰参与的表观遗传学研究提供了重要工具。在本工作中新发现的组蛋白修饰位点也将为未来表观遗传学的机制研究提供重要的基础。本文的通讯作者为芝加哥大学Ben May癌症研究所的赵英明教授和北京大学化学与分子工程学院、北大-清华生命联合中心、北京大学合成与功能生物分子中心的王初教授。赵英明课题组博士后高晋君(王初课题组2019届毕业生)为本文第一作者,明尼苏达大学陈悦教授、北京大学张迪教授、赵英明课题组盛心磊博士等合作者为本课题做出了贡献。该工作得到了国家自然科学基金委、科技部重点研发计划、北京市杰出青年科学家等项目的经费支持。
文章链接:https://www.science.org/doi/10.1126/sciadv.adf1416
原文引用:DOI: 10.1126/sciadv.adf1416
[来源:仪器信息网] 未经授权不得转载
2022.06.02

2021.04.01

北大王初与芝加哥大学赵英明课题组合作开发深度组蛋白修饰鉴定分析方法
2023.04.11

探秘类器官与器官芯片进展,锁定iCCA2024第七届细胞分析大会(扫码预约直播)
2024.06.28

5位嘉宾共话单细胞技术前沿|第七届细胞分析大会iCCA2024 开播倒计时
2024.06.28
版权与免责声明:
① 凡本网注明"来源:仪器信息网"的所有作品,版权均属于仪器信息网,未经本网授权不得转载、摘编或利用其它方式使用。已获本网授权的作品,应在授权范围内使用,并注明"来源:仪器信息网"。违者本网将追究相关法律责任。
② 本网凡注明"来源:xxx(非本网)"的作品,均转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责,且不承担此类作品侵权行为的直接责任及连带责任。如其他媒体、网站或个人从本网下载使用,必须保留本网注明的"稿件来源",并自负版权等法律责任。
③ 如涉及作品内容、版权等问题,请在作品发表之日起两周内与本网联系,否则视为默认仪器信息网有权转载。
![]() 谢谢您的赞赏,您的鼓励是我前进的动力~
谢谢您的赞赏,您的鼓励是我前进的动力~
打赏失败了~
评论成功+4积分
评论成功,积分获取达到限制
![]() 投票成功~
投票成功~
投票失败了~